En dépit de l’augmentation de sa prévalence chez les personnes âgées, l’ostéoporose (OP) et ses conséquences fracturaires sont sous-diagnostiquées et sous-traitées.1
L’appréciation objective des bénéfices et des risques annoncés à l’usage des inhibiteurs de la résorption du tissu osseux (IRTO) dans la prise en charge thérapeutique de l’ostéoporose fait souvent défaut. L’excès de crainte d’effets indésirables associées aux IRTO par les patients et les professionnels de santé, incluant certains chirurgiens-dentistes et médecins omnipraticiens, peut parfois conduire au renoncement de la prescription,2 voire à l’arrêt3 de traitements pourtant efficaces.
Les IRTO tels que les bisphosphonates (BP) et le dénosumab (DMAB) sont fréquemment utilisés avec succès pour réduire la morbidité des métastases osseuses et de l’hypercalcémie maligne chez les patients atteints de cancer.
Si le vieillissement de la population pourrait laisser supposer que le traitement par IRTO, comme les BP et le DMAB, est en augmentation, dans les faits il en est tout autrement : des données françaises, déjà anciennes, montraient que, dans la période allant de 2007 à 2013, si les BP per os étaient les plus prescrits en première ligne thérapeutique dans l’OP, durant les années de suivi, seul un tiers des patients restait sous traitement.4 D’autres statistiques françaises, issues de la base de données du Système national d’information inter-régimes de l’Assurance maladie, montraient que l’année suivant une hospitalisation pour fracture de la fragilité, seuls 15 % des patients avaient reçu un traitement contre l’OP.5 En outre, la base de données des médicaments remboursés par l’Assurance maladie (Medic’AM) et la base nationale de la pharmacovigilance française ont établi que le nombre de patients traités en France par BP pour une OP est passé de 603 907 en 2011 à 335 187 en 2020, soit une réduction de 44,5 %.6
L’objectif est ici de faire le point sur l’ostéonécrose de la mâchoire, principal effet indésirable redouté associé à l’usage des IRTO dans le contexte de fragilité osseuse due à l’OP.
Qu’est-ce que l’ostéonécrose de la mâchoire ?
L’ostéonécrose de la mâchoire (ONM) liée aux IRTO dans un contexte d’OP est un événement indésirable rare. Cette complication est cliniquement caractérisée par une exposition osseuse maxillaire de plus de huit semaines chez un patient ayant été ou étant traité par IRTO, sans antécédents de radiothérapie dans la région de la tête et du cou, ni de maladie métastatique évidente des maxillaires. Cette lésion osseuse peut survenir spontanément ou être induite par un traumatisme du tissu osseux comme lors d’un geste de chirurgie buccale (en premier lieu, les avulsions dentaires).7
Quels sont les mécanismes physiopathologiques en cause ?
La physiopathologie de l’ONM résulte de la combinaison de plusieurs mécanismes : l’inhibition de l’activité ostéo-clastique affecte le renouvellement osseux, tandis que l’activité antiangiogénique et la toxicité muqueuse de certains traitements altèrent la cicatrisation. En outre, l’accumulation de microtraumatismes et d’éventuels foyers infectieux locaux mènerait à une exposition osseuse. Inversement, un traumatisme muqueux permettant l’entrée bactérienne – et donc une infection –, couplé au faible renouvellement osseux, mènerait à l’ostéonécrose.
Les ONM concernent majoritairement la mandibule (deux fois plus fréquent que le maxillaire) du fait de sa vascularisation terminale et de la fragilité de la muqueuse couvrant ses reliefs osseux (ligne oblique interne, tori).8 - 10
L’inhibition du remodelage osseux, et en particulier de la résorption du tissu osseux, n’est cependant pas suffisante à elle seule pour provoquer une ONM. Des études montrent, en effet, que chez les patients ayant une ONM, 46 à 79 % avaient au préalable subi un traumatisme alvéolodentaire, et plus spécifiquement une extraction dentaire.11
Incidence dépendante de la dose et de la durée d’exposition
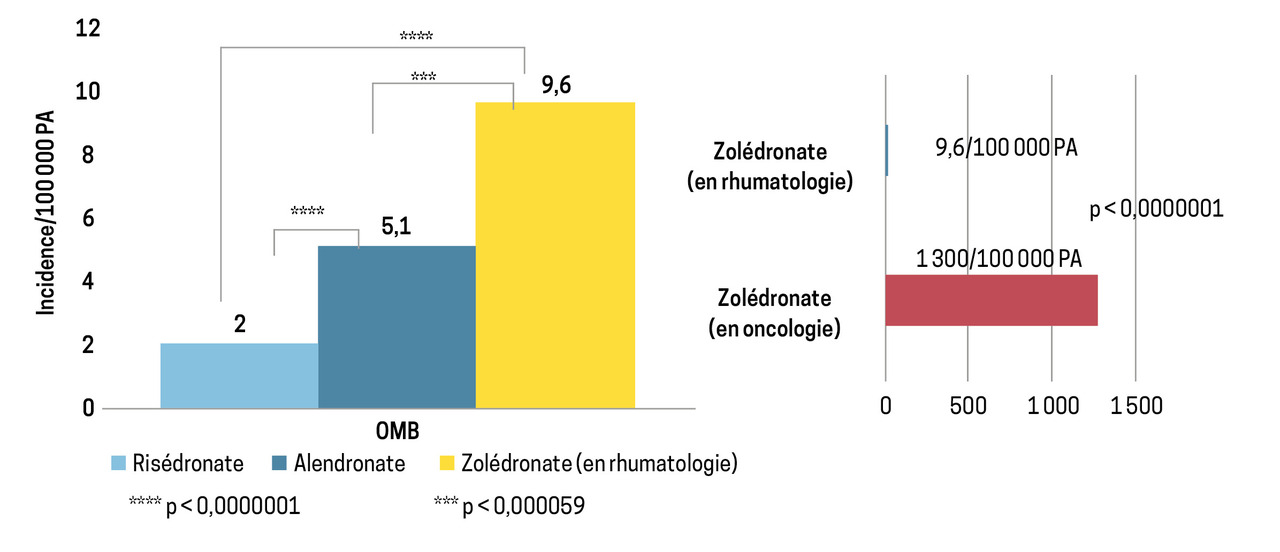
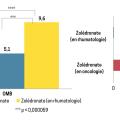
L’incidence de l’ONM associée à la prise des IRTO est dépendante de la dose et de la durée d’exposition de ceux-ci. Alors que l’incidence de l’ONM chez les patients traités dans un contexte de prise en charge de la fragilité ostéo-porotique est très basse (de 0,001 à 0,01 %), elle est plus élevée dans un contexte de prise en charge en oncologie (de 0,5 à 4,6 %).12
En France, le taux d’incidence des fractures du col du fémur chez les patients de plus de 55 ans a été évalué à 42,5 cas pour 10 000 patients-années.6 Il est donc possible d’estimer que le risque de survenue d’une fracture est au moins 40 fois plus élevé que celui des ONM chez les patients traités pour OP.
Une analyse très récente fondée sur la base de données de la pharmacovigilance française s’est intéressée à l’incidence et aux facteurs de risque de l’ONM associée au traitement par acide zolédronique.6 Entre 2011 et 2020, l’incidence des ONM était de 9,6/100 000 patients-années sous acide zolédronique, de 5,1/100 000 patients-années sous alendronate et de 2/100 000 patients-années sous risédronate (figure).6 Ces données confirment que le risque d’ONM associé aux BP par voie orale est faible et marginalement plus élevé que le risque d’ostéite des maxillaires dans la population non traitée par IRTO (inférieur à 0,001 %).8
De même, en 2022, les experts de l’Association américaine des chirurgiens de la sphère orale et maxillofaciale (AAOMS) ont indiqué que le risque d’ONM induit par les IRTO chez les patients ostéoporotiques se situe entre 0,02 et 0,05 % et chevauche celui de la survenue d’ONM constaté dans la population placebo (0 à 0,02 %).13
Quels facteurs de risque rechercher ?
De façon générale, les facteurs locaux compromettant l’intégrité des tissus mous et durs des maxillaires et/ou des facteurs systémiques nuisant à la cicatrisation osseuse (tableau 1) peuvent contribuer au développement, à la progression et à la sévérité de l’ONM.
L’un des facteurs dominants dans l’évaluation de la probabilité de survenue d’une ONM est l’exposition cumulée au traitement par les BP ou par le DMAB.14
Certains auteurs, dans leur schéma décisionnel d’appréciation de risque de survenue d’ONM, fixent un seuil de durée de traitement supérieur à trois ou quatre ans.12,14
Cependant, actuellement, aucune étude n’a permis de définir une limite de durée de traitement en dessous de laquelle une ONM ne peut survenir.13,14 Les données d’un large essai prospectif randomisé comparant acide zolédronique versus placebo ne mettent en évidence aucune augmentation significative de survenue des ONM chez des patients traités durant neuf ans. En revanche, dans le vaste essai du DMAB dans l’OP (n = 4 550), le risque d’ONM augmentait avec la durée de traitement : 0,04 % à trois ans, 0,06 % à cinq ans et 0,44 % à dix ans.15
L’analyse des facteurs de risque est essentielle pour éviter la survenue d’une ONM et repose sur l’évaluation de plusieurs critères :
- la posologie de BP ou de DMAB prescrite ;
- la durée du traitement ;
- l’existence de comorbidités associées.
Miser sur la prévention
Des consultations régulières chez le dentiste et l’autosurveillance des symptômes sont le moyen le plus efficace de prévenir la survenue de l’ONM. Les chirurgiens-dentistes jouent un rôle majeur dans l’optimisation de la prévention et de la diminution du développement des ONM (tableau 2). Il est essentiel d’éduquer les patients à reconnaître les signes d’alerte tels que les douleurs diffuses sans pathologie dentaire associée, une exposition spontanée de l’os, une mobilité dentaire de survenue rapide, un retard de cicatrisation osseuse ou tout autre symptôme inhabituel.
Il faut aussi insister auprès des patients afin qu’un suivi dentaire régulier annuel soit instauré si ce n’est pas déjà le cas. De même, l’hygiène buccodentaire doit être rigoureuse (brossage des dents en particulier).
2. Herrou J, Roux C. Preuves de l’efficacité antifracturaire des traitements antiostéoporotiques. Rev Prat 2020;70(10):1083‑8.
3. Lejeune-Cairon S, Guggenbuhl P. Les inhibiteurs de la résorption osseuse : un sujet d’inquiétude pour les patients, les médecins prescripteurs, les chirurgiens-dentistes ? Lett Rhumatol 2019;(455):28‑31.
4. Belhassen M, Confavreux CB, Cortet B, et al. Anti-osteoporotic treatments in France: initiation, persistence and switches over 6 years of follow-up. Osteoporos Int 2017;28(3):853‑62.
5. International osteoporosis foundation. A roadmap to solve the fragility fracture crisis in Europe report. Octobre 2018. https://bit.ly/3RNXCh2
6. Amigues C, Fresse A, Roux CH, et al. Zoledronate and osteonecrosis of the jaw in osteoporosis: incidence and risk factors. Analysis of the French Pharmacovigilance Database. Joint Bone Spine 2023;90(6):105599.
7. Coropciuc R, Coopman R, Garip M, et al. Risk of medication-related osteonecrosis of the jaw after dental extractions in patients receiving antiresorptive agents – A retrospective study of 240 patients. Bone 2023;170:116722.
8. Khan AA, Morrison A, Hanley DA, et al. Diagnosis and Management of Osteonecrosis of the Jaw: A Systematic Review and International Consensus: Osteonecrosis of the jaw: report from the international ONJ task force. J Bone Miner Res 2015;30(1):3‑23.
9. Otto S, Pautke C, Van den Wyngaert T, et al. Medication-related osteonecrosis of the jaw: Prevention, diagnosis and management in patients with cancer and bone metastases. Cancer Treat Rev 2018;69:177‑87.
10. Ruggiero SL. Emerging concepts in the management and treatment of osteonecrosis of the jaw. Oral Maxillofac Surg Clin N Am 2013;25(1):11‑20, v.
11. Yazdi PM, Schiodt M. Dentoalveolar trauma and minor trauma as precipitating factors for medication-related osteonecrosis of the jaw (ONJ): A retrospective study of 149 consecutive patients from the Copenhagen ONJ Cohort. Oral Surg Oral Med Oral Pathol Oral Radiol 2015;119(4):416‑22.
12. Song M. Dental care for patients taking antiresorptive drugs: A literature review. Restor Dent Endod 2019;44(4):e42.
13. Ruggiero SL, Dodson TB, Aghaloo T, et al. American Association of Oral and Maxillofacial Surgeons - Position Paper on Medication-Related Osteonecrosis of the Jaws-2022 Update. J Oral Maxillofac Surg 2022;80(5):920‑43.
14. Nicolatou-Galitis O, Schiødt M, Mendes RA, et al. Medication-related osteonecrosis of the jaw: Definition and best practice for prevention, diagnosis, and treatment. Oral Surg Oral Med Oral Pathol Oral Radiol 2019;127(2):117‑35.
15. Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol 2017;5(7):513‑23.
16. Dupic G, Collangettes D, Dillies AF, et al. Ostéonécrose des maxillaires liée aux bisphosphonates et denosumab : épidémiologie, diagnostic et traitement. Bull Cancer (Paris) 2015;102(12):1010‑9.
17. Agence française de sécurité sanitaire des produits de santé. Recommandations sur la prise en charge buccodentaire des patients traités par bisphosphonates. Décembre 2007. https://bit.ly/3v7W3S6
18. Briot K, Roux C, Thomas T, et al. 2018 update of French recommendations on the management of postmenopausal osteoporosis. Joint Bone Spine 2018;85(5):519‑30.
19. Hasegawa T, Kawakita A, Ueda N, et al. A multicenter retrospective study of the risk factors associated with medication-related osteonecrosis of the jaw after tooth extraction in patients receiving oral bisphosphonate therapy: Can primary wound closure and a drug holiday really prevent MRONJ? Osteoporos Int 2017;28(8):2465‑73.