Elle affecte le sujet jeune, 80 % des ostéonécroses survenant avant 50 ans, en pleine période d’activité professionnelle ; elle est donc source de handicap majeur comme toute atteinte de la hanche, d’autant qu’elle est le plus souvent bilatérale. Toute douleur inexpliquée de la hanche ou du genou chez le sujet jeune impose ainsi une IRM de la hanche.
L’ostéonécrose non traumatique de la hanche est une affection probablement d’origine multifactorielle. Certains auteurs considèrent qu’il s’agit d’un processus ischémique primitif comme au cours de la drépanocytose où la déformation des hématies peut entraîner des agrégats de globules rouges supposés obstruer les capillaires. Lors de certaines maladies inflammatoires systémiques comme le lupus, il peut exister une vascularite intra-osseuse. D’autres estiment que la nécrose ne relève pas d’un processus seulement ischémique et évoquent le rôle d’une toxicité directe de certaines substances sur l’os ou la moelle (alcool, corticoïdes, lipides...). Une diminution de l’activité ostéoblastique a été observée à distance des ostéonécroses. Cette observation doit être rapprochée des connaissances actuelles sur l’alcool et les corticoïdes, qui favorisent la différenciation des cellules souches mésenchymateuses en adipocytes. Cette diminution de l’activité ostéoblastique a la même signification que l’augmentation de la lipogenèse. Elle est en relation avec la capacité d’une même cellule souche de s’orienter soit vers une lignée adipocytaire, soit ostéoblastique en fonction de l’âge du patient ou de l’environnement et/ou de la pathologie associée. On peut alors proposer que la nécrose, ou mort cellulaire, soit la conséquence de phénomènes autres que primitivement vasculaires, en évoquant, par exemple, une toxicité directe de certaines substances sur la moelle, les ostéocytes ou les ostéoblastes, comme l’alcool et les corticoïdes : nécrose directe des ostéocytes par hyperlipémie.
Prévalence globale
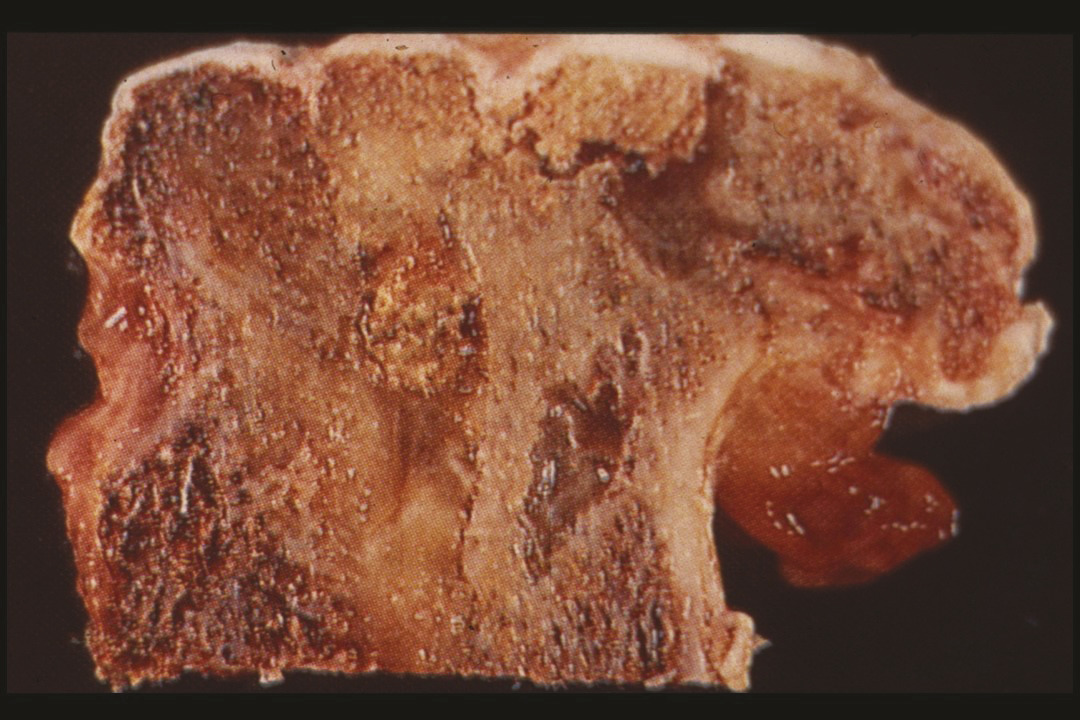
L’ostéonécrose de la hanche est une pathologie relativement fréquente,1 en France, environ 5 000 nouveaux patients sont diagnostiqués chaque année. La fréquence du caractère bilatéral est d’environ 70 %, ce qui représente donc environ 7 000 nouvelles ostéonécroses de la hanche diagnostiquées chaque année. Cette pathologie touche spécifiquement l’adulte jeune (18-55 ans). Il n’y a pas de régression spontanée de l’ostéonécrose et, dans un délai d’environ deux ans, l’effondrement de la tête fémorale (fig. 1 ) aboutit à une perte fonctionnelle, empêchant le patient de marcher. L’ostéonécrose est l’aboutissement de la mort cellulaire dans la tête fémorale, mort cellulaire en rapport avec différentes causes.
Maladies associées
Drépanocytose
C’est la maladie la plus fréquemment associée.2 L’ostéonécrose de la tête fémorale a été en effet rapportée chez 30 à 50 % des patients en fonction du type d’hémoglobinopathie. Avec cette fréquence (40 %) et la présence d’une ostéonécrose le plus souvent bilatérale dans cette population, le nombre d’ostéonécroses de la hanche dues à la drépanocytose en France est probablement autour de 6 000 cas, avec environ 600 nouveaux cas par an (soit 1/10 des nouveaux cas de nécrose en France), ce nombre correspondant aux naissances sur le territoire mais aussi aux mouvements migratoires. Pour information, l’hôpital Henri-Mondor, qui est un centre de référence pour la drépanocytose, voit environ 250 nouveaux cas de nécrose de la hanche drépanocytaire chaque année.
Lupus systémique
C’est le prototype des maladies auto-immunes à risque d’ostéonécrose.
Les patients atteints de lupus systémique ont un risque d’avoir une ostéonécrose de la hanche 7 fois plus élevé que la population normale. La survenue d’une ostéonécrose chez ces patients pourrait être liée à divers facteurs : corticostéroïdes, vascularite, syndrome des antiphospholipides et maladie rénale, chacun de ces facteurs augmentant le risque d’ostéonécrose. Il y a environ 500 cas de nécroses de la hanche associées au lupus en France, avec environ 30 nouveaux cas par an, soit 25 fois moins que de nécroses associées à la drépanocytose.
Les patients atteints de lupus systémique ont un risque d’avoir une ostéonécrose de la hanche 7 fois plus élevé que la population normale. La survenue d’une ostéonécrose chez ces patients pourrait être liée à divers facteurs : corticostéroïdes, vascularite, syndrome des antiphospholipides et maladie rénale, chacun de ces facteurs augmentant le risque d’ostéonécrose. Il y a environ 500 cas de nécroses de la hanche associées au lupus en France, avec environ 30 nouveaux cas par an, soit 25 fois moins que de nécroses associées à la drépanocytose.
Greffes, hémopathies, et néoplasies
Les ostéonécroses ont été rapportées chez environ 10 % (4-35 %) des patients ayant reçu une greffe d’organe ou ayant été traités pour une leucémie. Les corticoïdes et la réaction du greffon contre l’hôte sont les facteurs de risque associés chez ces patients. Les tumeurs solides sont aussi associées à la survenue d’une ostéonécrose du fait des traitements anticancéreux et/ou de la corticothérapie. Cependant, l’ostéonécrose aseptique ne doit pas être considérée comme une manifestation paranéoplasique, et n’implique donc pas de rechercher d’un cancer primitif. Les nouveaux immunosuppresseurs ont diminué la survenue des nécroses, mais la fréquence cumulée des ostéonécroses est plus élevée que dans le lupus.
Thrombophilie et syndrome des antiphospholipides
La survenue d’une ostéonécrose aseptique est parfois retrouvée chez les malades atteints d’un syndrome des antiphospholipides. Tout état d’hypercoagulabilité est associé au risque d’ostéonécrose (mutation facteur V de Leiden, hyperhomocystéinémie, déficit en protéines C et S). Dans ce cas, on peut observer des nécroses familiales comme dans la drépanocytose.
Maladie de Gaucher
Cette maladie génétique récessive et rare, causée par un déficit en bêta-glucocérébrosidase, est également une cause rare d’ostéonécrose.
Facteurs de risque
Si l’on considère qu’il y a environ 7 000 nouvelles nécroses en France et que seules 1 000 sont associées directement à une maladie (la plus fréquente étant la drépanocytose) chaque année, les facteurs de risque sont responsables de la majorité des ostéonécroses en France
Corticothérapie
L’incidence élevée des nécroses avasculaires chez les patients recevant des corticoïdes est bien établie. Les corticoïdes, par voie systémique, même en cure courte, sont un facteur de risque, surtout à fortes doses (bolus). Il n’y a pas de dose seuil établie ; la dose cumulative, la durée d’exposition, la susceptibilité du patient sont intriquées dans le risque. Les nécroses multifocales sont relativement fréquentes quand les doses sont élevées. Prescrits à faible dose pour une sinusite ou une uvéite, le risque est moins élevé mais persiste, en particulier en cas d’association avec un trouble lipidique.
Les cas d’ostéonécroses aseptiques secondaires aux corticoïdes topiques (voie cutanée en dermatologie, voie nasale pour l’asthme) sont rares et ne concernent que les doses massives appliquées sur l’ensemble du corps.
Les cas d’ostéonécroses aseptiques secondaires aux corticoïdes topiques (voie cutanée en dermatologie, voie nasale pour l’asthme) sont rares et ne concernent que les doses massives appliquées sur l’ensemble du corps.
Alcool et tabac
La consommation à risque est définie comme supérieure à 14 verres par semaine pour les hommes ou 7 verres par semaine pour les femmes par l’Organisation mondiale de la santé ; parce qu’une boisson standard contient environ 10 à 14 g d’éthanol pur, la quantité à risque est estimée à être d’environ 140 à 220 g par semaine pour les hommes ou 70 à 180 g par semaine pour les femmes. De plus, une méta-analyse récente a montré que le risque d’ostéonécrose était multiplié par 6,5 en cas de consommation hebdomadaire moyenne d’alcool de 400 g. Cependant, il n’est pas facile d’obtenir des informations sur la consommation chez tous les patients, et les estimations de la consommation d’alcool pourraient être biaisées.
Le tabac est un risque souvent associé à l’alcool ; néanmoins, des études récentes montrent que seul il est aussi un facteur de risque.
Le tabac est un risque souvent associé à l’alcool ; néanmoins, des études récentes montrent que seul il est aussi un facteur de risque.
Autres facteurs de risque
De nombreux facteurs de risque3 ont été décrits mais sont plus rares : troubles de la coagulation, chimiothérapie, hyperuricémie, hyperlipidémie, pancréatite, pathologies vasculaires, grossesse… Plus d’une centaine de facteurs de risque sont répertoriés, dont récemment des facteurs génétiques.
IRM de la hanche devant une douleur inexpliquée de la hanche (ou du genou)
Les phases initiales de l’ostéonécrose sont le plus souvent asymptomatiques. Le moment où la nécrose apparaît dans l’os ou sur l’imagerie par résonance magnétique (IRM) est habituellement silencieux, même si certains patients se plaignent de douleurs articulaires au moment de l’administration d’un bolus de corticoïdes. Parfois, sa découverte peut être fortuite, au décours d’examens réalisés pour d’autres indications.
Lorsqu’elle est symptomatique, une ostéonécrose se manifeste par des douleurs articulaires mécaniques, sans limitation des amplitudes articulaires ; mais la rotation interne forcée de la hanche est douloureuse. Il s’agit de douleurs de l’aine, de la fesse, du pli inguinal, de la région lombo-fessière, et parfois du genou.
Contrairement aux données classiques, les ostéonécroses surviennent précocement (3-6 mois) après l’exposition à un facteur de risque (corticothérapie, traumatisme), la totalité d’entre elles étant détectables en IRM dans un délai de 1 à 6 mois après celle-ci :4 c’est leur révélation clinique et radiologique qui est retardée.
Trois données doivent être retenues :
– l’apparition de symptômes précède toujours la perte de sphéricité ;
– le piège le plus fréquent est la symptomatologie lombaire ou sciatique : dans 10 % des cas de nécrose de la hanche, une IRM lombaire avait été demandée avant celle de la hanche ;
– lorsqu’il existe une maladie à risque ou un facteur de risque, une douleur de la hanche, du genou ou du rachis lombaire non expliquée par la radiographie standard et s’accompagnant d’une douleur à la rotation interne forcée de la hanche impose la prescription d’une IRM.
Lorsqu’elle est symptomatique, une ostéonécrose se manifeste par des douleurs articulaires mécaniques, sans limitation des amplitudes articulaires ; mais la rotation interne forcée de la hanche est douloureuse. Il s’agit de douleurs de l’aine, de la fesse, du pli inguinal, de la région lombo-fessière, et parfois du genou.
Contrairement aux données classiques, les ostéonécroses surviennent précocement (3-6 mois) après l’exposition à un facteur de risque (corticothérapie, traumatisme), la totalité d’entre elles étant détectables en IRM dans un délai de 1 à 6 mois après celle-ci :4 c’est leur révélation clinique et radiologique qui est retardée.
Trois données doivent être retenues :
– l’apparition de symptômes précède toujours la perte de sphéricité ;
– le piège le plus fréquent est la symptomatologie lombaire ou sciatique : dans 10 % des cas de nécrose de la hanche, une IRM lombaire avait été demandée avant celle de la hanche ;
– lorsqu’il existe une maladie à risque ou un facteur de risque, une douleur de la hanche, du genou ou du rachis lombaire non expliquée par la radiographie standard et s’accompagnant d’une douleur à la rotation interne forcée de la hanche impose la prescription d’une IRM.
Diagnostic et pronostic : la révolution IRM
Douleur de hanche du sujet jeune
Une douleur de la hanche du sujet jeune avec une radiographie normale impose une IRM de la hanche.
La radiologie conventionnelle est toujours en retard sur les autres méthodes d’imagerie.
Si le signe radiologique le plus précoce est une densification au sein de la tête fémorale, la radiographie standard a surtout un intérêt pour rechercher une dissection sous-chondrale. En effet, c’est l’examen le plus fiable pour rechercher la classique coquille d’œuf ou la perte de la sphéricité de la tête fémorale.
La scintigraphie osseuse avait une place importante dans le diagnostic précoce des nécroses en raison de l’extrême précocité de l’hyperfixation scintigraphique et de l’aspect particulièrement évocateur que peut prendre l’image dans certains cas. Cet examen manque cependant de spécificité.
La tomodensitométrie est habituellement en retard sur la scintigraphie osseuse et sur l’IRM pour le diagnostic ; néanmoins, les appareils de deuxième génération possédant en particulier un programme haute résolution et filtre osseux ont l’avantage de mettre en évidence en coupes transversales la dissection sous-chondrale à un stade plus précoce que la radiographie et de manière plus évidente que l’IRM.
La radiologie conventionnelle est toujours en retard sur les autres méthodes d’imagerie.
Si le signe radiologique le plus précoce est une densification au sein de la tête fémorale, la radiographie standard a surtout un intérêt pour rechercher une dissection sous-chondrale. En effet, c’est l’examen le plus fiable pour rechercher la classique coquille d’œuf ou la perte de la sphéricité de la tête fémorale.
La scintigraphie osseuse avait une place importante dans le diagnostic précoce des nécroses en raison de l’extrême précocité de l’hyperfixation scintigraphique et de l’aspect particulièrement évocateur que peut prendre l’image dans certains cas. Cet examen manque cependant de spécificité.
La tomodensitométrie est habituellement en retard sur la scintigraphie osseuse et sur l’IRM pour le diagnostic ; néanmoins, les appareils de deuxième génération possédant en particulier un programme haute résolution et filtre osseux ont l’avantage de mettre en évidence en coupes transversales la dissection sous-chondrale à un stade plus précoce que la radiographie et de manière plus évidente que l’IRM.
Diagnostic sur l’IRM
Seule l’IRM, avec une sensibilité et une spécificité de presque 100 %, permet de faire le diagnostic et renseigne sur l’état de la hanche controlatérale, qui peut être asymptomatique. La scintigraphie n’a donc plus de raison d’être.
L’examen par résonance magnétique5 est habituellement effectué sur les deux hanches, la maladie étant fréquemment bilatérale. Sur les images obtenues, l’analyse cherche à préciser :
– un liseré de démarcation, qui est le signe spécifique de l’ostéonécrose ; il correspond à l’interface réactive qui entoure l’os nécrosé. Sur les séquences en T1, il apparaît sous la forme d’une bande en hyposignal continu, allant « d’une corticale à l’autre corticale », ce liseré est sinueux et dans l’ensemble concave vers le haut. Son signal varie dans le temps sur les séquences T2 et T1 après injection intraveineuse de gadolinium. Au début de la maladie, le liseré de démarcation est un signal dit vasculaire pur, c’est-à-dire en hyposignal en T1 (fig. 2 ) et en hypersignal sur les séquences T2 ou T1 après injection intraveineuse de gadolinium. Secondairement, ce liseré va présenter sur les séquences en T2 une bande périphérique en hyposignal sur laquelle s’adosse en dedans une bande en hypersignal ;
– la zone nécrotique est la zone comprise entre le liseré de démarcation et la lame osseuse sous-chondrale. Son siège est le plus souvent antérosupérieur. Le signal dans la zone nécrotique varie au cours du temps. Les modifications du signal dans le temps peuvent éventuellement permettre de dater l’ancienneté de l’ostéonécrose et d’estimer les modifications histologiques qui peuvent survenir au sein de cette ostéonécrose. Au début de la maladie, le signal de la graisse de la zone nécrotique est strictement identique au signal de la graisse jaune normale retrouvée ailleurs dans l’extrémité supérieure du fémur, ou autour du fémur, et cela sur toutes les séquences. Cela est dû au fait que, malgré la mort des cellules graisseuses, les parois n’ont pas éclaté, et la graisse « momifiée » garde un signal purement graisseux.
L’examen par résonance magnétique5 est habituellement effectué sur les deux hanches, la maladie étant fréquemment bilatérale. Sur les images obtenues, l’analyse cherche à préciser :
– un liseré de démarcation, qui est le signe spécifique de l’ostéonécrose ; il correspond à l’interface réactive qui entoure l’os nécrosé. Sur les séquences en T1, il apparaît sous la forme d’une bande en hyposignal continu, allant « d’une corticale à l’autre corticale », ce liseré est sinueux et dans l’ensemble concave vers le haut. Son signal varie dans le temps sur les séquences T2 et T1 après injection intraveineuse de gadolinium. Au début de la maladie, le liseré de démarcation est un signal dit vasculaire pur, c’est-à-dire en hyposignal en T1 (
– la zone nécrotique est la zone comprise entre le liseré de démarcation et la lame osseuse sous-chondrale. Son siège est le plus souvent antérosupérieur. Le signal dans la zone nécrotique varie au cours du temps. Les modifications du signal dans le temps peuvent éventuellement permettre de dater l’ancienneté de l’ostéonécrose et d’estimer les modifications histologiques qui peuvent survenir au sein de cette ostéonécrose. Au début de la maladie, le signal de la graisse de la zone nécrotique est strictement identique au signal de la graisse jaune normale retrouvée ailleurs dans l’extrémité supérieure du fémur, ou autour du fémur, et cela sur toutes les séquences. Cela est dû au fait que, malgré la mort des cellules graisseuses, les parois n’ont pas éclaté, et la graisse « momifiée » garde un signal purement graisseux.
Pronostic : sphéricité de la tête conservée à l’IRM ?
Classification
La classification en stades associée à la mesure du volume et à la localisation aide au pronostic.La classification en stades utilise habituellement une classification proche de celle d’Arlet et Ficat : le stade 1 a été défini comme une ostéonécrose de la tête fémorale visible sur l’IRM et non diagnostiquée sur les radiographies ; le stade 2 correspond à une ostéonécrose visible radiologiquement ; au stade 3, l’ostéonécrose de la tête fémorale fait apparaître sur les radiographies une dissection sous-chondrale sans perte de la sphéricité ; au stade 4, il y a une perte de sphéricité de la tête humérale, mais l’arthrose est visible ; le stade 5 est caractérisé par l’existence d’un remaniement arthrosique sur la tête et le cotyle.
Par stades « utiles », il faut entendre les stades de la maladie au cours desquels la tête peut être sauvée et le processus nécrotique stabilisé. En d’autres termes, les stades où la sphéricité de la tête fémorale est conservée, sans décrochage, sans rupture sous-chondrale. Finalement il n’y a que deux stades utiles à connaître : sphéricité conservée et sphéricité non conservée. Lorsque le décrochage est là, la congruence articulaire est perdue et, tôt ou tard, l’arthrose secondaire imposera la mise en place d’une prothèse totale. Dans l’ostéonécrose de la tête fémorale, des radiographies de la hanche de face et de profil sont toujours indispensables.
La hanche est-elle toujours sphérique ou non ? Deux examens permettent de répondre :
– une radiographie de la hanche de face, en flexion à 30 °. Cet examen simple amène en position supérieure (donc tangentielle aux rayons X) la partie antéro-supérieure de la tête fémorale, siège habituel de la nécrose ; on peut ainsi détecter un décrochage passé inaperçu sur la radiographie de profil et en particulier sur le faux profil de Lequesne qui est fait en charge ;
– une tomodensitométrie de la hanche ; donnant des images en coupes transversales, elle peut aussi montrer des ruptures corticales antérieures passées inaperçues sur la radiographie standard.
Topographie et volume de la nécrose
Ce volume peut être calculé sur les coupes IRM jointives de la tête fémorale en séquences T1 (meilleure définition). On peut demander au radiologue ce calcul, simple à faire avec l’informatique des IRM modernes. Globalement, une ostéonécrose de volume inférieur à 10 % du volume de la tête a très peu de chance de s’effondrer rapidement, et l’abstention chirurgicale peut être proposée. Au-delà de 20 %, en revanche, le risque d’effondrement est très élevé, et la chirurgie est nécessaire. Les nécroses situées en zone portante ont un risque plus élevé d’effondrement.Diagnostic différentiel : une affaire de spécialiste
Le contexte dit « ostéonécrose post-traumatique » (en dehors de la fracture du col du fémur). L’ostéonécrose post-traumatique peut survenir après une fracture ou une luxation de la hanche. En l’absence de fracture ou luxation de la hanche, la filiation entre un traumatisme et une nécrose de hanche unilatérale est discutée. Elle pourrait être liée à un effet tamponnade ou à un hématome. En réalité, l’anomalie de signal doit le plus souvent être rapportée à une fracture sous-chondrale ou à une fracture de contrainte qui sont les deux pathologies à discuter. L’IRM permet de noter un œdème de la tête fémorale, souvent étendu au col, mais dans lequel il existe une bande d’hyposignal, linéaire ou arciforme plus régulière que dans l’ostéonécrose et perpendiculaire à l’axe des trabécules osseuses portantes de la zone sous-chondrale de la tête et à moins de 5 mm du cartilage.
Le radiologue répond algodystrophie sur l’IRM : que faire ?
L’algodystrophie de la hanche survient généralement dans un contexte clinique particulier. Elle se signale par un « retard radiologique » de quelques semaines, puis l’apparition sur les radiographies d’une raréfaction osseuse intéressant surtout la tête fémorale ; l’interligne coxo-fémorale reste toujours normale. L’IRM est positive d’emblée, montrant l’existence d’un œdème de la tête et du col fémoral, mal limité, et souvent accompagné d’un épanchement intra-articulaire modéré. L’évolution se fait vers la guérison, avec la normalisation des images en IRM.
La confirmation vient habituellement d’une deuxième IRM à 3 mois d’intervalle qui montre la diminution ou la disparition des anomalies. L’algodystrophie est spontanément régressive, contrairement à l’ostéonécrose.
Dans certaines circonstances, le diagnostic est difficile comme pendant la grossesse, qui est à la fois un facteur favorisant d’algodystrophie de la hanche et une cause rare de nécrose.
La confirmation vient habituellement d’une deuxième IRM à 3 mois d’intervalle qui montre la diminution ou la disparition des anomalies. L’algodystrophie est spontanément régressive, contrairement à l’ostéonécrose.
Dans certaines circonstances, le diagnostic est difficile comme pendant la grossesse, qui est à la fois un facteur favorisant d’algodystrophie de la hanche et une cause rare de nécrose.
Traitement médical ou plutôt conseil médical
Nous sommes obligés d’admettre l’absence presque totale d’effet des traitements médicamenteux sur le cours de l’ostéonécrose, dont la thérapeutique repose sur le traitement symptomatique, d’une part (antalgiques, limitation d’appui), et diverses techniques chirurgicales, d’autre part. La connaissance de l’évolution spontanée de l’ostéonécrose de la tête fémorale, et surtout des facteurs qui l’influencent, est donc fondamentale pour annoncer au patient l’évolution attendue, dégager rapidement les indications thérapeutiques, en particulier l’opportunité ou non d’une opération, et laquelle.
Traitement non médicamenteux
Décharge
Lorsque les patients sont symptomatiques, et en l’absence d’effondrement de la tête fémorale, une décharge de l’articulation avec des béquilles est parfois recommandée ; elle est bien sûr impossible en cas de nécrose bilatérale. La preuve de son efficacité n’a jamais été prouvée. Même si elle était efficace, la durée de sa prescription serait difficile à déterminer car le délai entre la douleur et l’apparition de l’effondrement peut demander plusieurs années pour les nécroses les plus petites…Autres méthodes physiques
L’utilisation de champs magnétiques pulsés, des ondes de choc extracorporelles ou encore du caisson hyperbare a été proposée sans succès.Traitement médicamenteux
Puisqu’un des mécanismes physiopathologiques repose sur une origine ischémique, des traitements anticoagulants, antiagrégants, et hypolipémiants ont été tentés, sans effet significatif sur la nécrose. Mais l’anticoagulation peut rester indiquée en cas de thrombophilie sous-jacente nécessitant de toute façon un traitement.
Conseil médical
Parmi les questions les plus fréquentes posées par les patients, certaines permettent une réponse aisée.
Dans quel délai l’ostéonécrose est-elle détectable ?
La quasi-totalité des ostéonécroses de la tête fémorale sont décelées 2 à 6 mois après le début de la corticothérapie. Aucun cas ne survient au-delà de 6 mois. Ces études montrent que l’ostéonécrose aseptique est une complication en réalité précoce de la corticothérapie à forte dose. À l’inverse, ceux qui n’en déclarent pas dans les 6 mois initiaux n’en auront probablement jamais, même si la corticothérapie est poursuivie, ce qui souligne le rôle probablement primordial de facteurs de susceptibilité individuels. Il faut garder en mémoire qu’il s’agit d’IRM, faites de façon prospective.Une ostéonécrose de la tête fémorale constituée peut-elle régresser (ou augmenter) ?
Les cas d’amélioration spontanée radiologiquement visible sont exceptionnels, on peut les considérer comme inexistants. Retenons que, une fois l’ostéonécrose constituée, son volume n’augmente pas, qu’il reste stable la plupart du temps.Peut-on avoir des ostéonécroses à d’autres endroits que la hanche ?
Oui, en particulier dans la drépanocytose ou pour les fortes doses de corticoïdes : épaules, genoux, chevilles sont des localisations possibles.Peut-on développer des ostéonécroses de la hanche successivement à droite puis à gauche ?
Toutes les ostéonécroses d’un même sujet lié à une corticothérapie (ou à une intoxication alcoolique) surviennent simultanément, et le risque d’ostéonécroses successives est très faible. L’IRM corps entier permet désormais le dépistage de nombreuses ostéonécroses à un stade précoce. L’ostéonécrose est d’emblée bilatérale dans environ 70 % des cas. Cependant, si au moment du diagnostic l’IRM montre une ostéonécrose unilatérale, celle-ci le restera ultérieurement, même alors que les facteurs de risque persistent. Une exception cependant : la drépanocytose.Quel est le risque d’évolution vers la déformation radiologique de la tête fémorale ? Dans quel délai ? Quels éléments conditionnent cette évolution ?
Globalement, l’évolution vers le collapsus de la tête fémorale survient dans 80 % des cas ; la variation vient de la cause, de la taille de la nécrose, et de sa localisation. Mais même les petites nécroses sont exposées à ce risque.Faut-il traiter les formes asymptomatiques controlatérales lorsqu’une chirurgie est faite sur le côté symptomatique ?
S’il est discutable de proposer un traitement chirurgical pour une nécrose non symptomatique compte tenu du fait que la chirurgie n’est jamais sans risque, à partir du moment où le patient doit être endormi pour une chirurgie du côté symptomatique il est raisonnable de discuter le traitement conservateur pour le côté asymptomatique ; en effet, l’efficacité du traitement conservateur est d’autant meilleure qu’il est effectué précocement. Cette problématique doit être bien expliquée au patient.Traitement chirurgical : inéluctable dans la plupart des cas
Traitement conservateur
L’ostéotomie de décharge de la nécrose est le plus ancien traitement ; le but est de modifier les contraintes sur la nécrose en orientant différemment la surface portante. Cette technique a été utilisée chez l’enfant et l’adulte jeune jusque dans les années 1980. Elle n’est pratiquement plus utilisée en France et en Europe.
Le forage cervico-céphalique proposé dans les années 1960 avait pour but de diminuer la douleur et l’hyperpression osseuse.6 Son objectif est de prévenir la perte de sphéricité. Il est actuellement proposé comme geste associé aux greffes osseuses et plus particulièrement à la thérapie cellulaire.
La thérapie cellulaire dans l’ostéonécrose a été débutée en 1990.7 Du fait que l’ostéonécrose de la hanche, au départ, n’est pas une maladie mécanique mais une maladie biologique, avec conservation de la trame osseuse mais perte des cellules, l’injection de cellules souches progénitrices apparaissait logique, d’autant que les études ont montré que le nombre de cellules présentes dans l’extrémité supérieure du fémur était réduit chez les patients ayant des ostéonécroses.
La moelle osseuse de la crête iliaque a été aspirée, dans un premier temps sans concentration, pour être introduite dans la tête fémorale. Ce simple geste a permis une amélioration, l’injection de moelle osseuse se faisant par un petit trocart de diamètre de 3 à 4 mm. L’utilisation d’un diamètre faible de trocart a été rendu possible par le caractère liquide de la moelle osseuse aspirée sur la crête iliaque. Cela a permis de diminuer le nombre de fractures trochantériennes, complications iatrogènes dues au gros diamètre des trocarts (8-10 mm) lorsque l’on devait introduire de l’os spongieux ou des péronés vascularisés. La substance active de la moelle osseuse est définie comme un progéniteur mésenchymateux médullaire, appelé aussi fibroblastique, quantifiable après une culture de 10 jours dans le test in vitro des CFU-F (colony-forming unit fibroblasts). Ces cellules étant peu nombreuses, il était donc important d’augmenter la concentration des cellules sans augmenter le volume injecté. D’où l’introduction dans la thérapeutique, à partir de 1990, de la concentration de la moelle osseuse8 qui permet d’augmenter le nombre de cellules dans la moelle osseuse injectée.
Depuis les 10 dernières années, de nombreux essais thérapeutiques ont été effectués dans le monde pour étudier le bénéfice de la greffe de moelle osseuse dans les ostéonécroses.8-10 L’ensemble de ces articles a conclu à une amélioration indiscutable pour le patient, sur les douleurs et sur le plan fonctionnel, avec la possibilité d’éviter une prothèse.
Le forage cervico-céphalique proposé dans les années 1960 avait pour but de diminuer la douleur et l’hyperpression osseuse.6 Son objectif est de prévenir la perte de sphéricité. Il est actuellement proposé comme geste associé aux greffes osseuses et plus particulièrement à la thérapie cellulaire.
La thérapie cellulaire dans l’ostéonécrose a été débutée en 1990.7 Du fait que l’ostéonécrose de la hanche, au départ, n’est pas une maladie mécanique mais une maladie biologique, avec conservation de la trame osseuse mais perte des cellules, l’injection de cellules souches progénitrices apparaissait logique, d’autant que les études ont montré que le nombre de cellules présentes dans l’extrémité supérieure du fémur était réduit chez les patients ayant des ostéonécroses.
La moelle osseuse de la crête iliaque a été aspirée, dans un premier temps sans concentration, pour être introduite dans la tête fémorale. Ce simple geste a permis une amélioration, l’injection de moelle osseuse se faisant par un petit trocart de diamètre de 3 à 4 mm. L’utilisation d’un diamètre faible de trocart a été rendu possible par le caractère liquide de la moelle osseuse aspirée sur la crête iliaque. Cela a permis de diminuer le nombre de fractures trochantériennes, complications iatrogènes dues au gros diamètre des trocarts (8-10 mm) lorsque l’on devait introduire de l’os spongieux ou des péronés vascularisés. La substance active de la moelle osseuse est définie comme un progéniteur mésenchymateux médullaire, appelé aussi fibroblastique, quantifiable après une culture de 10 jours dans le test in vitro des CFU-F (colony-forming unit fibroblasts). Ces cellules étant peu nombreuses, il était donc important d’augmenter la concentration des cellules sans augmenter le volume injecté. D’où l’introduction dans la thérapeutique, à partir de 1990, de la concentration de la moelle osseuse8 qui permet d’augmenter le nombre de cellules dans la moelle osseuse injectée.
Depuis les 10 dernières années, de nombreux essais thérapeutiques ont été effectués dans le monde pour étudier le bénéfice de la greffe de moelle osseuse dans les ostéonécroses.8-10 L’ensemble de ces articles a conclu à une amélioration indiscutable pour le patient, sur les douleurs et sur le plan fonctionnel, avec la possibilité d’éviter une prothèse.
Prothèse totale de hanche
La prothèse totale de la hanche11 est l’intervention de choix dans le traitement de l’ostéonécrose de la tête fémorale. Elle permet de « démédicaliser » le malade qui peut, 3 mois après l’intervention, reprendre une vie active, professionnelle et sociale ; la reprise d’un travail de force n’est pas exclue dans certains cas. L’existence ou non d’une rupture de l’os sous-chondral conditionne les indications thérapeutiques. S’il existe une rupture de l’os sous-chondral et une perte de sphéricité, la prothèse totale de la hanche reste l’intervention la plus fiable. Les arthroplasties de la hanche ont fait des progrès dont les malades atteints de nécrose peuvent bénéficier. Une prothèse ne doit pas être considérée comme un échec, mais comme une très bonne solution qui permet à un malade de reprendre rapidement une vie sociale et professionnelle. Pourtant, la prothèse totale de la hanche, lorsque l’indication est une ostéonécrose, a une mauvaise réputation.
Risques
Le sujet le plus à controverse concernant la mise en place d’une prothèse dans l’ostéonécrose est le taux de survie de ces prothèses en comparaison à leurs indications dans la coxarthrose en raison du jeune âge des patients. Parmi les facteurs incriminés dans les échecs, on peut citer la qualité osseuse médiocre dans certains cas (patients transplantés rénaux, lupus systémique), l’âge particulièrement jeune des patients, le risque infectieux (en particulier chez les patients drépanocytaires).Influence de la cause sur les résultats
Un paramètre important à considérer dans la décision d’une prothèse totale de la hanche est la cause de l’ostéonécrose aseptique. Si dans les nécroses idiopathiques ou d’origine alcoolique on obtient de bons ou très bons résultats dans plus de 85 % des cas, ces derniers ne sont respectivement que de 77 % et 66 % quand la nécrose survient chez un transplanté rénal ou dans le cadre d’un lupus systémique ou d’une drépanocytose.Cas particulier du transplanté rénal
Dans ce contexte, le taux de descellement aseptique est relativement élevé dans la littérature. L’origine des descellements est probablement multiple (hypercorticisme et augmentation de la résorption osseuse, hyperparathyroïdie, complications de l’hémodialyse [amylose secondaire et intoxication aluminique]). Enfin, les transplantés rénaux subissent les effets indésirables des traitements adjuvants immunosuppresseurs (hypercorticisme secondaire). La durée globale d’hémodialyse avant la transplantation apparaît souvent dans la littérature ; l’hémodialyse augmente non seulement le taux de descellement aseptique mais aussi perturbe les résultats fonctionnels.Des patients jeunes
L’ostéonécrose de la hanche atteint des patients jeunes ; elle est souvent bilatérale et irréversible. La corticothérapie, l’alcool, la drépanocytose, la dyslipidémie sont les facteurs associés les plus fréquents. Le pronostic de la hanche dépend de la taille et de la localisation de la nécrose. En l’absence d’effondrement de la surface articulaire, un traitement conservateur peut être envisagé, et ce d’autant que le patient est jeune. Après la fracture sous-chondrale, l’évolution vers la douleur et le handicap fonctionnel est inéluctable. Globalement, cet événement est considéré comme le tournant de la maladie. En effet, à partir de la déformation de la tête fémorale, une évolution clinique péjorative est observée dans la grande majorité des cas, avec généralement la nécessité de pose d’une prothèse totale de hanche.
Références
1. Mont MA, Zywiel MG, Marker DR, McGrath MS, Delanois RE. The natural history of untreated asymptomatic osteonecrosis of the femoral head: a systematic literature review J Bone Joint Surg Am 2010;92:2165-70.
2. Hernigou P, Bachir D, Galacteros F. The natural history of symptomatic osteonecrosis in adults with sickle-cell disease. J Bone Joint Surg Am 2003;85:500-4.
2 bis. Hernigou P, Flouzat-Lachaniette CH, Delambre J, Poignard A, Allain J, Chevallier N, Rouard H. Osteonecrosis repair with bone marrow cell therapies: state of the clinical art. Bone 2015;70:102-9
3. Pijnenburg L, Felten R, Javier RM. Ostéonécroses aseptiques, une revue générale des ostéonécroses de la hanche, et au-delà. Rev Med Interne 2020;41:27-36.
4. Paolaggi JB, Le Parc JM, Arfi S. Severe arthralgia after pulse corticoids therapy in transplant patients. J Rhumatol 1987;14:1077-8.
5. Mitchell DG, Rao VM, Dalinka MK, et al. Femoral head avascular necrosis: correlation of MR imaging, radiographic staging,radionuclide imaging, and clinical findings. Radiology 1987;162:709-15.
6. Ficat RP. Idiopathic bone necrosis of the femoral head. Early diagnosis andtreatment. J Bone Joint Surg Br 1985;67:3-9.
7. Hernigou P, Ukaj S, Pariat J, Flouzat-Lachaniette CH. La médecine régénérative au service de l’ostéonécrose. Rev Rhum 2019;8:301-5.
8. Hernigou P, Beaujean F. Treatment of osteonecrosis with autologous bone marrow grafting. Clin Orthop Relat Res 2002;405:14-23.
9. Hernigou P, Dubory A, Homma Y, et al. Cell therapy versus simultaneous contralateral decompression in symptomatic corticosteroid osteonecrosis: a thirty-year follow-up prospective randomized study of one hundred and twenty-five adult patients. Int Orthop 2018;42:1639-49.
10. Papakostidis C, Tosounidis TH, Jones E, Giannoudis PV. The role of «cell therapy» in osteonecrosis of the femoral head. Acta Orthop 2016;87:72-8.
11. Hernigou P. Prothèse de la hanche. Rev Prat 2019;69:1121-3.
2. Hernigou P, Bachir D, Galacteros F. The natural history of symptomatic osteonecrosis in adults with sickle-cell disease. J Bone Joint Surg Am 2003;85:500-4.
2 bis. Hernigou P, Flouzat-Lachaniette CH, Delambre J, Poignard A, Allain J, Chevallier N, Rouard H. Osteonecrosis repair with bone marrow cell therapies: state of the clinical art. Bone 2015;70:102-9
3. Pijnenburg L, Felten R, Javier RM. Ostéonécroses aseptiques, une revue générale des ostéonécroses de la hanche, et au-delà. Rev Med Interne 2020;41:27-36.
4. Paolaggi JB, Le Parc JM, Arfi S. Severe arthralgia after pulse corticoids therapy in transplant patients. J Rhumatol 1987;14:1077-8.
5. Mitchell DG, Rao VM, Dalinka MK, et al. Femoral head avascular necrosis: correlation of MR imaging, radiographic staging,radionuclide imaging, and clinical findings. Radiology 1987;162:709-15.
6. Ficat RP. Idiopathic bone necrosis of the femoral head. Early diagnosis andtreatment. J Bone Joint Surg Br 1985;67:3-9.
7. Hernigou P, Ukaj S, Pariat J, Flouzat-Lachaniette CH. La médecine régénérative au service de l’ostéonécrose. Rev Rhum 2019;8:301-5.
8. Hernigou P, Beaujean F. Treatment of osteonecrosis with autologous bone marrow grafting. Clin Orthop Relat Res 2002;405:14-23.
9. Hernigou P, Dubory A, Homma Y, et al. Cell therapy versus simultaneous contralateral decompression in symptomatic corticosteroid osteonecrosis: a thirty-year follow-up prospective randomized study of one hundred and twenty-five adult patients. Int Orthop 2018;42:1639-49.
10. Papakostidis C, Tosounidis TH, Jones E, Giannoudis PV. The role of «cell therapy» in osteonecrosis of the femoral head. Acta Orthop 2016;87:72-8.
11. Hernigou P. Prothèse de la hanche. Rev Prat 2019;69:1121-3.
Dans cet article
- Prévalence globale
- Maladies associées
- Facteurs de risque
- IRM de la hanche devant une douleur inexpliquée de la hanche (ou du genou)
- Diagnostic et pronostic : la révolution IRM
- Diagnostic différentiel : une affaire de spécialiste
- Traitement médical ou plutôt conseil médical
- Traitement chirurgical : inéluctable dans la plupart des cas
- Des patients jeunes