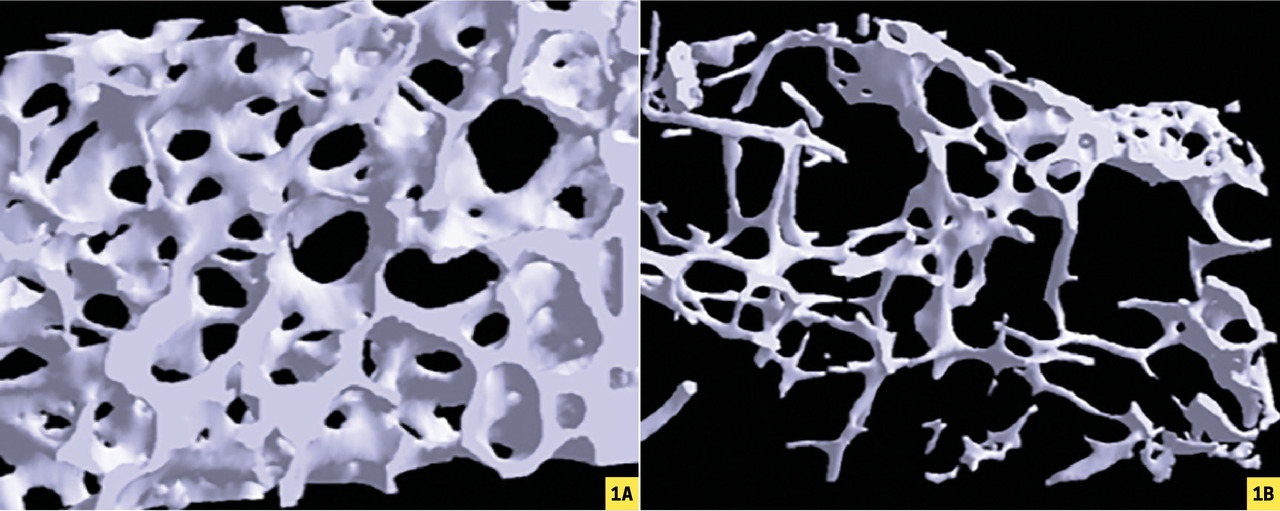
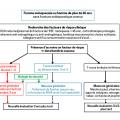
Au cours de cette pathologie, le squelette devient anormalement fragile, expliquant la survenue de fractures spontanées ou après une simple chute de la hauteur du patient. Le spectre des fractures ostéoporotiques est très large mais les plus emblématiques sont les vertébrales et celles du bassin (extrémité supérieure du fémur [ESF], cadre obturateur, sacrum) qui ne surviennent jamais, en l’absence de traumatisme violent, chez les sujets de moins de 50 ans en bonne santé.
Rappels physiopathologiques
Au cours de la croissance, la formation l’emporte sur la résorption et la masse osseuse augmente pour atteindre un maximum vers l’âge de 25 ans.
Ce capital osseux maximal (ou pic de masse osseuse), est très variable d’un individu à l’autre, en raison de divers facteurs : génétiques (pour 70 %) ; nutritionnels : apport de protéines, de calcium et d’énergie ; biomécaniques : activité physique régulière pendant l’enfance et l’adolescence ; hormonaux : estradiol, testostérone, parathormone (PTH) et hormone de croissance jouent un rôle majeur dans l’acquisition de ce capital.
Ainsi, certains individus ont vers 25 ans une densité osseuse (DO) basse de façon constitutionnelle. Elle deviendra plus tard – lors de la ménopause et du vieillissement – un facteur de risque de fracture. En l’absence de pathologies, le capital osseux acquis entre 20 et 25 ans , qu’il soit faible, moyen ou élevé, reste stable pendant une vingtaine d’années.
Des causes multiples
Chez les hommes, le même processus survient environ 10 ans plus tard, en raison du déficit androgénique qui progresse avec l’âge : à partir de 50 ans , la testo- stérone totale et sa forme biodisponible plasmatique diminuent respectivement d’environ 1 % et 2 % par an.
Corticothérapie prolongée et alcoolisme provoquent des ostéoporoses graves selon le mécanisme inverse : maintien de la résorption mais dépression majeure de la formation avec des travées osseuses de plus en plus fines, puis perforées.1
Les causes sont souvent multiples et intriquées chez un même patient. Âge, tabagisme, alcoolisme, anti-androgènes ou anti-estrogènes, sédentarité, dénutrition, chutes multiples, handicap neurosensoriel, carence en vitamine D, maladies inflammatoires, insuffisance rénale, cardiaque, respiratoire… accélèrent les processus pathologiques et favorisent la survenue de fractures plus précoces et plus fréquentes.
Certains facteurs ont un impact majeur :
– âge avancé : risque de fracture majoré de 50 % tous les 10 ans , à partir de 50 ans ; pour une même DO, il est multiplié par plus de 3 entre 50 et 80 ans ;
– corticothérapie prolongée : en l’absence de prévention, la perte osseuse est précoce et souvent massive (50 % de ces patients deviennent ostéoporotiques) ;
– handicap neurosensoriel (cécité, hémiplégie, Parkinson, démence…) : risque de fracture multiplié par 3 à 5 pour un même capital osseux ;
– ménopause précoce (avant 45 ans) ou aggravée par la prescription d’un anti-estrogène au décours d’un cancer du sein.
Fractures ostéoporotiques : 250 000 Français chaque année
La réalité hospitalière est différente : tous les services d’orthopédie, de rhumatologie et de gériatrie sont débordés par l’afflux de patients fracturés âgés de plus de 50 ans ; le nombre de journées d’hospitalisation dédiées est très supérieur à celui liés aux AVC, aux syndromes coronaires, aux décompensations de BPCO ou au cancer du sein.2
Une étude de la Caisse nationale d’Assurance maladie a confirmé ces chiffres : au cours de l’année 2013,3 177 000 patients de plus de 50 ans ont été hospi- talisés en France pour une fracture ostéoporotique, tous sites anatomiques confondus. Étaient concernées 3 femmes pour 1 homme, âgés de plus de 70 ans pour les deux tiers. Leur nombre a augmenté de 9 % entre 2011 et 2013. Douze mois plus tard, 6 325 patients sont décédés (7 %), 12 % se sont « refracturés » et 40 % ont été hospitalisés une deuxième fois. Le taux de décès était 2 fois plus important chez les hommes que chez les femmes. La prise en charge s’est avérée insuffisante, voire catastrophique : à 1 an, seulement 10 % avaient eu une densitométrie et moins de 20 % un traitement de fond adapté. Pourtant, il a été montré que dans les 5 ans suivant une première fracture, 25 % des individus de plus de 70 ans sont de nouveau hospitalisés pour le même motif.4
Les fractures ostéoporotiques majeures (bassin, rachis, humérus, fémur, tibia) sont associées à une forte surmortalité liée à la décompensation de maladies sous-jacentes (insuffisance cardiaque, respiratoire ou rénale, troubles cognitifs) ou aux complications de l’hospitalisation et de la chirurgie (escarres, infection, thrombose veineuse, accident artériel). Elle est d’autant plus élevée que le patient est très âgé, justifiant un dépistage et un traitement chez les vieillards, y compris après 85 ans , dès lors que l’espérance de vie dépasse 2 ans.4 Enfin, elle est nettement plus marquée chez l’homme que chez la femme.
La mortalité la plus importante (15 à 20 % dans l’année qui suit) est observée après une fracture du bassin (ESF et cadre obturateur). Elle est 3 fois supérieure à la mortalité notée dans la même tranche d’âge (en l’absence de fracture) et est équivalente à celle constatée après un infarctus du myocarde survenu au même âge.
Traitements de fond : trop peu prescrits
Contrairement aux idées reçues, la tolérance est très bonne. Le risque d’ostéonécrose de la mâchoire est largement surestimé. Cette complication, très rare, a une incidence comprise entre 1/10 000 et 1/100 000 patients quand les posologies sont conformes aux recommandations.9
Le risque de fractures atypiques du fémur est également très faible, surtout lié à des durées de traitement prolongées au-delà de 8 à 10 ans.9 Enfin, celui d’insuffisance rénale aiguë ne concerne que l’acide zolédronique. Il est estimé à moins de 1/10 000 patients si les précautions sont respectées : perfusion lente sur au moins 20 minutes, chez un patient bien hydraté (environ 5 verres d’eau/j pendant 48 h) et dont la clairance de la créatinine est > 40 mL/min. Ces médicaments ont un effet qui persiste après leur arrêt.
Le raloxifène (Evista, Optruma, per os) de la famille des SERMs (comme le tamoxifène) est agoniste des estrogènes sur le tissu osseux et antagoniste au niveau du sein, il prévient la perte osseuse, réduit le risque de fracture vertébrale ([FV] mais pas celles de l’EFS) d’environ 30 à 50 % et baisse aussi celui de cancer du sein de 50 %, sans conséquences particulières sur l’utérus (pas d’augmentation du risque néoplasique).
C’est donc un médicament pour les femmes méno- pausées dans la tranche d’âge 50-70 ans ayant une ostéoporose débutante. En raison d’une légère augmentation du risque de phlébite et d’embolie pulmonaire, il est contre-indiqué en cas d’antécédent thrombo-embolique veineux.
Le tériparatide, fragment de la PTH humaine (Forsteo, stylo prérempli, 20 μg, 1 x/j) est particulièrement efficace chez les patients ayant de multiples fractures vertébrales. La prescription, remboursée pour une durée limitée à 18 mois, doit être suivie par une séquence de bisphosphonates pendant 3 à 5 ans. Comme pour le raloxifène, le rapport bénéfices/risques est très bon.10, 11
Enfin, le dénosumab (Prolia), anticorps monoclonal bloquant le recrutement et la maturation des ostéoclastes, est indiqué en deuxième intention, après échec ou intolérance aux bisphosphonates. Ne se fixant pas dans l’os, il est dénué d’effet rémanent. Son arrêt doit être relayé par un bref traitement antirésorbeur.
La prise en charge diminue de 50 % le risque de fracture ultérieure (jusqu’à 70 % pour les FV avec les bisphosphonates ou le tériparatide). Ces performances sont très supérieures à celles des statines ou de l’aspirine dans la prévention des événements artériels après un syndrome coronaire.
Repérer les patients à haut risque de fracture
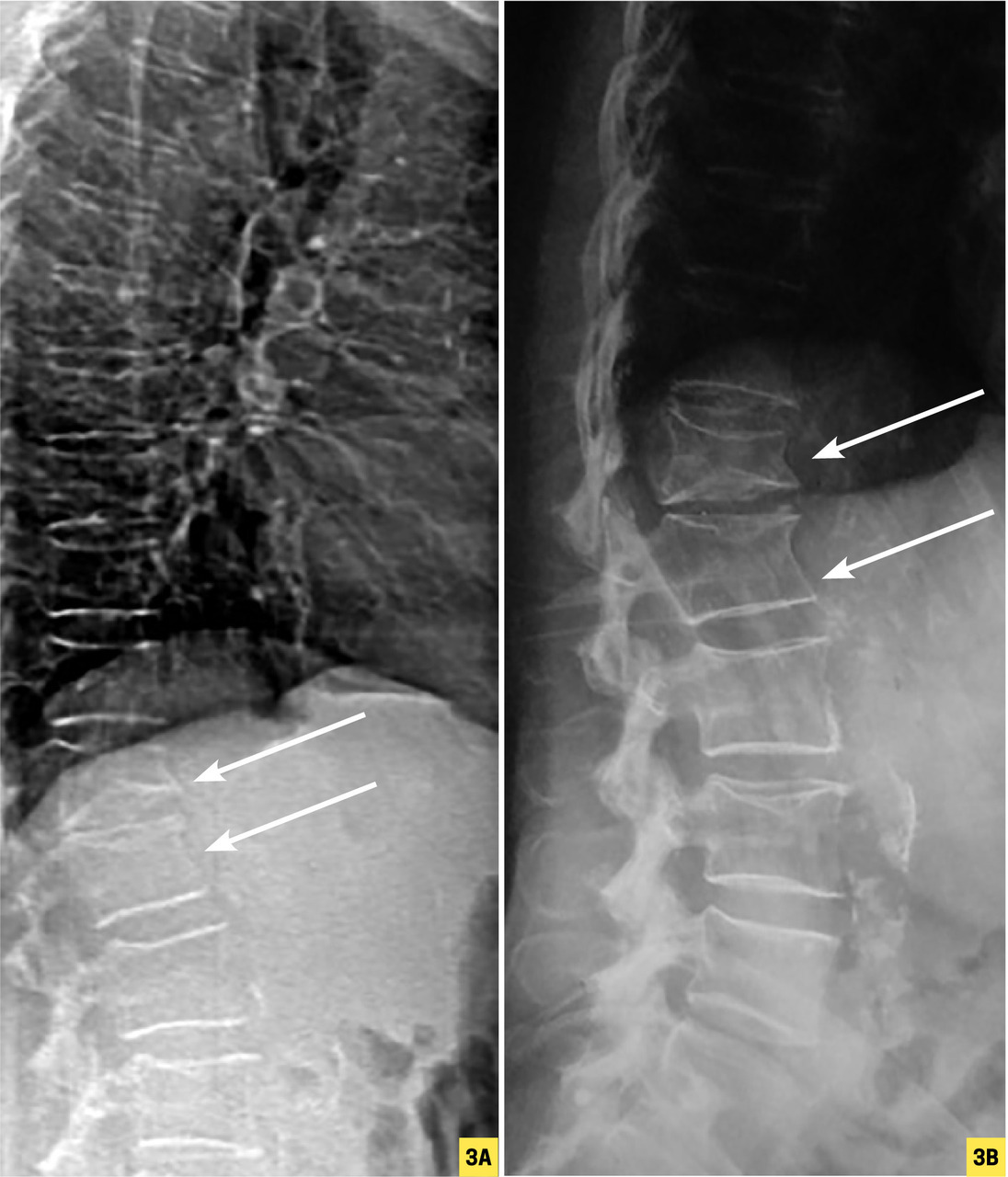
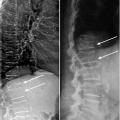
Des radiographies standard du rachis lombaire et thoracique sont indispensables en cas de densité osseuse basse, première fracture non traumatique, réduction de taille > 3 cm ou rachialgies. En effet, ces clichés révèlent souvent des fractures vertébrales peu symptomatiques (rachialgies trans itoires et banalisées) survenant chez 20 à 40 % des patients au cours de l’ostéoporose cortisonique,12 et également lors des ostéoporoses associées à une ménopause précoce ou à un traitement anti-aromatase,13 chez les sujets ayant une gammapathie monoclonale de signification indéterminée (MGUS)14 ou encore avec une fracture de l’ESF. Une fracture vertébrale est une indication claire à la mise en route d’un traitement de fond ; des FV multiples sont un critère de gravité et d’évolutivité justifiant la prescription de tériparatide suivie d’un bisphosphonate.
Qu’apporte la densitométrie osseuse ?
Quelle méthode ?
1. en fonction du site de mesure (
2. quel que soit le site (avant-bras, rachis lombaire ou col fémoral), la DO est fortement corrélée avec le risque de survenue ultérieure de fractures non traumatiques ;
3. son pouvoir prédictif concerne toutes les localisations : poignet, vertèbre, côtes, bassin, cheville, humérus et ESF (mais supériorité de la mesure fémorale pour prédire le risque de fracture de l’ESF).
La mesure vertébrale antéro-postérieure, classique, inclut au minimum 30 % d’os cortical, essentiellement contenu dans l’arc postérieur, et 70 % d’os trabéculaire. Ce tissu osseux, dont le remodelage est très important, est plus sensible aux modifications hormonales ou aux pathologies. Avant 70 ans , c’est le site idéal pour observer le retentissement osseux trabéculaire d’une carence hormonale, d’une corticothérapie, d’une intoxication alcoolotabagique. En revanche, chez les personnes âgées, l’arthrose rachidienne provoque une augmentation de la masse osseuse de l’arc postérieur, majorant artificiellement la densité osseuse vertébrale. C’est une cause connue de surestimation et de faux négatif. La reproductibilité de la mesure, de 1 à 2 %, est suffisante pour le suivi longitudinal des patients (cinétique de la perte osseuse ou gain de masse sous traitement).
Pour l’extrémité supérieure du fémur, plusieurs sites sont possibles : col fémoral (60 % d’os cortical), trochanter (50 %), zone intertrochantérienne (80 %) et triangle de Ward, région centrale de l’ESF ne contenant que de l’os trabéculaire. La mesure de la DO du col fémoral est la référence. Compte tenu de sa richesse en os cortical dont le remodelage est plus lent, elle est moins sensible au changement lors des pathologies. En revanche, c’est le site idéal après 70 ans , car non influencé par l’arthrose. La reproductibilité est légèrement moins bonne, de l’ordre de 2 à 3 % ; elle est donc moins adaptée au suivi longitudinal.
Au niveau de l’avant-bras, il est possible de mesurer la DO du radius proximal (95 % d’os cortical) ou ultra- distal (65 % d’os trabéculaire). La reproductibilité est bonne (1 à 2 %). La valeur prédictive en termes de risque de fracture est certaine, mais le risque relatif (pour une diminution de DO de 1 déviation standard) est plus faible que pour les autres sites, de 1,5 environ. Pour certains, cette mesure serait également intéressante au cours de l’hyperparathyroïdie primitive.
Ainsi, avant 70 ans , la mesure couplée rachis lombaire + ESF apporte toutes les informations utiles. Après cet âge, celle de l’ESF peut suffire. La mesure au poignet n’est utile en routine que lorsque les autres sites ne sont pas mesurables (arthrose lombaire et 2 prothèses totales de hanche, par exemple).
Après 50 ans , le T-score est le critère habituel d’interprétation (
En pratique, la règle est très simple : c’est toujours le T-score le plus bas (lombaire ou fémoral) qui doit être pris en compte. Enfin, l’interprétation ne doit pas se faire « à la lettre ». Il y a souvent un écart de 0,3 déviation standard pour un même individu, si la mesure est faite avec 2 appareils différents. Cette valeur doit toujours être confrontée au contexte clinique.
Quel intérêt ?
Dans la pratique, le médecin est confronté à 2 situations différentes : le sujet indemne de fracture dont on cherche à évaluer le risque afin de mettre en œuvre des mesures préventives ; la personne déjà victime d’une fracture typique pour qui on souhaite conforter le diagnostic d’ostéoporose.
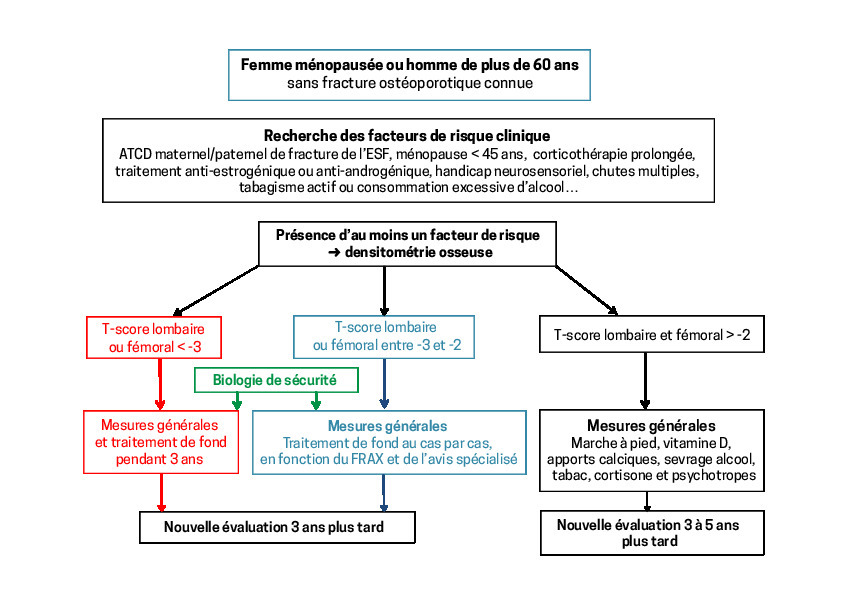
En l’absence de fracture, il est utile de mesurer la DO chez tous les individus ayant un ou plusieurs facteurs de risque d’ostéoporose (
Situations cliniques où le dépistage est essentiel :
– femme ménopausée vers 60-65 ans , avec un (ou plusieurs) facteur(s) de risque clinique (cf. supra) ;
– patiente de 35 ans , soumise à une corticothérapie quotidienne pour une maladie de Crohn ;
– homme de 70 ans atteint d’un cancer de la prostate et recevant un traitement anti-androgénique ;
– femme de 50 ans , ménopausée vers 35 ans et sans hormonothérapie substitutive depuis 15 ans ;
– femme de 55 ans recevant une anti-aromatase au décours d’un cancer du sein.
La décision thérapeutique peut s’appuyer sur l’outil FRAX, disponible sur internet, qui intègre 9 facteurs de risque clinique et la densitométrie (T-score du col fémoral). Validé dans des cohortes de plus de 100 000 patients, il calcule en moins de 60 secondes le risque absolu de fracture à 10 ans :9
– si ce risque est inférieur à 7 % : on envisage uniquement des mesures générales (
– s’il dépasse 15 % : on propose un traitement de fond ;
– entre 7 et 15 % : on demande l’avis du rhumatologue.
En revanche, après une fracture de l’ESF chez un sujet de plus de 65 ans , mesurer la DO n’est pas indispensable au diagnostic mais fournit une valeur de départ, avant traitement. Après une fracture vertébrale, une DO normale ou élevée remet en cause le diagnostic d’ostéoporose : il faut évoquer une cause traumatique, une déformation vertébrale sans vraie fracture, une fracture pathologique au cours d’un cancer ou d’un myélome. Lorsque le poignet, la cheville ou l’humérus sont concernés, la densitométrie est indispensable car, normale ou élevée, elle fait suspecter un mécanisme traumatique : torsion du membre, chute avec réception sur un objet contondant comme une bordure de trottoir…
Quelles limites ?
Une densité osseuse basse est un puissant facteur de risque de facture mais n’est pas synonyme d’ostéoporose. Elle peut témoigner de bien d’autres maladies osseuses (myélome, ostéomalacie, hyperparathyroïdie). Attention aux signes d’alerte (toujours absents au cours de l’ostéoporose primitive) :
– survenue des fractures avant 50 ans ;
– douleurs nocturnes ou persistant au repos ;
– fièvre ;
– amaigrissement supérieur à 5 % du poids corporel ;
– symptômes neurologiques (cruralgie, sciatique, déficit moteur ou sensitif, syndrome pyramidal) ;
– signes viscéraux.
La répétition à très court terme de plusieurs fractures vertébrales (par exemple 3 sur une période de 3 à 6 mois) est également suspecte.
Ainsi, le bilan biologique de sécurité est toujours indispensable, même si le contexte clinique semble évident : calcémie, phosphatémie, phosphatases alcalines totales, créatininémie, 25-hydroxyvita- mine D, hémogramme, électrophorèse des protéines et CRP. Ces paramètres sont normaux au cours de l’ostéoporose, hormis la vitamine D qui est souvent basse après 70 ans. Dans certains cas, d’autres examens sont utiles (
Chez environ 50 % des patients victimes d’une fracture ostéoporotique typique, la DO est intermédiaire, non effondrée, avec des T-scores entre -1 et -2,5.15 En effet, ce paramètre n’est que l’un des facteurs de risque de fracture. Au cours de la corticothérapie par exemple, la qualité de l’os est fortement impactée et les fractures surviennent avant même la diminution drastique de densité, ce qui fait toute la gravité de cette ostéoporose secondaire. Les chuteurs multiples de plus de 80 ans peuvent aussi en être victimes, alors que leur densité osseuse n’est pas effondrée.
Selon les dernières recommandations françaises,9 l’indication thérapeutique prend en compte le contexte clinique (fracture majeure ou mineure, facteurs de risque) et la DO (
Quel suivi ?
Après une première séquence thérapeutique de 3 à 5 ans , le bilan comprend suivi densitométrique et clinique : poids, évolution de la taille sur la période (toute perte de 2 cm évoque de possibles FV), circonstances de survenue des éventuelles fractures incidentes, nouvelles pathologies ou traitements ostéo- péniants (par exemple, début d’une corticothérapie pour une maladie inflammatoire), examens biologiques (calcémie, fonction rénale et 25-OH-vitamine D), recherche de nouvelles FV (radiographies ou VFA).
Il est important d’utiliser le même densitomètre que lors de l’évaluation initiale. Les variations minimes sont rarement cliniquement significatives. Une stabilisation ou un gain traduit l’efficacité du traitement. En cas de baisse de plus de 5 %, il faut s’interroger sur l’apparition d’une nouvelle cause (début d’une corticothérapie massive, par exemple) mais surtout sur l’observance : médicament non pris ou de façon irrégulière, bisphosphonate administrés après le repas, persistance d’une profonde carence en vitamine D…
Améliorer les parcours de soins, telle est l’ambition collective de la communauté médicale ! Le dépistage et le traitement des facteurs de risque artériel ont fait reculer la mortalité cardiovasculaire en France et en Europe. Les mêmes succès sont possibles dans la prévention des fractures ostéoporotiques.
- en fonction de la valeur absolue, en g/cm2 : cette densité surfacique est difficile à interpréter en l’absence de valeur de référence (variable selon les constructeurs) ;
- selon le Z-score, qui mesure l’écart, exprimé en déviation standard, entre la valeur du patient et la moyenne des sujets normaux de mêmes âge et sexe ;
- le T-score, qui mesure l’écart (en DS) entre la valeur du patient et la moyenne des adultes jeunes (entre 20 et 30 ans) du même sexe.
Sevrage tabagique et des médicaments non indispensables (opiacés, hypnotiques)
Réduction de la consommation d’alcool : < 7 verres/semaine
Alimentation apportant 3 produits laitiers par jour
Supplémenter en vitamine D et s’assurer que la concentration est bien comprise entre 75 et 100 nmol/L
Encourager largement l’activité physique en dehors du domicile ; objectif minimal : 30 minutes de marche par jour
Mesures de prévention des chutes : traiter une éventuelle cataracte, chaussons fermés à l’arrière et antidérapants, tapis antidérapants dans la salle de bain…
Densité osseuse basse chez un homme : testostéronémie totale avant 50 ans , biodisponible après cet âge (hypogonadisme), paramètres ferriques (hémochromatose), bilan hépatique (suspicion d’alcoolisme), tryptase (mastocytose).
DO basse avec amaigrissement franc : albuminémie, folates, B12, fer (syndrome de malabsorption), T4 et TSH (hyperthyroïdie), nouvelle lecture de l’électrophorèse des protéines pour vérifier l’absence d’hypogammaglobulinémie (possible myélome à chaînes légères).
DO basse avec hypercalcémie modérée : PTH pour rechercher une hyperparathyroïdie primitive, endocrinopathie fréquente chez les femmes de plus de 50 ans. Si la PTH est élevée, hyperparathyroïdie primitive hautement probable ; si elle est basse, demander un avis spécialisé pour envisager les autres causes d’hypercalcémie, moins courantes : surconsommation de calcium et de vitamine D, myélome, métastases osseuses, sarcoïdose.
DO basse avec hypocalcémie ou hypophosphatémie : albuminémie pour calculer la calcémie corrigée, PTH pour dépister une hyperparathyroïdie secondaire à la carence en vitamine D (sujet très âgé ou cloîtré) ; dans cette situation, la prise de vitamine D normalise dans un délai de 1 à 2 mois la calcémie, la phosphorémie et le taux de cette vitamine.
DO basse avec pic d’allure monoclonal : immuno-électrophorèse des protéines plasmatiques et urinaires, radio du squelette, sans inquiéter le patient inutilement car il s’agit probablement d’une gammapathie monoclonale de signification indéterminée, 50 fois plus fréquente que le myélome.
1. Densitométrie : comment exprimer les résultats ?
Trois modalités :
- en fonction de la valeur absolue, en g/cm2 : cette densité surfacique est difficile à interpréter en l’absence de valeur de référence (variable selon les constructeurs) ;
- selon le Z-score, qui mesure l’écart, exprimé en déviation standard, entre la valeur du patient et la moyenne des sujets normaux de mêmes âge et sexe ;
- le T-score, qui mesure l’écart (en DS) entre la valeur du patient et la moyenne des adultes jeunes (entre 20 et 30 ans) du même sexe.
2. Prévention du risque de fracture : mesures générales
Sevrage tabagique et des médicaments non indispensables (opiacés, hypnotiques)
Réduction de la consommation d’alcool : < 7 verres/semaine
Alimentation apportant 3 produits laitiers par jour
Supplémenter en vitamine D et s’assurer que la concentration est bien comprise entre 75 et 100 nmol/L
Encourager largement l’activité physique en dehors du domicile ; objectif minimal : 30 minutes de marche par jour
Mesures de prévention des chutes : traiter une éventuelle cataracte, chaussons fermés à l’arrière et antidérapants, tapis antidérapants dans la salle de bain…
3. Examens utiles dans certains cas
Densité osseuse basse chez un homme : testostéronémie totale avant 50 ans , biodisponible après cet âge (hypogonadisme), paramètres ferriques (hémochromatose), bilan hépatique (suspicion d’alcoolisme), tryptase (mastocytose).
DO basse avec amaigrissement franc : albuminémie, folates, B12, fer (syndrome de malabsorption), T4 et TSH (hyperthyroïdie), nouvelle lecture de l’électrophorèse des protéines pour vérifier l’absence d’hypogammaglobulinémie (possible myélome à chaînes légères).
DO basse avec hypercalcémie modérée : PTH pour rechercher une hyperparathyroïdie primitive, endocrinopathie fréquente chez les femmes de plus de 50 ans. Si la PTH est élevée, hyperparathyroïdie primitive hautement probable ; si elle est basse, demander un avis spécialisé pour envisager les autres causes d’hypercalcémie, moins courantes : surconsommation de calcium et de vitamine D, myélome, métastases osseuses, sarcoïdose.
DO basse avec hypocalcémie ou hypophosphatémie : albuminémie pour calculer la calcémie corrigée, PTH pour dépister une hyperparathyroïdie secondaire à la carence en vitamine D (sujet très âgé ou cloîtré) ; dans cette situation, la prise de vitamine D normalise dans un délai de 1 à 2 mois la calcémie, la phosphorémie et le taux de cette vitamine.
DO basse avec pic d’allure monoclonal : immuno-électrophorèse des protéines plasmatiques et urinaires, radio du squelette, sans inquiéter le patient inutilement car il s’agit probablement d’une gammapathie monoclonale de signification indéterminée, 50 fois plus fréquente que le myélome.
2. Lippuner K, von Overbeck J, Perrelet R, Bosshard H, Jaeger P. Incidence and direct medical costs of hospitalizations due to osteoporotic fractures in Switzerland. Osteoporos Int 1997;7:414-25.
3. Bouvard B, Leboucher C, Douge M, et al. Parcours de soins avant et après hospitalisation pour fracture ostéoporotique chez les sujets de plus de 50 ans. Données nationales de l’assurance maladie 2011-2013. Rev Rhum 2015;82(suppl 1):A37.
4. Bliuc D, Nguyen ND, Nguyen TV, Eisman JA, Center JR. Compound risk of high mortality following osteoporotic fracture and refracture in elderly women and men. J Bone Miner Res 2013;28:2317-24.
5. Black DM, Delmas PD, Eastell R, et al.; HORIZON Pivotal Fracture Trial. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007;356:1809-22.
6. Lyles KW, Colón-Emeric CS, Magaziner JS, et al; for the HORIZON Recurrent Fracture Trial. Zoledronic Acid in Reducing Clinical Fracture and Mortality after Hip Fracture. N Engl J Med 2007;357:1799-806.
7. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG. Adjuvant bisphosphonate treatment in early breast cancer: meta-analyses of individual patient data from randomised trials. Lancet 2015;386:1353-61.
8. Hadji P, Coleman RE, Wilson C, et al. Adjuvant bisphosphonates in early breast cancer: consensus guidance for clinical practice from a European Panel. Ann Oncol 2016;27:379-90.
9. Briot K, Roux C, Thomas T, et al. 2018 update of French recommendations on the management of postmenopausal osteoporosis. Joint Bone Spine 2018;85:519-30.
10. Barrett-Connor E, Mosca L, Collins P, et al.; Raloxifene Use for The Heart (RUTH) Trial Investigators. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med 2006;355:125-37.
11. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344:1434-41.
12. Briot K, Cortet B, Roux C, et al.; Bone Section of the French Society for Rheumatology (SFR) and Osteoporosis Research and Information Group (GRIO). 2014 update of recommendations on the prevention and treatment of glucocorticoid-induced osteoporosis. Joint Bone Spine 2014;81:493-501.
13. Bouvard B, Soulié P, Hoppé E, et al. Fracture incidence after 3 years of aromatase inhibitor therapy. Ann Oncol 2014;25:843-7.
14. Piot JM, Royer M, Schmidt-Tanguy A, et al. Factors associated with an increased risk of vertebral fracture in monoclonal gammopathies of undetermined significance. Blood Cancer J 2015;5:e345.
15. Lespessailles E, Cortet B, Legrand E, Guggenbuhl P, Roux C. Low-trauma fractures without osteoporosis. Osteoporos Int 2017;28:1771-8.

 Encadrés
Encadrés