L’insuffisance respiratoire est définie par l’incapacité des poumons à assurer leur fonction essentielle : apporter l’oxygène (O2) à l’organisme. En cas d’insuffisance respiratoire, quelle qu’en soit la cause, le traitement symptomatique le plus logique est d’apporter un supplément d’O2 dans les voies respiratoires. En France, la prescription d’oxygénothérapie au domicile a augmenté de 88 % entre 2006 et 2019, avec plus de 139 000 patients traités en 2019 (208/100 000 habitants).1 Les études ont concerné surtout les bronchopneumopathies chroniques obstructives (BPCO), et leurs résultats ont été extrapolés aux autres causes d’insuffisance respiratoire chronique (IRC).
Tout médecin peut prescrire une oxygénothérapie à court terme pour des soins palliatifs ou en cas d’insuffisance respiratoire transitoire.
Oxygénothérapie des insuffisances respiratoires chroniques en état stable
Chez l’adulte, l’indication de l’ oxygénothérapie à long terme (OLT) repose sur deux mesures des gaz du sang artériel en air ambiant, à quinze jours d’intervalle, en état stable, et une mesure des gaz du sang artériel sous oxygène. Le renouvellement nécessite une mesure des gaz du sang artériel en air ambiant ou sous O2.
La mesure de la saturation pulsée en oxygène (SpO2) est utile pour l’indication des gaz du sang et doit être systématique à chaque consultation de patients sous OLT.
L’objectif de l’oxygénothérapie est une SpO2 comprise entre 88 et 92 %.2 Le tableau 1 résume les indications de l’OLT dans les IRC en fonction des résultats des gaz du sang mesurés au repos en état stable, en air ambiant.
Indications précises
En cas de BPCO
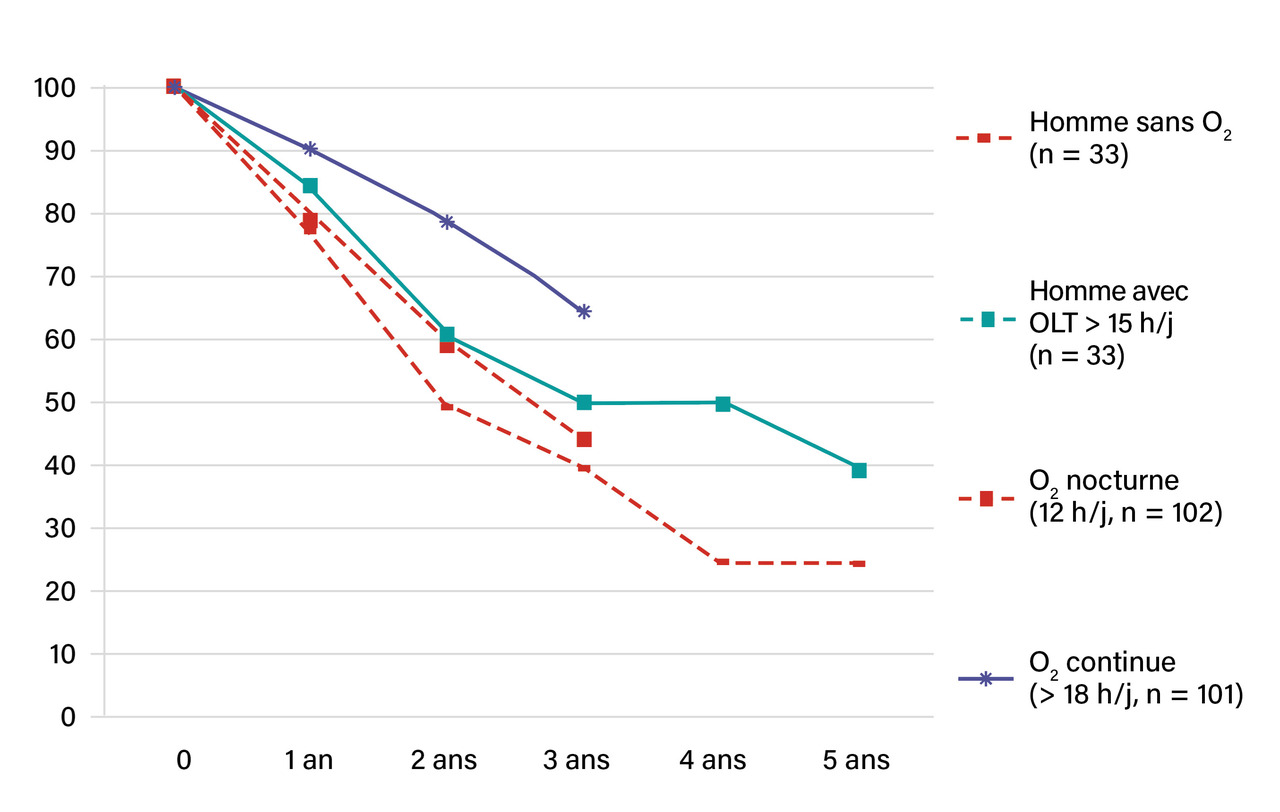
Deux études pivots ont permis de définir les indications de l’OLT pour les BPCO (fig. 1) :
- l’étude du Nocturnal Oxygen Therapy Trial Group3 a inclus des patients souffrant de BPCO hypoxémiques, randomisés entre O2 en continu (n = 101), et pendant douze heures la nuit (n = 102). À deux ans, la mortalité était respectivement de 22,4 % et de 40,8 % (p = 0,01) ;
- le Report of the Medical Research Council Working Party4 a inclus 87 patients randomisés entre O2 pendant plus de quinze heures par jour dans le bras traité et pas d’O2 dans le bras témoin. À cinq ans, la mortalité globale était respectivement de 45 % et de 66 %.
Des études plus récentes de patients moins hypoxémiques (PaO2 moyenne supérieure à 55 mmHg) n’ont pas montré de gain de survie sous OLT5 mais trouvent une amélioration de l’endurance à l’effort.6 Chez des personnes atteintes de BPCO ayant uniquement une désaturation à l’effort, l’oxygénothérapie exclusivement d’effort est sans effet sur le risque d’hospitalisation ou de décès dans l’étude LOTT.7 En France, l’oxygénothérapie administrée exclusivement à l’effort en cas de BPCO n’est pas reconnue, sauf en phase de réadaptation. Chez des patients atteints de BPCO n’ayant qu’une désaturation nocturne isolée sans apnées du sommeil, l’étude INOX8 n’a pas montré l’intérêt de l’oxygénothérapie nocturne.
Dans les autres insuffisances respiratoires chroniques
En dehors des BPCO, les indications de l’OLT les plus fréquentes sont les pathologies interstitielles chroniques, notamment les fibroses pulmonaires.9 L’hypoxémie est souvent profonde et impose des débits d’O2 élevés. Aucune étude n’a montré d’impact de l’OLT sur la survie de ces patients.
L’oxygénothérapie exclusivement à l’effort peut être proposée pour améliorer la qualité de vie10 et la capacité d’effort11. La désaturation à l’effort doit être étayée par un test de marche de six minutes ou une épreuve d’effort fonctionnelle. La titration du débit d’O2 à l’effort utilise ces mêmes tests. Il n’y a pas de recommandations dans le cadre des pneumopathies interstitielles chroniques pour les désaturations nocturnes isolées.
Nombreux bénéfices de l’oxygénothérapie
Outre des gains de survie dans la BPCO, l’OLT permet :
- une amélioration des capacités d’exercice physique,12 de la qualité du sommeil, de la qualité de vie à sévérité égale, et des performances neuropsychiques ;
- une diminution des hospitalisations pour exacerbations de BPCO,13 et de la vasoconstriction artérielle pulmonaire hypoxique, favorisant une baisse de la pression artérielle pulmonaire.
Risques de l’OLT
Aggravation de l’hypercapnie
Le risque de l’oxygénothérapie le plus connu est l’aggravation d’une hypercapnie préexistante. Les trois mécanismes en sont :14
- un émoussement des centres respiratoires à l’hypercapnie ;
- une aggravation de l’effet shunt par levée de la vasoconstriction hypoxique ;
- un effet Haldane (en présence d’O2, le CO2 se dissocie davantage de l’hémoglobine).
Au moindre doute d’aggravation d’hypercapnie (apparition de troubles neurologiques, prise concomitante de sédatifs ou d’alcool), les gaz du sang doivent être contrôlés.
Inflammabilité de l’oxygène
L’O2 est inflammable : il doit être stocké à distance de toute flamme, source de chaleur ou d’appareils électriques pouvant produire des étincelles. Il ne faut jamais graisser ni lubrifier le système, ne pas utiliser de crème cutanée ni de bombe aérosol ou de solvant sur l’appareillage ou à proximité.
Concernant les personnes tabagiques, il est interdit de fumer dans la pièce où l’O2 est utilisé. Les brûlures des fumeurs sous OLT sont souvent peu étendues, et touchent le visage.15 Certains pays contre-indiquent l’OLT aux fumeurs.
Divers autres risques
Les autres risques sont un assèchement des muqueuses – en particulier oculaires –, les dermites allergiques avec l’interface, la manipulation de gaz sous pression ou de l’O2 liquide stocké à - 183 °C, les chutes favorisées par les tuyaux reliant la source d’O2.
Prescription en pratique
Au moins quinze heures par jour
La durée recommandée de l’oxygénothérapie de longue durée est d’au moins quinze heures par jour quelle que soit l’origine de l’IRC. Il faut maintenir l’oxygénothérapie à l’effort et la nuit, et éviter les interruptions de plus de trois heures d’affilée.
Débits souvent faibles
Le débit de l’oxygénothérapie doit permettre d’obtenir une SpO2 supérieure à 90 % ou une PaO2 supérieure à 60 mmHg, sans entraîner d’acidose et en maintenant une PaCO2 inférieure à 70 mmHg quelle que soit l’origine de l’IRC.
En pratique, les débits nécessaires sont souvent faibles, de l’ordre de 1 à 3 L/min dans les BPCO, mais ils peuvent être beaucoup plus élevés dans les pathologies interstitielles. Ces débits, plus difficiles à atteindre, peuvent nécessiter de recourir à l’oxygène liquide, voire à plusieurs appareils d’assistance simultanément.
Il faut être vigilant avec les extracteurs portatifs qui délivrent des débits d’O2 dépendant de la demande du patient selon un réglage spécifique, et qui n’affichent pas directement les débits en L/min.
Mise en place d’une OLT en pratique
Aspects administratifs
Plusieurs documents sont nécessaires à la mise en place d’une OLT :
- une demande de prise en charge à 100 % dans le cadre de l’ALD au titre de l’IRC par le médecin traitant ;
- une ordonnance pour la fourniture de l’O2 (fig. 2) par le spécialiste (pneumologue, médecin compétent en mucoviscidose, en hypertension pulmonaire, pédiatre expert en IRC). La prescription initiale de trois mois est à renouvellement annuel (en établissement d’hébergement pour personnes âgées dépendantes [Ehpad], ce renouvellement peut être effectué par le médecin coordinateur après avis). Toute modification doit faire l’objet d’une nouvelle prescription.
Sources d’oxygène
Il existe différents dispositifs sources d’oxygène :16
- les bouteilles d’O2 gazeux comprimé sont utiles pour des traitements de courte durée, ou en appoint et en secours en l’absence de courant électrique. Elles sont peu utilisées du fait des contraintes de manipulation et des risques ;
- les concentrateurs permettent de produire de l’O2 par adsorption de l’azote de l’air ambiant sur des tamis moléculaires de zéolithe, avec une pureté de 90 ± 5 %. Ils peuvent être bruyants. Il en existe plusieurs types :
• fixes, fournissant un débit entre 0,5 et 10 L/min avec des concentrateurs à « haut débit » ;
• mobiles, alimentés par des batteries rechargeables offrant une meilleure autonomie aux patients. Ils sont portables en bandoulière (ou sac à dos) pesant de 1,4 à 4 kg ou transportables sur roulettes (7 à 10 kg) et sont équipés de valves pulsées se déclenchant à l’inspiration. Certains permettent un débit continu jusqu’au 3 L/min. L’autonomie varie d’une à sept heures en mode pulsé et de 40 minutes à 4 heures 30 en continu. En France, leur prescription a été multipliée par plus de 5 entre 2014 et 2019 ;4
• certains concentrateurs fixes, munis d’un système d’extracteur et de compresseur, peuvent extraire l’O2 et le compresser pour remplir une bouteille. Ce système complexe est de moins en moins utilisé ;
- l’O2 liquide donne une grande quantité de gaz sous un faible volume (1 L d’O2 liquide correspond à 860 L de gaz). La cuve fixe est remplie régulièrement par le prestataire et un réservoir portable (de 0,4 à 1,2 L) permet la déambulation. L’avantage est l’autonomie du réservoir fixe permettant un débit de 2 L/min pendant cinq à sept jours, la possibilité de haut débit (fibroses pulmonaires) et l’utilisation en ambulatoire. Outre la nécessité de remplissages réguliers par le prestataire à domicile, le coût est élevé : la politique de l’Assurance maladie est d’en limiter l’usage aux indications non couvertes par les autres dispositifs. Entre 2006 et 2019, le recours à l’O2 liquide a diminué en France de 13 %.4
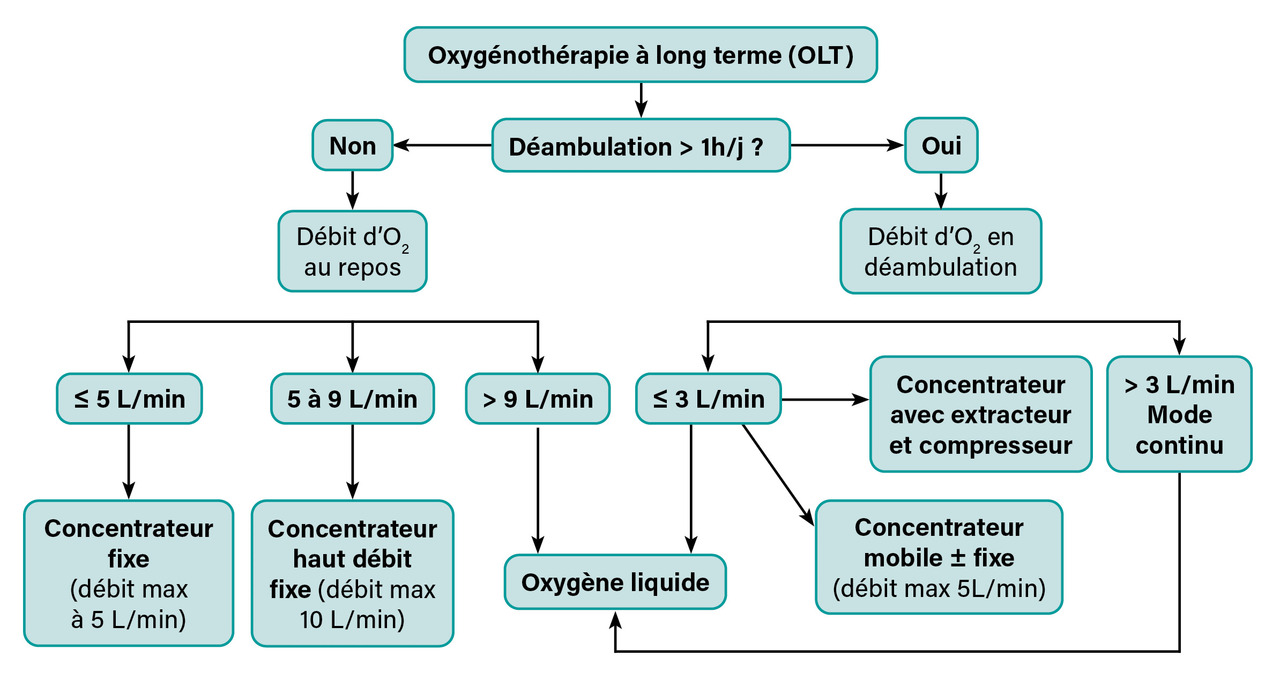
Le choix entre les différentes sources d’oxygène dépend des possibilités de déambulation du patient et du débit d’O2 nécessaire (fig. 3). Un forfait journalier est facturé par le prestataire (tableau 2).
Choix de l’interface entre la source et le patient
Le choix de l’interface entre la source et le patient dépend des débits d’O2 et du confort attendu (tableau 3).
Une nouvelle modalité de prescription est en cours d’évaluation en cas d’hypercapnie : l’oxygénothérapie à haut débit (20 à 60 L/min) délivrant de l’air réchauffé et humidifié, enrichi en O2via une canule nasale. On obtient un lavage de l’espace mort, une diminution des résistances inspiratoires, une pression positive dans les voies aériennes et une amélioration de la clairance mucociliaire. Ce système, surtout utilisé lors d’insuffisances respiratoires aiguës très hypoxémiques, est étudié pour des BPCO hypercapniques à domicile.17
Contrôle régulier des gaz du sang
Le contrôle des gaz du sang doit être effectué trois mois après la mise en route de l’OLT, puis au moins une fois par an.
La surveillance de la SpO2 doit se faire à chaque consultation de pneumologie, et en cas d’aggravation clinique.
La télésurveillance des patients insuffisants respiratoires sous OLT relève d’une décision partagée entre patients et prescripteurs, selon les recommandations actuelles de la Haute Autorité de santé (« Télésurveillance médicale du patient insuffisant respiratoire chronique », référentiel adopté par la Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé le 21 mars 2023).
Adaptation des débits selon l’autocontrôle de la SpO2
L’adaptation des débits doit permettre de maintenir une SpO2 supérieure à 90 % sans entraîner d’acidose respiratoire.
En pratique, dans le cas des BPCO, il est recommandé d’augmenter le débit de 1 à 2 L/min avant un effort prévisible et de revenir au débit de base lors du retour au repos.
Les patients peuvent utiliser un saturomètre s’ils en disposent pour apprécier plus objectivement leur besoin en oxygène, mais cet autosuivi ne fait pas l’objet d’une recommandation actuellement.
Des tests d’effort réalisés avec différents débits d’oxygène permettent de déterminer plus précisément les réglages des débits à l’effort, notamment pour les indications d’oxygénothérapie exclusivement à l’effort (exemples : pathologies interstitielles).
Situations particulières
Oxygénothérapie à court terme
L’O2 est le premier traitement des exacerbations aiguës hypoxémiques. Tout médecin peut prescrire une oxygénothérapie transitoire pour une période d’un mois, renouvelable deux fois. Deux sources sont utilisables : concentrateur fixe et obus d’O2 gazeux.
Au décours des exacerbations aiguës, l’indication d’une éventuelle OLT disparaît souvent : une étude a montré que plus de 80 % des patients réévalués dans les trois mois suivant l’exacerbation n’avaient plus les critères indiquant une OLT.18
En cas d’hypercapnie, le débit d’O2 vise une SpO2 de 88 à 92 % pour limiter le risque. Une étude a montré que cet objectif réduisait significativement la mortalité par rapport à des débits plus élevés chez les patients BPCO.19
Au décours d’une exacerbation d’IRC, l’ensemble du traitement doit être revu, y compris les modalités de l’OLT.
Oxygénothérapie en avion
La pression en vol dans les avions de ligne est plus basse que la pression atmosphérique au niveau de la mer et les pressions partielles des gaz respirés en vol sont diminuées, ce qui peut entraîner une hypoxémie préoccupante chez des patients atteints de pathologies respiratoires.
Les patients sous OLT doivent maintenir leur traitement durant le vol. Les personnes « limites », sans OLT mais ayant une hypoxémie qui peut s’aggraver lors du vol peuvent être détectées par un test d’aptitude lors d’une épreuve d’hypoxie. Ce test est rarement réalisé.
Souvent, le patient est appareillé pendant le vol avec un concentrateur portable agréé par la Federal Aviation Administration américaine. Avant le vol, il doit :
- contacter la compagnie aérienne pour l’informer et pouvoir utiliser à bord le concentrateur. Les compagnies indiquent le nombre de batteries autorisées. Les batteries au lithium sont soumises à la réglementation des transports aériens (https://www.humanairmedical.com/app/webroot/filemanager/Bagages_batterie_lithium_fr.pdf). Les compagnies peuvent demander une attestation médicale. Certaines fournissent l’O2, mais ce service est habituellement payant ;
- vérifier auprès du prestataire et/ou de la compagnie aérienne que le concentrateur est conforme ;
- s’assurer du bon état de marche du concentrateur et que les batteries sont suffisamment chargées ;
- arriver tôt le jour du départ pour l'inspection de l’équipement.
Rôle du médecin traitant
En France, de plus en plus de patients sont appareillés pour recevoir une OLT. La prescription initiale et les demandes de renouvellement sont du ressort de certains spécialistes.
Le médecin traitant garde une place dans ce traitement pour en apprécier la tolérance, l’observance (par l’interrogatoire) et la surveillance.
Il peut prescrire une oxygénothérapie de court terme, en cas d’insuffisance respiratoire transitoire.
2. Oxygénothérapie : recommandations et dangers. Société de pneumologie de langue française (splf.fr). D’après la session « oxygénothérapie » du 5 mai 2023.
3. Continuous or nocturnal oxygen therapy in hypoxemic chronic obstructive lung disease: A clinical trial. Nocturnal Oxygen Therapy Trial Group. Ann Intern Med 1980;93(3):391-8.
4. Long term domiciliary oxygen therapy in chronic hypoxic cor pulmonale complicating chronic bronchitis and emphysema. Report of the Medical Research Council Working Party. Lancet 1981;1(8222):681-6.
5. Górecka D, Gorzelak K, Sliwiński P, Tobiasz M, Zieliński J. Effect of long-term oxygen therapy on survival in patients with chronic obstructive pulmonary disease with moderate hypoxaemia. Thorax 1997;52:674-9.
6. Haidl P, Clement C, Wiese C, Dellweg D, Köhler K. Long-term oxygen therapy stops the natural decline of endurance in COPD patients with reversible hypercapnia. Respiration 2004;71 (4):342-7.
7. Long-Term Oxygen Treatment Trial Research Group; Albert RK, Au DH, Blackford AL, Casaburi R, Cooper Jr JA, et al. A randomized trial of long-term oxygen for COPD with moderate desaturation. N Engl J Med 2016;27;375(17):1617-27.
8. Lacasse Y, Sériès F, Corbeil F, Baltzan M, Paradis B, Simao P, et al.; INOX Trial Group. Randomized trial of nocturnal oxygen in chronic obstructive pulmonary disease. N Engl J Med 2020;383(12):1129-38.
9. Cordeiro R, Nunes A, Smith O, Renzoni EA. Oxygen in interstitial lung diseases. Breathe (Sheff) 2023;19(1):220271.
10. Khor YH, Harrison A, Robinson J, Goh NSL, Glaspole I, McDonald CF. Moderate resting hypoxaemia in fibrotic interstitial lung disease. Eur Respir J 2021;57(1):2001563.
11. Arizono S, Furukawa T, Taniguchi H, Sakamoto K, Kimura T, Kataoka K, et al. Supplemental oxygen improves exercise capacity in IPF patients with exertional desaturation. Respirology 2020;25(11):1152-59.
12. Nonoyama ML, Brooks D, Lacasse Y, Guyatt GH, GOLTstein RS. Oxygen therapy during exercise training in chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2007;18:CD005372.
13. Ringbaek TJ, Viskum K, Lange P. Does long-term oxygen therapy reduce hospitalization in hypoxaemic chronic obstructive pulmonary disease? Eur Respir J 2002;20:38-42.
14. Abdo WF, Heunks LMA. Oxygen-induced hypercapnia in COPD: Myths and facts Crit Care 2012;16(5):323.
15. Assimacopoulos EM, Liao J, Heard JP, Kluesner KM, Wilson W, Wibbenmeyer LA. The national incidence and resource utilization of burn injuries sustained while smoking on home oxygen therapy. J Burn Care Res 2016 ;37(1):25-31.
16. Arrêté du 23 février 2015 portant modification des modalités de prise en charge de dispositifs médicaux et prestations associées pour l’oxygénothérapie et ses forfaits associés. Journal officiel du 27 février 2015.
17. Zhang L, Wang Y, Ye Y, Gao J, Zhu F, Min L. Comparison of high-flow nasal cannula with conventional oxygen therapy in patients with hypercapnic chronic obstructive pulmonary disease: A systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis 2023:18:895-906.
18. Spece LJ, Epler EM, Duan K, Donovan LM, Griffith MF, LaBedz S, et al. Reassessment of home oxygen prescription after hospitalization for chronic obstructive pulmonary disease. A potential target for deimplementation. Ann Am Thorac Soc 2021;18(3):426-32.
19. Austin MA, Wills KE, Blizzard L, Walters EH, Wood-Baker R. Effect of high flow oxygen on mortality in chronic obstructive pulmonary disease patients in prehospital setting: Randomised controlled trial. BMJ 2010;341:c5462.