Les paralysies faciales périphériques (PFP) sont la conséquence d’une souffrance du VII nerf facial entre son noyau au niveau du tronc cérébral et ses branches parotidiennes.1 Centrales, elles témoignent d’une atteinte prénucléaire et sont bien différentes. Elles sont aisées à reconnaître car elles ne sont jamais totales et prédominent sur la partie inférieure du visage. Elles s’accompagnent d’une dissociation automatico-volontaire (asymétrie surtout visible lors des mimiques forcées) et de signes neurologiques : hémiparésies, troubles sensitifs de l’hémicorps, troubles de conscience.
Isolée, brutale et sans cause évidente : la forme a frigore est la plus fréquente
Dans la très grande majorité des cas, les PFP ne semblent répondre à aucune cause évidente, d’où le qualificatif « d’idiopathique » qui leur fut donné, mais une origine virale est en fait sous-jacente : essentiellement le virus herpès simplex de type 1 (HSV1) ou le virus varicelle-zona (VZV).2 Ces virus se répliquent dans le ganglion géniculé à la faveur d’une baisse de l’état général ou d’un stress local, mécanique ou thermique et notamment une exposition au froid, d’où la dénomination de paralysies a frigore ou virales.
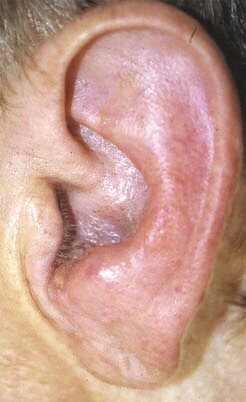
Le zona n’est pas constamment associé à une éruption caractéristique. Les zonas sans vésicules représenteraient même 30 % des formes virales anéruptives.3 Il faut y penser devant une paralysie faciale d’emblée massive, des otalgies importantes, voire un œdème péri-auriculaire. Plaident pour ce diagnostic : une névrite associée du nerf cochléo-vestibulaire annoncée par des acouphènes, une surdité ou des vertiges.
Les formes traumatiques, rares aujourd’hui, sont liées à un traumatisme crânien et une fracture du rocher, rarement à une plaie cervicale ou une intervention chirurgicale. De diagnostic évident, elles sont du ressort d’équipes spécialisées.
L’atteinte inflammatoire nerveuse peut être plus diffuse. C’est le cas dans le syndrome de Guillain-Barré (polyradiculonévrite assez fréquente chez l’enfant, se manifestant sous la forme d’une diplégie) et dans le syndrome de Heerfordt de la sarcoïdose (paralysie faciale associée de façon bruyante à une parotidite aiguë inflammatoire et à une uvéite).
Dans la maladie de Lyme, la paralysie faciale apparaît dans la phase secondaire de l’infection à Borrelia burgdoferi. Parfois bilatérale, elle suit une piqûre de tique et un érythème migrant caractéristique, voire des arthrites. Dans les zones d’endémie, elle peut être la cause de 20 % des paralysies faciales vues aux urgences.4 Le diagnostic positif est fondé sur la sérologie sanguine ou du liquide cérébrospinal. Un traitement de 2 semaines par amoxicilline-acide clavulanique, voire doxycycline en cas d’allergie, est proposé.5
La cause sous-jacente peut être focale, intrinsèque ou extrinsèque au nerf facial :
- intrapétreuse, comme dans l’otite aiguë, les mastoïdites, le cholestéatome, le cancer de l’oreille, les métastases osseuses de néoplasies mammaires, pulmonaires ou prostatiques, ou des tumeurs bénignes plus rares (paragangliomes, neurinomes du nerf facial, hémangiomes). Le contexte otoscopique ou clinique est ici tout à fait parlant et la PF très rarement isolée ;
- extrapétreuse : les tumeurs malignes de la parotide sont la grande crainte. Des cancers très localisés au foramen stylomastoïdien peuvent être imperceptibles à la palpation. C’est alors le contraste entre le caractère très progressif ou massif de la paralysie et la préservation des réflexes stapédiens et des fonctions gustatives et lacrymales qui doit alerter et conduire à une IRM ciblée.
Les tumeurs de l’angle ponto-cérébelleux peuvent donner des paralysies faciales progressives associées à une atteinte cochléo-vestibulaire. Il s’agit des métastases de l’angle ponto-cérébelleux, des méningiomes et des neurinomes.
La clinique avant tout
Le diagnostic est évident dès l’inspection : on est frappé par une asymétrie du visage qui s’aggrave à la mimique, l’hémiface mobile attirant vers elle la moitié paralysée.
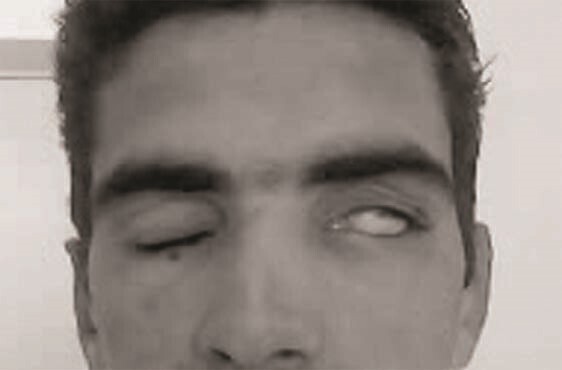
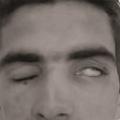
Quand le déficit est important, l’inocclusion palpébrale, appelée lagophtalmie, s’accompagne souvent d’un signe de Charles Bell, mouvement d’ascension du globe oculaire faisant disparaître cornée et iris derrière la paupière supérieure (fig. 1). Ce mécanisme de protection automatique de la cornée est très efficace : son absence augmente la menace de lésions cornéennes. L’atteinte des branches non motrices du nerf n’est pas au premier plan mais est souvent retrouvée : dysgueusie (corde du tympan, branche innervant les deux tiers antérieurs de la langue), œil sec (nerf pétreux) ou hyperacousie (nerf du muscle de l’étrier).
L’interrogatoire, essentiel, part en quête de l’ancienneté et de la chronologie d’installation du symptôme, de l’éventualité d’une récidive ou d’un contexte clinique particulier. On recherche systématiquement : douleur de la région mastoïdienne ou du conduit auditif externe, otorrhée, surdité, vertiges, troubles du goût, hyperacousie ou acouphènes. Il est fondamental de préciser les antécédents : traumatisme crânien, plaie du cou, cancer récent, contact avec des tiques, érythème cutané, fièvre ou syndrome infectieux. Le diabète est un facteur de risque important impactant le traitement, comme une éventuelle infection par le VIH.
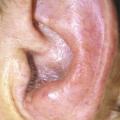
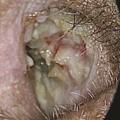
L’inspection de l’oreille est fondamentale : on recherche des vésicules au niveau de la conque et de l’entrée du méat acoustique externe (zone de Ramsay-Hunt, fig. 2) ou une tuméfaction mastoïdienne inflammatoire imposant une prise en charge urgente. À l’otoscope, ou mieux au microscope, on écarte une otite moyenne aiguë, un cholestéatome, une tumeur du conduit auditif externe ou de l’oreille moyenne, on traque les signes évoquant une otite externe nécrosante du diabétique (douleurs térébrantes, otorrhée, polype du plancher du méat). Ce temps otoscopique est incontournable comme l’est la palpation soigneuse de la glande parotide – pour détecter une éventuelle tuméfaction globale ou localisée – ainsi que celle des aires ganglionnaires.
On porte une attention particulière à l’œil homolatéral qui peut se révéler inflammatoire et douloureux. On recherche un signe de Charles Bell.
Enfin, on chiffre l’importance de la paralysie à l’aide de la classification de House & Brackmann en 6 stades (tableau) qui a l’avantage de formaliser l’état initial et surtout le suivi évolutif, car elle tient compte des anomalies de repousse nerveuse (syncinésies et spasmes).
Quels examens complémentaires ?
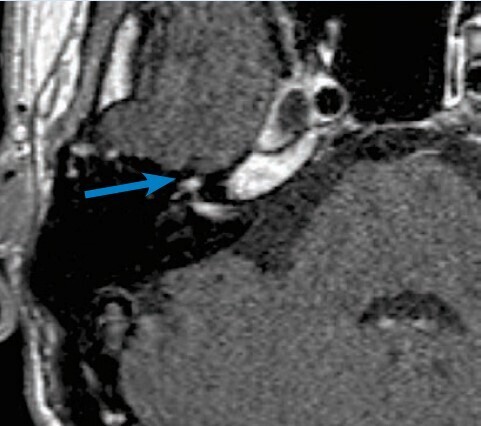
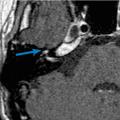
Nécessaire et utile, une audiométrie avec tympanométrie et étude des réflexes stapédiens est précieuse. Depuis les dernières recommandations de la Société française d’ORL (SFORL),6 une IRM injectée (sans urgence) est aussi préconisée. Les formes virales se caractérisent par une prise de contraste importante et focalisée du ganglion géniculé et des portions avoisinantes du nerf facial (fig. 3). Le scanner n’est indiqué qu’en cas d’otoscopie anormale, à la recherche d’une pathologie de l’oreille moyenne ou du rocher.
La prévalence assez forte dans certaines régions de la borréliose a également conduit le groupe d’experts de la SFORL à recommander la réalisation d’une sérologie spécifique devant une PFP ne faisant pas sa preuve. Quant aux sérologies virales, elles n’ont aucun intérêt pratique.
L’électroneuronographie ou l’électromyographie de stimulation et de détection du nerf facial n’a d’intérêt que face à une PF massive et durable installée depuis plus de 2 à 3 semaines malgré un traitement bien conduit.
Évolution et pronostic
L’installation d’une paralysie faciale virale est aiguë. Plus elle se complète rapidement, plus elle est sévère. Mais elle ne dépasse jamais quelques jours. Un développement progressif sur une ou plusieurs semaines doit faire rechercher une tumeur compressive par une imagerie adaptée.
Son évolution spontanée est favorable dans plus de 80 % des cas.1 La vitesse et la complétude de la récupération sont fonction du type de lésion nerveuse. En cas de neurapraxie pure, jusqu’à 5 à 7 semaines sont nécessaires pour une régression sans séquelle. Dès qu’il existe une part de dénervation, le délai de récupération s’allonge au prorata du nombre de fibres dénervées, et apparaissent des séquelles liées aux anomalies de la repousse axonale : déficit moteur, syncinésies et spasmes (favorisés par les stimulations électriques pratiquées par certains kinés), voire « syndrome des larmes de crocodile » (le patient pleure en mangeant). L’impact psychique peut être lourd.
Facteurs de bon pronostic : caractère incomplet, peu douloureux, récupération rapide, préservation des réflexes stapédiens, mise en route précoce du traitement. Les formes zostériennes, les plus syndromiques et les plus douloureuses, sont de mauvais pronostic et laissent dans 50 à 60 % des cas des séquelles syncinétiques ou surtout spastiques. Le traitement antiviral et corticoïde est une urgence absolue si l’on veut en limiter l’importance.
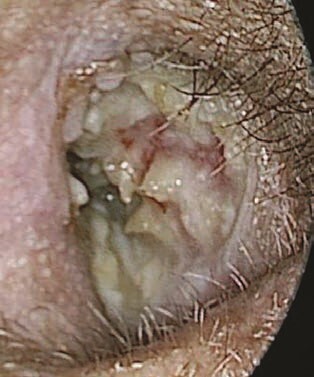
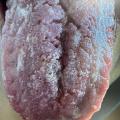
Il faut prévenir le patient de la possibilité d’une récidive. On doit évoquer systématiquement un syndrome de Melkersson-Rosenthal (paralysie faciale récidivante, langue scrotale et hypertrophie labiale, voire épisode d’œdème de la face, fig. 4).
Traitement des formes virales
C’est une véritable urgence, et ce d’autant plus que le déficit est massif. La précocité du traitement anti-inflammatoire, visant à éviter la mort neuronale, est cruciale : corticothérapie à fortes doses (1 mg/kg d’équivalent prednisone pendant 8 jours), en respectant les contre-indications. En cas de diabète, on la réserve, sous contrôle serré de la glycémie, aux formes sévères d’emblée. Le traitement doit être pris si possible dans les 2 à 3 premiers jours après l’installation de la paralysie. Son bénéfice a été démontré dans les atteintes de l’adulte.7
Le valaciclovir, 6 comprimés/jour pendant 8 jours, bloqueur de la réplication virale, semble efficace, avec cependant un niveau de preuve inférieur à celui de la corticothérapie.8Il doit être pris très tôt, dans les 3 ou 4 premiers jours, quand le virus est en réplication.8Les risques induits étant faibles, il est recommandé pour peu que le patient soit vu précocement.9
La décompression chirurgicale du nerf facial, longtemps pratiquée, n’a pas fait la preuve de son efficacité au regard de ses risques.10
Des soins oculaires +++ (humidification par larmes artificielles, fermeture nocturne, voire diurne, par des bandes adhésives) ont pour but de protéger la cornée. La consultation d’un ophtalmologiste s’impose en cas de rougeur et de douleurs importantes dans la crainte d’une kératite.
Dans les formes sévères, la rééducation de la face est pratiquée par un kinésithérapeute ou un orthophoniste (sans stimulation électrique du visage, afin de ne pas favoriser le spasme post-paralytique). On propose en outre au patient de travailler lui-même devant une glace les différents mouvements du visage, groupe musculaire par groupe musculaire, 2 à 3 fois par jour.
Dans tous les cas, le patient est revu au 8e jour pour juger de l’évolution. La paralysie peut en effet s’améliorer – cas le plus fréquent – ou continuer à s’aggraver, ce qui doit conduire à poursuivre la corticothérapie pendant 1 semaine.
Ce n’est qu’en cas de paralysie faciale massive et non régressive que l’on peut se poser la question d’un bilan d’imagerie secondaire ou d’une électromyographie.
Le traitement des séquelles est particulièrement complexe.
Cas particulier de l’enfant
En dehors des formes malformatives et obstétricales propres au nouveau-né, l’enfant est surtout victime de formes virales, où dominent l’herpès mais aussi les oreillons et les adénovirus. L’otite moyenne aiguë est également souvent en cause. Le zona est absent. Il convient de rechercher systématiquement une borréliose et de se méfier des formes tumorales (sarcomes embryonnaires, lymphomes malins, hémopathies). La corticothérapie est d’indication plus prudente.
Points forts
- Les PF isolées d’allure idiopathique sont en fait d’origine herpétique (HSV1 et VZV).
- Indispensables : otoscopie et palpation de la parotide.
- Face à une forme isolée, réaliser une IRM injectée, sans urgence, une sérologie de la borréliose et une audiométrie avec recherche des réflexes stapédiens.
- Une PF d’installation progressive, sur plus de 8 jours, ou longtemps incomplète, est a priori tumorale.
- Le traitement des formes virales (corticothérapie auquel on peut adjoindre l’aciclovir) doit être instauré dans les premiers jours.
- La prévention des lésions oculaires est fondamentale.
- Chez la femme enceinte, rechercher une toxémie gravidique (mécanismes physiopathologiques proches).1
2. Furuta Y, Fukuda S, Chida E, et al. Reactivation of herpes simplex virus typ 1 in patients with Bell’s palsy. J Med Virol 1998;54:162-6.
3. Furuta Y, Ohtani F, Kawabata H, et al. High prevalence of varicella-zoster virus reactivation in herpes simplex virus-seronegative patients with acute peripheral facial palsy. Clin Infect Dis 2000;30:529-33.
4. Ho K, Melanson M, Desai JA. Bell palsy in Lyme disease-endemic regions of Canada: a cautionary case of occult bilateral peripheral facial nerve palsy due to Lyme disease. CJEM 2012;14:321-4.
5. Kowalski TJ, Berth WL, Mathiason MA, et al. Oral antibiotic treatment and long-term outcomes of Lyme facial nerve palsy. Infection 2011;39:239-45.
6. SFORL. Recommandations pour la pratique clinique : prise en charge de la paralysie faciale idiopathique à la phase aiguë chez l’adulte. SFORL 28 juillet 2020.
7. Salinas RA, Alvarez G, Daly F, et al. Corticosteroids for Bell’s palsy (idiopathic facial paralysis). Cochrane Database Syst Rev 2010;3:CD001942.
8. Dong Y, Zhu Y, Ma C, et al. Steroid-antivirals treatment versus steroids alone for the treatment of Bell’s palsy: a meta-analysis. Int J Clin Exp Med 2015;8:413-21.
9. Gronseth GS, Paduga R. Evidence-based guideline update: steroids and antivirals for Bell palsy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology 2012;79:2209-13.
10. McAllister K, Walker D, Donnan PT, et al. Surgical interventions for the early management of Bell’s palsy. Cochrane Database Syst Rev 2013;10:CD007468.
Pour en savoir plus :
Darrouzet V. Paralysie faciale périphérique. Rev Prat Med Gen 2016;30(965):537-40.
Benichou L. Paralysie faciale : traquer les séquelles. Rev Prat Med Gen 2019;33(1021);361-2.

 Encadrés
Encadrés