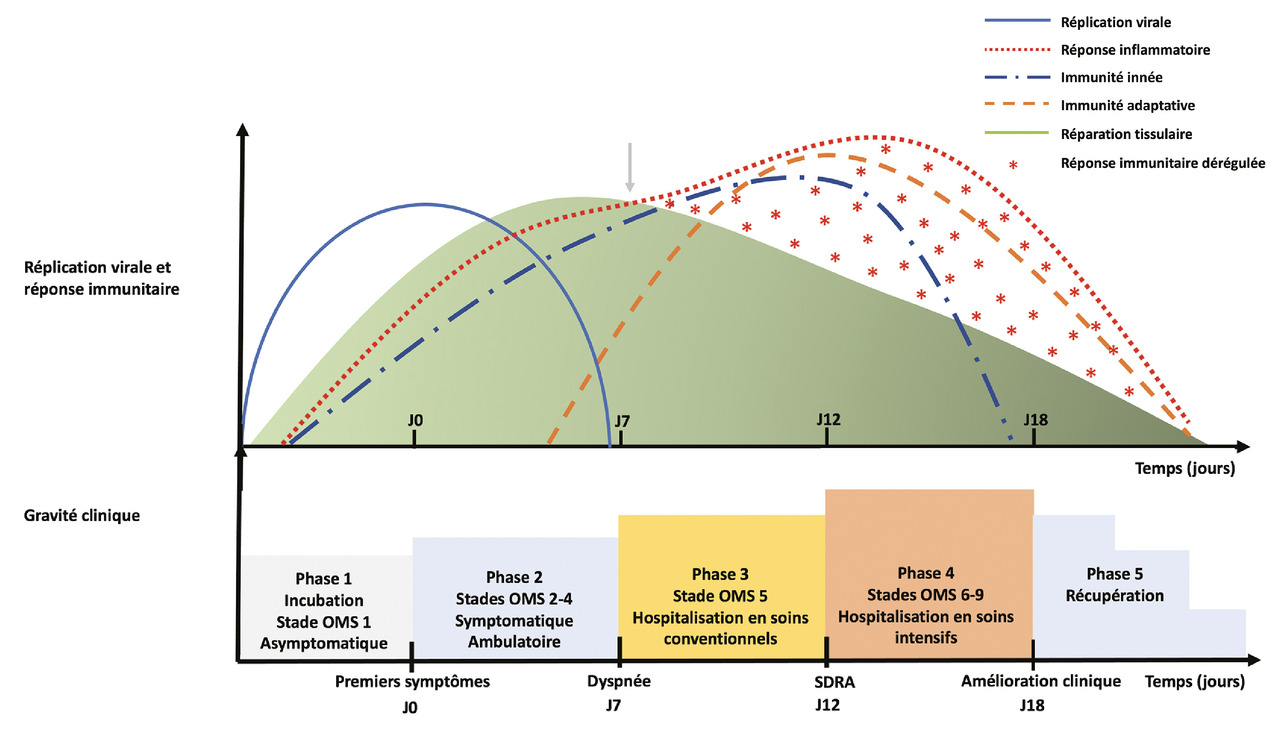
L’infection par le SARS-CoV-2 suit une évolution relativement reproductible qu’il est possible de diviser en plusieurs phases.1 Toutes ne sont cependant pas obligatoires : certains patients restent asymptomatiques ou évoluent rapidement vers la guérison, alors que d’autres, généralement porteurs de facteurs de risque, développent des formes sévères de la maladie.2 La progression vers les formes les plus graves est sous-tendue par une pathogenèse stéréotypée qui fait intervenir successivement cytotoxicité virale et réponse inflammatoire dérégulée.1 Préciser ces mécanismes physiopathologiques permet notamment de mieux comprendre le positionnement de chaque traitement du Covid-19 (antiviral ou immunomodulateur).
Première phase : incubation, stade OMS 1
La période d’incubation médiane est estimée à 5,1 jours (écart interquartile [IQR, pour interquartile range] : 4,5-5,8).1 Elle s’étend de l’inoculation virale à l’apparition des premiers symptômes dans 80 % des cas (environ 20 % des patients infectés restent asymptomatiques).3 Cette phase est marquée par une cytotoxicité du virus et par l’initiation d’une réponse inflammatoire impliquant les cellules de l’immunité innée.1 En parallèle, le SARS-CoV-2 met en jeu un système de défense permettant l’évasion virale.4
Cytotoxicité virale à tropisme multiple
Une fois inoculé, le SARS-CoV-2 infecte les cellules hôtes après la fixation de la protéine virale de surface Spike sur le récepteur cellulaire ACE2 (angiotensin converting enzyme 2) et le corécepteur TMPRSS2 (transmembrane protease serine 2).5 Des études autopsiques de patients infectés ont montré que le SARS-CoV-2 est ainsi capable d’infecter les cellules des voies respiratoires hautes (pneumocytes) mais aussi les cellules rénales, hépatiques, myocardiques, intestinales et endothéliales.5 Si l’atteinte clinique prédominante est pulmonaire, ce tropisme multiple peut expliquer, pour certains auteurs, les différentes formes extrarespiratoires observées lors de l’infection par le SARS-CoV-2 : insuffisance rénale aiguë, myocardite, troubles du transit et complications thrombotiques.5
Initiation de la réponse immunitaire innée
L’infection des cellules respiratoires par le SARS-CoV-2 génère des produits microbiens reconnus comme des signaux de danger par les PRR (pattern recognition receptors). Une cascade de signalisation est alors activée, aboutissant à la synthèse de facteurs de transcription, comme NF-κB (nuclear factor kappa B), qui induisent la sécrétion de chimiokines (CXCL10, CCL2, CCL4) et de cytokines pro-inflammatoires (interleukine 6 [IL-6], tumor necrosis factor α [TNF-α], interleukin-1 receptor antagonist [IL-1RA], interféron α [IFN-α], IFN-β).
Cette production de médiateurs de l’inflammation sur les sites infectés par le SARS-CoV-2 attire les cellules effectrices de l’inflammation : monocytes, cellules dendritiques, lymphocytes, dont l’objectif est la clairance virale et la destruction des cellules hôtes infectées. C’est le début de la réponse inflammatoire locale antivirale. La voie des interférons de type 1 y tient une place particulièrement importante, puisqu’elle permet d’inhiber la réplication virale, de protéger les cellules saines, de potentialiser l’immunité lymphocytaire antivirale cytotoxique (lymphocytes T CD8, lymphocytes NK [natural killer]) et d’initier l’immunité adaptative.1
Cette production de médiateurs de l’inflammation sur les sites infectés par le SARS-CoV-2 attire les cellules effectrices de l’inflammation : monocytes, cellules dendritiques, lymphocytes, dont l’objectif est la clairance virale et la destruction des cellules hôtes infectées. C’est le début de la réponse inflammatoire locale antivirale. La voie des interférons de type 1 y tient une place particulièrement importante, puisqu’elle permet d’inhiber la réplication virale, de protéger les cellules saines, de potentialiser l’immunité lymphocytaire antivirale cytotoxique (lymphocytes T CD8, lymphocytes NK [natural killer]) et d’initier l’immunité adaptative.1
Mécanismes d’évasion virale
Les multiples mécanismes d’évasion laissent au SARS-CoV-2 la possibilité de poursuivre sa réplication malgré l’engagement de la réponse immune innée antivirale. Ils permettent en effet notamment d’échapper à la reconnaissance virale par les récepteurs PRR, d’inhiber la mise en route de la réponse immunitaire ou de contourner la voie des interférons.4
Cette persistance de la réplication virale en dépit des mécanismes de défense immunitaire entraîne une réaction inflammatoire croissante, responsable de symptômes locaux et systémiques.1
Cette persistance de la réplication virale en dépit des mécanismes de défense immunitaire entraîne une réaction inflammatoire croissante, responsable de symptômes locaux et systémiques.1
Deuxième phase : du premier jour des symptômes à l’apparition de la dyspnée, stades OMS 2-4
Le premier jour des symptômes correspond au jour 0, l’apparition de la dyspnée au 7e jour.
Clairance virale et initiation de la réponse immunitaire adaptative
Dans les formes non sévères, le recrutement des cellules effectives inflammatoires sur les sites infectés lutte efficacement contre l’infection virale et permet l’amorce de la clairance virale. Dans 80 % des cas, cette réponse inflammatoire est responsable de l’apparition des premiers symptômes de la maladie, notamment de la fièvre.3 C’est pourquoi la charge virale, mesurée après RT-PCR (reverse transcriptase-polymerase chain reaction) sur écouvillon nasal, atteint généralement son pic simultanément à l’apparition des premiers symptômes et décroît ensuite progressivement en trois semaines.6 La clairance virale est en réalité plus rapide puisque les cultures virales réalisées à partir de prélèvements pulmonaires, reflet de la réplication virale et non simplement de la présence d’ARN viral, se négativent après huit jours de symptômes.7 Ce résultat est corroboré par l’analyse de l’ARN messager sous-génomique, uniquement transcrit par les cellules infectées et donc aussi révélateur de réplication active, qui décroît à partir de dix à onze jours de symptômes. De même, l’analyse épidémiologique de traçage des cas contacts estime la durée de contagiosité, et donc de portage de virus au pouvoir infectant, à cinq jours après les premiers symptômes.8
En parallèle de l’immunité cellulaire débute une réponse immunitaire adaptative marquée par l’apparition d’immunoglobulines M (IgM), d’IgA puis d’IgG respectivement à partir des 5e et 7e jours après les premiers symptômes (figure ).1
En parallèle de l’immunité cellulaire débute une réponse immunitaire adaptative marquée par l’apparition d’immunoglobulines M (IgM), d’IgA puis d’IgG respectivement à partir des 5e et 7e jours après les premiers symptômes (
Réponse immunitaire inappropriée
L’interaction hôte-pathogène peut théoriquement se résumer en trois étapes : immunité innée, immunité adaptative et mécanismes de réparation tissulaire. La réponse immunitaire est dite « appropriée » si elle est efficace et qu’elle ne surpasse pas les capacités de réparation tissulaire.9
Dans le cas de l’infection sévère par le SARS-CoV-2, différents mécanismes concourent à une réponse immune exagérée, dépassant un seuil d’efficacité (l’infection virale est déjà en cours de contrôle) et surpassant les processus de réparation tissulaire (figure ). Cette réponse inflammatoire dérégulée cause alors des dommages tissulaires, notamment au niveau pulmonaire : dégradation de la fonction respiratoire généralement observée vers le 7e jour des symptômes.1
Plusieurs mécanismes sont responsables de cette réponse inappropriée :
– l’évasion virale déroute la mise en place de la réponse immunologique vers une boucle d’amplification du signal inflammatoire et majore ainsi l’infiltration des tissus par les macrophages et les neutrophiles ;1
– la synthèse par le SARS-CoV-2 de la protéine de surface NSP10, inhibiteur d’un répresseur de NF-κB, aboutit à une hyperproduction d’IL-8, médiateur pro-inflammatoire ;10
– la faible signalisation interféron, qu’elle soit constitutive ou due à la présence d’anticorps anti-interféron, retarde la résolution de l’infection et s’associe aux formes les plus sévères de la maladie ;11, 12
– un défaut d’initiation ou de polarisation adaptée de la réponse immunitaire adaptative est enfin observé dans les formes sévères de Covid-19 et participe à l’entretien d’une inflammation locale non résolutive.1
L’ensemble de ces mécanismes conduit à une hypersécrétion cytokinique souvent appelée « orage cytokinique », responsable des formes les plus sévères de Covid-19.13
Dans le cas de l’infection sévère par le SARS-CoV-2, différents mécanismes concourent à une réponse immune exagérée, dépassant un seuil d’efficacité (l’infection virale est déjà en cours de contrôle) et surpassant les processus de réparation tissulaire (
Plusieurs mécanismes sont responsables de cette réponse inappropriée :
– l’évasion virale déroute la mise en place de la réponse immunologique vers une boucle d’amplification du signal inflammatoire et majore ainsi l’infiltration des tissus par les macrophages et les neutrophiles ;1
– la synthèse par le SARS-CoV-2 de la protéine de surface NSP10, inhibiteur d’un répresseur de NF-κB, aboutit à une hyperproduction d’IL-8, médiateur pro-inflammatoire ;10
– la faible signalisation interféron, qu’elle soit constitutive ou due à la présence d’anticorps anti-interféron, retarde la résolution de l’infection et s’associe aux formes les plus sévères de la maladie ;11, 12
– un défaut d’initiation ou de polarisation adaptée de la réponse immunitaire adaptative est enfin observé dans les formes sévères de Covid-19 et participe à l’entretien d’une inflammation locale non résolutive.1
L’ensemble de ces mécanismes conduit à une hypersécrétion cytokinique souvent appelée « orage cytokinique », responsable des formes les plus sévères de Covid-19.13
Facteurs de risque de maladie sévère
La réponse immunitaire inappropriée conduisant aux formes sévères de la maladie est essentiellement observée chez les patients aux comorbidités suivantes : âge élevé, sexe masculin, hypertension artérielle, surpoids, diabète, existence d’une coronaropathie.2 Différentes hypothèses sont proposées pour expliquer l’impact de ces facteurs de risque : ACE2, récepteur du SARS-CoV-2, surexprimé chez les patients diabétiques ; immunosénescence ; plus faible production d’interféron chez ces patients porteurs de comorbidités.
Enfin, des prédispositions génétiques aux formes sévères ont été rapportées, impliquant des mutations « perte de fonction » sur des gènes codant pour des médiateurs de la voie des interférons de type 1.1
Enfin, des prédispositions génétiques aux formes sévères ont été rapportées, impliquant des mutations « perte de fonction » sur des gènes codant pour des médiateurs de la voie des interférons de type 1.1
Troisième phase : du jour 7 au jour 12 après les premiers symptômes, stade OMS 5
Les patients qui développent une réaction inflammatoire inappropriée présentent généralement une dyspnée au 7e jour des symptômes (soit 7 jours après le début de la diminution de la charge virale), témoignant des dégâts inflammatoires causés sur le parenchyme pulmonaire.1 Le syndrome inflammatoire biologique est le plus souvent marqué, et le scanner met en évidence une atteinte pulmonaire dont l’importance est significativement corrélée à la sévérité de l’infection. La prise en charge nécessite une hospitalisation en secteur conventionnel et une oxygénothérapie.
Si l’atteinte pulmonaire est prédominante, l’infection des cellules rénales, hépatiques, intestinales, myocardiques ou endothéliales peut également amener à une réponse inflammatoire préjudiciable : myocardites, endothélites... L’endothélite conduit à une surproduction de thrombine, une inhibition de la fibrinolyse et une activation du complément responsables d’une thrombo-inflammation qui peut, elle-même, se compliquer de microthrombus et de dysfonction circulatoire.5
Si l’atteinte pulmonaire est prédominante, l’infection des cellules rénales, hépatiques, intestinales, myocardiques ou endothéliales peut également amener à une réponse inflammatoire préjudiciable : myocardites, endothélites... L’endothélite conduit à une surproduction de thrombine, une inhibition de la fibrinolyse et une activation du complément responsables d’une thrombo-inflammation qui peut, elle-même, se compliquer de microthrombus et de dysfonction circulatoire.5
Quatrième phase : du jour 12 au jour 18 après les premiers symptômes, stades OMS 6-9
Entretenu par la mort cellulaire et la génération de signaux de danger, le signal inflammatoire s’amplifie et s’accompagne d’une activation du complément, d’un risque majoré de thrombose, et d’une hyperperméabilité vasculaire associée à la production de VEGF (vascular endothelial growth factor) qui aggrave les lésions pulmonaires et provoque un syndrome de détresse respiratoire aiguë.1
Cinquième phase, récupération : létalité faible mais des symptômes résiduels
Si, en majorité, les patients infectés par le SARS-CoV-2 évoluent favorablement (le taux de létalité dans la population générale est estimé à 1 %), la possibilité de symptômes résiduels n’est pas négligeable. Ces symptômes post-infectieux, très variés, sont généralement regroupés sous le terme de « Covid-long » ; ils sont observés chez les patients ayant nécessité une hospitalisation comme chez les autres :
– une étude menée chez des patients hospitalisés pour une infection par le SARS-CoV-2 a ainsi montré que 51 % d’entre eux déclaraient des symptômes résiduels après quatre mois d’évolution. Les plus fréquents étaient une asthénie (31 %), une perte de mémoire (17 %), une dyspnée (16 %) et des paresthésies (12 %). Sur le plan respiratoire, 63 % avaient des séquelles scanographiques, plus fréquentes chez les patients intubés (76 %) que chez les patients non intubés (58 %) ; des lésions de fibrose pulmonaire étaient identifiées chez 38 % des patients intubés contre 12 % des patients non intubés ; 21 % des patients avaient un score de Nijmegen élevé, évocateur de syndrome d’hyperventilation (aucun n’ayant pourtant de lésions fibrosantes sur les scanners thoraciques) ; enfin, parmi les 16 % de patients présentant une dyspnée persistante, 56 % avaient des lésions pulmonaires scanographiques et 23 % des lésions de fibrose. Divers troubles psychiques étaient également rapportés : insomnie (54 % des patients), anxiété (31 %), dépression (21 %) et syndrome de stress post-traumatique (14 %) ;14
– une autre étude, norvégienne, a révélé que 61 % des patients infectés et majoritairement non hospitalisés présentaient des symptômes résiduels à six mois. De plus, chez 52 % des patients non hospitalisés et âgés de 18 à 30 ans persistait une symptomatologie avec perte du goût et/ou de l’odorat (28 %), asthénie (21 %), dyspnée (13 %), difficultés de concentration (13 %) et troubles de la mémoire (11 %).15
La physiopathologie de cette symptomatologie résiduelle n’est, à ce jour, pas complétement élucidée.
– une étude menée chez des patients hospitalisés pour une infection par le SARS-CoV-2 a ainsi montré que 51 % d’entre eux déclaraient des symptômes résiduels après quatre mois d’évolution. Les plus fréquents étaient une asthénie (31 %), une perte de mémoire (17 %), une dyspnée (16 %) et des paresthésies (12 %). Sur le plan respiratoire, 63 % avaient des séquelles scanographiques, plus fréquentes chez les patients intubés (76 %) que chez les patients non intubés (58 %) ; des lésions de fibrose pulmonaire étaient identifiées chez 38 % des patients intubés contre 12 % des patients non intubés ; 21 % des patients avaient un score de Nijmegen élevé, évocateur de syndrome d’hyperventilation (aucun n’ayant pourtant de lésions fibrosantes sur les scanners thoraciques) ; enfin, parmi les 16 % de patients présentant une dyspnée persistante, 56 % avaient des lésions pulmonaires scanographiques et 23 % des lésions de fibrose. Divers troubles psychiques étaient également rapportés : insomnie (54 % des patients), anxiété (31 %), dépression (21 %) et syndrome de stress post-traumatique (14 %) ;14
– une autre étude, norvégienne, a révélé que 61 % des patients infectés et majoritairement non hospitalisés présentaient des symptômes résiduels à six mois. De plus, chez 52 % des patients non hospitalisés et âgés de 18 à 30 ans persistait une symptomatologie avec perte du goût et/ou de l’odorat (28 %), asthénie (21 %), dyspnée (13 %), difficultés de concentration (13 %) et troubles de la mémoire (11 %).15
La physiopathologie de cette symptomatologie résiduelle n’est, à ce jour, pas complétement élucidée.
Maladie virale puis inflammatoire
L’infection par le SARS-CoV-2, coronavirus du genre des Betacoronavirus, est une maladie complexe. La pathogenèse, qui implique d’abord une cytotoxicité virale puis une réponse inflammatoire exagérée (dans les formes sévères), fait de cette infection une maladie successivement virale puis inflammatoire. L’inflammation fait toute la gravité de la maladie, puisqu’elle est responsable de lésions d’organes et d’évolution vers le syndrome de détresse respiratoire aiguë. Le découpage chronologique des mécanismes viraux et immunologiques permet de mieux comprendre le positionnement précoce des traitements antiviraux et plus tardif des immuno-modulateurs. Plus globalement, l’étude de la cinétique de l’infection permet de définir une stratégie thérapeutique adaptée pour chaque stade évolutif de la maladie.
Références
1. Plaçais L, Richier Q, Noël N, Lacombe K, Mariette X, Hermine O. Immune interventions in COVID-19: a matter of time? Mucosal Immunol 2022;15:198-210.
2. Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): A review. JAMA 2020; 324:782-93.
3. Chen X, Huang Z, Wang J, Zhao S, Wong MC, Chong KC, et al. Ratio of asymptomatic COVID-19 cases among ascertained SARS-CoV-2 infections in different regions and population groups in 2020: a systematic review and meta-analysis including 130 123 infections from 241 studies. BMJ Open 2021;11(12):e049752.
4. Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. Immunology of COVID-19: current state of the science. Immunity 2020;52(6):910-41.
5. Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, et al. Extrapulmonary manifestations of COVID-19. Nat Med 2020;26:1017-32.
6. He X, Lau EHY, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med 2020;26:672-5.
7. Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature 2020;581:465-9.
8. Cheng HY, Jian SW, Liu DP, Ng TC, Huang WT, Lin HH; Taiwan COVID-19 Outbreak investigation Team. Contact tracing assessment of COVID-19 transmission dynamics in Taiwan and risk at different Exposure periods before and after symptom onset. JAMA Intern Med 2020;180:1156-63.
9. Martins R, Carlos AR, Braza F, Thompson JA, Bastos-Amador P, Ramos S, et al. Disease tolerance as an inherent component of immunity. Annual Review of Immunology 2019;37:405-37.
10. Li J, Guo M, Tian X, Wang X, Yang X, Wu P, et al. Virus-host interactome and proteomic survey reveal potential virulence factors influencing SARS-CoV-2 pathogenesis. Med (NY) 2021;2(1):99-112.
11. Hadjadj J, Yatim N, Barnabei L, Corneau A, Boussier J, Smith N, et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science 2020;369:718-24.
12. Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann HH, Zhang Y, et al. Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science 2020;370(6515).
13. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395:497-506.
14. Writing committee for the COMEBAC study group; Morin L, Savale L, Pham T, Colle R, Figueiredo S, Harrois A, et al. Four-month clinical status of a cohort of patients after hospitalization for COVID-19. JAMA 2021;325:1525-34.
15. Blomberg B, Mohn KG-I, Brokstad KA, Zhou F, Linchausen DW, Hansen BA, et al. Long COVID in a prospective cohort of home-isolated patients. Nat Med 2021;27:1607-13.
2. Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): A review. JAMA 2020; 324:782-93.
3. Chen X, Huang Z, Wang J, Zhao S, Wong MC, Chong KC, et al. Ratio of asymptomatic COVID-19 cases among ascertained SARS-CoV-2 infections in different regions and population groups in 2020: a systematic review and meta-analysis including 130 123 infections from 241 studies. BMJ Open 2021;11(12):e049752.
4. Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. Immunology of COVID-19: current state of the science. Immunity 2020;52(6):910-41.
5. Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, et al. Extrapulmonary manifestations of COVID-19. Nat Med 2020;26:1017-32.
6. He X, Lau EHY, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med 2020;26:672-5.
7. Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature 2020;581:465-9.
8. Cheng HY, Jian SW, Liu DP, Ng TC, Huang WT, Lin HH; Taiwan COVID-19 Outbreak investigation Team. Contact tracing assessment of COVID-19 transmission dynamics in Taiwan and risk at different Exposure periods before and after symptom onset. JAMA Intern Med 2020;180:1156-63.
9. Martins R, Carlos AR, Braza F, Thompson JA, Bastos-Amador P, Ramos S, et al. Disease tolerance as an inherent component of immunity. Annual Review of Immunology 2019;37:405-37.
10. Li J, Guo M, Tian X, Wang X, Yang X, Wu P, et al. Virus-host interactome and proteomic survey reveal potential virulence factors influencing SARS-CoV-2 pathogenesis. Med (NY) 2021;2(1):99-112.
11. Hadjadj J, Yatim N, Barnabei L, Corneau A, Boussier J, Smith N, et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science 2020;369:718-24.
12. Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann HH, Zhang Y, et al. Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science 2020;370(6515).
13. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395:497-506.
14. Writing committee for the COMEBAC study group; Morin L, Savale L, Pham T, Colle R, Figueiredo S, Harrois A, et al. Four-month clinical status of a cohort of patients after hospitalization for COVID-19. JAMA 2021;325:1525-34.
15. Blomberg B, Mohn KG-I, Brokstad KA, Zhou F, Linchausen DW, Hansen BA, et al. Long COVID in a prospective cohort of home-isolated patients. Nat Med 2021;27:1607-13.
Dans cet article
- Première phase : incubation, stade OMS 1
- Deuxième phase : du premier jour des symptômes à l’apparition de la dyspnée, stades OMS 2-4
- Troisième phase : du jour 7 au jour 12 après les premiers symptômes, stade OMS 5
- Quatrième phase : du jour 12 au jour 18 après les premiers symptômes, stades OMS 6-9
- Cinquième phase, récupération : létalité faible mais des symptômes résiduels
- Maladie virale puis inflammatoire