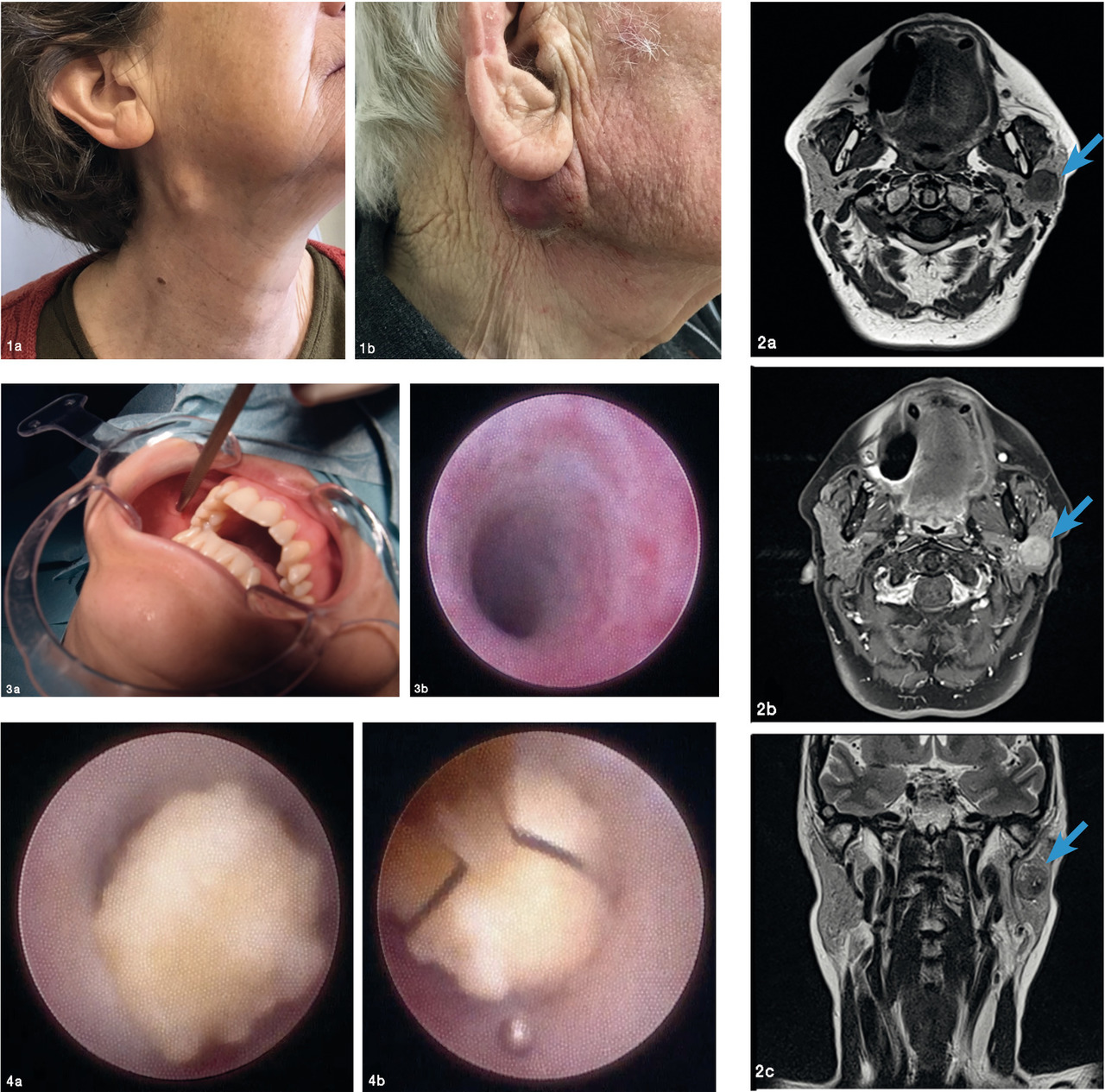
Pathologies tumorales
La tuméfaction est classiquement nodulaire, prétragienne, rétro-angulo-mandibulaire, voire jugale (
Une paralysie faciale périphérique, une infiltration cutanée, une croissance rapide et/ou une adénomégalie cervicale homolatérale doivent être recherchées à l’examen et sont des critères d’agressivité évoquant un cancer (
Bilan préthérapeutique
La cytologie analysée à partir d’une ponction (échoguidée ou non, après l’IRM) a également une valeur prédictive positive élevée, elle est systématiquement associée à l’IRM par de nombreuses équipes. Pour Fakhry et al., la spécificité de la cytologie parotidienne est de 89,5 %.2 Les techniques de biologie moléculaire, comme l’hybridation fluorescente in situ (FISH) permettent de déceler des altérations génétiques affinant le diagnostic (cassure PLAG1 pour l’adénome pléomorphe, fusion MYB-NFIB pour le carcinome adénoïde kystique et fusion MECT1-MAML2 pour les muco-épidermoïdes).
Avec ces données, les délais et modalités de la parotidectomie peuvent ainsi être définis, et exposés au patient.
LE TRAITEMENT EST ChirurgiCaL
Lors de l’exérèse, une analyse extemporanée est préconisée afin de ne pas méconnaître une histologie plus agressive. En effet, si en peropératoire, on doute de la bénignité, cela conduit à la parotidectomie totale d’emblée afin de limiter au maximum une réintervention dans la loge parotidienne (à haut risque pour le nerf facial). Un diagnostic de malignité fera évidemment totaliser la parotidectomie et acquérir autant de marges carcinologiques que possible.
Selon les recommandations du réseau d’expertise français sur les cancers ORL rares (REFCOR), en présence d’un cancer parotidien, le sacrifice du nerf facial n’est indiqué qu’en cas de déficit clinique initial ou d’envahissement macroscopique peropératoire.3 Le curage cervical est indispensable s’il y a des adénopathies suspectes.3 En l’absence de cible ganglionnaire, ce dernier est indiqué en fonction du stade tumoral et du grade histologique.3 La radiothérapie postopératoire est recommandée si les marges de résection sont positives, en cas d’adénopathies métastatiques, ou de tumeurs de stade avancé et/ou de haut grade histologique.3 Le bilan d’extension d’une lésion maligne recherche des adénopathies et des métastases pulmonaires (les plus fréquentes).
Pathologie obstructive
Ces obstructions sont volontiers récidivantes.
De façon plus rare, une parotidite chronique peut s’exprimer par une parotidomégalie permanente, isolée et sensible.
La principale étiologie est la lithiase. Autres mécanismes : sténose canalaire ou encombrement de bouchons muqueux comme lors de parotidites récurrentes juvéniles ou encore de parotidites chroniques post-irathérapie.
Bilan préthérapeutique
À visée diagnostique mais également thérapeutique, la sial-endoscopie occupe une place de choix dans la prise en charge des obstructions parotidiennes chroniques.4, 5 En effet, l’endoscopie salivaire pratiquée après dilatation de la papille du Sténon (
Traitement
La sialendoscopie pratiquée en dehors d’un épisode infectieux, au bloc opératoire, permet souvent de lever l’obstacle :
– extraction lithiasique endocanalaire (si calcul < 4 mm) [
– éventuellement associée à un abord chirurgical combiné endobuccal, voire transjugal, ou bien précédée d’une fragmentation (lithiase plus volumineuse) ;
– dilatation de sténoses ;
– et irrigation canalaire systématique permettant un rinçage glandulaire au sérum physiologique cortisoné.
Selon l’indication et la tolérance, le geste peut être conduit sous anesthésie générale ou locale.4
Maladies d’expression salivaire
Les sialadénoses provoquent généralement une parotidomégalie bilatérale et symétrique, indolore. Principales étiologies : alimentation riche en amidon, malnutrition, trouble du comportement alimentaire, obésité, éthylisme chronique, cirrhose, certaines médications…
De nombreuses pathologies systémiques peuvent avoir une expression salivaire. Il faut y penser lors de symptômes évocateurs avec atteinte multifocale : tuméfaction permanente éventuellement associée à une sensibilité glandulaire et/ou un syndrome sec (asialie, xérophtalmie, sécheresse des autres muqueuses).
Les explorations initiales sont : hémogramme, protéine C réactive, bilan hépatorénal, électrophorèse des protéines sériques, sérologies VIH, VHC, anticorps antinucléaires et anti-antigènes nucléaires solubles ou anti-ENA (anti-SSA, SSB…) ; radiographie thoracique ; biopsie des glandes salivaires accessoires. L’avis d’un confrère médecin interniste est utile.
Notons que s’il y a une symptomatologie obstructive, une sialendoscopie avec irrigation de sérum cortisoné peut permettre une amélioration fonctionnelle avec une diminution de fréquence et d’intensité des hernies et coliques parotidiennes.
Histologie
Les tumeurs bénignes prédominent (80 % des cas). Les types histologiques sont nombreux.
L’adénome pléomorphe représente 60 % des tumeurs parotidiennes. Récidivant, il a un potentiel de dégénérescence maligne.
Le cystadénolymphome ou tumeur de Warthin (5 à 15 %) est volontiers superficiel et situé dans le pôle inférieur parotidien. Il touche plutôt les hommes, quinquagénaires au moins, souvent fumeurs.
La liste des tumeurs malignes est également très longue : carcinomes salivaires mais aussi lymphomes et extensions ganglionnaires intraparotidiennes de primitifs cutanés, sinusiens, voire rhinopharyngés.
Les grades de malignité sont très variables, parfois au sein d’une même histologie (par exemple : carcinomes muco-épidermoïdes, à cellules acineuses et adénocarcinomes pouvant être de grade bas, intermédiaire ou haut). Les carcinomes canalaires infiltrants et les épidermoïdes sont agressifs tandis que ceux développés sur adénome pléomorphe sont plutôt de bas grade, surtout si la capsule nodulaire est respectée.
Principaux critères pronostiques : stade et grade tumoraux, engainements périnerveux, qualité de l’exérèse chirurgicale. Ainsi, il est primordial que le bilan clinique et paraclinique soit optimal afin de limiter le risque de méconnaître un cancer lors de la chirurgie.
Que dire à vos patients
• Le bilan et la chirurgie d’une tumeur parotidienne sont justifiés par le risque de méconnaître un cancer.
• L’exérèse comprend une identification puis une dissection minutieuse du nerf facial, indispensables pour préserver son intégrité.
• Les obstructions parotidiennes responsables de hernies et/ou coliques salivaires peuvent nécessiter une sialendoscopie.
2. Fakhry N, Antonini F, Michel J, et al. Fine-needle aspiration cytology in the management of parotid masses: evaluation of 249 patients. Eur Ann Otorhinolaryngol Head Neck Dis 2012;129:131-5.
3. REFCOR. Tumeurs malignes primitives des glandes salivaires. Argumen- taire. http://bit.ly/2C7oZss
4. Vergez S, Vairel B, Chossegros C, De Bonnecaze G, Faure F. Chirurgie endoscopique des glandes salivaires. EMC – Techniques chirurgicales – Tête et cou 2016 ;11 :1-11 [Article 46-541].
5. Vergez S, Vairel B, De Bonnecaze G, Astudillo L. Pathologies salivaires médicales. EMC – Oto-rhino-laryngologie 2014 ;9 :1-15 [Article 20-628-A-10].
Fiches d’information du Collège des enseignants ORL :
– avant réalisation d’une parotidectomie. http://bit.ly/2E6aQgV
– avant réalisation d’une sialendoscopie. http://bit.ly/2FPGK1s

 Encadrés
Encadrés