Les pathologies thyroïdiennes en cours de grossesse sont très fréquentes : de 1 à 10 % selon la dysfonction. La grossesse entraîne d’importantes modifications de la fonction thyroïdienne maternelle, par différents mécanismes :1
– majoration des besoins maternels en iode, du fait de l’augmentation de la clairance rénale de cet oligo-élément et de l’augmentation du transfert transplacentaire de sa composante inorganique vers le fœtus ;
– intensification de l’activité fonctionnelle de la thyroïde maternelle causée par l’augmentation de la concentration plasmatique de la thyroxine-binding globulin (TBG) et de l’action analogue à la thyroid-stimulating hormone ou thyréostimuline (TSH) qu’exerce l’hormone chorionique gonadotrophique humaine (hCG).
Une suppression partielle de l’activité immunologique maternelle, notamment de l’auto-immunité thyroïdienne, est également observée au cours de la grossesse.
Les hormones thyroïdiennes – qu’elles soient d’origine maternelle d’abord, ou fœtale ensuite – jouent un rôle essentiel dans les processus de croissance, de myélinisation et d’acquisition des fonctions supérieures cérébrales.
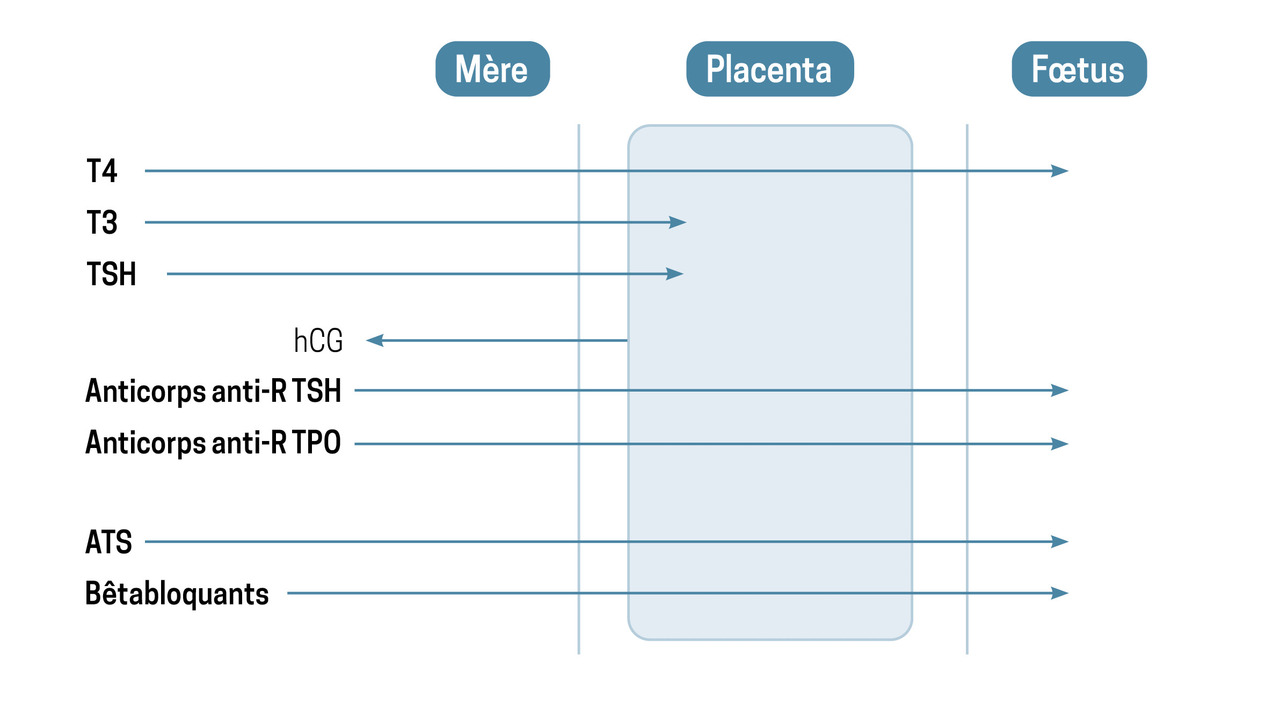
Au premier trimestre, la thyroïde fœtale est non fonctionnelle ; sa propre production hormonale débute entre la 16e et la 18e semaine de grossesse. Néanmoins, dès le premier trimestre, le cerveau fœtal exprime des récepteurs aux hormones thyroïdiennes, d’où l’importance de l’apport de ces hormones par la mère, via un transfert transplacentaire (fig. 1 ).
– majoration des besoins maternels en iode, du fait de l’augmentation de la clairance rénale de cet oligo-élément et de l’augmentation du transfert transplacentaire de sa composante inorganique vers le fœtus ;
– intensification de l’activité fonctionnelle de la thyroïde maternelle causée par l’augmentation de la concentration plasmatique de la thyroxine-binding globulin (TBG) et de l’action analogue à la thyroid-stimulating hormone ou thyréostimuline (TSH) qu’exerce l’hormone chorionique gonadotrophique humaine (hCG).
Une suppression partielle de l’activité immunologique maternelle, notamment de l’auto-immunité thyroïdienne, est également observée au cours de la grossesse.
Les hormones thyroïdiennes – qu’elles soient d’origine maternelle d’abord, ou fœtale ensuite – jouent un rôle essentiel dans les processus de croissance, de myélinisation et d’acquisition des fonctions supérieures cérébrales.
Au premier trimestre, la thyroïde fœtale est non fonctionnelle ; sa propre production hormonale débute entre la 16e et la 18e semaine de grossesse. Néanmoins, dès le premier trimestre, le cerveau fœtal exprime des récepteurs aux hormones thyroïdiennes, d’où l’importance de l’apport de ces hormones par la mère, via un transfert transplacentaire (
Vers un dépistage systématique des dysthyroïdies ?
L’hypothyroïdie clinique associe une augmentation de la TSH à une thyroxine (T4) libre basse. L’hypothyroïdie infraclinique correspond à une concentration normale de T4 libre et à une TSH plus ou moins augmentée.
À l’inverse, le diagnostic d’hyperthyroïdie repose sur la diminution du taux de TSH, en tenant compte des normes adaptées au terme de la grossesse. Une TSH basse et un taux de T4 libre normal correspondent à une hyperthyroïdie infraclinique. Une TSH basse et un taux de T4 libre élevé correspondent à une hyperthyroïdie patente (ou clinique).
Les dysthyroïdies maternelles peuvent avoir de graves conséquences sur la grossesse et le développement du fœtus. Il est donc necessaire de pouvoir les dépister en préconceptionnel.
À l’inverse, le diagnostic d’hyperthyroïdie repose sur la diminution du taux de TSH, en tenant compte des normes adaptées au terme de la grossesse. Une TSH basse et un taux de T4 libre normal correspondent à une hyperthyroïdie infraclinique. Une TSH basse et un taux de T4 libre élevé correspondent à une hyperthyroïdie patente (ou clinique).
Les dysthyroïdies maternelles peuvent avoir de graves conséquences sur la grossesse et le développement du fœtus. Il est donc necessaire de pouvoir les dépister en préconceptionnel.
Quel consensus pour les normes de TSH ?
Un décalage vers le bas de la plage de référence de la TSH est observé pendant la grossesse : abaissements de la limite inférieure (à environ 0,1-0,2 mUI/L) et de la limite supérieure par rapport à la plage de référence de la TSH hors grossesse.
La diminution de la TSH la plus remarquable est observée au cours du premier trimestre en raison des concentrations élevées d’hCG, stimulant directement le récepteur de la TSH ainsi que la production d’hormones thyroïdiennes.
Au cours des deuxième et troisième trimestres, la TSH et les plages de référence augmentent progressivement mais restent inférieures à celles des femmes en population générale. Ce décalage vers le bas des plages de référence de la TSH est observé dans toutes les populations, mais il semblerait que son ampleur varie d’une origine ethnique à l’autre.
Les recommandations de l’American Thyroid Association (ATA) de 2017 proposent que les laboratoires définissent des plages de référence pour la TSH.2 En l’absence de telles normes, il est actuellement suggéré que la borne haute de normalité soit fixée à 4 mUI/L quel que soit le trimestre de grossesse. Pour la plupart des tests, cette limite correspond à une réduction de 0,5 mUI/L de la limite supérieure de référence de la TSH hors grossesse.
La diminution de la TSH la plus remarquable est observée au cours du premier trimestre en raison des concentrations élevées d’hCG, stimulant directement le récepteur de la TSH ainsi que la production d’hormones thyroïdiennes.
Au cours des deuxième et troisième trimestres, la TSH et les plages de référence augmentent progressivement mais restent inférieures à celles des femmes en population générale. Ce décalage vers le bas des plages de référence de la TSH est observé dans toutes les populations, mais il semblerait que son ampleur varie d’une origine ethnique à l’autre.
Les recommandations de l’American Thyroid Association (ATA) de 2017 proposent que les laboratoires définissent des plages de référence pour la TSH.2 En l’absence de telles normes, il est actuellement suggéré que la borne haute de normalité soit fixée à 4 mUI/L quel que soit le trimestre de grossesse. Pour la plupart des tests, cette limite correspond à une réduction de 0,5 mUI/L de la limite supérieure de référence de la TSH hors grossesse.
Mères après 30 ans : toutes concernées par le dépistage !
Le dépistage d’une dysthyroïdie chez la femme enceinte se fait sur le seul dosage de la TSH, comme dans la population générale.3 Si le taux de TSH est supérieur à 2,5 mUI/L, il doit être complété par le dosage des anticorps antithyropéroxydase (anti-TPO).
Sur la base des directives 2017 de l’ATA,2 le dosage de la TSH est indiqué chez une femme enceinte ou qui envisage de l’être, si elle a au moins un facteur de risque parmi les suivants : histoire familiale de dysthyroïdie auto-immune ou d’hypothyroïdie, âge supérieur à 30 ans, goitre, anticorps anti-TPO positifs, symptômes évocateurs d’hypothyroïdie, diabète de type 1 ou autre maladie auto-immune, infertilité, antécédents de fausse(s) couche(s) ou d’accouchement(s) prématuré(s), antécédents d’irradiation de la tête et du cou, de chirurgie thyroïdienne, résidence dans une région en carence iodée présumée, prise d’un traitement substitutif par hormones thyroïdiennes (lévothyroxine ou LT4).
Ainsi, même si les preuves sont actuellement insuffisantes pour plaider en faveur d’un dépistage universel, l’âge moyen de la première grossesse en France étant de 31 ans, ce dépistage a vocation à être fréquemment réalisé.
Sur la base des directives 2017 de l’ATA,2 le dosage de la TSH est indiqué chez une femme enceinte ou qui envisage de l’être, si elle a au moins un facteur de risque parmi les suivants : histoire familiale de dysthyroïdie auto-immune ou d’hypothyroïdie, âge supérieur à 30 ans, goitre, anticorps anti-TPO positifs, symptômes évocateurs d’hypothyroïdie, diabète de type 1 ou autre maladie auto-immune, infertilité, antécédents de fausse(s) couche(s) ou d’accouchement(s) prématuré(s), antécédents d’irradiation de la tête et du cou, de chirurgie thyroïdienne, résidence dans une région en carence iodée présumée, prise d’un traitement substitutif par hormones thyroïdiennes (lévothyroxine ou LT4).
Ainsi, même si les preuves sont actuellement insuffisantes pour plaider en faveur d’un dépistage universel, l’âge moyen de la première grossesse en France étant de 31 ans, ce dépistage a vocation à être fréquemment réalisé.
Grossesse et hypothyroïdie : distinguer les formes cliniques des formes frustes
L’hypothyroïdie avérée (clinique) affecte entre 2 et 4 % des femmes en âge de procréer. L’hypothyroïdie fruste est plus répandue, avec une prévalence pouvant atteindre 10 % de cette même population.
Des conséquences pour l’hypothyroïdie avérée
En dehors de la thyroïdectomie, l’hypothyroïdie est le plus souvent causée par une thyroïdite chronique auto-immune, dont le diagnostic se fait, en première intention, par le dosage des anticorps anti-TPO.
L’hypothyroïdie clinique est classiquement associée à une augmentation du risque de fausses couches précoces et spontanées ainsi qu’à des complications obstétricales :
– fœtales (retard de croissance intra-utérin, petit poids de naissance, accouchement prématuré avec une morbidité et une mortalité fœtales) ;
– périnatales et maternelles (augmentation de la fréquence de l’hypertension artérielle liée à la grossesse ou de l’apparition d’une prééclampsie) [tableau 1 ].
Des complications néonatales peuvent aussi survenir dans ce contexte d’hypothyroïdie maternelle : au cours du premier trimestre de la grossesse, la T4 fœtale est exclusivement d’origine maternelle ; or les hormones thyroïdiennes jouent un rôle important dès les premières étapes du développement du cerveau humain. En 1999, une étude rapportait ainsi une diminution des performances intellectuelles chez des enfants âgés de 7 à 9 ans nés de mères ayant une hypothyroïdie (TSH moyenne à 13 mUI/L) au cours du deuxième trimestre de la grossesse.4 Le quotient intellectuel (QI) des enfants nés de femmes hypothyroïdiennes non traitées était significativement diminué (100 versus 107), tandis que le QI des enfants nés de femmes hypothyroïdiennes traitées était comparable à celui des enfants nés de femmes euthyroïdiennes (111 versus 107).4 Le principe du traitement de l’hypothyroïdie chez la femme enceinte repose pour beaucoup sur cette étude.
L’hypothyroïdie clinique est classiquement associée à une augmentation du risque de fausses couches précoces et spontanées ainsi qu’à des complications obstétricales :
– fœtales (retard de croissance intra-utérin, petit poids de naissance, accouchement prématuré avec une morbidité et une mortalité fœtales) ;
– périnatales et maternelles (augmentation de la fréquence de l’hypertension artérielle liée à la grossesse ou de l’apparition d’une prééclampsie) [
Des complications néonatales peuvent aussi survenir dans ce contexte d’hypothyroïdie maternelle : au cours du premier trimestre de la grossesse, la T4 fœtale est exclusivement d’origine maternelle ; or les hormones thyroïdiennes jouent un rôle important dès les premières étapes du développement du cerveau humain. En 1999, une étude rapportait ainsi une diminution des performances intellectuelles chez des enfants âgés de 7 à 9 ans nés de mères ayant une hypothyroïdie (TSH moyenne à 13 mUI/L) au cours du deuxième trimestre de la grossesse.4 Le quotient intellectuel (QI) des enfants nés de femmes hypothyroïdiennes non traitées était significativement diminué (100 versus 107), tandis que le QI des enfants nés de femmes hypothyroïdiennes traitées était comparable à celui des enfants nés de femmes euthyroïdiennes (111 versus 107).4 Le principe du traitement de l’hypothyroïdie chez la femme enceinte repose pour beaucoup sur cette étude.
Hypothyroïdie infraclinique : pas de données claires
Les données évaluant les effets de l’hypothyroïdie fruste sont moins claires : certaines études suggèrent une augmentation du risque de fausse couche chez les femmes ayant une hypothyroïdie infraclinique même avec anticorps négatifs ;5 les données sur l’augmentation du risque d’accouchement prématuré sont contradictoires.
S’il existe un lien de causalité entre hypothyroïdie infraclinique et accouchement prématuré, fausses couches ou troubles cognitifs fœtaux, un traitement par hormones thyroïdiennes devrait faire reculer ces risques. Or, dans une étude randomisée controversée – des hormones thyroïdiennes ont été administrées à 17 semaines de grossesse –, ni diminution du taux d’accouchement prématuré ni améliorations cognitives n’ont, entre autres, été constatées.6
S’il existe un lien de causalité entre hypothyroïdie infraclinique et accouchement prématuré, fausses couches ou troubles cognitifs fœtaux, un traitement par hormones thyroïdiennes devrait faire reculer ces risques. Or, dans une étude randomisée controversée – des hormones thyroïdiennes ont été administrées à 17 semaines de grossesse –, ni diminution du taux d’accouchement prématuré ni améliorations cognitives n’ont, entre autres, été constatées.6
Traiter l’hypothyroïdie avant, pendant et après la grossesse
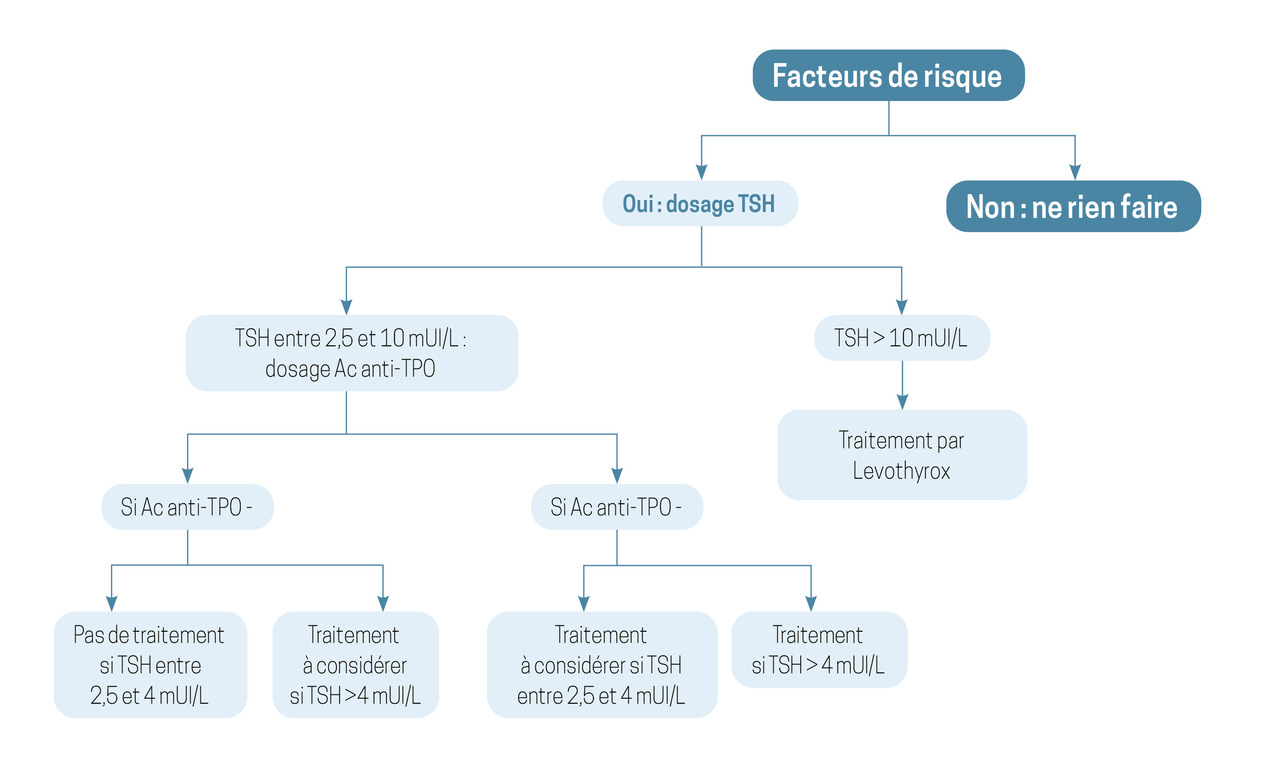
Une hypothyroïdie dont le diagnostic se fait au cours de la grossesse nécessite une prise en charge sans délai (fig. 2 ) :
– une TSH entre 2,5 et 10 mUI/L impose un dosage des anticorps anti-TPO pour orienter la décision de prise en charge. Si le dosage des anticorps est positif, un traitement peut être discuté ;
– devant la balance bénéfice-risque favorable, un traitement est indiscutablement recommandé si la TSH est supérieure à 4 mUI/L au cours de la grossesse et même si le dosage des anticorps anti-TPO est négatif.2 La lévothyroxine est prescrite à dose pleine d’emblée (1,6 à 2 μg/kg/j pour une hypothyroïdie avérée ; 1 μg/kg/j pour une hypothyroïdie infraclinique).
Un dosage de contrôle de la TSH doit être réalisé après quatre semaines de traitement. La posologie de la lévothyroxine est à adapter tout au long de la grossesse, avec la réalisation d’un dosage de TSH mensuel pendant les deux premiers trimestres, puis à huit mois (tableau 2 ).
En cas d’hypothyroïdie préconceptionnelle, les besoins augmentent de 25 à 30 % et nécessitent d’accroître la substitution en hormones thyroïdiennes. Il est ainsi possible de revoir la posologie : ajout de 2 comprimés par semaine ou augmentation de la dose de 25 μg si la dose de base est inférieure à 100 μg/j ; un ajout de 50 μg est possible si la dose de base est supérieure à 100 μg/j. Cette augmentation de posologie est rendue nécessaire par l’accroissement des besoins en hormones thyroïdiennes tout au long de la gestation.
Après l’accouchement, les besoins de lévothyroxine diminuent et redeviennent comparables à ceux antérieurs à la grossesse. À noter que l’allaitement maternel n’est pas contre-indiqué chez les patientes sous traitement substitutif par lévothyroxine.
– une TSH entre 2,5 et 10 mUI/L impose un dosage des anticorps anti-TPO pour orienter la décision de prise en charge. Si le dosage des anticorps est positif, un traitement peut être discuté ;
– devant la balance bénéfice-risque favorable, un traitement est indiscutablement recommandé si la TSH est supérieure à 4 mUI/L au cours de la grossesse et même si le dosage des anticorps anti-TPO est négatif.2 La lévothyroxine est prescrite à dose pleine d’emblée (1,6 à 2 μg/kg/j pour une hypothyroïdie avérée ; 1 μg/kg/j pour une hypothyroïdie infraclinique).
Un dosage de contrôle de la TSH doit être réalisé après quatre semaines de traitement. La posologie de la lévothyroxine est à adapter tout au long de la grossesse, avec la réalisation d’un dosage de TSH mensuel pendant les deux premiers trimestres, puis à huit mois (
En cas d’hypothyroïdie préconceptionnelle, les besoins augmentent de 25 à 30 % et nécessitent d’accroître la substitution en hormones thyroïdiennes. Il est ainsi possible de revoir la posologie : ajout de 2 comprimés par semaine ou augmentation de la dose de 25 μg si la dose de base est inférieure à 100 μg/j ; un ajout de 50 μg est possible si la dose de base est supérieure à 100 μg/j. Cette augmentation de posologie est rendue nécessaire par l’accroissement des besoins en hormones thyroïdiennes tout au long de la gestation.
Après l’accouchement, les besoins de lévothyroxine diminuent et redeviennent comparables à ceux antérieurs à la grossesse. À noter que l’allaitement maternel n’est pas contre-indiqué chez les patientes sous traitement substitutif par lévothyroxine.
Hyperthyroïdie : deux causes principales
L’hyperthyroïdie peut se révéler en début de grossesse chez une patiente sans antécédents particuliers. Les causes sont généralement la thyrotoxicose gestationnelle transitoire et la maladie de Basedow ; les autres causes sont exceptionnelles. Différencier la thyrotoxicose gestationnelle transitoire d’une authentique maladie de Basedow débutante est indispensable car leur prise en charge est différente.
Les signes cliniques de la thyrotoxicose gestationnelle transitoire sont, le plus souvent, modérés.
La présence d’un goitre diffus, d’une orbitopathie ou d’antécédents personnels orientent vers une maladie de Basedow.
En cas de doute, le dosage des anticorps antirécepteurs de la TSH (anti-RTSH) confirme le diagnostic (tableau 2 ). La scintigraphie thyroïdienne est contre-indiquée. Rarement et dans des cas difficiles, le recours à l’échographie thyroïdienne se discute.
Les signes cliniques de la thyrotoxicose gestationnelle transitoire sont, le plus souvent, modérés.
La présence d’un goitre diffus, d’une orbitopathie ou d’antécédents personnels orientent vers une maladie de Basedow.
En cas de doute, le dosage des anticorps antirécepteurs de la TSH (anti-RTSH) confirme le diagnostic (
Des conséquences fœto-maternelles variables
En cas d’hyperthyroïdie clinique durant la grossesse, des risques accrus de fausse couche, d’hypertension artérielle gravidique, de thyrotoxicose aiguë, d’insuffisance cardiaque sont notifiés pour la mère. Un risque de retard de croissance intra-utérin et/ou de petit poids de naissance est aussi constaté (tableau 1 ).
En revanche, l’hyperthyroïdie fruste ne semble pas avoir de conséquence sur le déroulement de la grossesse.
Le risque de dysthyroïdie fœtale et néonatale est lié au passage transplacentaire des anticorps anti-RTSH mais aussi des antithyroïdiens de synthèse (ATS). Le dosage des anticorps anti-RTSH doit être réalisé en début de grossesse, entre 18 et 22 semaines d’aménorrhée (SA), puis entre 30 et 34 SA. Lorsque leur concentration est supérieure à 5 UI/L (c’est-à-dire 2 à 3 fois la normale, dosage de 2e génération), une surveillance rapprochée du fœtus par échographie est nécessaire. Le goitre fœtal étant le signe le plus précoce d’hyperthyroïdie fœtale, l’échographie doit être réalisée par un opérateur expérimenté et, en cas d’anomalie, le suivi doit être fait en centre expert.
En revanche, l’hyperthyroïdie fruste ne semble pas avoir de conséquence sur le déroulement de la grossesse.
Le risque de dysthyroïdie fœtale et néonatale est lié au passage transplacentaire des anticorps anti-RTSH mais aussi des antithyroïdiens de synthèse (ATS). Le dosage des anticorps anti-RTSH doit être réalisé en début de grossesse, entre 18 et 22 semaines d’aménorrhée (SA), puis entre 30 et 34 SA. Lorsque leur concentration est supérieure à 5 UI/L (c’est-à-dire 2 à 3 fois la normale, dosage de 2e génération), une surveillance rapprochée du fœtus par échographie est nécessaire. Le goitre fœtal étant le signe le plus précoce d’hyperthyroïdie fœtale, l’échographie doit être réalisée par un opérateur expérimenté et, en cas d’anomalie, le suivi doit être fait en centre expert.
Prudence avec les antithyroïdiens de synthèse
Généralement, une hyperthyroïdie modérée n’a que peu de répercussions sur la mère ou le fœtus. Ainsi, elle ne relève que d’une surveillance clinico-biologique rapprochée, compte tenu des risques inhérents à la prescription d’ATS durant la grossesse. En effet, les ATS peuvent être tératogènes (1 enfant sur 30 exposé aux dérivés imidazolés et 1 sur 40 aux dérivés du thio-uracile [avec toutefois des atteintes moins sévères]) et passent librement le placenta (fig. 1 ), induisant une hypothyroïdie fœtale pour de faibles posologies (la thyroïde fœtale étant plus sensible à leur action que la thyroïde maternelle).
De plus, l’évolution spontanée d’une maladie de Basedow peut se faire vers la normalisation de la fonction thyroïdienne en deuxième partie de grossesse (suppression partielle de l’activité immunologique maternelle).
La prise en charge thérapeutique d’une hyperthyroïdie modérée ou sévère en rapport avec la maladie de Basedow dépend de l’évaluation du rapport bénéfices-risques des traitements par ATS : risque d’une hyperthyroïdie maternelle versus risque de tératogénicité des ATS.
Le bilan thyroïdien est à surveiller à deux semaines, puis toutes les deux à quatre semaines, et le contrôle du bilan hépatique doit être mensuel (tableau 2 ).
De plus, l’évolution spontanée d’une maladie de Basedow peut se faire vers la normalisation de la fonction thyroïdienne en deuxième partie de grossesse (suppression partielle de l’activité immunologique maternelle).
La prise en charge thérapeutique d’une hyperthyroïdie modérée ou sévère en rapport avec la maladie de Basedow dépend de l’évaluation du rapport bénéfices-risques des traitements par ATS : risque d’une hyperthyroïdie maternelle versus risque de tératogénicité des ATS.
Le bilan thyroïdien est à surveiller à deux semaines, puis toutes les deux à quatre semaines, et le contrôle du bilan hépatique doit être mensuel (
Nodules thyroïdiens et thyroïdite du post-partum : la prise en charge peut attendre
Si un nodule thyroïdien est mis en évidence pendant la grossesse, la prise en charge est nécessaire mais non urgente, au vu du bon pronostic associé au cancer thyroïdien.
Nodules thyroïdiens : après l’accouchement
La prise en charge des nodules thyroïdiens en cours de grossesse est similaire à celle de la population générale.7 Elle repose sur la réalisation d’une échographie thyroïdienne en cas de nodules palpés ou s’il existe une gêne fonctionnelle. À l’échographie, le risque de malignité et les indications de cytoponction des nodules sont posés selon la classification EU-TIRADS (European Thyroid Imaging and Reporting and Data System).7
Dans la mesure où le cancer de la thyroïde est d’évolution lente et de très bon pronostic, la cytoponction peut, le plus souvent, être réalisée après l’accouchement, selon les résultats échographiques et l’anxiété de la patiente.
Dans la mesure où le cancer de la thyroïde est d’évolution lente et de très bon pronostic, la cytoponction peut, le plus souvent, être réalisée après l’accouchement, selon les résultats échographiques et l’anxiété de la patiente.
Thyroïdite du post-partum : le plus souvent transitoire
La thyroïdite du post-partum est une dysfonction thyroïdienne auto-immune qui survient durant la première année (vers le 6e mois en général) du post-partum chez des femmes euthyroïdiennes avant la grossesse. Les anticorps anti-TPO sont souvent positifs. Dans son évolution classique, la thyroïdite du post-partum débute par une thyrotoxicose transitoire, suivie d’une hypothyroïdie (autour du 3e mois du post-partum) également transitoire, avec un retour à l’euthyroïdie à la fin de la première année du post-partum. À noter que l’hypothyroïdie, après plusieurs poussées, peut être définitive dans 10 à 20 % des cas.
Encadre
Que dire à vos patientes ?
Les pathologies thyroïdiennes de la grossesse sont fréquentes et peuvent être transitoires.
Si un facteur de risque est présent, un dépistage de la TSH en préconceptionnel ou en début de grossesse est à prévoir.
Le traitement par lévothyroxine doit être pris avec une rigoureuse régularité. Si le traitement est antérieur à la grossesse, une augmentation d’un tiers de la dose à l’annonce de la grossesse est nécessaire.
Les interactions médicamenteuses avec la lévothyroxine sont possibles : les prises de fer et de lévothyroxine doivent être distantes de trois heures.
Références
1. Glinoer D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev 1997;18(3):404-33.
2. Alexander EK, Pearce EN, Brent GA, et al. Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27(3):315-89.
3. Haute Autorité de santé. Hypothyroïdies frustes chez l’adulte : diagnostic et prise en charge. Recommandation de bonne pratique. 2007.
4. Haddow JE, Palomaki GE, Allan WC, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 1999;341(26):549-55.
5. Negro R, Schwartz A, Gismondi R, et al. Increased pregnancy loss rate in thyroid antibody negative women with TSH levels between 2.5 and 5.0 in the first trimester of pregnancy. J Clin Endocrinol Metab 2010;95(9):E44-8.
6. Casey BM, Thom EA, Peaceman AM, et al. Treatment of Subclinical Hypothyroidism or Hypothyroxinemia in Pregnancy. N Engl J Med 2017;376(9):815-25.
7. Russ G, Bonnema SJ, Erdogan M, et al. European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS. Eur Thyroid J 2017;6(5):225-37.
2. Alexander EK, Pearce EN, Brent GA, et al. Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27(3):315-89.
3. Haute Autorité de santé. Hypothyroïdies frustes chez l’adulte : diagnostic et prise en charge. Recommandation de bonne pratique. 2007.
4. Haddow JE, Palomaki GE, Allan WC, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 1999;341(26):549-55.
5. Negro R, Schwartz A, Gismondi R, et al. Increased pregnancy loss rate in thyroid antibody negative women with TSH levels between 2.5 and 5.0 in the first trimester of pregnancy. J Clin Endocrinol Metab 2010;95(9):E44-8.
6. Casey BM, Thom EA, Peaceman AM, et al. Treatment of Subclinical Hypothyroidism or Hypothyroxinemia in Pregnancy. N Engl J Med 2017;376(9):815-25.
7. Russ G, Bonnema SJ, Erdogan M, et al. European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS. Eur Thyroid J 2017;6(5):225-37.

 Encadrés
Encadrés