Quelles causes ?
Dans les pays développés, la péricardite idiopathique, dite « virale », est le diagnostic final le plus courant. Dans une étude portant sur 259 biopsies effectuées chez des patients ayant un épanchement péricardique important, une cause sous-jacente a été identifiée par des méthodes moléculaires et immunohistologiques principalement comme autoréactive/lymphocytaire (c’est-à-dire idiopathique ou « virale », 35 %), maligne (28 %), traumatique (c’est-à-dire postchirurgie cardiaque, 15 %) et virale (12 %).1
Le spectre étiologique est différent dans les pays en développement, avec une prévalence élevée de la tuberculose (70 % des péricardites en Afrique subsaharienne et ≥ 90 % lorsqu’elle est associée à une infection par le virus de l’immunodéficience humaine [VIH]).
Certaines caractéristiques se sont avérées être des prédicteurs indépendants d’une cause spécifique (péricardite non virale ou non idiopathique) : une fièvre (hazard ratio [HR] : 3,56), l’évolution subaiguë (HR : 3,97), un épanchement péricardique important ou une tamponnade cardiaque (HR : 2,15), et l’échec des anti-inflammatoires non stéroïdiens (AINS) [HR : 2,50].2
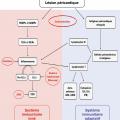
Quels mécanismes ?
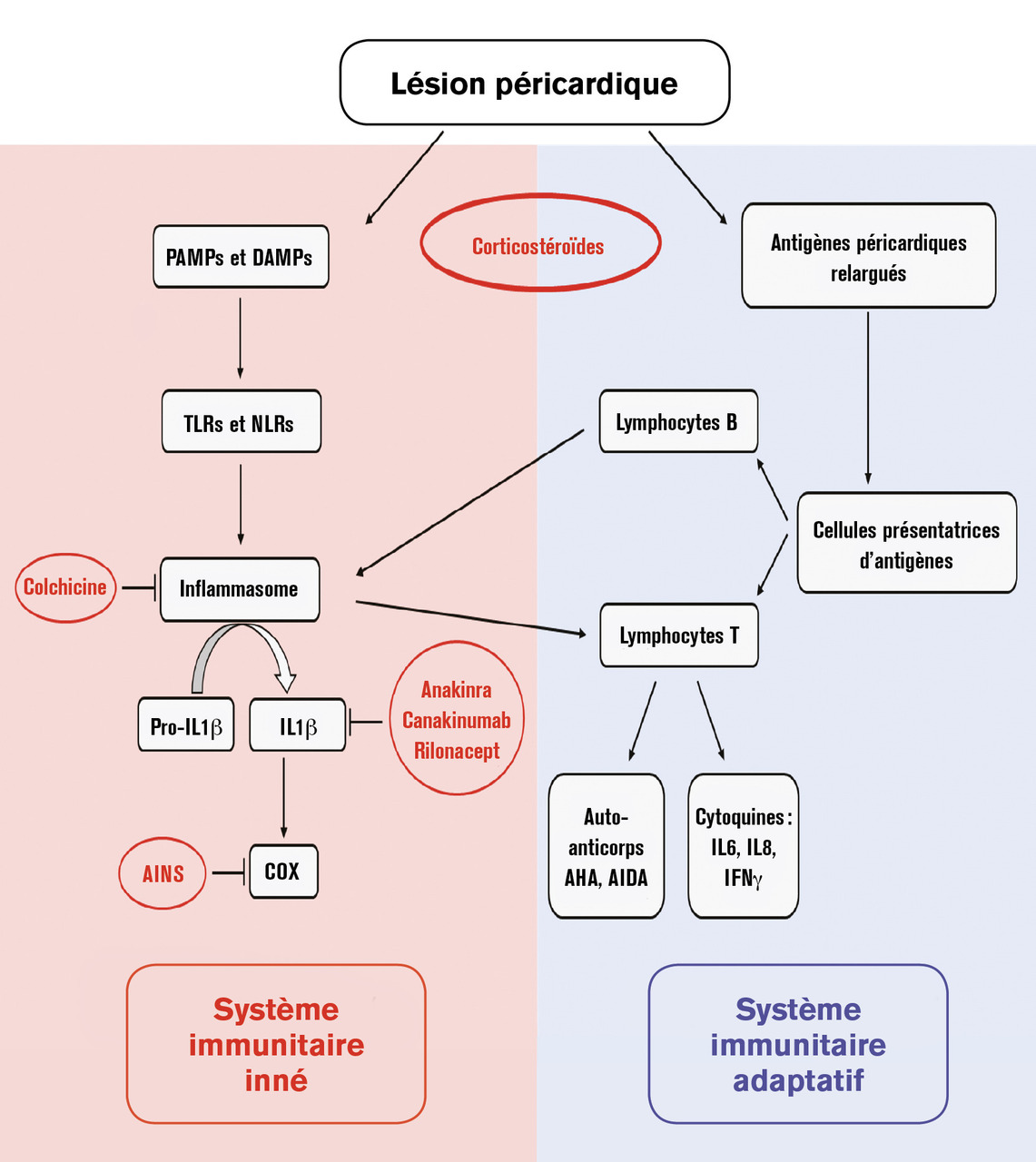
À l’inverse, les maladies auto-inflammatoires telles que les syndromes périodiques associés à la cryopyrine et la fièvre méditerranéenne familiale sont caractérisées par l’apparition spontanée de poussées inflammatoires intermittentes avec fièvre et sérite incluant fréquemment une péricardite. Dans la péricardite récurrente, le mécanisme auto-inflammatoire peut résulter de l’activation de l’inflammasome par un virus cardiotrope ou un agent non spécifique chez un patient qui a une immunité innée anormale. Cela entraîne la libération de cytokines pro-inflammatoires, y compris les interleukines – principalement l’IL-1 – qui amènent les neutrophiles et les macrophages dans la zone lésée.
Par ailleurs, la réponse inflammatoire du système immunitaire adaptatif, typique des maladies auto-immunes – principalement médiées par des auto-anticorps ou des lymphocytes T autoréactifs – semble également impliquée dans la péricardite idiopathique récurrente. Des auto-anticorps anti-cœur ou des auto-anticorps anti-disque intercalés ont été mis en évidence chez des adultes et ont été associés à un nombre plus élevé de récidives et d’hospitalisations.4
Conduite diagnostique
Une douleur thoracique quasi constante
Quelles investigations ?
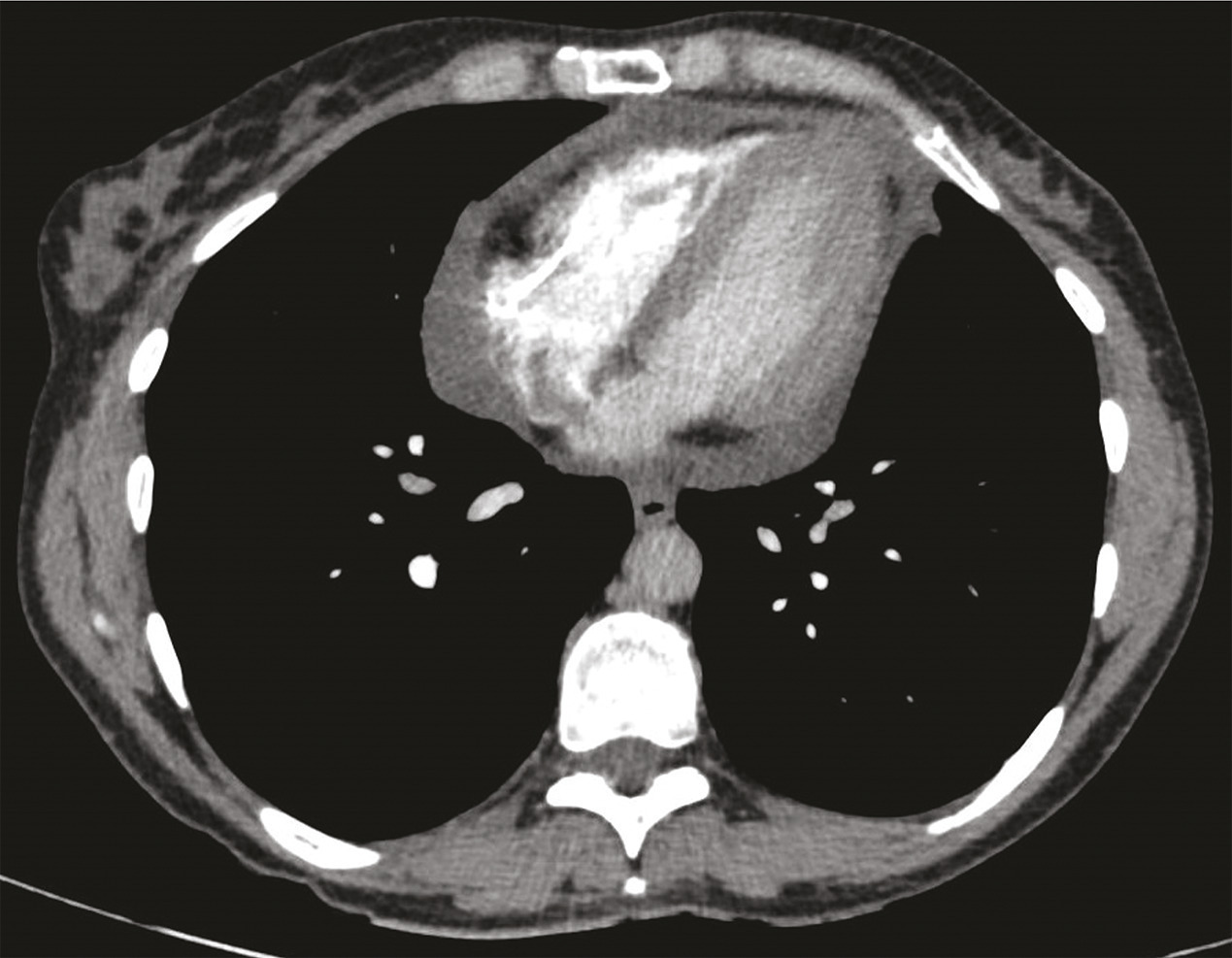
La radiographie de thorax est le plus souvent normale lorsque l’épanchement est modéré. La tomodensitométrie thoracique (
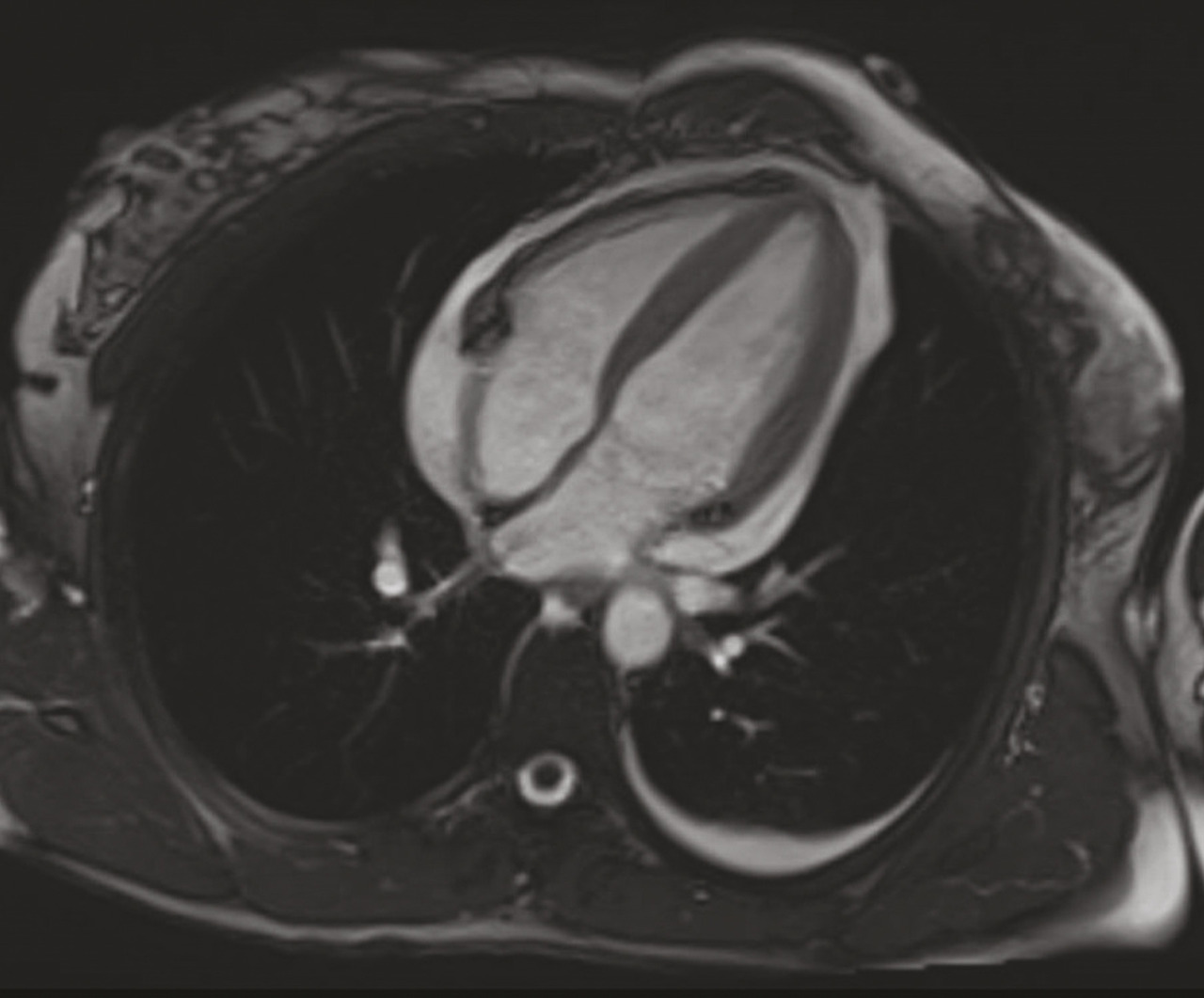
L’imagerie par résonance magnétique (IRM) cardiaque (
Quel traitement ?
Colchicine et AINS
Corticostéroïdes ou agents immunosuppresseurs
L’ère de l’antagoniste des récepteurs de l’interleukine-1
Les différentes molécules et leur voie d’action sont reprises dans la
Quelle évolution !
La péricardite constrictive, une complication rare
La péricardite constrictive est une complication rare de la péricardite aiguë, quelle qu’en soit la cause ; elle est caractérisée par l’altération fibrinocalcique du péricarde entraînant une perte de son élasticité. Le péricarde forme alors une coque rigide autour du cœur empêchant la transmission des pressions intrathoraciques aux cavités cardiaques, limitant le remplissage ventriculaire, et entraînant une insuffisance cardiaque diastolique à fraction d’éjection conservée.
Les symptômes sont variables, comprenant des signes d’insuffisance cardiaque droite et gauche, parfois des douleurs thoraciques et des palpitations. La dilatation des oreillettes peut entraîner une fibrillation atriale, et la fibrose peut se compliquer d’une oblitération des artères coronaires entraînant des complications ischémiques. Une hépatomégalie de stase, une ascite, voire une cirrhose peuvent compliquer le foie cardiaque chronique.
Le diagnostic est conforté par la tomodensitométrie et l’IRM cardiaque, qui permettent la mesure de l’épaisseur du péricarde (> 4 à 6 mm), la recherche de calcifications et de signaux inflammatoires. L’échocardiographie montre une fonction systolique conservée, des anomalies de la fonction diastolique et des anomalies de la cinétique du septum interventriculaire. Le Doppler du flux transmitral montre un profil restrictif. Un cathétérisme cardiaque est parfois nécessaire pour confirmer le diagnostic, notamment en cas de difficultés échographiques.
Dans les formes précoces, le traitement est d’abord celui de l’insuffisance cardiaque par diurétiques. Dans les formes évoluées, la péricardectomie est la seule option thérapeutique chez les patients ayant des symptômes sévères et invalidants. Si elle permet une amélioration des symptômes dans près de 70 % des cas, elle est grevée d’une lourde mortalité (de 4 à 12 % selon les séries) en raison du risque de lésion myocardique peropératoire si le péricarde est très calcifié, de décompensation cardiaque ou encore de rupture ventriculaire.
2. Imazio M, Cecchi E, Demichelis B, et al. Indicators of poor prognosis of acute pericarditis. Circulation 2007;115:2739-44.
3. Pankuweit S, Wädlich A, Meyer E, Portig I, Hufnagel G, Maisch B. Cytokine activation in pericardial fluids in different forms of pericarditis. Herz 2000;25:748-54.
4. Caforio ALP, Brucato A, Doria A, et al. Anti-heart and anti-intercalated disk autoantibodies: evidence for autoimmunity in idiopathic recurrent acute pericarditis. Heart 2010;96:779-84.
5. Imazio M, Demichelis B, Parrini I, et al. Day-hospital treatment of acute pericarditis: a management program for outpatient therapy. J Am Coll Cardiol 2004;43:1042-6.
6. Soler-Soler J, Sagristà-Sauleda J, Permanyer-Miralda G. Relapsing pericarditis. Heart 2004;90:1364-8.
7. Imazio M, Adler Y. Treatment with aspirin, NSAID, corticosteroids, and colchicine in acute and recurrent pericarditis. Heart Fail Rev 2013;18:355-60.
8. Imazio M, Belli R, Brucato A, et al. Efficacy and safety of colchicine for treatment of multiple recurrences of pericarditis (CORP-2): a multicentre, double-blind, placebo-controlled, randomised trial. Lancet 2014;383:2232-7.
9. Peiffer-Smadja N, Domont F, Saadoun D, Cacoub P. Corticosteroids and immunosuppressive agents for idiopathic recurrent pericarditis. Autoimmun Rev 2019;18:621-6.
10. Brucato A, Imazio M, Gattorno M, et al. Effect of anakinra on recurrent pericarditis among patients with colchicine resistance and corticosteroid dependence: the AIRTRIP randomized clinical trial. JAMA 2016;316:1906-12.
11. Klein A, Lin P, Cremer P, et al. Efficacy and safety of rilonacept in recurrent pericarditis: a multicenter phase 2 clinical trial. Circulation 2019;140:A12851.
12. Cacoub P, Marques C. Acute recurrent pericarditis: from pathophysiology towards new treatment strategy. Heart 2020;106:1046-51.
13. Imazio M, Cecchi E, Demichelis B, et al. Indicators of poor prognosis of acute pericarditis. Circulation 2007;115:2739-44.
14. Imazio M, Brucato A, Adler Y, et al. Prognosis of idiopathic recurrent pericarditis as determined from previously published reports. Am J Cardiol 2007;100:1026-8.

 Encadrés
Encadrés