Rationnel biologique
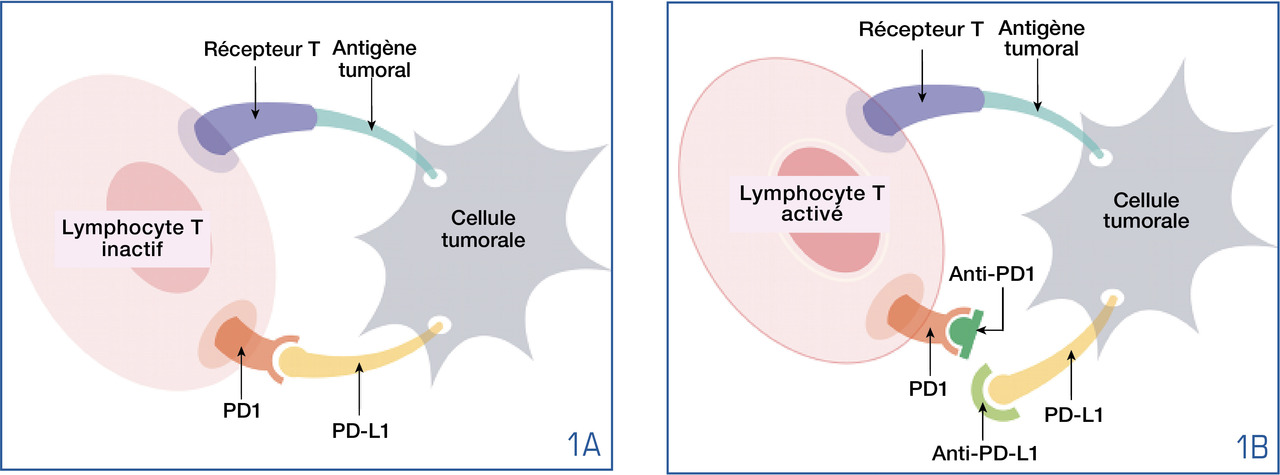
L’interaction entre le récepteur PD1 (Programmed cell Death 1), présent à la surface des lymphocytes T, et PD-L1, son ligand exprimé par la tumeur, aboutit à cette « tolérance » (fig. 1A-B). L’administration d’un anticorps monoclonal anti-PD1 ou anti-PD-L1 lève l’inhibition lymphocytaire.
La voie CTLA-4 (antigène 4 des lymphocytes T cytotoxiques) est un autre verrou inhibiteur utilisé en thérapeutique.
Cancers du rein métastatiques
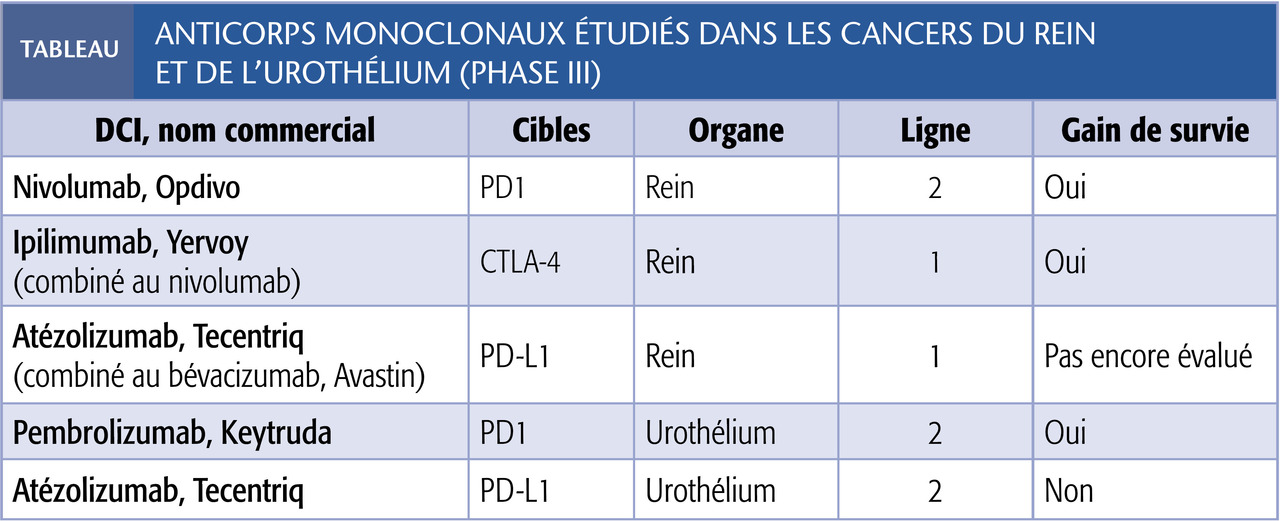
Le nivolumab, anticorps monoclonal humain anti-PD1, a été évalué après échec d’un anti-angiogénique, un inhibiteur du VEGF-R (récepteur du Vascular Endothelial Growth Factor). Une étude randomisée de phase III comparant cette molécule (3 mg/kg en perfusion IV courte d’une heure en hôpital de jour tous les 14 jours) à l’évérolimus (anti-angiogénique ciblant la protéine mTOR - mammalian Target Of Rapamycin) montre une réduction du risque de décès de 27 % en faveur du nivolumab (médianes de survie de 25 vs 19,6 mois).1 Dans l’ensemble, la tolérance est meilleure que celle des médicaments ciblant la néo-angiogenèse. Des manifestations générales (fatigue, pics fébriles lors des perfusions) et spécifiques peuvent néanmoins survenir chez environ 10 % des patients : cutanées (éruptions maculo-papuleuses), digestives (colites avec diarrhées), endocriniennes (hypothyroïdie, hyperthyroïdie, hypophysite), hépatiques (élévation asymptomatique des transaminases), pulmonaires (pneumopathie inter-stitielle) et cardiaques (myocardite). Ces effets indésirables, si sévères, imposent une prise en charge rapide par un spécialiste.
L’intérêt de l’immunothérapie en première ligne a été évalué dans 2 études récentes de phase III.
Un premier essai a comparé le sunitinib (anti-VEGF-R) à l’association nivolumab (anti-PD1-L1) + ipilimumab (anti-CTLA-4). Cette combinaison a permis une réduction de 37 % du risque de décès chez les patients au pronostic intermédiaire ou mauvais.2 Le gain d’efficacité est obtenu au prix d’une toxicité plus importante que celle du nivolumab seul ou du sunitinib : le traitement a dû être précocement interrompu chez 15 % des patients, et 7 décès toxiques sont survenus parmi les 425 sujets ayant reçu l’immunothérapie. Cette association pourrait constituer le prochain standard de prise en charge pour les patients ayant un moins bon pronostic.
Une deuxième étude a comparé atézoli-zumab (anti-PD-L1) + bévacizumab (anti-VEGF) et sunitinib. Un gain de survie sans progression de la maladie est observé avec l’association (11, 2 vs 7,7), mais les résultats en termes de survie globale ne sont pas encore disponibles.3
Cancers urothéliaux métastatiques
Quel intérêt dans les cancers gastriques ?
La survie des patients atteints de cancer de l’estomac métastatique est limitée. Les traitements de 1re et 2e ligne sont des bichimiothérapie à base de sels de platine, irinotécan ou taxotère associé à du 5-fluorouracile ou Herceptin si surexpression de HER2. En 3e ligne, il n’y a pas de recommandation thérapeutique. Deux essais cliniques de phase I-II ont montré l’efficacité chez ces patients du nivolumab ou du pembrolizumab, avec une toxicité gérable.1, 2
ATTRACTION-2 (étude de phase III randomisée)3 a été menée chez des sujets asiatiques ayant un cancer primitif de l’estomac ou de la jonction œsogastrique non résécable après échec d’au moins 2 lignes de chimiothérapies. Les patients inclus n’avaient pas reçu d’immunothérapie précédemment, n’avaient pas de métastases cérébrales ni d’antécédents de maladies auto-immunes, de pneumopathie interstitielle ou de maladie inflammatoire intestinale. 350 patients ont été traités par nivolumab (vs 162 dans le groupe placebo) entre 2014 à 2016 ; il était administré à la dose de 3 mg/kg en IV toutes les 2 semaines, jusqu’à progression. Les patients étaient surveillés toutes les 6 semaines par scanner ou IRM. Une différence significative en termes de survie globale et sans progression a été rapportée en faveur du nivolumab (5,26 mois vs 4,14). La durée moyenne de réponse était de 9,5 mois.
Concernant la tolérance, 5 décès liés aux effets indésirables (EI) de l’immunothérapie (2 %) contre 1 dans le groupe placebo ; EI graves chez 34 patients contre 7. Principaux EI : diarrhées (colites), hépatites, pneumopathie interstitielle (moins de 10 % des patients).
C’est le premier essai validant l’intérêt du nivolumab en 3e lignedes cancers gastriques fortement prétraités. Les patients ont une survie globale plus longue, avec une réponse en plateau qui semble durable. Les données concernant la qualité de vie ne sont pas encore disponibles. Il sera intéressant de valider ces résultats dans une population non asiatique et de mieux identifier les sous-types de patients « bons répondeurs ».
Une dizaine d’essais cliniques sont en cours, aussi bien dans les formes métastatiques que résécables : ils devraient permettre de mieux déterminer la place de ces thérapeutiques
.
2. Muro K, et al. Pembrolizumab for patient with PD-L1 positive advanced gastric cancer (KEYNOTE-012): a multicenter, open label, phase 1b trial. Lancet Oncol 2016;17:717-26.
3. Kang YK, et al. Nivolumab in patients with advanced gastric or gastro- oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017;390:2461-71.
2. Motzer RJ, Tannir NM, McDermott DF, et al.; CheckMate 214 enquêteurs. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018;378:1277-90.
3. Motzer RJ, Powles T, Atkins MB, et al. IMmotion 151: a randomized phase III study of atezolizumab plus bevacizumab versus sunitinib in untreated metastatic renal cell carcinoma (abstract). J Clin Oncol 2018;36 (suppl):578.
4. Bellmunt J, de Wit R, Vaughn DJ, et al.; DEYNOTE -045 investigators. Pembrolizumab as second-line therapy for advanced urothelial carcinoma. N Engl J Med 2017;376:1015-26.
5. Powles T, Duran I, van der Heijden MS, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2018;391:748-57.
S. Culine déclare participer ou avoir participé à des interventions ponctuelles pour Roche, MSD, Astellas, Janssen et avoir été pris en charge lors de congrès par Janssen, Roche, Astellas.

 Encadrés
Encadrés