L’observation d’un pic à l’électrophorèse est une situation fréquente en médecine générale. Quelles causes évoquer ? Quelles explorations complémentaires et quel suivi proposer aux patients ? Quand adresser au spécialiste ? L’essentiel pour le MG.
Quelques rappels
Une électrophorèse de protéines sériques (EPS ; indications ci-dessous*) consiste à séparer les protéines du sérum (partie liquide du sang, dépourvue des cellules et du fibrinogène, et contenant très peu de facteurs de coagulation) grâce à un champ électrique, en plusieurs fractions (1 d’albumine et 4 ou 5 de globulines). Le résultat comprend le dosage des protéines sériques totales, un tracé figurant les différentes fractions séparées et un commentaire du biologiste (figure 1). Un pic résulte de l’accumulation de protéines toutes identiques (puisqu’issues d’un même clone de cellules B) en un endroit particulier lors de la séparation des protéines à l’électrophorèse (figure 2). Ce peut être une Ig entière (IgG, IgA ou IgM, rarement une IgD ou IgE) ou incomplète, à savoir une chaîne légère libre (kappa ou lambda) ou parfois une chaîne lourde (gamma, alpha, mu, ou delta et epsilon).
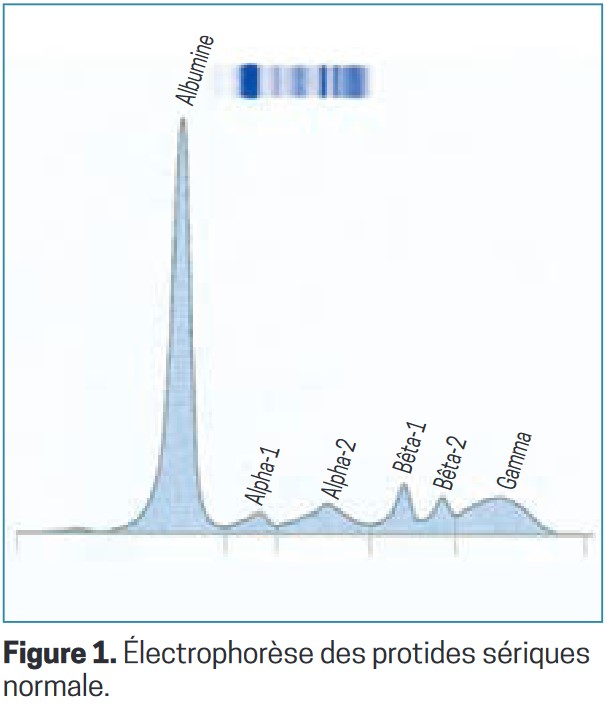
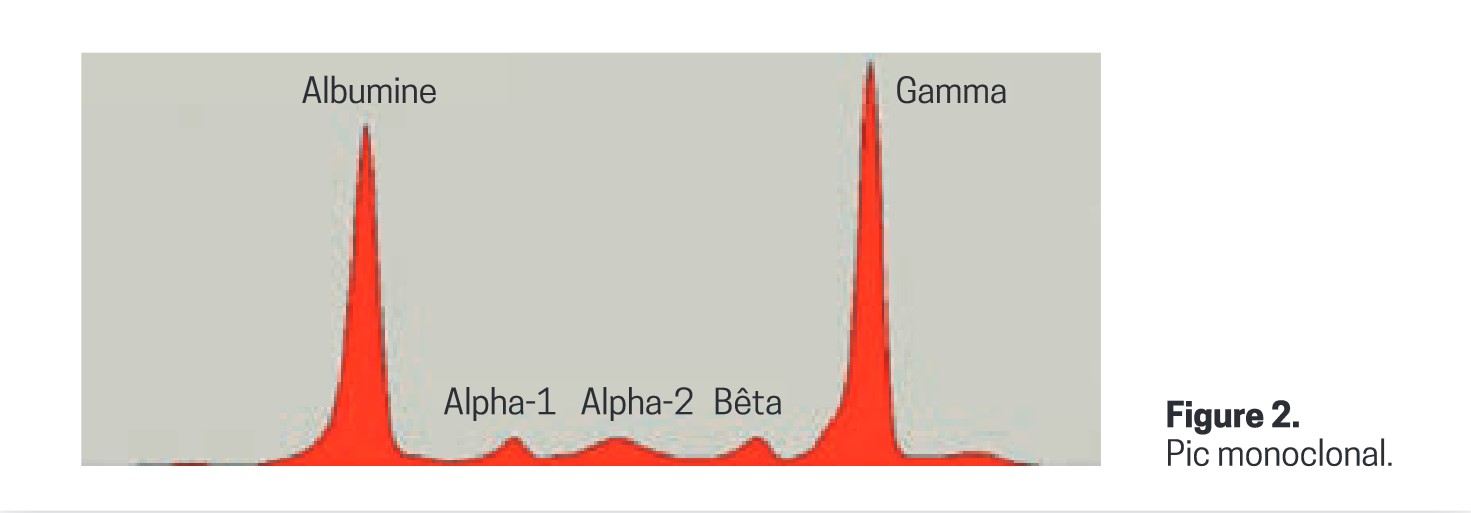
La fraction des gammaglobulines comprend 95 % des IgG et des IgM, et environ 50 % des IgA. C’est donc dans cette zone que l’on observe la majorité des pics. Plus rarement, il peut être situé dans la fraction des bêtaglobulines, voire dans celle des alpha-2-globulines.
Attention : certains médicaments peuvent fausser l’analyse (injection de produits de contraste, traitement par biothérapies). Ils peuvent donner lieu à un pic et inquiéter à tort cliniciens et patients ; ils correspondent à des IgG, et leurs taux ne dépassent pas 1 à 3 g/L.
Que faire devant un pic ?
Sa présence n’est pas suffisante à elle seule pour affirmer une Ig monoclonale. Le laboratoire doit confirmer sa monoclonalité en identifiant la protéine impliquée, puis la quantifier et joindre un commentaire.
L’identification d’une Ig monoclonale est réalisée par immunofixation ou immunotypage.
Sa quantification est directement réalisée sur l’EPS par la mesure de l’aire du pic sous la courbe. Il y a 2 modalités de mesure (orthogonale ou tangentielle), ce qui engendre des estimations différentes. Ainsi, il est recommandé d’effectuer la surveillance d’un pic dans le même laboratoire.
Enfin, le biologiste rédige un commentaire. Il peut aussi proposer des investigations complémentaires (dosage de chaînes légères libres sériques, recherche de protéines de Bence-Jones, de cryoglobulinémie…) ; le clinicien jugera de leur pertinence selon le contexte clinique.
À savoir : une EPS seule ne permet pas d’affirmer le caractère monoclonal d’une anomalie. Mais, à l’inverse, une EPS normale n’exclut pas une Ig monoclonale, même s’il existe une hypogammaglobulinémie. Ainsi, en cas de suspicion clinique, il est préférable de prescrire nommément la recherche d’une Ig monoclonale car l’EPS seule, dans certaines situations, peut être mise en défaut.
Quelles causes ?
La découverte d’une Ig monoclonale est fréquente et concerne environ 1 % de la population générale. Sa prévalence augmente avec l’âge (5 % pour des sujets > 70 ans, 15 % chez ceux > 85 ans). On estime que près de 70 % des Ig monoclonales sont des IgG, 15 % des IgA et 15 % des IgM. Rarement, un double ou triple pic est observé. Cela ne préjuge ni de sa cause ni de sa gravité.
Les causes peuvent être classées en 3 catégories :
1. les gammapathies monoclonales de signification indéterminée (GMSI), traduction de l’acronyme anglais MGUS (Monoclonal Gammopathy of Undetermined Significance), qui représentent la majorité des pics monoclonaux détectés en médecine de ville. Elles sont définies comme une gammapathie isolée dont la quantification reste stable et qui ne s’accompagne d’aucun signe clinique ou biologique de myélome, de maladie de Waldenström ou d’une autre hémopathie maligne. Il s’agit donc d’un diagnostic d’exclusion. Elles ne sont pas « bénignes », car considérées comme des états prénéoplasiques : une partie d’entre elles peut évoluer vers une hémopathie maligne, le risque évolutif étant « faible », de 1 % par année de suivi. Trois principaux facteurs de risque : l’isotype (IgA et IgM), le taux du composant monoclonal > à 15 g/L et le dosage anormal des chaînes légères libres sériques avec un rapport kappa/lambda inadapté ;
2. les hémopathies malignes, essentiellement le myélome multiple et la macroglobulinémie de Waldenström. Les examens complémentaires dépendent de l’observation clinique et du type d’Ig monoclonale. Pour les gammapathies à IgG et IgA, la principale hémopathie responsable est le myélome multiple. Dans cette hypothèse, on recherche une anémie, une insuffisance rénale, une hypercalcémie, une plasmocytose médullaire (> 10 %), un taux du composant monoclonal sérique ou urinaire élevé et/ou des lésions osseuses (lacunes).
Attention : les nouveaux critères du myélome multiple (2014)1 ne prennent plus en compte le taux de l’Ig monoclonale, sachant qu’il existe des cas où l’EPS ne révèle pas de pic monoclonal (myélomes non sécrétants ou à chaînes légères).
Pour les gammapathies à IgM, le principal diagnostic est la maladie de Waldenström, association d’une IgM > à 5 g/L et d’une infiltration lymphoplasmocytaire. L’interrogatoire et l’examen clinique objectivent une splénomégalie et/ou des adénopathies, une cytopénie, des symptômes généraux (fièvre, sueurs nocturnes, perte de poids).
Les examens complémentaires de 1ère intention comportent des analyses biologiques (hémogramme, créatininémie, LDH, protéinurie), une radiographie du thorax et une échographie abdominale à la recherche d’adénopathies profondes, de splénomégalie ou de syndrome tumoral.
3. les gammapathies associées à d’autres pathologies « non lymphoïdes ». Toutes les infections virales, bactériennes ou parasitaires peuvent s’accompagner d’une gammapathie monoclonale (transitoire lors d’infections aiguës ; persistante lors d’infections chroniques), mais aussi les maladies auto-immunes (lupus, polyarthrite rhumatoïde, syndrome de Gougerot-Sjögren...), les hépatopathies chroniques, les déficits immunitaires acquis ou non (VIH, patients greffés…). Considérée comme « réactionnelle », la gammapathie évolue dans certains cas (syndrome de Gougerot-Sjögren, hépatite virale C) vers un syndrome lymphoprolifératif malin, ce qui impose une surveillance.
Quelle est conduite à tenir ?
Les circonstances dans lesquelles cette recherche a été prescrite doivent être prises en compte, ainsi que l’âge du patient et les caractéristiques de cette Ig monoclonale (IgM ou non). L’objectif est de répondre à la question cruciale : s’agit-il ou non d’une hémopathie maligne, sachant que les GMSI sont un diagnostic d’exclusion et qu’elles représentent plus de 50 % des Ig monoclonales détectées en pratique courante, leur prévalence augmentant avec l’âge ?
Des recommandations ont été rédigées par différents groupes de travail.2-4Les examens paracliniques de 1ère intention comportent au minimum un hémogramme, une calcémie corrigée, une créatininémie. L’imagerie est à adapter.
Il faut adresser le patient pour avis si :
– la symptomatologie clinique évoque une hémopathie maligne ;
– au moins un des examens de première intention est anormal ;
– l’Ig monoclonale sérique est élevée (IgG > 15 g/L, IgA ou IgM > 10 g/L) ;
– son âge est < à 60 ans.
Si l’Ig monoclonale est asymptomatique et sans signe biologique, la surveillance de l’EPS, de l’hémogramme, de la calcémie corrigée et de la créatininémie doit être régulière.
Le premier rendez-vous de suivi est à 6 mois, puis annuel, éventuellement rapproché en cas de signes d’appel particuliers.
La répétition de l’identification de l’Ig monoclonale est inutile. En cas de progression de plus de 25 % de la concentration du pic en g/L ou d’apparition de signes cliniques d’appel ou d’anomalie des examens biologiques de suivi, le patient doit être adressé pour avis complémentaire.
*Indications de prescription d’une électrophorèse en médecine générale (classées dans l’ordre du consensus)
• Anomalie de l’hémogramme sans cause évidente (en particulier cytopénie, hémolyse)
• Tassement vertébral suspect, fracture pathologique
• Hypercalcémie vraie (corrigée en fonction de l’albuminémie/protidémie)
• Protéinurie significative (> 0,5 g/L)
• Neuropathie périphérique inexpliquée
• Vitesse de sédimentation élevée avec protéine C-réactive normale en dehors de la grossesse
• Douleurs osseuses non traumatiques
• Insuffisance rénale récente (sans obstacle)
• Infections à répétition
• Purpura vasculaire
• Signes cliniques ou biologiques d’hépatopathie
• Adénopathies, splénomégalie
• Polyarthrite inexpliquée
Il faut aussi considérer une situation d’urgence rare : le syndrome d’hyperviscosité.
Cinzia Nobile, La Revue du Praticien
D’après :
Gatfossé M. Interpréter une électrophorèse des protides sériques.Rev Prat Med Gen 2022;36(1063);22-5.
Musset L. Pic monoclonal à l’électrophorèse : comment l’interpréter ?Rev Prat Med Gen 2020;34(1048);696-8.
Références : (1) Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014;15(12):e538-48. (2) HAS. Quand prescrire une électrophorèse des protéines sériques (EPS) et conduite à tenir en cas d’une immunoglobuline monoclonale. 30 janvier 2017. (3) Labruyère A, Partouche H. Élaboration et validation d’un référentiel de prescription et de décision en cas de pic monoclonal. Exercer 2011;97(4):68-74. (4) Decaux O. Conduite à tenir devant une gammapathie monoclonale ? Rev Prat 2018;68(7):777-84.


