Mélanome
Excepté en Australie et Nouvelle Zélande, son incidence dans le monde est croissante depuis les années 1980, quel que soit l’âge. En France, l’incidence représente environ 15 000 nouveaux cas par an (âge médian 60 ans et 67 ans chez l’homme et la femme, respectivement). Les progrès considérables en termes de thérapeutiques réalisés au cours des 10 dernières années commencent à avoir un impact mesurable depuis 2015 sur la mortalité liée au mélanome.1, 2
Quels biomédicaments ont révolutionné sa prise en charge ?
Les thérapies ciblées
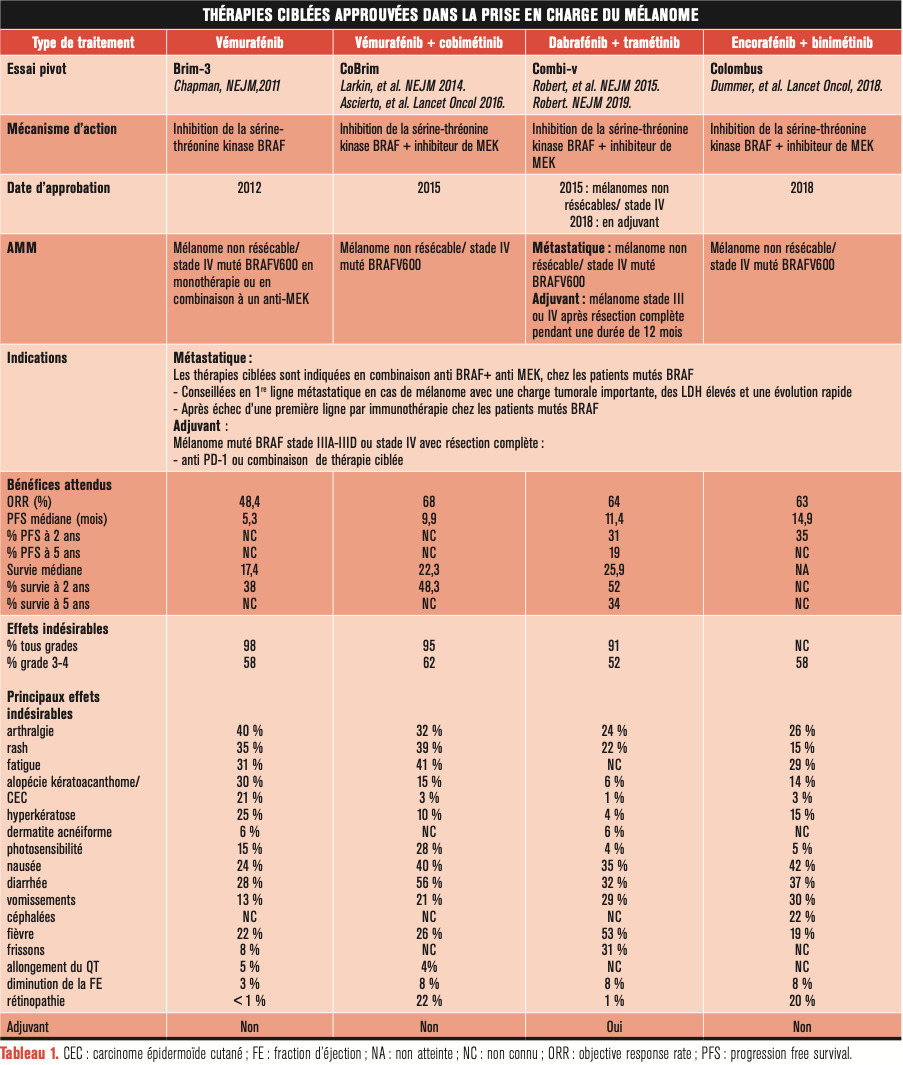
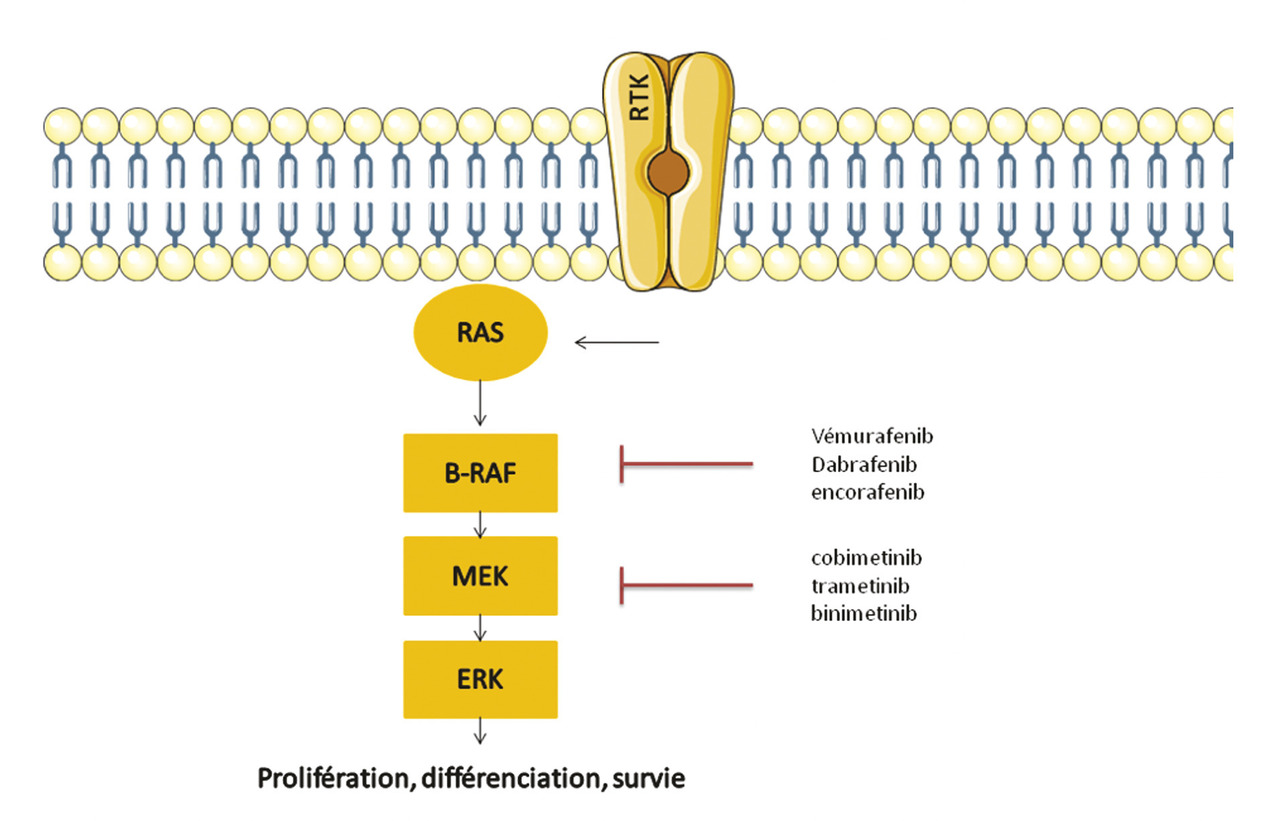
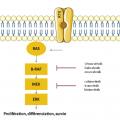
Environ 40 % des mélanomes cutanés sont mutés BRAF V600 et 20 % sont mutés NRAS. Ces mutations entraînent une suractivation de la voie des MAPkinases impliquée dans la prolifération, la différenciation et la survie cellulaire. La découverte de ces mutations a permis l’émergence des thérapies ciblées : les inhibiteurs de BRAF puis les inhibiteurs de MEK (Actuellement, ce sont les combinaisons anti-MEK/anti-BRAF qui sont couramment utilisées chez les patients mutés BRAF. Les associations vémurafenib plus cobimétinib et dabrafénib plus tramétinib ont eu l’autorisation de mise sur le marché (AMM) en 2015. Ces deux combinaisons étaient comparées dans les essais pivots au vémurafénib en monothérapie. Elles permettaient une augmentation du taux de réponse objective tout en diminuant la survenue d’effets indésirables de grades 3 et 4 (
L’encorafénib associé au binimétinib est une nouvelle association approuvée depuis 2018. Son efficacité n’a été évaluée qu’en comparaison au vémurafénib et à l’encorafénib seul.
Bien que ces combinaisons de thérapie ciblées étaient indiquées initialement en première ligne chez les patients mutés BRAF, ces combinaisons thérapeutiques sont de plus en plus données en première ligne aux patients ayant une charge tumorale et un taux de LDH élevés, progressant rapidement, et dont l’efficacité attendue d’une immunothérapie antitumorale semblerait trop tardive.3
L’immunothérapie antitumorale
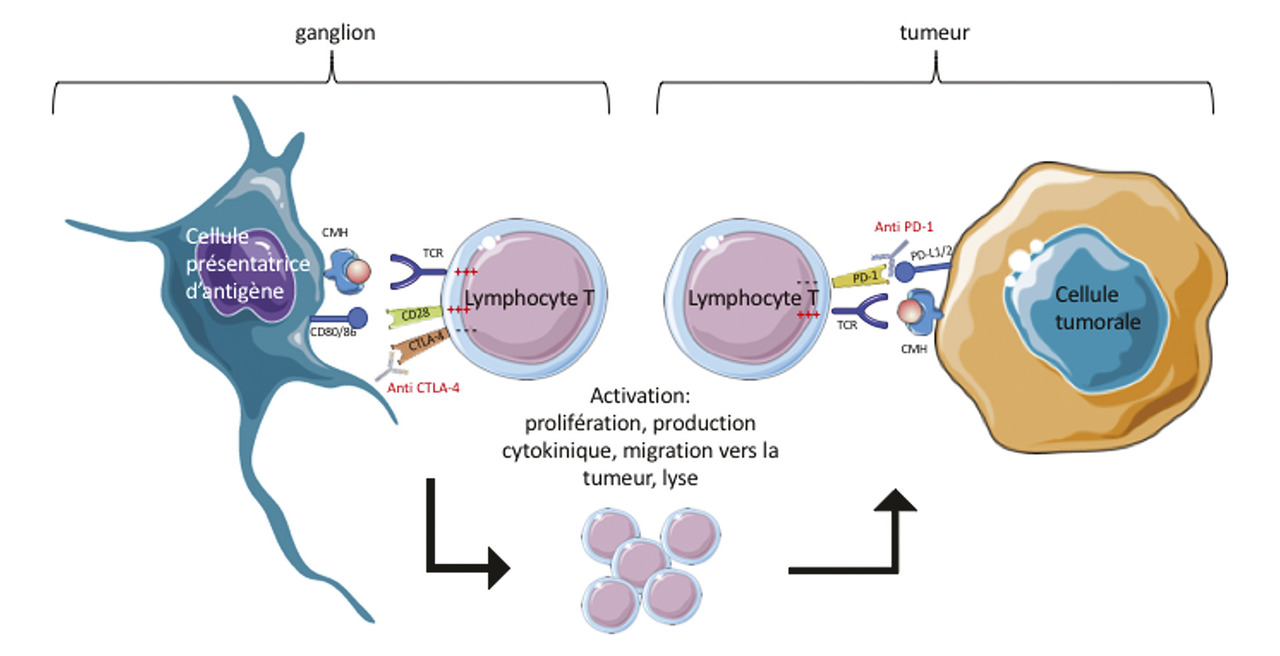
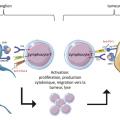
Le système immunitaire joue un rôle clé dans la clairance des cellules tumorales. L’immunothérapie antitumorale approuvée dans le traitement du mélanome aux stades avancés cible les points de contrôles immunitaires impliqués dans l’activation lymphocytaire T : PD-1 (programmed cell death 1) et CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) :– CTLA-4 est un récepteur immunitaire homologue au CD28 ; CD28 est une molécule de costimulation permettant l’activation du lymphocyte T lors de la présentation de l’antigène par une cellule présentatrice d’antigène (cellule dendritique, complexe majeur d’histocompatibilité 1/2 [CMH-1/2]) au niveau du ganglion lymphatique ; CTLA-4 a une affinité plus forte que CD28 aux ligands CD80/86 et génère un signal inhibiteur au lymphocyte T ;
– PD-1 est exprimé par les lymphocytes T tandis que PDL-1, son ligand, est exprimé par les cellules tumorales et les cellules immunitaires de l’environnement tumorale. Lors de la présentation de l’antigène tumorale via le CMH-1 par les cellules tumorales, la liaison de PD-1 au PD-L1 bloque l’activation du lymphocyte T et donc la réponse T antitumorale, au site tumoral (
L’inhibition de ces deux points de contrôles immunitaires permet de restaurer la réponse immunitaire adaptative lymphocytaire T CD4 Th1 et T CD8+ cytotoxique antitumorale du patient. Par ailleurs, la restauration de cette réponse immunitaire adaptative permet de générer une mémoire immunitaire antitumorale. L’immunothérapie antitumorale ouvre des perspectives de réponses prolongées, voire de rémission, chez les patients traités.
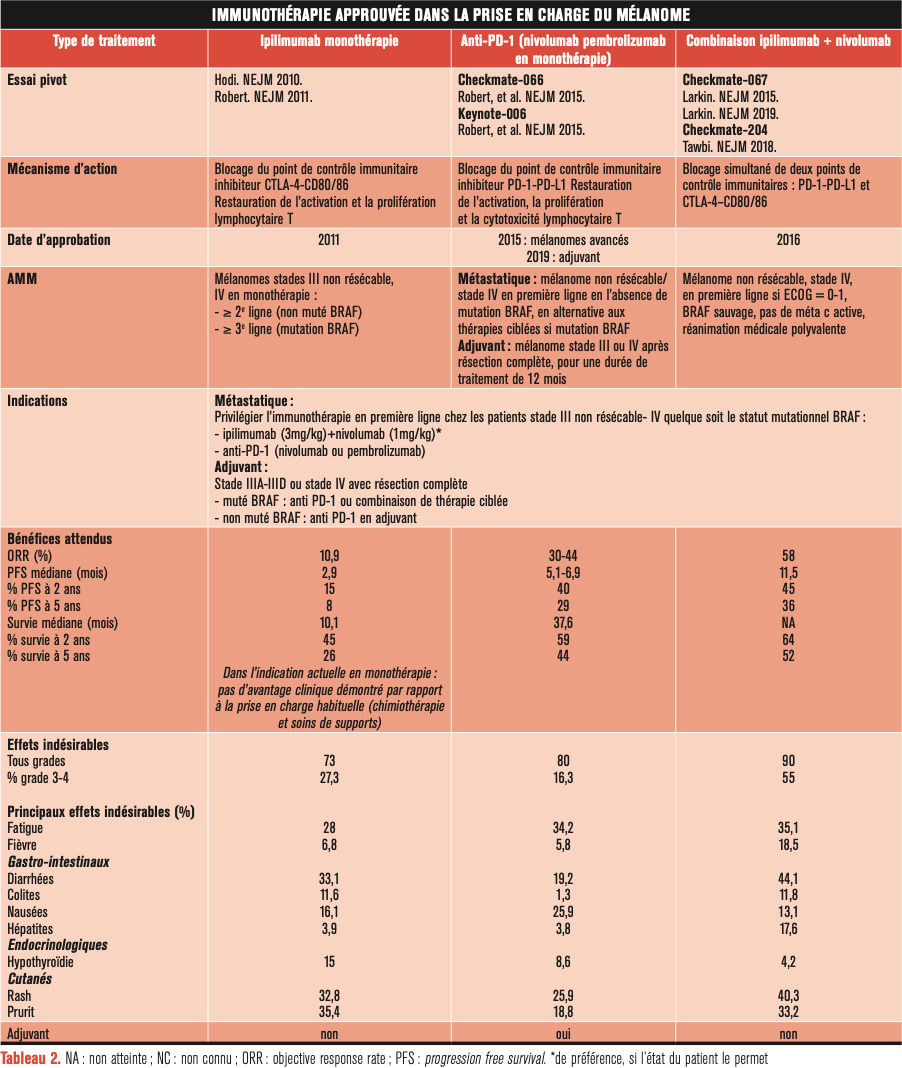
L’immunothérapie repose actuellement principalement sur l’utilisation des anticorps anti-PD-1 : le nivolumab et le pembrolizumab, qui ont prouvé un gain en survie sans progression et en survie globale obtenu en comparaison à l’ipilimumab en monothérapie. Ils ont tous les deux obtenu l’AMM en 2015 pour la prise en charge du mélanome avancé non muté BRAF en première ligne, sinon en alternative aux thérapies ciblées en cas de mutation BRAF.
L’association ipilimumab (anti-CTLA-4) et nivolumab a eu l’AMM en 2016. Bien que l’essai pivot soit dimensionné pour comparer la combinaison à l’ipilimumab seul et non au nivolumab (monothérapie), il a été noté une augmentation des chiffres en termes de taux de réponse, de survie sans progression et de pourcentage de survie globale à 5 ans, en faveur de la combinaison (
En France, cette combinaison est remboursée chez les patients aux stades III inopérables ou stade IV, en bon été général (ECOG 0-1), en première ligne, en l’absence de mutation BRAF, de métastase cérébrale active. Cependant, cette combinaison a maintenant sa place en première ligne aussi pour les patients mutés BRAF car les données à 5 ans de l’essai pivot récemment publiées montrent une survie plus importante chez les patients mutés BRAF traités en première ligne par la combinaison ipilimumab-nivolumab (60 % de survie à 5 ans), en comparaison indirecte à ceux traités en première ligne par l’association dabrafénib-tramétinib (34 % de survie à 5 ans).
Également, de récentes études ont montré le bénéfice particulier de cette association chez les patients atteints de métastases cérébrales asymptomatiques avant ou en combinaison à un traitement par radiothérapie stéréotaxique sur ces lésions (taux de réponse objective en intracrânien ipilimumab + nivolumab 47 % vs nivolumab 20 %) et avant même l’administration d’un anti-BRAF + anti-MEK.
La stratégie actuelle recommandée au niveau européen est de privilégier une première ligne par immunothérapie : de préférence l’ipilimumab (3 mg/kg) associé au nivolumab (1 mg/kg) si l’état général du patient le permet, sinon une monothérapie par anti PD-1.3
Pour limiter les effets indésirables liés à l’association ipilimumab (3 mg/kg) plus nivolumab (1 mg/kg), la posologie de ipilimumab (1 mg/kg) plus nivolumab (3 mg/kg) a été investiguée (CheckMate 511). L’efficacité ne semblait pas diminuée et était associée à une diminution de 20 % des toxicités sévères. Cette posologie, qui n’a pas démontré son bénéfice à long terme, peut être discutée au cas par cas chez les sujets âgés, et peut constituer une association prometteuse en adjuvant ou en néoadjuvant.
La place de ces traitements en adjuvant
D’après l’AJCC n°8, les stades IIIb et IIIc ont un pronostic sombre. Seulement 77 % et 60 % des patients sont vivants à 10 ans, respectivement.Les nouveaux traitements ont été évalués en adjuvant pour les stades III avérés ou IV selon les essais, après résection complète de la tumeur.
La supériorité de l’association dabrafénib-tramétinib administrée pendant 12 mois a été prouvée versus placebo chez les mélanomes mutés BRAF (stade IIIA, B ou C, après résection complète). L’extension d’indication a été approuvée en 2018.
En 2019, les anti-PD-1 (nivolumab et pembrolizumab) ont également eu l’AMM en adjuvant pour les mélanomes stades III ou IV après résection complète, pour une durée de traitement de 12 mois. Ce traitement adjuvant permet d’accroître considérablement la survie sans récidive en comparaison à un traitement placébo (hazard ratio [HR] : 0,57 [0,43-0,74] ; p < 0,001) ou à l’ipilimumab seul (HR : 0,68 [0,67-0,82] ; p < 0,001).
En pratique, les patients ayant un mélanome stade IIIA-IIID ou stade IV avec résection complète muté BRAF peuvent bénéficier aussi bien d’un anti-PD-1 que de la combinaison de thérapies ciblées tandis que les patients ayant un mélanome non muté BRAF ne pourront bénéficier que de l’anti-PD-1 en adjuvant. Le rapport bénéfice-risque d’un traitement adjuvant mérite d’être mieux évalué chez les patients ayant un mélanome de stade IIIA avec métastase ganglionnaire inférieure à 1 mm de diamètre, non concerné par les essais.3
Avec quels effets indésirables ?
Les thérapies ciblées
Il est intéressant de noter qu’une bithérapie anti-BRAF/anti-MEK améliore le profil de tolérance par rapport à un anti-BRAF seul. Les toxicités cutanées rencontrées avec la monothérapie anti-BRAF, principalement le développement de carcinomes cutanés et kérato-acanthomes, sont le reflet d’une activation paradoxale de la voix des MAP kinases. Cette activation paradoxale est alors inhibée par l’association d’un anti-MEK. Les principaux effets secondaires d’intérêt rencontrés avec les anti-MEK sont les complications oculaires et cardiaques. Les toxicités cardiaques font l’objet d’une surveillance rapprochée, clinique et échographique. L’ensemble de ces toxicités sont décrites dans leL’immunothérapie antitumorale
À l’état physiologique, les inhibiteurs des points de contrôles immunitaires ont un rôle majeur. Au cours de la réponse immunitaire, ces points de contrôles constituent un mécanisme de rétrocontrôle important pour empêcher l’emballement de la réponse immunitaire. De plus, ils constituent un mécanisme de tolérance périphérique, en empêchant la réactivité contre des antigènes du soi de clones lymphocytaires autoréactifs ayant échappé aux mécanismes de tolérance centrale (thymiques). L’engagement de ces points de contrôles immunitaires permet donc la prévention de la maladie auto-immune. Leur inhibition peut donc lever un frein sur des clones autoréactifs et par conséquent déclencher une maladie auto-immune.C’est initialement avec les anti-CTLA-4 (ipilimumab) que ces toxicités immunomédiées ont été décrites et diffèrent des toxicités rencontrées avec les chimiothérapies classiques et les thérapies ciblées. Les anti-PD-1 en monothérapie ont un meilleur profil de tolérance que l’ipilimumab. Leur association (ipilimumab plus nivolumab), du fait de la levée d’inhibition simultanée de deux points de contrôles immunitaires, augmente la réponse antitumorale, mais entraîne un surcroît de toxicité par rapport à chacune des monothérapies (
Les toxicités immunomédiées liées à ces thérapies peuvent intéresser tous les organes. Leur prise en charge est fondée sur des recommandations européennes.4 Elle est adaptée et basée sur les connaissances actuelles pour chaque toxicité. Elle consiste, pour leur majorité, à la suspension du traitement, l’administration de stéroïdes en cas de sévérité (grade ≥ 3) et en cas d’échec, à l’administration d’un immunosuppresseur plus puissant. Selon la balance bénéfice-risque, l’immunosuppression sera diminuée aussi rapidement que possible s’il est décidé d’une reprise du traitement par immunothérapie antitumorale. Les toxicités endocriniennes, en raison de la non-réversibilité de l’insuffisance d’organe induite et du potentiel effet néfaste des corticoïdes sur la réponse lymphocytaire T antitumorale, ne requièrent le plus souvent pas l’administration de corticoïdes. Pour les toxicités hépatiques, d’autres paramètres biologiques (bilirubinémie, taux de prothrombine) pourraient être des indicateurs pour leur administration.
Quelles perspectives ?
Au stade métastatique, le véritable enjeu est de potentialiser l’efficacité des traitements actuels grâce à de nouvelles associations, tout en limitant les toxicités.
Pour cela, de nouvelles molécules sont testées en associations systémiques (BMS986213 : anti-LAG3 + anti PD-1 (NCT03470922) ou BMS045 : NKTR214 + anti PD-1 [NCT03635983]) ou associent une immunothérapie antitumorale intralésionnelle à une immunothérapie antitumorale systémique (Nivipit [NCT02857569], Illuminate [NCT03445533]).
Les anti-BRAF et les anti-MEK semblent avoir un rôle immunomodulateur. Ils induiraient un microenvironnement immunitaire favorable à l’action des immunothérapies antitumorales et à une réponse immunitaire effectrice. Inversement, l’échappement tumoral à ces thérapies ciblées induit un environnement immunitaire immunosuppresseur, défavorable aux immunothérapies antitumorales. Bien que leur association aux immunothérapies antitumorales (Keynote-022 [NCT02130466],5 Combi-i [NCT02967692 ; abstract LBA43 esmo02020]) s’est révélée décevante, les bénéfices potentiels liés à la modulation des séquences d’administration des immunothérapie antitumorales avec les thérapies ciblées (EBIN [NCT03235245], Secombit [NCT02631447]) sont également en cours d’investigations dans plusieurs essais.
Les stratégies néoadjuvantes fondées sur l’association de l’ipilimumab et du nivolumab ont fait l’objet d’essais cliniques en comparaison à une stratégie adjuvante. Il était montré dans l’essai OpACIN (NCT02437279) une meilleure survie sans rechute et une meilleure survie globale dans le bras néoadjuvant versus adjuvant. D’autre part la réponse pathologique à l’immunothérapie antitumorale, déterminée sur la pièce opératoire dans le cas du traitement néoadjuvant, constituait un marqueur prometteur de l’absence de rechute ultérieure. Du fait de la fréquence élevée des effets indésirables graves dans l’association ipilimumab 3 mg/kg + nivolumab 1 mg/kg, l’essai OpcACIN neo visait à déterminer la meilleure posologie pour cette association en néoadjuvant. L’effet de la combinaison avec des doses d’ipilimumab à 1 mg/kg est également testé en adjuvant dans l’essai NCT03068455.
Enfin, l’administration d’un traitement adjuvant après résection d’un mélanome aux stades plus précoces, IIb et IIc, dont le pronostic est également sombre, est testée dans un essai clinique de phase III (NCT04099251).
Carcinomes épidermoïdes cutanés
Ils surviennent avec une plus grande fréquence chez les patients immunodéprimés : principalement les patients transplantés d’organe avec une incidence de carcinomes épidermoïdes cutanés agressifs 36 fois plus élevée.
Quels biomédicaments et quelle place dans la stratégie thérapeutique ?
Cependant, il n’y a aucune étude contrôlée ou randomisée sur le bénéfice des thérapies systémiques dans la prise en charge du carcinome épidermoïde cutané métastatique. L’indication et la sélection d’un traitement systémique (chimiothérapie, thérapies ciblées ou immunothérapie antitumorale) sont discutées en réunion de concertation pluridisciplinaire. Certains patients éligibles peuvent recevoir un traitement innovant en cours d’évaluation dans un essai clinique.
Les chimiothérapies
Seules de petites cohortes de patients traités ont permis d’obtenir des données pour le traitement des carcinomes épidermoïdes cutanés métastatiques par chimiothérapie. Les CT évaluées sont principalement des associations à base de sels de platine : principalement le cisplatine en association au 5-fluorouracile (5-FU). Les taux de réponse sont élevés (55 à 86 %) mais les rechutes rapides.6Les thérapies ciblées
Le récepteur de l’epidermal growth factor (EGFR) est fortement exprimé par les carcinomes épidermoïdes cutanés. Son activation joue un rôle majeur dans la régulation de la prolifération cellulaire, l’invasion, l’angiogenèse et la dissémination des cellules cancéreuses.Le cétuximab, un anticorps monoclonal qui inhibe ce récepteur, peut être utilisé dans le traitement des carcinomes épidermoïdes cutanés localement avancés ou métastatiques en association avec la chimiothérapie si l’état général du patient le permet.7
En lien avec la prise en charge des carcinomes épidermoïdes de la tête et du cou, la combinaison généralement utilisée en l’absence de contre-indication repose sur l’association : cisplatine ou carboplatine (ou taxol), 5-FU, cetuximab.6 L’association de la chimiothérapie à la radiothérapie peut être proposée dans les formes localement avancées inopérables.
L’immunothérapie antitumorale
Il existe de forts arguments pour l’utilisation de l’immunothérapie antitumorale dans la prise en charge des carcinomes épidermoïdes cutanés avancés. En effet, ces tumeurs ont une charge mutationnelle très élevée et sont soumises au contrôle immunologique comme en témoigne leur fréquence plus élevée dans les populations immunodéprimées.Le cémiplimab, un anticorps monoclonal anti-PD-1, est le premier traitement approuvé (Food & Drug Administration [FDA], European Medicines Agency [EMA]) pour le carcinome épidermoïde cutané localement avancé ou métastatique. Cette approbation est fondée sur les données récemment générées de l’essai R2810-ONC-1540 (NCT02760498). Au cours de cette étude de phase II non randomisée, le taux de réponse objective s’élevait à 50 % et la médiane de survie sans progression à 18,4 mois. La survie médiane n’était pas atteinte et la survie à 2 ans était estimée à 71 %.8
Au vu de ces résultats, le cémiplimab a l’AMM depuis juin 2019 en monothérapie pour le traitement de patients adultes non éligibles à un essai clinique atteints d’un carcinome épidermoïde cutané localement avancé ou métastatique, non éligible à la chirurgie et à la radiothérapie et devrait constituer la première ligne thérapeutique à proposer à ces patients.
Avec quels effets indésirables ?
Les principaux effets indésirables rapportés sous cétuximab sont cutanés et surviennent chez plus de 80 % des patients traités : rash acnéiformes, prurit, xérose cutanée et paronychies ; mais aussi une hypomagnésémie chez 10 % des malades.
Dans l’essai pivot du cémiplimab, 42 % des patients ont eu un effet indésirable de grade supérieur ou égal à 3, ce qui est plus élevé que le pourcentage rapporté dans les essais concernant les mélanomes (environ 10-15 %). Cela peut être lié à l’âge élevé de la population traitée et au faible effectif de la cohorte analysée, augmentant la variabilité du résultat présenté. Cependant, seulement 7 % des patients arrêtaient le traitement pour cause d’effets secondaires. Le cémiplimab était donc relativement bien toléré car malgré le pourcentage élevé d’effets indésirables de haut grade, peu d’entre eux étaient graves. Comme les autres immunothérapie antitumorales décrites dans le mélanome (v. supra), les effets secondaires spécifiques aux traitements sont immunomédiés.
Quelles perspectives pour les carcinomes épidermoïdes cutanés aux stades avancés ?
L’utilisation du talimogène laherparepvec (TVEC), un virus oncolytique capable d’entraîner une action antitumorale locale (lyse des cellules tumorales), associée à une stimulation immunitaire antitumorale systémique, fait l’objet d’un essai de phase II dans les carcinomes épidermoïdes cutanés localement avancées, inopérables (NCT03714828). Enfin, des combinaisons associant une immunothérapie (pembrolizumab ; anti PD-1) à l’abexinostat, un HDAC inhibiteur (NCT03590054) ou au cétuximab (NCT03082534) sont également en cours d’évaluation.
Carcinomes basocellulaires
Quels biomédicaments et quelle place dans la stratégie thérapeutique ?
Avec quels effets indésirables ?
D’autre part, chez les sujets âgés, le risque d’altération de l’état général est important en raison des dysgueusies, de l’anorexie, de la perte de poids, voire des nausées engendrées. Les atteintes musculaires asymptomatiques (augmentation des créatines phosphokinases) ou symptomatique (crampes, myalgies) sont également fréquemment rapportés.
Quelles perspectives pour les carcinomes basocellulaires aux stades avancés ?
Place du généraliste dans la surveillance de ces traitements
Le médecin généraliste pourrait avoir un rôle clé dans le dépistage et le diagnostic précoce des effets indésirables de ces traitements. Cela permettrait ainsi une prise en charge rapide des malades, limitant la gravité de l’évènement indésirable. Un suivi au domicile, en lien avec l’hôpital, pourrait réduire le temps d’hospitalisation des malades.
Pour cela, il est impératif que les patients eux-mêmes et les médecins de ville soient informés et formés via les sites institutionnels à l’identification des effets indésirables potentiels et aux réflexes à adopter pour un recours rapide et adapté aux soins. Il est important de mettre en œuvre des points d’articulation « hôpital-ville ».
Le coût est-il un facteur limitant ?
Les traitements innovants du cancer comme les immunothérapies antitumorales et les thérapies ciblées sont des thérapies coûteuses. Le coût de prise en charge globale des patients ayant un mélanome atteint une moyenne de 269 682 euros par an et par patient, dont 80 % sont liés aux traitements.13 Le coût de l’ensemble des traitements liés aux cancers revient à 3,2 milliards d’euros à l’Assurance maladie chaque année. Leur coût est en constante augmentation (6 à 8 % par an) et le surcoût annuel attendu est de 1 à 1,2 milliard d’euros (données de l’observatoire du cancer de l’Institut Curie de 2017). La Haute Autorité de santé s’interroge alors sur la capacité du système de protection sociale à assurer la prise en charge financière pérenne de ces traitements et à garantir équitablement leur accès à tous les patients concernés, ce qui risque d’entraîner des inégalités de traitement.
L’intégration des patients dans des essais thérapeutiques est une bonne solution pour faire bénéficier les patients des avancées thérapeutiques tout en réduisant les dépenses de la sécurité sociale.
L’essentiel
Mélanome avancé
• Cancer fréquent chez les sujets jeunes et responsable de 90 % des décès par cancer cutané.
• L’immunothérapie (anti-PD1, anti CTLA-4) et les thérapies ciblées (anti-BRAF, anti-MEK) ont révolutionné le pronostic du mélanome aux stades avancés.
• Quel que soit le statut mutationnel, l’immunothérapie (principalment la combinaison ipilimumab + nivolumab) est à privilégier en première ligne métastatique.
• Les toxicités des immunothérapies correspondent à des manifestations autoimmunes et nécessitent une prise en charge rapide et spécialisée.
• Les essais thérapeutiques en cours visent à potentialiser l’efficacité des traitements actuels grâce à de nouvelles associations, tout en limitant les toxicités.
Carcinome épidermoïde cutané avancé
• Le traitement du carcinome épidermoïde cutané est la chirurgie. Les traitements systémiques sont reservés aux formes localement avancées inopérables ou métastatiques.
• Seul le cemiplimab a l’AMM en monothérapie.
• Aucune étude controlée ou randomisée n’a été réalisée sur le bénéfice des thérapies systémiques dans la prise en charge du carcinome épidermoïde cutané métastatique. Le choix du traitement sera donc discuté en réunion de concernation pluridisciplinaire. Certains patients pourront bénéficier d’une molécule innovante évaluée dans un essai clinique.
Carcinome basocellulaire avancé
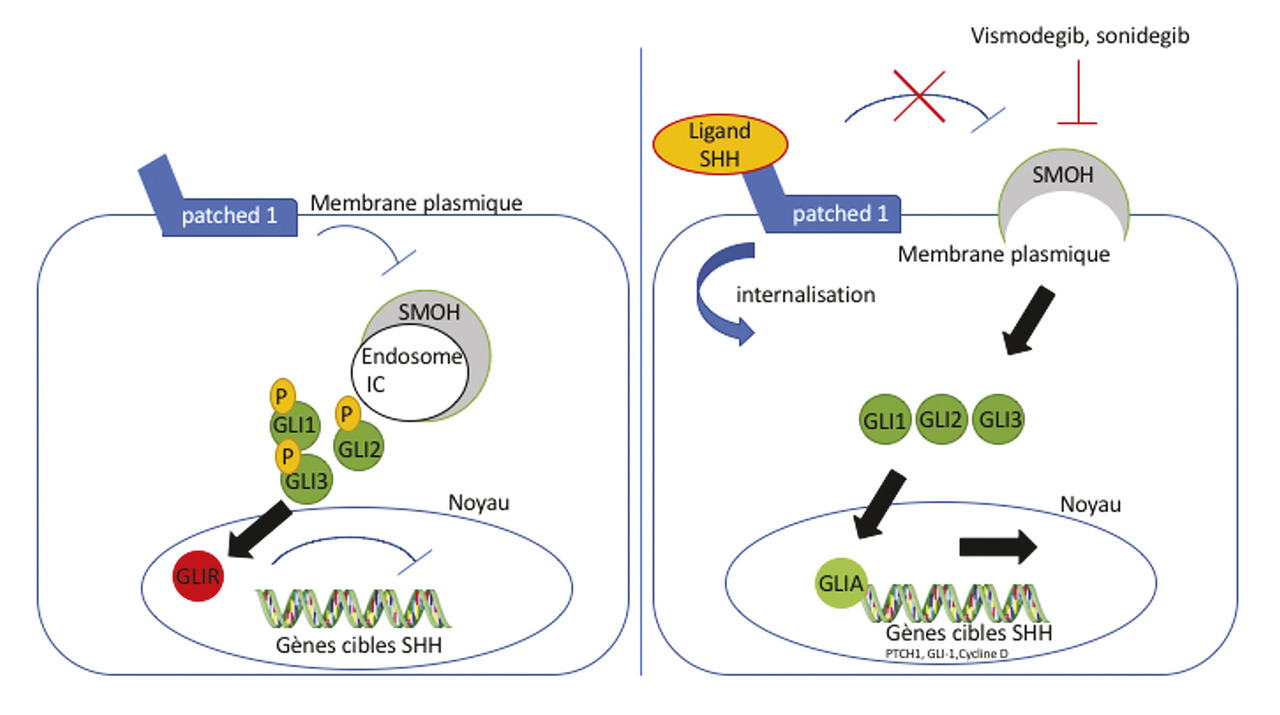
• La voie de signalisation sonic Hedgehog est capitale dans l’oncogenèse des carcinomes basocellulaires.
• Deux molécules sont aujourd’hui disponibles pour le traitement des formes inopérables : le vismodegib (AMM 2014) et le sonidegib (AMM 2016).
• Leurs principaux effets indésirables sont la tératogénicité chez les sujets jeunes et l’altération de l’état général chez les sujets âgés.
2. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30. doi:10.3322/caac.21590
3. Garbe C, Amaral T, Peris K, et al. European consensus-based interdisciplinary guideline for melanoma. Part 2: Treatment – Update 2019. Eur J Cancer. 2020;126(xxxx):159-177. doi:10.1016/j.ejca.2019.11.015
4. Haanen JBAG, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2017;28(suppl_4):iv119-iv142. doi:10.1093/annonc/mdx225
5. Ascierto PA, Ferrucci PF, Fisher R, et al. Dabrafenib, trametinib and pembrolizumab or placebo in BRAF-mutant melanoma. Nat Med. 2019;25(6):941-946. doi:10.1038/s41591-019-0448-9
6. Chapalain M, Baroudjian B, Dupont A, et al. Stage IV cutaneous squamous cell carcinoma: treatment outcomes in a series of 42 patients. J Eur Acad Dermatology Venereol. 2019. doi:10.1111/jdv.16007
7. Maubec E, Petrow P, Scheer-Senyarich I, et al. Phase II study of cetuximab as first-line single-drug therapy in patients with unresectable squamous cell carcinoma of the skin. J Clin Oncol. 2011;29(25):3419-3426. doi:10.1200/JCO.2010.34.1735
8. Migden MR, Rischin D, Schmults CD, et al. PD-1 blockade with cemiplimab in advanced cutaneous squamous-cell carcinoma. N Engl J Med. 2018;379(4):341-351. doi:10.1056/NEJMoa1805131
9. Maubec E, Boubaya M, Petrow P, et al. Phase II Study of Pembrolizumab As First-Line, Single-Drug Therapy for Patients With Unresectable Cutaneous Squamous Cell Carcinomas. J Clin Oncol. 2020;38(26):3051-3061. doi:10.1200/JCO.19.03357
10. Sekulic A, Migden MR, Lewis K, et al. Pivotal ERIVANCE basal cell carcinoma (BCC) study: 12-month update of efficacy and safety of vismodegib in advanced BCC. J Am Acad Dermatol. 2015;72(6):1021-1026.e8. doi:10.1016/j.jaad.2015.03.021
11. Chang ALS, Tran DC, Cannon JGD, et al. Pembrolizumab for advanced basal cell carcinoma: An investigator-initiated, proof-of-concept study. J Am Acad Dermatol. 2019;80(2):564-566. doi:10.1016/j.jaad.2018.08.017
12. Stratigos AJ, Sekulic A, Peris K, et al. LBA47 Primary analysis of phase II results for cemiplimab in patients (pts) with locally advanced basal cell carcinoma (laBCC) who progress on or are intolerant to hedgehog inhibitors (HHIs). Ann Oncol. 2020;31:S1175-S1176. doi:10.1016/j.annonc.2020.08.2277
13. Kandel M, Allayous C, Dalle S, et al. Update of survival and cost of metastatic melanoma with new drugs: Estimations from the MelBase cohort. Eur J Cancer. 2018;105:33-40. doi:10.1016/j.ejca.2018.09.026

 Encadrés
Encadrés