En 2001, Science et Nature publiaient la première version de la séquence du génome humain, après plus d’une dizaine d’années de travail intensif, impliquant plusieurs pays et de nombreux scientifiques, pour un coût estimé à 3 milliards de dollars. Depuis, les technologies de séquençage et d’analyse bio-informatique ont été révolutionnées.
Très récemment, le consortium Human Pangenome a annoncé le séquençage et l’annotation complète du premier génome humain.1 En une dizaine d’années, la possibilité de séquencer un génome humain à titre individuel dans un but médical est devenue une réalité. Cette révolution technologique est considérée comme équivalente à celle de la découverte du microscope2, classée d’ailleurs comme la septième révolution technologique la plus importante au monde par le McKinsey Global Institute.3
À l’échelle internationale, le Royaume-Uni est le premier pays à avoir lancé, en 2012, un plan national d’envergure pour le séquençage du génome de patients dans un cadre de recherche, puis de nombreux pays ont suivi.4
En France, en avril 2015, Manuel Valls, alors Premier ministre, a sollicité l’alliance AVIESAN pour examiner la mise en place, et la prospective sur dix ans, des conditions de l’accès au séquençage à très haut débit (STHD) dans la pratique clinique. Le 22 juin 2016, le Pr Yves Lévy, au titre de l’alliance AVIESAN, lui a remis le Plan France médecine génomique 2025 (PFMG 2025), qui poursuit trois objectifs majeurs :
– positionner la France dans le peloton de tête des grands pays engagés dans la médecine de précision ;
– préparer l’intégration de la médecine génomique dans le parcours de soins ;
– développer une filière nationale de médecine génomique capable d’être un levier d’innovation scientifique et technologique, de valorisation industrielle et de croissance économique.
Le gouvernement a alors souscrit au PFMG 2025 et annoncé 670 millions d’euros d’investissement sur cinq ans.
À l’échelle internationale, le Royaume-Uni est le premier pays à avoir lancé, en 2012, un plan national d’envergure pour le séquençage du génome de patients dans un cadre de recherche, puis de nombreux pays ont suivi.4
En France, en avril 2015, Manuel Valls, alors Premier ministre, a sollicité l’alliance AVIESAN pour examiner la mise en place, et la prospective sur dix ans, des conditions de l’accès au séquençage à très haut débit (STHD) dans la pratique clinique. Le 22 juin 2016, le Pr Yves Lévy, au titre de l’alliance AVIESAN, lui a remis le Plan France médecine génomique 2025 (PFMG 2025), qui poursuit trois objectifs majeurs :
– positionner la France dans le peloton de tête des grands pays engagés dans la médecine de précision ;
– préparer l’intégration de la médecine génomique dans le parcours de soins ;
– développer une filière nationale de médecine génomique capable d’être un levier d’innovation scientifique et technologique, de valorisation industrielle et de croissance économique.
Le gouvernement a alors souscrit au PFMG 2025 et annoncé 670 millions d’euros d’investissement sur cinq ans.
Un plan national pour ancrer la médecine génomique sur le long terme
Le PFMG 2025 ambitionne que chaque patient puisse accéder au séquençage à très haut débit sur tout le territoire et bénéficier ainsi d’une prise en charge diagnostique et thérapeutique optimisée et personnalisée. La médecine génomique est d’abord déployée pour les maladies rares, l’oncogénétique et les cancers. À terme, une extension aux maladies communes est prévue, en fonction de l’évolution des connaissances.
Le PFMG 2025 prend en compte quatre enjeux majeurs :
– l’aspect santé publique, avec l’organisation du parcours de soins ;
– les aspects cliniques, biologiques et scientifiques, avec l’identification de nouveaux gènes, de nouvelles voies physiopathologiques, de nouvelles cibles thérapeutiques ;
– l’aspect technologique, avec les innovations dans la gestion des données massives et les opportunités de développer une filière industrielle génomique ;
– et l’aspect médico-économique dans le système de soins.
Le PFMG 2025 prend en compte quatre enjeux majeurs :
– l’aspect santé publique, avec l’organisation du parcours de soins ;
– les aspects cliniques, biologiques et scientifiques, avec l’identification de nouveaux gènes, de nouvelles voies physiopathologiques, de nouvelles cibles thérapeutiques ;
– l’aspect technologique, avec les innovations dans la gestion des données massives et les opportunités de développer une filière industrielle génomique ;
– et l’aspect médico-économique dans le système de soins.
Une organisation complexe dans un véritable continuum soins-recherche
Le PFMG2025 se déploie en trois axes : mettre en œuvre les instruments du parcours génomique, assurer la montée en puissance de l’activité, mettre en place les outils de suivi et de pilotage. Il s’appuie ainsi sur trois piliers principaux :
– le réseau des laboratoires de biologie médicale de France médecine génomique (LBM-FMG) ;
– le Centre national de collecte et d’analyse des données (CAD) ;
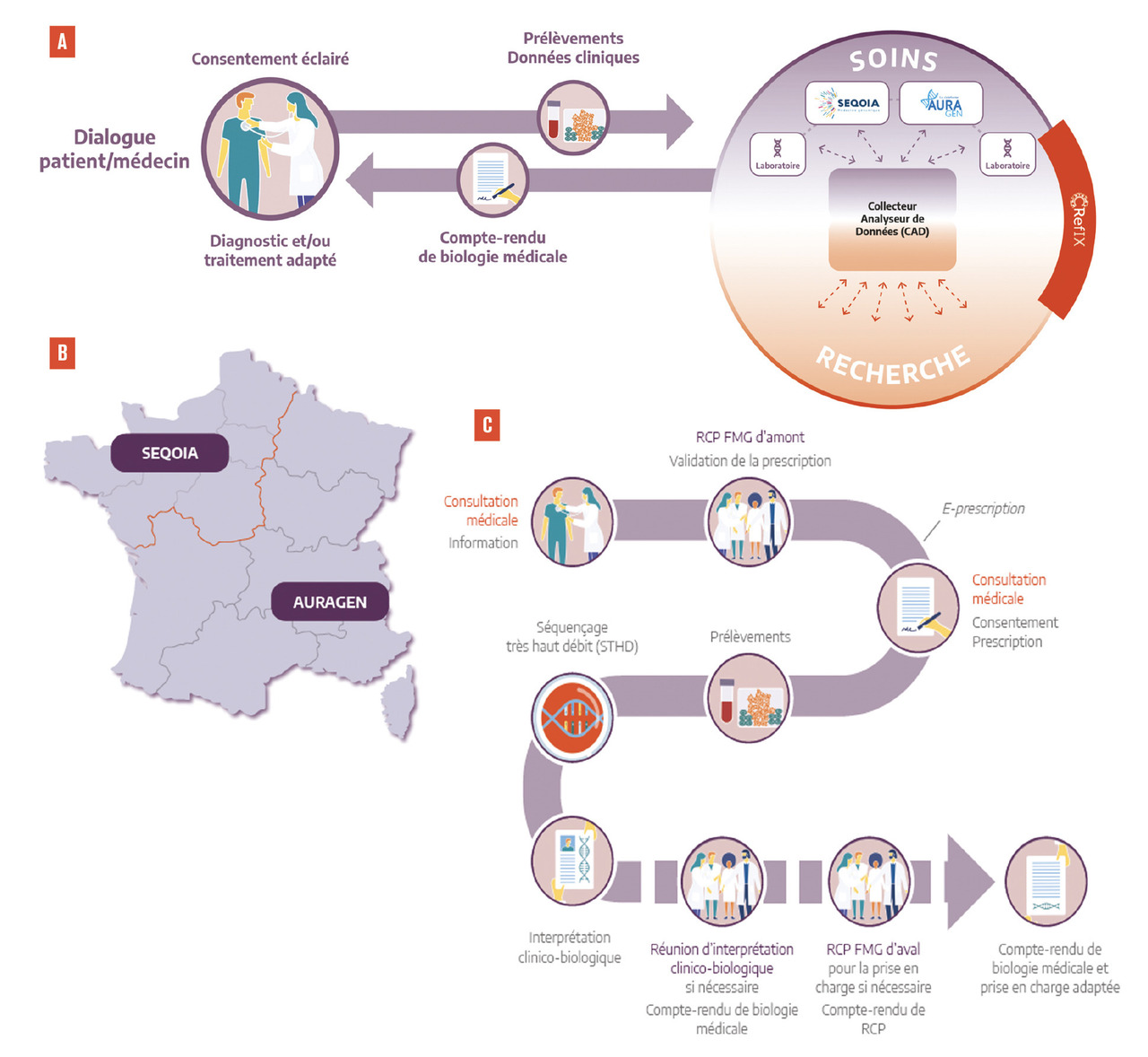
– le Centre de référence, d’innovation, d’expertise et de transfert (CRefIX) (fig. 1A ).
Au second semestre 2019, les deux premiers LBM-FMG, SeqOIA et AURAGEN, adossés à des groupements de coopération sanitaire, ont démarré leur activité, couvrant l’ensemble du territoire métropolitain et d’outre-mer (fig. 1B ). Ces laboratoires de biologie médicale France Médecine Génomique réalisent des analyses de génétique constitutionnelle (séquençage du génome entier) chez les patients atteints de maladies rares ou avec une forte suspicion de prédisposition génétique au cancer, et leurs apparentés, afin d’établir un diagnostic génétique.
Pour les cancers, les LBM-FMG réalisent des analyses de génétique somatique de la tumeur (séquençage du génome entier, de l’exome et de l’ensemble des ARN), complétées par le séquençage du génome entier du patient afin d’identifier des cibles thérapeutiques.
Le PFMG 2025 intègre également quatre projets pilotes :
– des actions de communication ;
– la rédaction et la mise à jour de modèles de consentement et de notices d’information pour le soin, intégrant les spécificités éthiques et réglementaires de la médecine génomique ;
– la mise en œuvre d’une politique de collaboration internationale ;
– le déploiement d’un plan de formation.
– le réseau des laboratoires de biologie médicale de France médecine génomique (LBM-FMG) ;
– le Centre national de collecte et d’analyse des données (CAD) ;
– le Centre de référence, d’innovation, d’expertise et de transfert (CRefIX) (
Au second semestre 2019, les deux premiers LBM-FMG, SeqOIA et AURAGEN, adossés à des groupements de coopération sanitaire, ont démarré leur activité, couvrant l’ensemble du territoire métropolitain et d’outre-mer (
Pour les cancers, les LBM-FMG réalisent des analyses de génétique somatique de la tumeur (séquençage du génome entier, de l’exome et de l’ensemble des ARN), complétées par le séquençage du génome entier du patient afin d’identifier des cibles thérapeutiques.
Le PFMG 2025 intègre également quatre projets pilotes :
– des actions de communication ;
– la rédaction et la mise à jour de modèles de consentement et de notices d’information pour le soin, intégrant les spécificités éthiques et réglementaires de la médecine génomique ;
– la mise en œuvre d’une politique de collaboration internationale ;
– le déploiement d’un plan de formation.
Comment accéder au séquençage à très haut débit au sein du PFMG 2025 ?
Contrairement aux autres plans nationaux de génomique, le plan français s’inscrit d’emblée dans le soin, avec des retombées directes pour les patients (diagnostic, conseil génétique, prise en charge médicale et thérapeutique). Un parcours de soins générique a ainsi été défini pour permettre l’accès au séquençage à très haut débit (fig. 1C ).
Pour qui ? Pour quelles indications ?
À ce jour, la Haute Autorité de santé (HAS) a retenu 61 préindications dans le champ des maladies rares, de l’oncogénétique et de la cancérologie. Il s’agit de pathologies pour lesquelles les patients peuvent bénéficier d’une analyse de séquençage à très haut débit au sein des laboratoires de biologie médicale France Médecine Génomique. Afin d’élargir les indications, la HAS déploie une nouvelle vague de priorisation de préindications.
Qui peut prescrire ?
Tout médecin, généraliste ou spécialiste, peut adresser son patient à un médecin prescripteur de séquençage à très haut débit lorsque la pathologie du patient est en lien avec les préindications retenues par la HAS.
Est habilité à prescrire ce STHD au sein des laboratoires de biologie médicale France médecine génomique :
– pour les maladies rares, tout médecin ayant obtenu l’accord de la filière de santé nationale maladies rares couvrant la préindication ;
– pour les cancers et l’oncogénétique, tout médecin ayant obtenu l’accord des sociétés savantes ou des groupes coopérateurs porteurs de la préindication.
Une cinquantaine d’assistants de prescription se déploie actuellement sur l’ensemble du territoire français pour faciliter les prescriptions.
Est habilité à prescrire ce STHD au sein des laboratoires de biologie médicale France médecine génomique :
– pour les maladies rares, tout médecin ayant obtenu l’accord de la filière de santé nationale maladies rares couvrant la préindication ;
– pour les cancers et l’oncogénétique, tout médecin ayant obtenu l’accord des sociétés savantes ou des groupes coopérateurs porteurs de la préindication.
Une cinquantaine d’assistants de prescription se déploie actuellement sur l’ensemble du territoire français pour faciliter les prescriptions.
Comment prescrire ? Pour quels résultats ?
Le parcours de soins s’organise autour du patient, depuis la prescription médicale d’un examen de séquençage à très haut débit jusqu’à la restitution des résultats par le médecin prescripteur (le délai moyen entre la prescription et la transmission des compte-rendus au prescripteur est de quelques semaines pour les cancers et de 4 à 6 mois pour les maladies rares).
Après accord d’une réunion de concertation pluridisciplinaire (RCP-FMG d’amont), le médecin prescripteur reçoit le patient, et le cas échéant ses apparentés, le ou les informe et recueille le(s) consentement(s) dédié(s). La prescription s’effectue de façon connectée, sur des outils d’e-prescription, SPICE (SeqOIA) et HYGEN (AURAGEN).
Les prélèvements (sang total, tissus fœtaux congelés, tumeurs congelées) sont envoyés aux séquençage à très haut débit suivant une logistique dédiée, commune aux deux laboratoires. À la suite de l’analyse des données de STHD par des biologistes habilités, via des interfaces d’interprétation développées par les bio-informaticiens des deux LBM-FMG, un compte-rendu d’examen de biologie médicale est mis à la disposition du prescripteur, après discussions, si nécessaire, avec plusieurs spécialistes dans le cadre de réunions d’interprétation clinico-biologique (RICB-FMG).
Pour les préindications de cancérologie, et selon les besoins pour les maladies rares, des réunions de concertation pluridisciplinaires en aval du STHD (RCP-FMG d’aval) permettent d’élaborer des recommandations thérapeutiques spécifiques.
Après accord d’une réunion de concertation pluridisciplinaire (RCP-FMG d’amont), le médecin prescripteur reçoit le patient, et le cas échéant ses apparentés, le ou les informe et recueille le(s) consentement(s) dédié(s). La prescription s’effectue de façon connectée, sur des outils d’e-prescription, SPICE (SeqOIA) et HYGEN (AURAGEN).
Les prélèvements (sang total, tissus fœtaux congelés, tumeurs congelées) sont envoyés aux séquençage à très haut débit suivant une logistique dédiée, commune aux deux laboratoires. À la suite de l’analyse des données de STHD par des biologistes habilités, via des interfaces d’interprétation développées par les bio-informaticiens des deux LBM-FMG, un compte-rendu d’examen de biologie médicale est mis à la disposition du prescripteur, après discussions, si nécessaire, avec plusieurs spécialistes dans le cadre de réunions d’interprétation clinico-biologique (RICB-FMG).
Pour les préindications de cancérologie, et selon les besoins pour les maladies rares, des réunions de concertation pluridisciplinaires en aval du STHD (RCP-FMG d’aval) permettent d’élaborer des recommandations thérapeutiques spécifiques.
Qui finance ?
Les analyses de séquençage à très haut débit au sein des laboratoires de biologie médicale France Médecine Génomique sont financées par l’état dans le cadre du PFMG 2025. Leur coût n’est à la charge ni du patient ni de l’établissement du prescripteur. Une étude médico-économique est en cours afin de déterminer les futures modalités de prise en charge financière.
Comment le PFMG 2025 fonctionne-t-il en 2021 ?
Le déploiement du séquençage à très haut débit en diagnostic dans le parcours de soins est un défi de taille, impliquant des changements conséquents des pratiques médicales. L’implantation des deux premiers aboratoires de biologie médicale France Médecine Génomique s’est avérée plus complexe que prévu. Le pilotage du PFMG 2025 et la Direction générale de l’offre de soins (DGOS), en lien étroit avec les laboratoires de biologie médicale France médecine génomique et le CRefIX, ont permis de lever un certain nombre de verrous, de mobiliser la communauté médicale et de rendre opérationnel le parcours de soins spécifique de chaque préindication. Plus de 1 600 médecins cliniciens ont maintenant accès aux logiciels d’e-prescription des deux LBM-FMG, plus de 150 RCP d’amont sont opérationnelles et plusieurs centaines de professionnels se sont portés volontaires pour participer à l’analyse biologique des données de STHD des LBM-FMG, témoignant de l’adhésion de la communauté nationale au PFMG 2025.
L’activité des laboratoires de biologie médicale France Médecine Génomique est en constante augmentation. Leur montée en charge se poursuit sur une très bonne dynamique en 2021 par rapport à 2020 (+77 %). Au 1er septembre 2021, environ 6 500 prescriptions avaient été validées en RCP-FMG d’amont, plus de 14 000 échantillons séquencés et plus de 1 600 comptes-rendus transmis aux prescripteurs (tableau ).
L’activité des laboratoires de biologie médicale France Médecine Génomique est en constante augmentation. Leur montée en charge se poursuit sur une très bonne dynamique en 2021 par rapport à 2020 (+77 %). Au 1er septembre 2021, environ 6 500 prescriptions avaient été validées en RCP-FMG d’amont, plus de 14 000 échantillons séquencés et plus de 1 600 comptes-rendus transmis aux prescripteurs (
Diminuer l’errance et exploiter de nouvelles cibles thérapeutiques
Depuis 2016, la France s’est dotée d’un plan ambitieux afin d’intégrer de façon pérenne la médecine génomique dans le parcours de soins, tout en soutenant les activités de recherche et développement. Il contribue à diminuer l’errance diagnostique, enjeu du 3e Plan national maladies rares et très attendu des associations de patients. Il donne la possibilité aux patients atteints de cancer de bénéficier de l’identification de nouvelles cibles thérapeutiques.
Bien que nettement ralentie en 2020 par la crise sanitaire, l’activité est depuis en constante augmentation. Ainsi, le premier semestre 2021 a été marqué par une importante dynamique du PFMG 2025, dans un véritable continuum soins-recherche, avec non seulement une nette accélération de l’activité des laboratoires de biologie médicale France Médecine Génomique dans le soin mais également la mise en place du Centre national de collecte et d’analyse des données, permettant aux chercheurs d’accéder aux données génomiques. Cela renforcera la compétitivité des équipes de recherche académique et des entreprises françaises, tout en leur permettant de développer des collaborations internationales ambitieuses.
Bien que nettement ralentie en 2020 par la crise sanitaire, l’activité est depuis en constante augmentation. Ainsi, le premier semestre 2021 a été marqué par une importante dynamique du PFMG 2025, dans un véritable continuum soins-recherche, avec non seulement une nette accélération de l’activité des laboratoires de biologie médicale France Médecine Génomique dans le soin mais également la mise en place du Centre national de collecte et d’analyse des données, permettant aux chercheurs d’accéder aux données génomiques. Cela renforcera la compétitivité des équipes de recherche académique et des entreprises françaises, tout en leur permettant de développer des collaborations internationales ambitieuses.
Encadre
Des adresses pour la pratique
Consortium Human Pangenome : https://humanpangenome.org/
Plan France médecine génomique : https://pfmg2025.aviesan.fr/
Préindications du PFMG 2025 : https://pfmg2025.aviesan.fr/professionnels/preindications-et-mise-en-place/
LBMMS SeqOIA : www.laboratoire-seqoia.fr
LBMMS AURAGEN : https://www.auragen.fr
Références
1. Nurk S, Koren S, Rhie A, Rautiainen M, Bzikadze AV, Mikheenko A, et al. The complete sequence of a human genome. Disponible sur : https://www.biorxiv.org/content/10.1101/2021.05.26.445798v1.
2. Shendure J, Balasubramanian S, Church GM, Gilbert W, Rogers J, Schloss JA, et al. DNA sequencing at 40: past, present and future. Nature 2017;550:345-53.
3. Manyika J, Chui M, Bughin J, Dobbs R, Bisson P, Marrs A. Disruptive technologies: Advances that will transform life, business, and the global economy. Rapport 2013 du McKinsey Global Institute.
4. Stark Z, Dolman L, Manolio TA, Ozenberger B, Hill SL, Caulfied MJ, et al. Integrating genomics into healthcare: A global responsibility. Am J Hum Genet 2019;104:13-20.
2. Shendure J, Balasubramanian S, Church GM, Gilbert W, Rogers J, Schloss JA, et al. DNA sequencing at 40: past, present and future. Nature 2017;550:345-53.
3. Manyika J, Chui M, Bughin J, Dobbs R, Bisson P, Marrs A. Disruptive technologies: Advances that will transform life, business, and the global economy. Rapport 2013 du McKinsey Global Institute.
4. Stark Z, Dolman L, Manolio TA, Ozenberger B, Hill SL, Caulfied MJ, et al. Integrating genomics into healthcare: A global responsibility. Am J Hum Genet 2019;104:13-20.
Dans cet article
- Un plan national pour ancrer la médecine génomique sur le long terme
- Une organisation complexe dans un véritable continuum soins-recherche
- Comment accéder au séquençage à très haut débit au sein du PFMG 2025 ?
- Comment le PFMG 2025 fonctionne-t-il en 2021 ?
- Diminuer l’errance et exploiter de nouvelles cibles thérapeutiques

 Encadrés
Encadrés