Au-delà des différences qui apparaissent surtout réglementaires, c’est bien la question de la non-marchandisation du corps humain qui est en jeu.
Des progrès considérables ont été réalisés ces 15 dernières années pour améliorer la qualité et la sécurité transfusionnelle des produits sanguins. À tel point que des auteurs ont pu qualifier la transfusion sanguine de domaine « ultrasûr », comparable à l’aviation civile.1 Mais la médecine transfusionnelle, bien qu’essentielle, demeure fragile car elle repose sur l’engagement quotidien de milliers de donneurs de sang et sur des structures soumises à des défis permanents.
Le plasma, qu’il soit considéré comme un produit sanguin labile ou comme un médicament, a une origine unique : le sang humain. En France, la collecte de sang, qui relève depuis 2000 du monopole d’un établissement public (l’Établissement français du sang [EFS] et pour le versant militaire du Centre de transfusion sanguine des armées [CTSA]), répond à quatre principes éthiques : l’anonymat, le bénévolat, le volontariat et le non-profit. Ce socle éthique, amorcé en 1952 et défini- tivement consolidé en 1993, vise à éviter la marchan- disation du corps humain, mais ces principes, particulièrement ceux de non-profit et de bénévolat, ne sont pas universels. Le plasma est un produit sanguin acellulaire obtenu à partir d’un prélèvement chez un donneur de sang. Après une qualification biologique systématique sur chaque don (notamment groupage sanguin et recherche sérologique/génomique d’agents pathogènes viraux, bactériens, parasitaires), le plasma est séparé des autres constituants du sang et peut être utilisé comme plasma thérapeutique direct ou subir un processus de transformation industrielle par fractionnement. Ce fractionnement à l’éthanol, processus industriel décrit par E. Cohn en 1940, est, en ce qui concerne le plasma collecté en France, de la compétence exclusive d’une société à capitaux publics, le Laboratoire français du fractionnement et des biotechnologies (LFB). Ce plasma permet de fabriquer des médicaments dérivés du sang par isolement de ces différents composants plasmatiques.
Le plasma, qu’il soit considéré comme un produit sanguin labile ou comme un médicament, a une origine unique : le sang humain. En France, la collecte de sang, qui relève depuis 2000 du monopole d’un établissement public (l’Établissement français du sang [EFS] et pour le versant militaire du Centre de transfusion sanguine des armées [CTSA]), répond à quatre principes éthiques : l’anonymat, le bénévolat, le volontariat et le non-profit. Ce socle éthique, amorcé en 1952 et défini- tivement consolidé en 1993, vise à éviter la marchan- disation du corps humain, mais ces principes, particulièrement ceux de non-profit et de bénévolat, ne sont pas universels. Le plasma est un produit sanguin acellulaire obtenu à partir d’un prélèvement chez un donneur de sang. Après une qualification biologique systématique sur chaque don (notamment groupage sanguin et recherche sérologique/génomique d’agents pathogènes viraux, bactériens, parasitaires), le plasma est séparé des autres constituants du sang et peut être utilisé comme plasma thérapeutique direct ou subir un processus de transformation industrielle par fractionnement. Ce fractionnement à l’éthanol, processus industriel décrit par E. Cohn en 1940, est, en ce qui concerne le plasma collecté en France, de la compétence exclusive d’une société à capitaux publics, le Laboratoire français du fractionnement et des biotechnologies (LFB). Ce plasma permet de fabriquer des médicaments dérivés du sang par isolement de ces différents composants plasmatiques.
Modalités d’obtention du plasma thérapeutique
Le plasma thérapeutique direct, le plus souvent dénommé plasma frais congelé, représente entre 10 et 12 % des 3 millions d’unités de produits sanguins labiles transfusés, une part minoritaire par rapport à celle prépondérante des concentrés de globules rouges (78 %). Après une sélection clinique rigoureuse des donneurs de sang, le plasma peut être prélevé selon deux moda- lités. S’il est possible d’extraire en moyenne 250 mL de plasma à partir d’un don de sang total de 450 mL, en revanche une seconde modalité, la plasmaphérèse (réalisée grâce à un séparateur de cellules auquel le donneur est branché) permet de collecter spécifiquement jusqu’à 750 mL de plasma par don. Une partie relativement faible (en France environ 15 %) du plasma issu des 3 millions de dons annuels est destinée à une utilisation thérapeutique directe. Les unités de plasma thérapeutique, une fois qualifiées, doivent en outre subir une étape supplémentaire, dite de sécurisation, avant de pouvoir être transfusées à un patient (tableau 1).
Types de plasma thérapeutique
Le plasma thérapeutique est issu d’un don unique ou d’un pool de quelques dons (pour le produit sanguin labile) ou d’un mélange d’un nombre important de dons différents traité ensuite par solvant-détergent (SD) [de 100 pour le plasma SD de l’EFS à plusieurs milliers pour le plasma SD médicament). En France, depuis 1994, le plasma thérapeutique direct doit subir un processus additionnel de sécurisation via une quarantaine de 60 jours (le plasma congelé du don N n’est libéré que si le don N + 1 est conforme biologiquement) ou un traitement par une méthode d’atténuation des pathogènes comme la méthode solvant-détergent ou celle d’un traitement par un agent intercalant des bases nucléiques combiné à une illumination par une lumière visible ou des rayons ultraviolets A ou B (bleu de méthylène, amotosalen ou riboflavine). Une place particulière doit être faite au PLYO, acronyme désignant le plasma lyophilisé, préparé par le CTSA à partir de 10 plasmas traités par amotosalène-UVA. Par opposition, de nombreux pays (États-Unis, Grande-Bretagne, Australie…) utilisent majoritairement des plasmas « natifs » sans quarantaine et sans traitement d’atténuation des pathogènes. Bien que les méthodes physico-chimiques d’atténuation aient des inconvénients (altération quantitative ou qualitative de certaines protéines plasmatiques) et des limites à leurs performances anti- infectieuses (le plus souvent inactives contre les virus non enveloppés), l’efficacité thérapeutique et hémo- statique de ces plasmas est considérée comme équi- valente. Depuis le 1er février 2015, l’EFS ne prépare plus de plasma SD (il était produit depuis 1994). L’arrêt de production est la conséquence de l’application par le Conseil d’État des principes dégagés par un arrêt de la Cour de justice de l’Union européenne de mars 2014 qui a conduit à requalifier ce produit en médicament et l’a fait basculer dans le domaine commercial et concurrentiel du médicament. Cette décision s’appuie sur le fait que la production du plasma SD répondait à un processus industriel. Ce plasma thérapeutique, qui était jusqu’à cette date un produit sanguin labile, relevait de la compétence exclusive pour sa production et sa distribution du champ public de la transfusion. Cette entité « plasma médicament » (qui doit provenir, selon la législation française, de donneurs non rémunérés) crée une situation originale où cohabitent un produit sanguin labile produit et distribué par l’EFS et le CTSA et un plasma SD produit par un fractionneur privé et distribué par les « pharmacies à usage intérieur ».
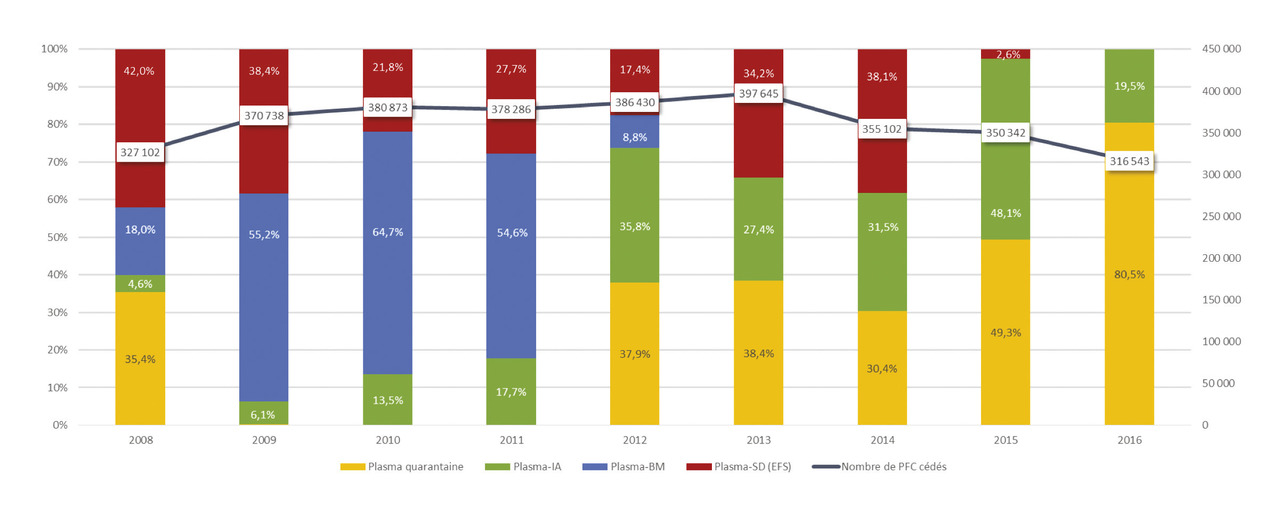
Cette innovation n’est pas sans induire des impacts financiers et organisationnels tant sur le plan des circuits de distribution des produits que de ceux des vigilances pour un produit qui a connu une croissance importante entre 2002 et 2012 suivie depuis d’une phase de décrue de plus 20 % (v. figure). Si la réactualisation en 2012 par la Haute Autorité de santé des recommandations de bonnes pratiques (tableau 2)2 a peut-être contribué à cette inversion de tendance, il n’est pas erroné d’affirmer que son usage demeure encore sans doute inapproprié (sous-dosage par rapport aux préconisations de 15 mL/kg),3 voire inadéquat (usage prophylactique dans certaines pathologies comme l’insuffisance hépatocellulaire).4 Ce constat n’est pas particulier à la France5, et une réflexion est menée pour une meilleure maîtrise de la prescription en favorisant une approche pluridisciplinaire (transfuseurs, anesthésistes, chirurgiens), voire un recours à des thérapeutiques alternatives (acide tranexamique, concentrés de fibrinogène...). Plusieurs essais publiés récemment montrent que la réduction de son utilisation est possible, une étude récente observant une diminution jusqu’à 77 % de la consommation de plasma sur une période de 10 années dans des hôpitaux américains.6
Cette innovation n’est pas sans induire des impacts financiers et organisationnels tant sur le plan des circuits de distribution des produits que de ceux des vigilances pour un produit qui a connu une croissance importante entre 2002 et 2012 suivie depuis d’une phase de décrue de plus 20 % (v. figure). Si la réactualisation en 2012 par la Haute Autorité de santé des recommandations de bonnes pratiques (tableau 2)2 a peut-être contribué à cette inversion de tendance, il n’est pas erroné d’affirmer que son usage demeure encore sans doute inapproprié (sous-dosage par rapport aux préconisations de 15 mL/kg),3 voire inadéquat (usage prophylactique dans certaines pathologies comme l’insuffisance hépatocellulaire).4 Ce constat n’est pas particulier à la France5, et une réflexion est menée pour une meilleure maîtrise de la prescription en favorisant une approche pluridisciplinaire (transfuseurs, anesthésistes, chirurgiens), voire un recours à des thérapeutiques alternatives (acide tranexamique, concentrés de fibrinogène...). Plusieurs essais publiés récemment montrent que la réduction de son utilisation est possible, une étude récente observant une diminution jusqu’à 77 % de la consommation de plasma sur une période de 10 années dans des hôpitaux américains.6
Des effets indésirables communs aux différents plasmas
Comme tout produit d’origine humaine, la transfusion de plasma (produit sanguin labile ou médicament) peut être à l’origine d’effets d’intolérance clinique (principalement de type allergique souvent d’intensité modérée mais parfois anaphylactique), de surcharge volémique (transfusion acute cardiogenic overload [TACO]) ou d’incompatibilité immunologique (transfusion related acute lung injury [TRALI]), voire, exceptionnellement, de transmission d’agents pathogènes (tableau 3). Sur un plan immunologique, il est impératif de respecter les règles de compatibilité ABO (inverses de celles établies pour les globules rouges) pour éviter une hémolyse. Le plasma peut être à l’origine d’une complication redoutable, l’œdème pulmonaire lésionnel (TRALI) pour laquelle l’EFS a pris des mesures de prévention depuis 2011 (exclusion des donneuses ayant des anticorps anti-HLA) qui ont permis une diminution drastique de ces accidents transfusionnels. Si depuis 17 ans, aucune transmission par le plasma des virus des hépatites C ou B ou du virus de l’immunodéficience humaine n’a été déclarée en France, en revanche entre 2008 et 2012 plusieurs cas d’hépatite E (zoonose émergente souvent asymptomatique et habituellement bénigne) ont été déclarés par le réseau d’hémovigilance après la transfusion de plasma SD, amotosalen-UVA ou sécurisé par quarantaine.7 Dès 2013, l’EFS a pris la décision de dépister ce virus par diagnostic génomique pour une fraction des plasmas, notamment ceux destinés à la transfusion de patients immunodéprimés chez lesquels cette hépatite peut provoquer des complications graves (cirrhose).
Différences entre plasma produit sanguin labile et plasma médicament
Le plasma traité solvant-détergent issu de lots de dons de sang plus ou moins importants est aujourd’hui le seul plasma qualifié de médicament. Ses différences avec le plasma « produit sanguin », tant sur les caractéristiques biologiques que sur la survenue d’effets indésirables chez les receveurs, sont modérées et liées, en partie, à l’effet de pool : une moindre variabilité du taux de facteurs de la coagulation, des réactions de type allergique moins nombreuses et un risque moins important de TRALI chez les receveurs. Ces différences méritent d’être confortées, dans les années à venir, par un recueil exhaustif des signaux sanitaires par le système français des vigilances.
Une autre filière du plasma : les médicaments dérivés du sang
Le plasma collecté en France par l’EFS (déduction faite du plasma à un usage thérapeutique direct) est orienté vers le Laboratoire français du fractionnement et des biotechnologies pour la fabrication de médicaments dérivés du sang qui étaient antérieurement nommés produits sanguins stables. Ailleurs, le plasma collecté est traité par des sociétés multinationales (CSL Behring, Grifols, Shire, Octapharma…) qui ont des usines de fractionnement et qui ont la particularité de disposer dans de nombreux pays (États-Unis, Allemagne, Autriche, République tchéque…) de très nombreux centres de prélèvement de plasma par aphérèse. Les donneurs de plasma qui se présentent dans ces centres sont rémunérés, une rétribution qui va à l’encontre des principes éthiques de la collecte de sang en France.
De ce plasma sont extraits plusieurs protéines, notamment des facteurs de la coagulation (VIII, IX, XI, VII, antithrombine, alpha-antitrypsine…), de l’albumine et des immunoglobulines. Les immunoglobulines sont un des produits dont la consommation connaît l’évolution la plus forte (> 10 % à l’échelle mondiale) avec une consommation en France en 2014 de 127 g pour 1 000 habitants (67,7 g en 2005) ;8 la demande restant soutenue, les besoins en plasma sont en constante progression. À l’échelle mondiale, la collecte en plasma majoritairement couverte par des dons rémunérés (centres de profit, sociétés internationales) font de celui-ci un produit dont les enjeux de production sont à la fois stratégiques, médicaux et éthiques.
De ce plasma sont extraits plusieurs protéines, notamment des facteurs de la coagulation (VIII, IX, XI, VII, antithrombine, alpha-antitrypsine…), de l’albumine et des immunoglobulines. Les immunoglobulines sont un des produits dont la consommation connaît l’évolution la plus forte (> 10 % à l’échelle mondiale) avec une consommation en France en 2014 de 127 g pour 1 000 habitants (67,7 g en 2005) ;8 la demande restant soutenue, les besoins en plasma sont en constante progression. À l’échelle mondiale, la collecte en plasma majoritairement couverte par des dons rémunérés (centres de profit, sociétés internationales) font de celui-ci un produit dont les enjeux de production sont à la fois stratégiques, médicaux et éthiques.
Marchandisation ou non ?
Qu’est-ce qui différencie le plasma « produit sanguin » du « plasma médicament » ? Bien peu de chose à vrai dire si ce n’est une catégorisation réglementaire. Le plasma médicament est plus proche d’un produit sanguin que d’un médicament dérivé du sang car il est moins standardisé (variabilité des taux de facteurs de coagulation) et nécessite le respect d’une compatibilité immunologique ABO. Certains pays, comme la Suisse, classent tous les produits sanguins labiles comme des médicaments sans que leurs processus de production et de sécurité ne diffèrent de ceux en vigueur en France. Le contraste actuel n’est donc qu’apparent entre plasma médicament et plasma produit sanguin labile. La coexistence de ces deux plasmas considérés comme équivalents sur le plan de l’efficacité thérapeutique perdurera sans nul doute et pour plusieurs raisons (circuit de délivrance et prise en charge de certaines pathologies, sécurité des approvisionnements, tarifs de cession…). En revanche, dans les prochaines années, l’essor d’un plasma universel (compatible quel que soit le groupe ABO) ou l’émergence, toujours redoutée, d’un nouvel agent pathogène, pernicieux et transmissible par le sang et les dérivés sanguins, qui échapperait aux méthodes actuelles d’atténuation des pathogènes pourraient conduire à l’abandon d’une forme ou d’une autre. La réflexion collective portera aussi, à l’avenir, sur les questions de la non-marchan- disation du corps humain, des valeurs morales attachées au don, de l’accès des malades à des produits de meilleure qualité (le service public n’a jamais été mis en défaut sur ces points) et in fine sur l’éthique thérapeutique d’un acte qui repose entièrement sur un geste social, le don de sang.
Références
1. Amalberti R. Quel futur et quelle stratégie de sécurité pour un système devenu ultrasûr ? Transfus Clin Biol 2009;16;80-5.
2. Transfusion de plasma thérapeutique : produits-indications. Recommandations, actualisation 2012. www.has-sante.fr ou https://bit.ly/2jooMdc
3. Fillet AM, Desmaret M, Assari S, et al. Blood products use in France: a nationwide cross-sectional survey. Transfusion 2016;56;3033-41.
4. Ozier Y, Cadic A, Dovergne A. Prise en charge des troubles de l’hémostase chez l’insuffisant hépatique. Transfus Clin Biol 2013;20;249-54.
5. Stanworth SJ, Grant-Casey J, Lowe D, et al. The use of fresh-frozen plasma in England: high levels of inappropriate use in adults and children. Transfusion 2011;51;62-70.
6. Nixon. CP, Tavares MF, Sweeney JD. How do we reduce plasma transfusion in Rhode Island? Transfusion 2017;57;1863-73.
7. Mallet. V, Sberro-Soussan R, Roque-Afonso AM, et al. Transmission of hepatitis E virus with plasma exchange in kidney-transplant recipients: a retrospective cohort study. Transplantation. 2018 Mar 20. doi: 10.1097/TP.0000000000002185.
8. Bult JM. The world needs plasma: global perspective and dynamics: views for potential solutions. PPTA meeting Budapest, March 2018.
2. Transfusion de plasma thérapeutique : produits-indications. Recommandations, actualisation 2012. www.has-sante.fr ou https://bit.ly/2jooMdc
3. Fillet AM, Desmaret M, Assari S, et al. Blood products use in France: a nationwide cross-sectional survey. Transfusion 2016;56;3033-41.
4. Ozier Y, Cadic A, Dovergne A. Prise en charge des troubles de l’hémostase chez l’insuffisant hépatique. Transfus Clin Biol 2013;20;249-54.
5. Stanworth SJ, Grant-Casey J, Lowe D, et al. The use of fresh-frozen plasma in England: high levels of inappropriate use in adults and children. Transfusion 2011;51;62-70.
6. Nixon. CP, Tavares MF, Sweeney JD. How do we reduce plasma transfusion in Rhode Island? Transfusion 2017;57;1863-73.
7. Mallet. V, Sberro-Soussan R, Roque-Afonso AM, et al. Transmission of hepatitis E virus with plasma exchange in kidney-transplant recipients: a retrospective cohort study. Transplantation. 2018 Mar 20. doi: 10.1097/TP.0000000000002185.
8. Bult JM. The world needs plasma: global perspective and dynamics: views for potential solutions. PPTA meeting Budapest, March 2018.