L’ incidence annuelle de la pneumonie aiguë communautaire (PAC)1 est estimée à 5,6 cas pour 1 000 habitants en France. Elle est plus élevée chez l’homme et augmente avec l’âge. La mortalité varie de moins de 1 % (sujet immunocompétent sans comorbidité, traité en ambulatoire) à 50 % (personne âgée avec comorbidités, hospitalisée en réanimation). L’impact économique est majeur : le coût annuel est de 10 milliards d’euros par an en Europe (surtout lié à l’hospitalisation).
La documentation microbiologique n’est obtenue que dans 50 à 60 % des cas via les tests diagnostiques conventionnels.2 Le pneumocoque est le premier pathogène impliqué (10 à 40 % des PAC documentées). Puis les germes varient selon l’âge, les comorbidités, les expositions antérieures aux antibiotiques et le secteur de prise en charge : Haemophilus influenzae, Staphylococcus aureus, bacilles à Gram négatif (entérobactéries, Pseudo-monas aeruginosa), bactéries intracellulaires (Legionella spp., Mycoplasma pneumoniae et Chlamydia pneumoniae). Les virus respiratoires sont impliqués dans 30 % des cas, notamment le rhinovirus, les influenza A et B et les paramyxovirus (métapneumovirus humain, virus respiratoire syncytial et virus parainfluenza).
Faire le diagnostic
Des symptômes respiratoires (toux et expectoration) s’accompagnent classi- quement d’asthénie, anorexie, fièvre et tachypnée. Dans environ 30 % des cas, l’examen objective des signes témoignant d’un foyer de condensation alvéolaire. L’imagerie thoracique met en évidence un infiltrat alvéolaire ou alvéolo-interstitiel systématisé ou non, parfois une pleurésie. La radio est l’examen de référence, mais son interprétation est complexe, sa sensibilité étant de 44 % par rapport à celle du scanner thoracique. Ce dernier n’est pas systématique, mais il est utile en cas de clinique et de syndrome inflammatoire biologique en faveur d’une PAC mais sans foyer à la radio de thorax. À terme, l’échographie pleuro-parenchymateuse pourrait être une alternative pour diagnostiquer de manière fiable un infiltrat parenchymateux au lit du malade.
Certains signes cliniques ou radiologiques peuvent orienter vers un germe donné (
Le diagnostic microbiologique est réservé aux patients requérant une hospitalisation en secteur conventionnel ou en réanimation.3 L’intérêt est double, individuel (désescalade thérapeutique [réduction du spectre de l’antibiotique] et ciblage de celui-ci) et collectif (bon usage de ces médicaments, maîtrise des résistances).
Les recommandations préconisent :
– un examen cytobactériologique de l’expectoration (ECBC) : sensibilité de 30 à 60 % et spécificité : 50 à 85 % ;
– des hémocultures : positives dans 20 à 25 % des cas de PAC à pneumocoque avec une spécificité > 95 % ;
– antigénuries légionelle et pneumocoque : sensibilité de 50 à 80 % et de 60 à 90 % respectivement, et spécificité > 90 %.
La PCR multiplex est très performante pour détecter M. pneumoniae, C. pneumoniae et surtout des virus respiratoires, notamment en période épidémique (automne-hiver).
Dans certains cas, l’imputabilité d’une souche virale identifiée dans les voies aériennes supérieures reste cependant à démontrer
Évaluer la gravité
La décision d’hospitaliser tient compte également du risque de décompensation d’une comorbidité et de la capacité à mener à bien le traitement en ville (prise orale). Elle doit aussi être envisagée en cas d’incertitude diagnostique ou d’échec d’une prise en charge ambulatoire initiale.
Prendre en charge
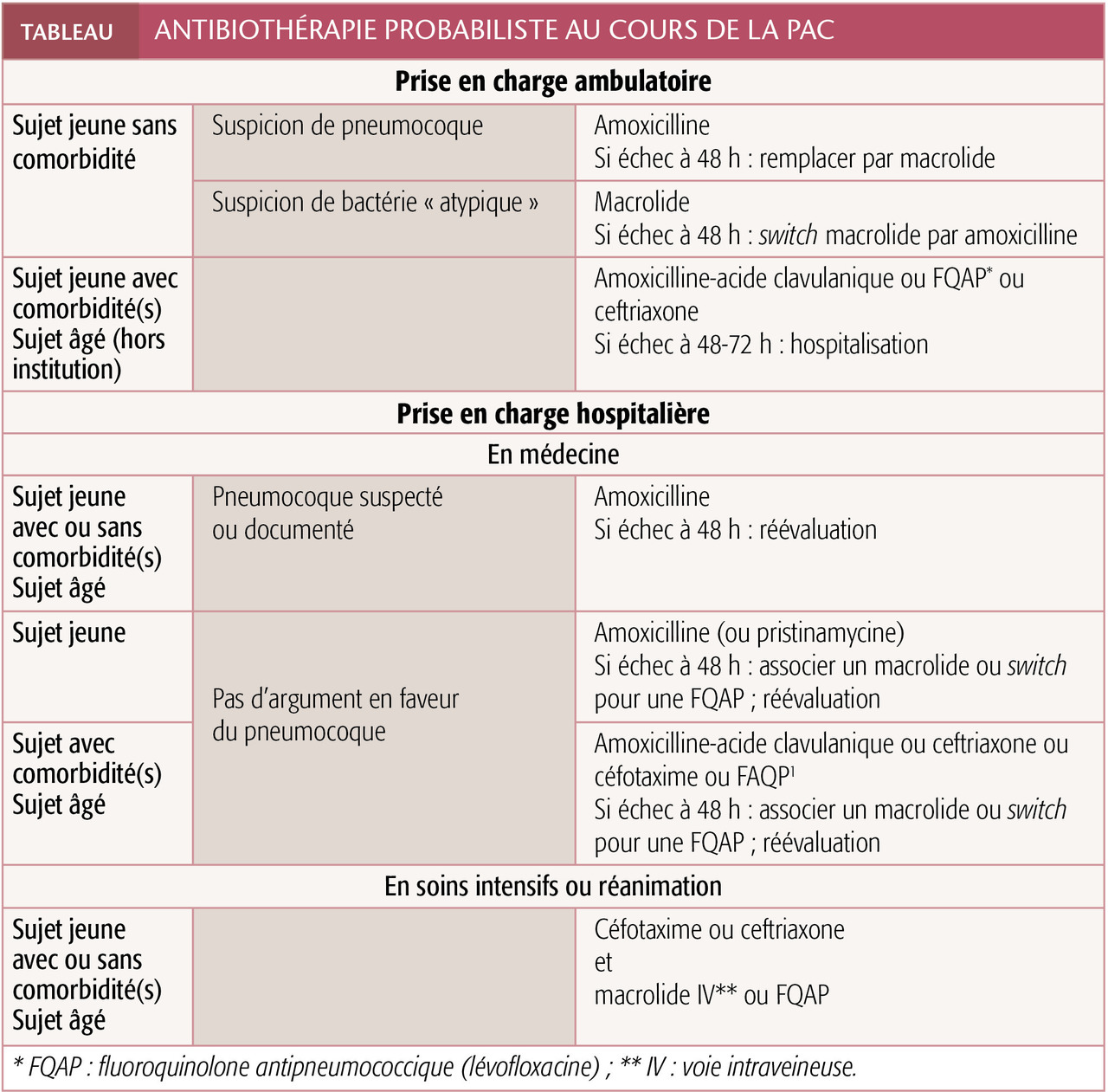
En raison de sa fréquence et de sa gravité potentielle, le pneumocoque doit systématiquement être visé (hors PAC supposée à germe atypique du sujet jeune en ambulatoire). Les taux de PSPD (pneumocoque de sensibilité diminuée à la pénicilline) ou de pneumocoques résistant aux macrolides sont d’environ 25 % en France. En cas de PSDP, l’amoxicilline reste néanmoins efficace à la posologie de 3 g/j. Céphalosporines orales, cyclines et cotrimoxazole ne le sont pas.
S. aureus, H. influenzae et les streptocoques du groupe A doivent être envisagés en cas d’infection dans un contexte grippal. La légionnelle doit systématiquement être ciblée en cas de forme grave. Les antibiothérapies probabilistes recommandées dépendent du terrain et du secteur de prise en charge (
Le traitement doit systématiquement être réévalué à 48-72 heures. Certains critères de stabilité clinique ont été proposés : fréquence respiratoire ≤ 24/min, oxymétrie de pouls ≥ 90 %, fréquence cardiaque ≤ 100/min, PA systolique ≥ 90 mmHg et température ≤ 37,2 °C.5 La disparition des signes radiologiques, plus lente, peut prendre plusieurs semaines. L’adaptation de l’antibiothérapie à la documentation microbiologique doit être envisagée.
Si l’évolution est défavorable (persistance ou aggravation clinique), il faut rechercher la cause de l’échec thérapeutique et éventuellement élargir le spectre de l’antibiothérapie. En cas de pneumonie compliquée (pleurésie, abcès pulmonaire et obstacle endobronchique), on suspecte une antibiothérapie inadaptée ou mal conduite. Il faut aussi savoir remettre en cause le diagnostic de PAC.
La durée de l’antibiothérapie ne doit pas excéder 7 jours sauf en cas de PAC documentée à S. aureus ou P. aeruginosa (15 jours). Chez les patients hospitalisés, la cinétique de décroissance de la procalcitonine peut être utilisée pour guider l’arrêt du traitement.
à noter que des antiviraux (oseltamivir ou zanamivir) peuvent être prescrits chez des patients à risque de gravité ayant des symptômes typiques de grippe depuis moins de 2 jours en période épidémique.
La prévention est-elle possible ?
Elle comprend également la déclaration obligatoire des cas de légionellose.
En faveur du pneumocoque :
– agent le plus fréquent après 40 ans et/ou si comorbidité(s) ;
– début brutal ; fièvre élevée initiale, malaise général ; point douloureux thoracique ;
– opacité alvéolaire systématisée ;
– hyperleucocytose à polynucléaires neutrophiles.
En faveur des bactéries atypiques :
– contexte épidémique (notamment pour M. pneumoniae) ;
– début progressif en 2 à 3 jours.
En faveur d’une légionellose :
– contexte épidémique ou « situation à risque » (voyage, thermes, exposition à de l’eau en aérosol contaminée…) ; comorbidité(s) fréquente(s) ;
– pneumonie d’allure sévère, début progressif, sans signe ORL, pouls dissocié, atteinte souvent bilatérale ;
– signes extrathoraciques : douleurs abdominales, vomissements, diarrhée, troubles de la conscience, céphalées, myalgies ;
– échec des bêtalactamines.
➜ Le pneumocoque est le premier pathogène impliqué.
➜ L’évaluation de la gravité conditionne le secteur de prise en charge et les modalités du traitement initial.
➜ L’antibiothérapie est probabiliste, précoce, et doit impérativement être réévaluée à 48-72 heures.
C Confusion
R Fréquence respiratoire > 30/min
B PA systolique < 90 mmHg ou diastolique < 60 mmHg
65 Âge > 65 ans
1 critère : évaluation à l’hôpital
1. Éléments d’orientation diagnostique
En faveur du pneumocoque :
– agent le plus fréquent après 40 ans et/ou si comorbidité(s) ;
– début brutal ; fièvre élevée initiale, malaise général ; point douloureux thoracique ;
– opacité alvéolaire systématisée ;
– hyperleucocytose à polynucléaires neutrophiles.
En faveur des bactéries atypiques :
– contexte épidémique (notamment pour M. pneumoniae) ;
– début progressif en 2 à 3 jours.En faveur d’une légionellose :
– contexte épidémique ou « situation à risque » (voyage, thermes, exposition à de l’eau en aérosol contaminée…) ; comorbidité(s) fréquente(s) ;
– pneumonie d’allure sévère, début progressif, sans signe ORL, pouls dissocié, atteinte souvent bilatérale ;
– signes extrathoraciques : douleurs abdominales, vomissements, diarrhée, troubles de la conscience, céphalées, myalgies ;
– échec des bêtalactamines.
2. Score CRB-65
C Confusion
R Fréquence respiratoire > 30/min
B PA systolique < 90 mmHg ou diastolique < 60 mmHg
65 Âge > 65 ans
1 critère : évaluation à l’hôpital
2. Welte T, Torres A, Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2012;67:71-9.
3. Woodhead M, Blasi F, Ewig S, et al. Guidelines for the management of adult lower respiratory tract infections. Clin Microbiol Infect 2011;17 (suppl 6):E1-59.
4. Afssaps. Antibiothérapie par voie générale dans les infections respiratoires basses de l’adulte. Juillet 2010. https://bit.ly/2KgXJx2
5. Halm EA, Fine MJ, Marrie TJ, et al. Time to clinical stability in patients hospitalized with community-acquired pneumonia: implications for practice guidelines. JAMA 1998;279:1452-7.

 Encadrés
Encadrés