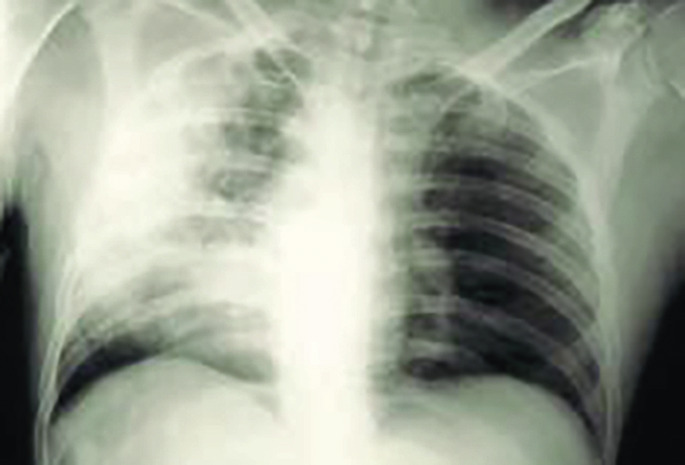
Dans cette population, la pneumonie est fréquente. D’après une étude espagnole récente, l’incidence globale est de 63,4/100 000 habitants et augmente à 209,3/100 000 chez les plus de 65 ans. Son diagnostic est difficile car les symptômes sont souvent atypiques. Enfin, chez le sujet âgé aux réserves physiologiques réduites, une pneumonie même correctement prise en charge peut modifier la trajectoire de vie impactant l’état nutritionnel et musculaire, les fonctions cognitives et thymiques, aboutissant à un déclin fonctionnel, voire à une perte d’autonomie définitive ou au décès.
L’hospitalisation pour pneumonie aiguë communautaire (PAC) est un indicateur de pronostic défavorable à 1 an chez les patients âgés. Dans une étude incluant 158 960 sujets ayant une PAC et 794 333 contrôles hospitalisés, la mortalité à 1 an était de 41 versus 29 %.1
Les principaux facteurs de risque sont les fausses routes (liées à des troubles de la conscience ou de la déglutition) et la baisse des défenses locales (tabagisme, BPCO, insuffisance cardiaque) ou générales (dénutrition, diabète non équilibré, splénectomie, insuffisance rénale chronique, cirrhose, déficit immunitaire primitif ou secondaire altérant la réponse humorale ou la fonction des polynucléaires neutrophiles).
Risque accru chez les seniors
En effet, une sénescence du système immunitaire au cours du vieillissement a été démontrée dans les modèles animaux, notamment une baisse de l’immunité humorale (qui joue un rôle important contre les infections respiratoires).
Les troubles de la déglutition sont fréquents (maladie neurologique dégénérative, séquelles d’AVC). Ainsi, chez les patients ayant fait un AVC, on retrouve une forte corrélation entre le volume des inhalations et la survenue d’une pneumonie.
L’hyposalivation induite par les médicaments (antidépresseurs, antiparkin- soniens, diurétiques, antihypertenseurs, antihistaminiques…) et la pathologie parodontale favorisent la colonisation par des bactéries pathogènes. Ainsi, les entérobactéries et Staphylococcus aureus sont retrouvés respectivement chez 22-37 % et 12 % des malades vivant en institution. Le risque de pneumonie par inhalation est plus faible chez les patients édentés. Les comorbidités qui augmentent le risque de pneumonie par diminution des défenses locales ou générales (cf. ci-dessus) sont également plus fréquentes dans la population gériatrique.
Enfin, les seniors ont une moindre sensibilité à l’hypoxémie et à l’hypercapnie. Ces modifications diminuent les capacités de drainage bronchique et augmentent le risque d’insuffisance respiratoire hypercapnique en cas de pneumonie.
Étiologies : bactériennes et virales
Dans 60-80 % des travaux, les PAC sont d’origine bactérienne, Streptococcus pneumoniae était le premier germe identifié. Cependant, les études anciennes sous-estiment la part des virus dans les formes communautaires.
Dans un essai prospectif chez 885 malades hospitalisés pour PAC ayant eu une recherche systématique des virus respiratoires, influenza et rhinovirus était parmi les 5 pathogènes les plus fréquemment retrouvés, respectivement chez 7,7 et 5,2 % des patients.3
Certaines bactéries sont associées à des contextes particuliers : les anaérobies aux troubles de la déglutition ou à un mauvais état dentaire.
Les infections sont plurimicrobiennes dans 5 à 10 % des PAC avec identification microbiologique.
Diagnostic : difficile
Les crépitants manquent souvent, et les tableaux cliniques et radiologiques des diverses infections respiratoires basses ne sont pas spécifiques. L’hyperleucocytose peut être absente, alors que l’élévation de la CRP est plus constante.
Parfois, la symptomatologie d’une autre comorbidité décompensée par la pneumonie (insuffisance cardiaque, diabète…) est au premier plan.
Ainsi, toute modification de l’état clinique, général et cognitif d’un sujet âgé doit alerter, même en l’absence de symptômes typiquement respiratoires, afin de ne pas retarder le traitement, de limiter les complications et de diminuer la période de stress physiologique.
Prise en charge : bien codifiée
Une antibiothérapie adaptée doit être rapidement débutée, à réévaluer impérativement à 48-72 heures. Le lieu de prise en charge est décidé en fonction de la sévérité, des comorbidités à risque de décompensation et d’éventuels facteurs sociaux.
Quand hospitaliser ?
En pratique, une prise en charge ambulatoire n’est envisagée que si l’observance et la surveillance du patient sont assurées (capacité à ingérer les comprimés, personnes présentes au domicile, disponibilité du médecin traitant) et en l’absence de signes de sepsis sévère, de lutte respiratoire, ou de comorbidité en voie de décompensation.
Chez les sujets institutionnalisés, le choix d’un traitement au sein de l’EHPAD se fonde sur les mêmes critères cliniques de bonne tolérance, et sur l’habitude et la capacité du personnel à fournir des soins rapides et une surveillance rapprochée.
Quelle antibiothérapie ?
Chez le patient hospitalisé en secteur de médecine, compte tenu de la sévérité réelle ou potentielle, les experts français recommandent une association β-lactamine/macrolide ou une fluoroquinolone à activité antipneumococcique en monothérapie en cas d’allergie à la pénicilline.
En réanimation, le spectre doit être large de manière à couvrir S. pneumoniae, Legionella pneumophila, les entérobactéries, S. aureus, dans l’attente d’une identification microbiologique formelle. On recommande le plus couramment la combinaison céphalosporine de 3e génération + macrolide.
Prévenir le déclin fonctionnel
Des mesures doivent être associées à l’antibiothérapie et au traitement des comorbidités décompensées :
– assurer une nutrition hypercalorique et hyperprotidique (30-35 kcal/kg/j et 1-1,5 g de protides/kg/j). Pour atteindre ces objectifs en dépit de l’anorexie induite par l’hypercatabolisme, il faut conseiller d’enrichir les plats (ajout de fromage râpé, crème fraîche, œufs, poudre de protéines…) et/ou prescrire des compléments hypercaloriques/ protidiques, à consommer à distance des repas. Ce régime doit être poursuivi pendant 1 mois après la résolution de l’infection ;
– promouvoir le maintien d’une activité physique et proscrire le confinement complet au lit, afin de lutter contre l’aggravation de la sarcopénie et le déclin fonctionnel. Dès que possible, on conseille des exercices simples de renforcement musculaire aux 4 membres (se lever d’une chaise avec puis sans l’aide des mains, « pompes contre le mur »...), à pratiquer tous les 2 jours au décours de l’infection, de façon progressive (commencer par des efforts légers et augmenter l’intensité si possible au fil du temps) ; ces exercices ne doivent pas être pénibles ni provoquer essoufflement, douleur ou inconfort ;
– dépister un éventuel syndrome dépressif, fréquent et pourvoyeur d’autres complications.
Mesures préventives
La vaccination contre la grippe est actuellement recommandée en France à partir de 65 ans. Une récente méta-analyse a repris toutes les études depuis 1964 dans lesquelles l’infection est confirmée par RT-PCR7 (31 sélectionnées dont 17 randomisées contrôlées et 14 observationnelles). L’efficacité du vaccin a été montrée durant 8 saisons sur les 12 étudiées dans 10 essais randomisés (efficacité globale de 59 % chez les adultes entre 18 et 59 ans). Cette étude n’a pas fourni de données pour la population gériatrique, mais elle a mis en évidence que la vaccination du personnel des institutions pour sujets âgés permettait, chez ces derniers, une diminution des épisodes, du recours au système de soins et de la mortalité.
Enfin, plusieurs études ont démontré l’effet additif des vaccinations antigrippale et antipneumococcique chez les seniors : baisse de la mortalité ou des hospitalisations liées à ces infections.
Les soins dentaires, limitant la maladie parodontale et la colonisation oropharyngée, ont un vrai intérêt chez les patients âgés institutionnalisés : ils diminuent les pneumonies par inhalations.
En cas de facteurs de risque de ces dernières (dépendance, démence, maladie de Parkinson, séquelle d’AVC, pathologie respiratoire ou ORL, dysphagie, diabète, mauvais état bucco-dentaire, traitement psychotrope, IPP ou ARA-2), la surveillance de l’alimentation doit être attentive, et les repas pris dans des conditions environnementales et posturales strictes (assis à 90°, la tête penchée en avant, sans distraction sonore ou visuelle), en évitant les mélanges de textures.
Enfin, arrêt du tabac et maintien d’un état nutritionnel optimal contribuent à la diminution du risque d’infections.
Qui vacciner contre le pneumocoque ?
Immunodéprimés : aspléniques ou hypospléniques (incluant les syndromes drépanocytaires majeurs) ; atteints de déficits immunitaires héréditaires ; infectés par le VIH ; patients ayant une tumeur solide ou une hémopathie maligne ; transplantés ou en attente de greffe d’organe solide ; greffés de cellules souches hématopoïétiques ; traités par immunosuppresseur, biothérapie et/ou corticothérapie pour une maladie auto-immune ou inflammatoire chronique ; syndrome néphrotique.
Non immunodéprimés ayant une maladie prédisposant à la survenue d’une infection invasive à pneumocoque (bactériémie, pneumonie, méningite) : cardiopathie congénitale cyanogène, insuffisance cardiaque ; insuffisance respiratoire chronique, bronchopneumopathie obstructive, emphysème ; asthme sévère sous traitement continu ; insuffisance rénale ; hépatopathie chronique d’origine alcoolique ou non ; diabète non équilibré par le simple régime ; patients ayant une brèche ostéo-méningée, un implant cochléaire ou candidats à une implantation cochléaire.
2. Rello J, Rodriguez R, Jubert P, Alvarez B. Severe community-acquired pneumonia in the elderly: epidemiology and prognosis. Study Group for Severe Community-Acquired Pneumonia. Clin Infect Dis 1996; 23:723-8.
3. Charles PG, Whitby M, Fuller AJ, et al. The etiology of community-acquired pneumonia in Australia: why penicillin plus doxycycline or a macrolide is the most appropriate therapy. Clin Infect Dis 2008;46:1513-21.
4. Shefet D, Robenshtock E, Paul M, Leibovici L. Empiric antibiotic coverage of atypical pathogens for community acquired pneumonia in hospitalized adults. Cochrane Database Syst Rev 2005;2:CD004418.
5. SPLF/SPILF. Prise en charge des infections respiratoires basses de l’adulte immunocompétent. Paris: XVe conférence de consensus en thérapeutique anti- infectieuse. Mars 2006.
6. Bonten MJ, Huijts SM, Bolkenbaas M, CAPITA Co- authors. Vaccine against Pneumococcal Pneumonia in Adults. N Engl J Med 2015;373:93.
7. Osterholm MT, Kelley NS, Sommer A, Belongia EA. Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. Lancet Infect Dis 2012;12:36-44.

 Encadrés
Encadrés