L’irruption d’air au sein de la cavité pleurale entraîne la perte de pression négative habituelle ou une pression positive ; cela peut s’accompagner d’un collapsus, partiel ou complet, du poumon sous-jacent.
Plus fréquent chez l’homme : incidence annuelle comprise entre 18 et 28 cas pour 100 000 habitants (
1,2-6 cas pour 100 000 chez la femme).
Plus fréquent chez l’homme : incidence annuelle comprise entre 18 et 28 cas pour 100 000 habitants (
1,2-6 cas pour 100 000 chez la femme).
Types
Spontané primaire (PSP) : ou idiopathique, touche de préférence le sujet jeune ayant un poumon sain ; il se formerait par rupture de bulles sous-pleurales ( blebs) à la suite d’une élévation de pression.
Spontané secondaire (PSS) :
– chez des sujets ayant une affection respiratoire sous-jacente : surtout BPCO avec emphysème mais aussi asthme, mucoviscidose, pathologie interstitielle, cancer bronchique ou infection pulmonaire nécrosante ;
– souvent moins bien toléré que le primaire et associé à une plus grande morbi-mortalité.
Cataménial :survient 24 à 72 heures après le début des menstruations ; volontiers associé à une endométriose thoracique, qu’il faut rechercher.
Traumatique : consécutif à une effraction de la plèvre pariétale, liée à un traumatisme direct (plaie pénétrante), indirect (écrasement thoracique responsable d’une hyperpression) ou iatrogène (biopsies ou ponction transthoraciques, ventilation).
Spontané secondaire (PSS) :
– chez des sujets ayant une affection respiratoire sous-jacente : surtout BPCO avec emphysème mais aussi asthme, mucoviscidose, pathologie interstitielle, cancer bronchique ou infection pulmonaire nécrosante ;
– souvent moins bien toléré que le primaire et associé à une plus grande morbi-mortalité.
Cataménial :
Traumatique :
Facteurs de risques
Tabagisme +++ :
– risque multiplié par 9 chez la femme et 22 chez l’homme ;
– accentué par la consommation de cannabis, qui favorise le développement de lésions bulleuses pulmonaires.
Conditions météorologiques (variations de la pression atmosphérique) ; associées parfois à de petites « épidémies ». 3
– risque multiplié par 9 chez la femme et 22 chez l’homme ;
– accentué par la consommation de cannabis, qui favorise le développement de lésions bulleuses pulmonaires.
Conditions météorologiques
Diagnostic
Signes cliniques variables, souvent d’apparition brutale :
– douleur thoracique « en coup de poignard », dyspnée, toux ;
– diminution ou abolition du murmure vésiculaire ;
– si pneumothorax sous tension (compressif) : la pression positive engendrée entraîne une détresse respiratoire et une compression des cavités cardiaques responsable d’un état de choc par tamponnade gazeuse, mettant en jeu le pronostic vital.
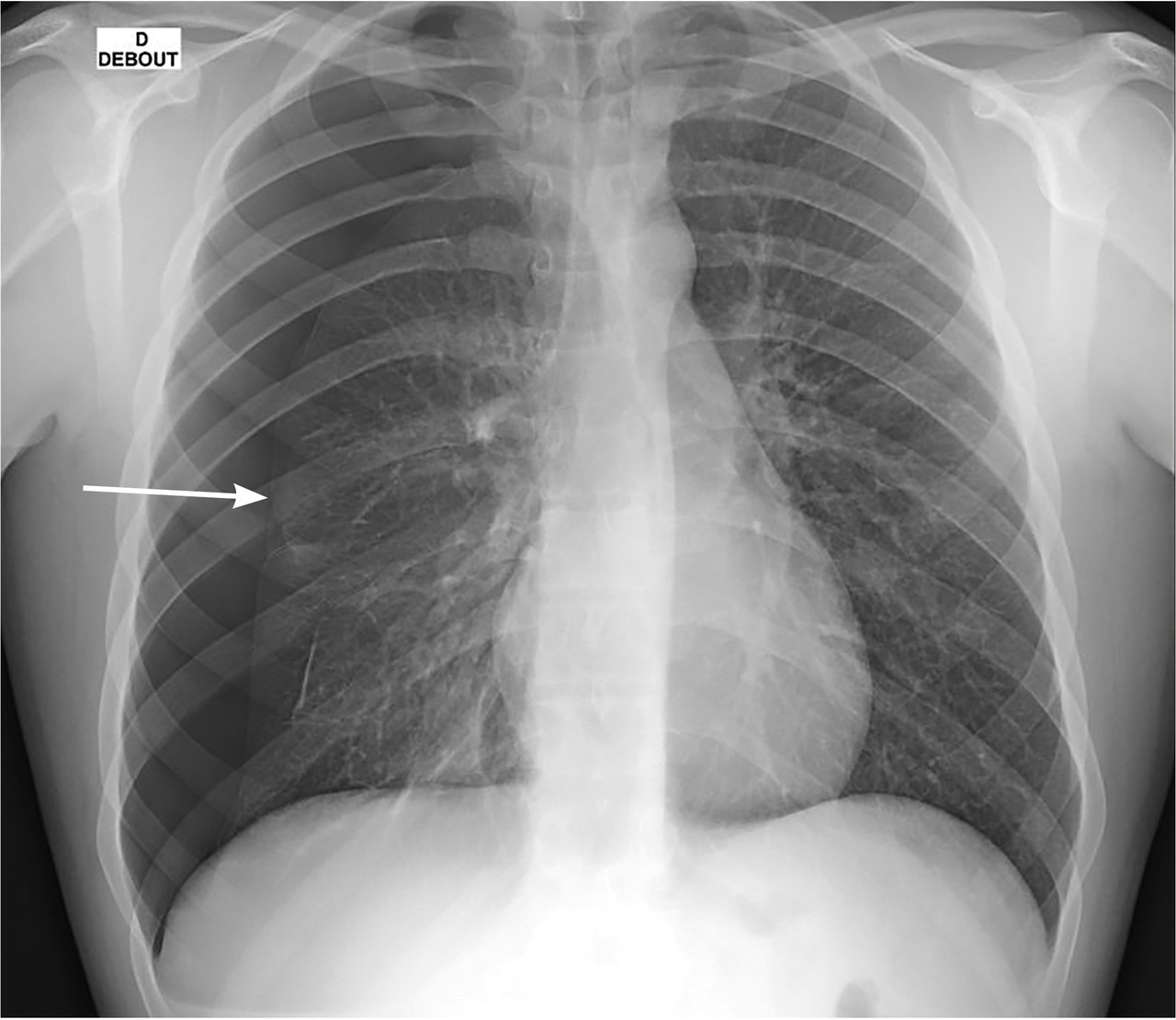
à la radiographie thoracique(de face, debout et en inspiration ; clichés en expiration non recommandés) :
– hyperclarté avasculaire plus ou mois importante délimitée en dedans par la plèvre viscérale visualisée par une ligne bordante pleurale ;
– pneumothorax dit « complet » en cas de décollement sur toute la longueur de la ligne axillaire de l’apex au diaphragme ;
– on recherche des signes de compression avec déviation médiastinale et refoulement des organes, une bride retenant partiellement le poumon à la paroi (sa rupture peut provoquer un hémopneumothorax) ;
– on peut estimer la taille : pneumothorax de grande abondance défini par un décollement à l’apex de plus de 3 cm (pour l’
) et/ou de plus de 2 cm au niveau du hile (selon la
).
Scanner thoracique :utile en cas d’incertitude diagnostique, de suspicion de pathologie sous-jacente ou avant chirurgie.
– diminution ou abolition du murmure vésiculaire ;
– si pneumothorax sous tension (compressif) : la pression positive engendrée entraîne une détresse respiratoire et une compression des cavités cardiaques responsable d’un état de choc par tamponnade gazeuse, mettant en jeu le pronostic vital.
à la radiographie thoracique
– hyperclarté avasculaire plus ou mois importante délimitée en dedans par la plèvre viscérale visualisée par une ligne bordante pleurale ;
– pneumothorax dit « complet » en cas de décollement sur toute la longueur de la ligne axillaire de l’apex au diaphragme ;
– on recherche des signes de compression avec déviation médiastinale et refoulement des organes, une bride retenant partiellement le poumon à la paroi (sa rupture peut provoquer un hémopneumothorax) ;
– on peut estimer la taille : pneumothorax de grande abondance défini par un décollement à l’apex de plus de 3 cm (pour l’
) et/ou de plus de 2 cm au niveau du hile (selon la
).
Scanner thoracique :
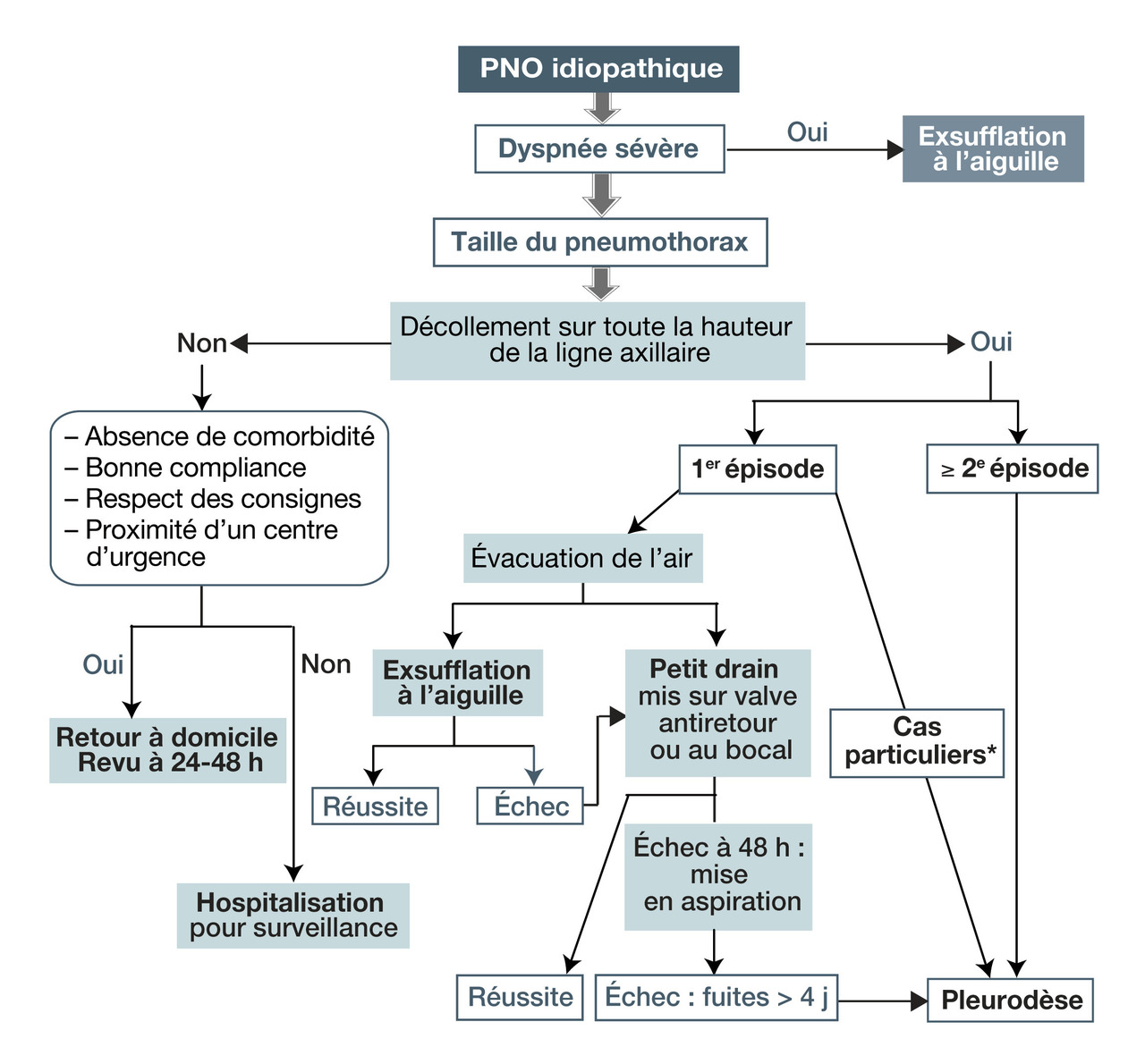
Prise en charge du premier épisode
PSP récent, de petite taille et peu symptomatique :
– surveillance ++ (recommandation de grade B), une résorption spontanée étant possible ;
– si le patient est compliant et peut consulter rapidement : suivi ambulatoire, avec réévaluation clinique précoce (48 heures) ;
– repos strict au lit : pas recommandé ;
– si échec ou aggravation : évacuation de l’air par exsufflation ou drainage.
PSP symptomatique :
– exsufflation à l’aiguille : proposée en 1 re intention (grade A) ; . consiste à insérer, après anesthésie locale, une aiguille par voie antérieure, au niveau du 2 e ou 3 e espace intercostal et en dehors de la ligne médio-claviculaire ; aspiration manuelle avec une seringue ou murale (pas en 1 re intention) ; 3, 4
. après une surveillance de 3 à 6 heures, prise en charge ambulatoire ;
. en cas d’échec, pose d’un drain thoracique de petite taille (≤ 14 F) par voie antérieure ou axillaire (drain de gros calibre non indiqué) ;
– alternative à l’exsufflation : pose d’un cathéter de Fuhrman (drain « en queue de cochon ») raccordé à une valve anti-retour de Heimlich, permettant au patient de déambuler ; réalisé en hospitalisation courte mais également en ambulatoire.
PSP de grande abondance asymptomatique : l’évacuation de l’air peut s’effectuer après une période d’observation (recommandations de grade A). 4
PSS et traumatiques : drainage en 1 re intention, si la taille du pneumothorax le permet, en hospitalisation (au moins 24 heures) ; 4 pour les iatrogènes (évolution généralement favorable) : l’abstension est possible (surveillance).
Pneumothorax compressif :prise en charge urgente +++, avec mesures de réanimation et décompression à l’aiguille creuse de gros calibre, assez longue, en association avec un remplissage vasculaire ; le drain doit être posé immédiatement après la décompression. 4
Hémopneumothorax (rupture de bride vascularisée) : drainage chirurgical conseillé.
Si échec du drainage à 4-7 jours ou pneumothorax bilatéral simultané : pleurodèse chirurgicale – par abrasion pleurale – ou médicale par talcage (peut être proposée en première intention en cas de professions à risque : pilotes d’avion, plongeurs, militaires).
– si le patient est compliant et peut consulter rapidement : suivi ambulatoire, avec réévaluation clinique précoce (48 heures) ;
– repos strict au lit : pas recommandé ;
– si échec ou aggravation : évacuation de l’air par exsufflation ou drainage.
PSP symptomatique :
. après une surveillance de 3 à 6 heures, prise en charge ambulatoire ;
. en cas d’échec, pose d’un drain thoracique de petite taille (≤ 14 F) par voie antérieure ou axillaire (drain de gros calibre non indiqué) ;
– alternative à l’exsufflation : pose d’un cathéter de Fuhrman (drain « en queue de cochon ») raccordé à une valve anti-retour de Heimlich, permettant au patient de déambuler ; réalisé en hospitalisation courte mais également en ambulatoire.
PSP de grande abondance asymptomatique :
PSS et traumatiques :
Pneumothorax compressif :
Hémopneumothorax (rupture de bride vascularisée) : drainage chirurgical conseillé.
Si échec du drainage à 4-7 jours ou pneumothorax bilatéral simultané : pleurodèse chirurgicale – par abrasion pleurale – ou médicale par talcage (peut être proposée en première intention en cas de professions à risque : pilotes d’avion, plongeurs, militaires).
Récidives
Taux de récidive homolatérale : 30 % après un 1
épisode, jusqu’à 60 % après un 2
et 80 % après un 3
.
En cas de récidive homolatérale ou d’épisode controlatéral : pleurodèse mécanique ou chimique à préférer par rapport à la pleurectomie (efficacité semblable mais moins de complications) ; privilégier un abord par vidéo-thoracoscopie.
épisode, jusqu’à 60 % après un 2
et 80 % après un 3
.
En cas de récidive homolatérale ou d’épisode controlatéral : pleurodèse mécanique ou chimique à préférer par rapport à la pleurectomie (efficacité semblable mais moins de complications) ; privilégier un abord par vidéo-thoracoscopie.
Encadre
Que dire aux patients après un épisode ?
Le sevrage tabagique est indispensable pour diminuer le risque de récidive.
La plongée sous-marine avec détendeur est contre-indiquée à vie.
Vols aériens : proscrits si le pneumothorax n’est pas résolu ; autorisés 3 à 6 semaines après (pas de consensus).
Pas de contre-indication aux efforts à glotte fermée.
Consulter en urgence en cas de réapparition des symptômes
Références
1. Melton LJ, Hepper NG, Offord KP. Incidence of spontaneous pneumothorax in Olmsted County, Minnesota: 1950 to 1974. Am Rev Respir Dis 1979;120:1379-82.
2. Bense L, Eklund G, Wiman LG. Smoking and the increased risk of contracting spontaneous pneumothorax. Chest 1987;92:1009-12.
3. Tschopp JM, Bintcliffe O, Astoul P, et al. ERS task force statement: diagnosis and treatment of primary spontaneous pneumothorax. Eur Respir J 2015;46:321-35.
4. MacDuff A, Arnold A, Harvey J; BTS Pleural Disease Guideline Group. Management of spontaneous pneumothorax: British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010;65(Suppl 2):ii18-31.
5. Massongo M, Leroy S, Scherpereel A, et al. Outpatient management of primary spontaneous pneumothorax: a prospective study. Eur Respir J 2014;43:582-90.
2. Bense L, Eklund G, Wiman LG. Smoking and the increased risk of contracting spontaneous pneumothorax. Chest 1987;92:1009-12.
3. Tschopp JM, Bintcliffe O, Astoul P, et al. ERS task force statement: diagnosis and treatment of primary spontaneous pneumothorax. Eur Respir J 2015;46:321-35.
4. MacDuff A, Arnold A, Harvey J; BTS Pleural Disease Guideline Group. Management of spontaneous pneumothorax: British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010;65(Suppl 2):ii18-31.
5. Massongo M, Leroy S, Scherpereel A, et al. Outpatient management of primary spontaneous pneumothorax: a prospective study. Eur Respir J 2014;43:582-90.

 Encadrés
Encadrés