La pollution lumineuse est liée à l’omniprésence et au mésusage des systèmes d’éclairage dans notre société. Ses effets délétères dépassent le cadre de l’œil et celui de l’humain.
Avec Thomas Edison, la fin du XIXe siècle a vu naître l’ampoule électrique, véritable révolution de l’éclairage. Depuis cette période, la recherche de sources lumineuses de plus en plus puissantes n’a pas cessé, dans le but d’accroître les performances énergétiques, d’améliorer la qualité de la lumière émise et d’étendre les possibilités d’utilisation de cet éclairage artificiel.
Cependant, l’exposition à de nouvelles sources lumineuses très performantes s’avère toxique pour les photorécepteurs rétiniens. Elle est, de plus, particulièrement délétère la nuit, car elle inhibe la régénération physiologique des photopigments rétiniens indispensables à la vision et entraîne une désynchronisation de l’horloge interne, elle-même responsable de perturbations du sommeil, de troubles de l’humeur et de troubles cognitifs. Sur le long terme, cette désynchronisation est préjudiciable à la santé. Les données épidémiologiques les plus robustes concernant l’augmentation du risque de cancer du sein chez les femmes en travail posté* ou de nuit montrent qu’il s’agit d’une question de santé publique, au vu du nombre très important de personnes concernées. De plus, l’utilisation souvent abusive des divers types d’écran par les enfants et les adolescents les expose à la toxicité rétinienne de la bande bleue de la lumière, à la myopie évolutive et aux conséquences du dérèglement du cycle circadien.
Cependant, l’exposition à de nouvelles sources lumineuses très performantes s’avère toxique pour les photorécepteurs rétiniens. Elle est, de plus, particulièrement délétère la nuit, car elle inhibe la régénération physiologique des photopigments rétiniens indispensables à la vision et entraîne une désynchronisation de l’horloge interne, elle-même responsable de perturbations du sommeil, de troubles de l’humeur et de troubles cognitifs. Sur le long terme, cette désynchronisation est préjudiciable à la santé. Les données épidémiologiques les plus robustes concernant l’augmentation du risque de cancer du sein chez les femmes en travail posté* ou de nuit montrent qu’il s’agit d’une question de santé publique, au vu du nombre très important de personnes concernées. De plus, l’utilisation souvent abusive des divers types d’écran par les enfants et les adolescents les expose à la toxicité rétinienne de la bande bleue de la lumière, à la myopie évolutive et aux conséquences du dérèglement du cycle circadien.
La rétine impliquée dans la vision et le rythme circadien
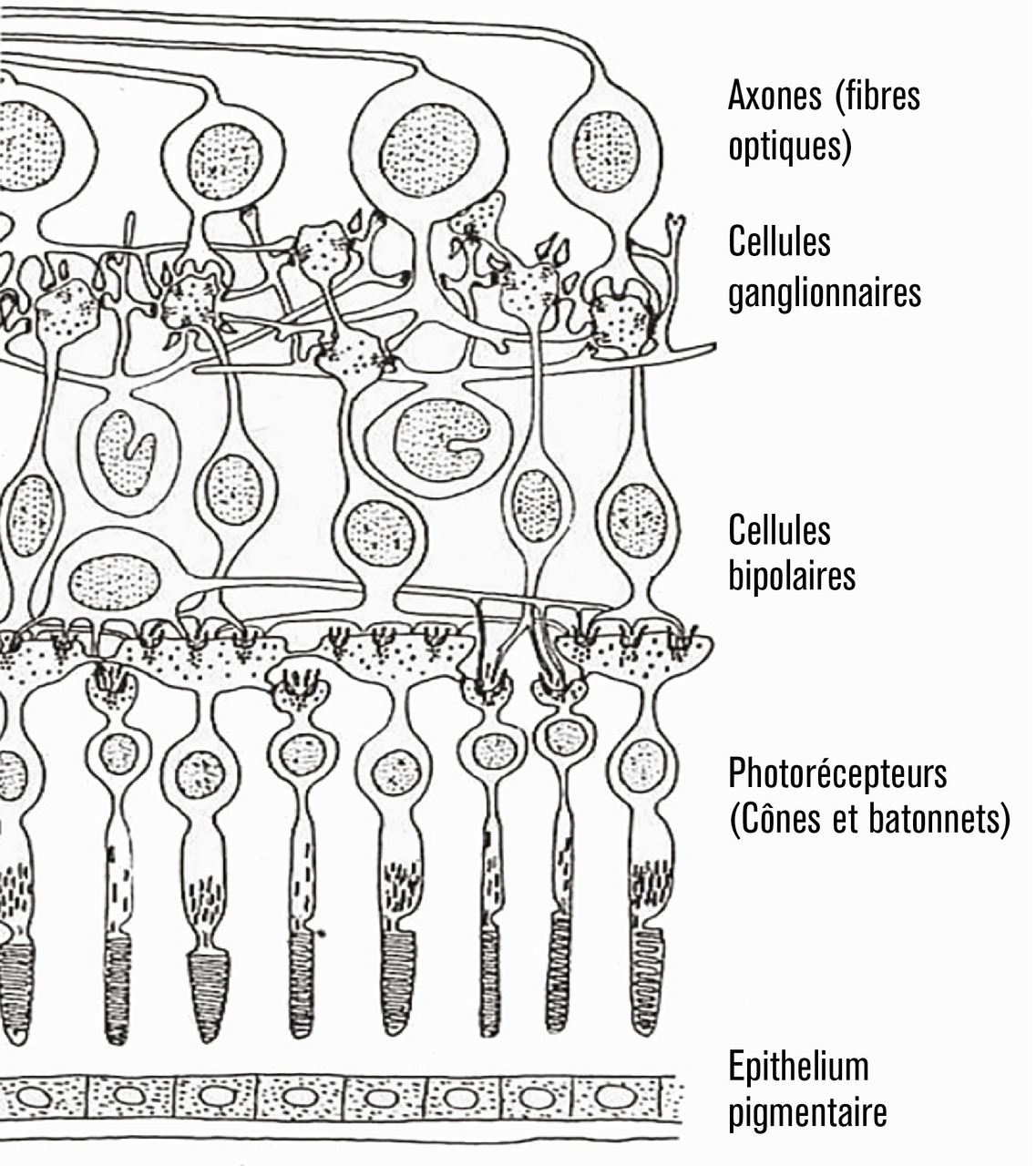
La rétine (fig. 1 ), réceptrice des photons lumineux, assume deux fonctions :
– l’une, évidente, est la fonction visuelle grâce au couple photorécepteur-épithélium pigmenté ;
– l’autre, tout aussi essentielle, assure la régulation du cycle veille-sommeil, encore appelé cycle circadien ou nycthéméral, grâce à certaines cellules ganglionnaires photoréceptrices.
– l’une, évidente, est la fonction visuelle grâce au couple photorécepteur-épithélium pigmenté ;
– l’autre, tout aussi essentielle, assure la régulation du cycle veille-sommeil, encore appelé cycle circadien ou nycthéméral, grâce à certaines cellules ganglionnaires photoréceptrices.
Une structure neurosensorielle complexe
Les photorécepteurs rétiniens sont le lieu d’une subtile alchimie, la phototransduction, qui transforme les photons en influx nerveux (signal électrique ou potentiel d’action). Ces signaux électriques, codés au niveau de la rétine, parcourent les voies visuelles intracérébrales jusqu’au cortex visuel occipital pour y être décodés et interprétés en fonction de la banque d’images répertoriées et mémorisées par le cerveau.
On estime que 80 % des fonctions cérébrales sont impliquées dans le phénomène de la vision.
Les 6,5 millions de photorécepteurs de type cône sont dévolus à la vision diurne, à la discrimination fine, la lecture, l’écriture, la vision des couleurs et du relief. Ils sont surtout situés dans la macula, zone centrale de la rétine. Leur altération est responsable de la perte de la vision centrale observée dans la dégénérescence maculaire liée à l’âge (DMLA).
Les 130 millions de photorécepteurs de type bâtonnet tapissent l’ensemble de la rétine périphérique. Ils assurent la vision nocturne et la perception du monde environnant. Leur atteinte se manifeste par l’altération de la vision nocturne et par un rétrécissement du champ visuel périphérique, comme dans le glaucome chronique et les rétinopathies pigmentaires.
Les photopigments contenus dans ces photorécepteurs, opsines pour les cônes, rhodopsines pour les bâtonnets, constituent le point de départ moléculaire de la vision. Ils sont consommés le jour et régénérés la nuit. Le respect du rythme circadien, notamment de l’obscurité nocturne, est donc fondamental pour leur régénération.
L’épithélium pigmenté joue un rôle essentiel de soutien des photorécepteurs, à la fois d’écran protecteur vis-à-vis de la lumière et de recyclage des photopigments usagés.
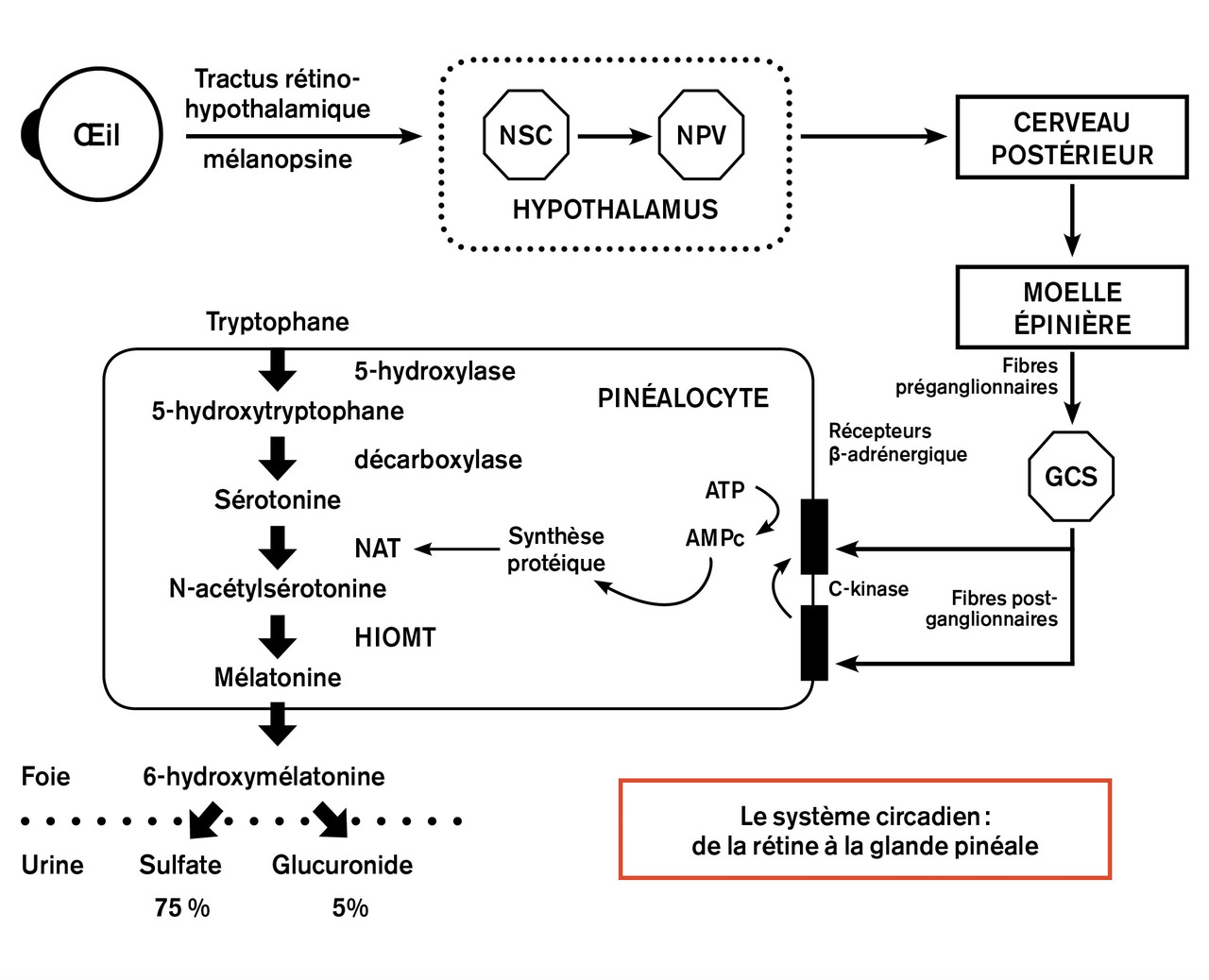
Enfin, des cellules ganglionnaires spécialisées, dites intrinsèquement photosensibles (ipRGC, pour intrinsically photosensitive retinal ganglion cells), réagissent à la lumière grâce à un autre photopigment, la mélanopsine. Cette dernière régit la sécrétion de la mélatonine, qui intervient sur le sommeil en favorisant l’endormissement. Dans l’obscurité, la mélatonine, neurohormone sécrétée par la glande pinéale intracérébrale, plonge l’organisme dans le sommeil.
Le moindre rayon lumineux stimule la mélanopsine. Elle bloque la sécrétion de mélatonine et place l’organisme en état de veille.1 Son rôle s’avère donc majeur dans la régulation du cycle veille-sommeil. Ainsi, le respect du rythme nycthéméral, donc de l’obscurité nocturne totale, est également essentiel pour la sécrétion de la mélatonine, garante d’un sommeil réparateur.
L’homme est bien un être à activité diurne et repos nocturne.
On estime que 80 % des fonctions cérébrales sont impliquées dans le phénomène de la vision.
Les 6,5 millions de photorécepteurs de type cône sont dévolus à la vision diurne, à la discrimination fine, la lecture, l’écriture, la vision des couleurs et du relief. Ils sont surtout situés dans la macula, zone centrale de la rétine. Leur altération est responsable de la perte de la vision centrale observée dans la dégénérescence maculaire liée à l’âge (DMLA).
Les 130 millions de photorécepteurs de type bâtonnet tapissent l’ensemble de la rétine périphérique. Ils assurent la vision nocturne et la perception du monde environnant. Leur atteinte se manifeste par l’altération de la vision nocturne et par un rétrécissement du champ visuel périphérique, comme dans le glaucome chronique et les rétinopathies pigmentaires.
Les photopigments contenus dans ces photorécepteurs, opsines pour les cônes, rhodopsines pour les bâtonnets, constituent le point de départ moléculaire de la vision. Ils sont consommés le jour et régénérés la nuit. Le respect du rythme circadien, notamment de l’obscurité nocturne, est donc fondamental pour leur régénération.
L’épithélium pigmenté joue un rôle essentiel de soutien des photorécepteurs, à la fois d’écran protecteur vis-à-vis de la lumière et de recyclage des photopigments usagés.
Enfin, des cellules ganglionnaires spécialisées, dites intrinsèquement photosensibles (ipRGC, pour intrinsically photosensitive retinal ganglion cells), réagissent à la lumière grâce à un autre photopigment, la mélanopsine. Cette dernière régit la sécrétion de la mélatonine, qui intervient sur le sommeil en favorisant l’endormissement. Dans l’obscurité, la mélatonine, neurohormone sécrétée par la glande pinéale intracérébrale, plonge l’organisme dans le sommeil.
Le moindre rayon lumineux stimule la mélanopsine. Elle bloque la sécrétion de mélatonine et place l’organisme en état de veille.1 Son rôle s’avère donc majeur dans la régulation du cycle veille-sommeil. Ainsi, le respect du rythme nycthéméral, donc de l’obscurité nocturne totale, est également essentiel pour la sécrétion de la mélatonine, garante d’un sommeil réparateur.
L’homme est bien un être à activité diurne et repos nocturne.
Interaction rétine-lumière
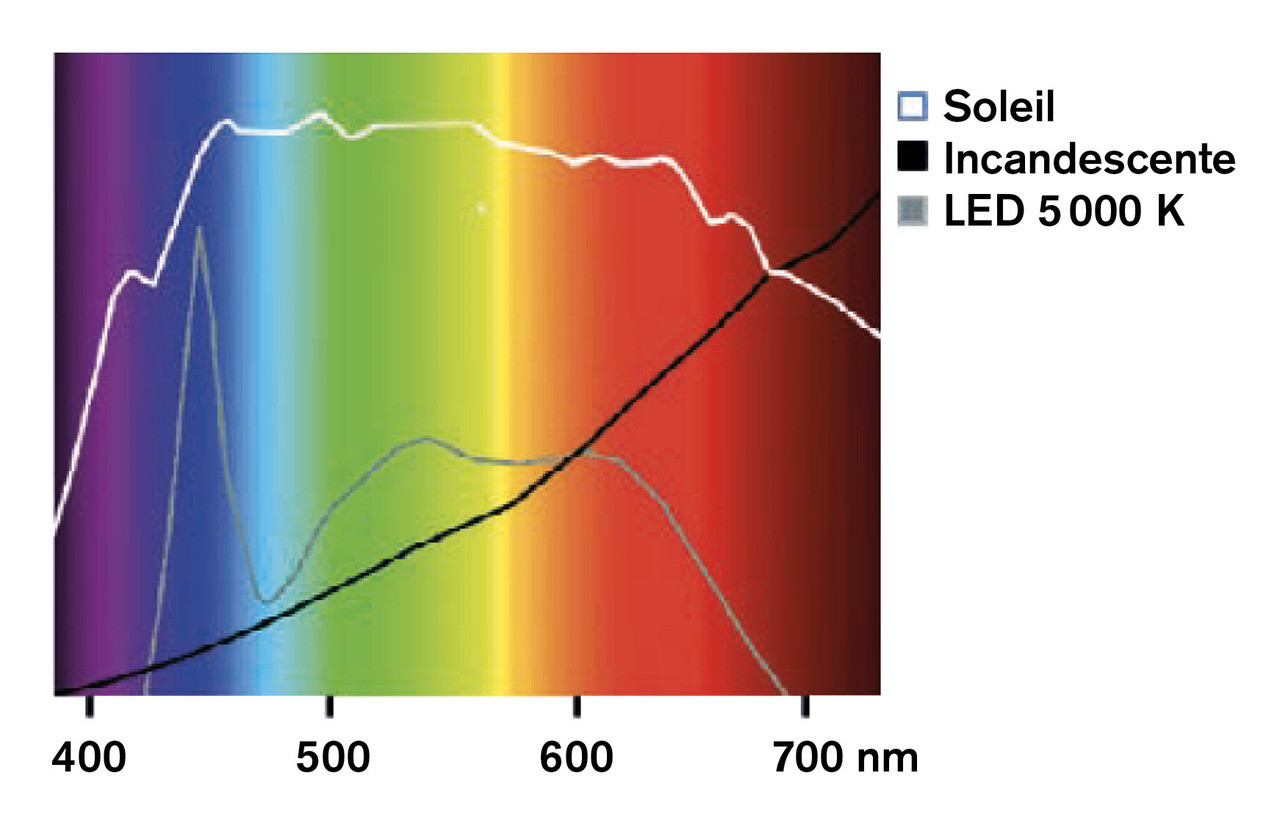
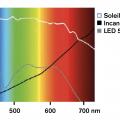
La lumière est l’expression de l’énergie rayonnante des photons. Le spectre visible par l’œil humain s’étend entre les longueurs d’onde 380 et 700 nm (fig. 2 ). En deçà se situent les courtes longueurs d’onde des rayonnements ultraviolets, dont on connaît la nocivité pour l’œil et la peau, puis les radiations ionisantes, aux effets mutagènes. Au-delà, les chaudes longueurs d’onde de l’infrarouge sont suivies par les micro-ondes, puis les ondes radio.
Depuis l’aube des temps, la rétine humaine s’est adaptée successivement à la lumière naturelle du soleil, pendant des millénaires à la lumière dansante du feu et vacillante d’une bougie, puis à la fin du XIXe siècle à l’ampoule électrique à incandescence, véritable révolution de l’éclairage (Thomas Edison, 1878). Elle est maintenant exposée à de nouvelles sources de lumière artificielle, les diodes électroluminescentes (LED)**.
Ces diodes sont des dispositifs semi-conducteurs qui émettent une lumière monochromatique incohérente lorsqu’elles sont parcourues par un courant électrique. Ce ne sont donc pas des lasers (dont la lumière, également monochromatique, est cohérente, c’est-à-dire dont les photons sont en phase). Selon le composé utilisé, ces diodes peuvent émettre dans l’ultraviolet, l’infrarouge ou le spectre visible, entre 380 et 700 nm.
L’atout majeur de la technologie LED réside dans son efficacité énergétique. Les ampoules à incandescence dispersent en chaleur 90 % de leur énergie et les tubes fluorescents 40 %, mais une LED seulement 15 %. Les LED sont 1 000 fois plus lumineuses que les lampes à incandescence et ont une durée de vie moyenne de l’ordre de 50 000 heures. Comment résister à de tels avantages ?
Cependant, elles font naître des préoccupations, pour deux raisons : leur présence ubiquitaire et leur composition spectrale. En effet, la plupart des LED commercialisées diffusent une lumière blanche en utilisant une LED bleue (bande spectrale entre 380 et 500 nm), avec un pic de lumière bleu-violet entre 415 et 455 nm, pro-che du rayonnement ultraviolet, dont le risque phototoxique est maximal pour la rétine.2
Depuis l’aube des temps, la rétine humaine s’est adaptée successivement à la lumière naturelle du soleil, pendant des millénaires à la lumière dansante du feu et vacillante d’une bougie, puis à la fin du XIXe siècle à l’ampoule électrique à incandescence, véritable révolution de l’éclairage (Thomas Edison, 1878). Elle est maintenant exposée à de nouvelles sources de lumière artificielle, les diodes électroluminescentes (LED)**.
Ces diodes sont des dispositifs semi-conducteurs qui émettent une lumière monochromatique incohérente lorsqu’elles sont parcourues par un courant électrique. Ce ne sont donc pas des lasers (dont la lumière, également monochromatique, est cohérente, c’est-à-dire dont les photons sont en phase). Selon le composé utilisé, ces diodes peuvent émettre dans l’ultraviolet, l’infrarouge ou le spectre visible, entre 380 et 700 nm.
L’atout majeur de la technologie LED réside dans son efficacité énergétique. Les ampoules à incandescence dispersent en chaleur 90 % de leur énergie et les tubes fluorescents 40 %, mais une LED seulement 15 %. Les LED sont 1 000 fois plus lumineuses que les lampes à incandescence et ont une durée de vie moyenne de l’ordre de 50 000 heures. Comment résister à de tels avantages ?
Cependant, elles font naître des préoccupations, pour deux raisons : leur présence ubiquitaire et leur composition spectrale. En effet, la plupart des LED commercialisées diffusent une lumière blanche en utilisant une LED bleue (bande spectrale entre 380 et 500 nm), avec un pic de lumière bleu-violet entre 415 et 455 nm, pro-che du rayonnement ultraviolet, dont le risque phototoxique est maximal pour la rétine.2
LED ubiquitaires et pollution lumineuse
La pollution lumineuse naît de cette débauche de lumière émise de façon ubiquitaire par les LED à laquelle les yeux sont maintenant exposés, de jour comme de nuit, par les enseignes lumineuses criardes, l’éclairage urbain permanent, les phares automobiles éblouissants, les écrans, de télévision, d’ordinateurs, de tablettes, et surtout de téléphones portables. Initialement destiné au sens de l’audition, l’usage de ces derniers est devenu presque exclusivement visuel. L’énergie diminuant avec le carré de la distance, les yeux sont particulièrement exposés à leur rayonnement du fait de l’étroitesse de leur écran qui impose une lecture en vision de près.
Chez l’enfant, leur nocivité est aggravée par la parfaite transparence du cristallin (qui ne filtre donc pas la lumière) et, a fortiori, par un usage nocturne inapproprié, qui inhibe la régénération physiologique des pigments rétiniens.
Par ailleurs, cette vision rapprochée, qui sollicite exagérément l’accommodation de l’enfant, est considérée comme un des facteurs responsables de l’augmentation de la prévalence de la myopie, observée mondialement.
Deux ordres de conséquence néfastes résultent de cette pollution lumineuse : la phototoxicité rétinienne et la dérégulation du cycle veille-sommeil.
Chez l’enfant, leur nocivité est aggravée par la parfaite transparence du cristallin (qui ne filtre donc pas la lumière) et, a fortiori, par un usage nocturne inapproprié, qui inhibe la régénération physiologique des pigments rétiniens.
Par ailleurs, cette vision rapprochée, qui sollicite exagérément l’accommodation de l’enfant, est considérée comme un des facteurs responsables de l’augmentation de la prévalence de la myopie, observée mondialement.
Deux ordres de conséquence néfastes résultent de cette pollution lumineuse : la phototoxicité rétinienne et la dérégulation du cycle veille-sommeil.
La rétine en danger
En laboratoire, 2 000 lux délivrés jour et nuit pendant une semaine suffisent à rendre un animal aveugle par photodestruction de sa rétine. Ce fut un des principes du supplice de Regulus.La souche de drosophiles Nina E, mutées dans le gène de la rhodopsine, doit être maintenue dans l’obscurité pour éviter la dégénérescence de leurs omatidies (unités élémentaires formant l'œil composé d’un insecte) à la lumière.
En clinique humaine, la notion d’exposition à un fort ensoleillement, sans protection a souvent été rapportée dans les antécédents de patients atteints de maladies rétiniennes dégénératives.
Le mécanisme de la phototoxicité rétinienne implique la bande bleue (380-500 nm) du spectre visible (400-700 nm), la plus proche du rayonnement ultraviolet, notamment les longueurs d’onde comprises entre 415 et 455 nm.
Il ne s’agit pas d’un phototraumatisme, comme après l’observation imprudente d’une éclipse solaire ou lors de la manipulation accidentelle d’un rayon laser, mais de lésions photochimiques au niveau cellulaire, sous l’effet d’une exposition chronique au polluant lumineux.
Parmi les mécanismes moléculaires invoqués, certains ciblent directement les photorécepteurs,3 d’autres impliquent l’épithélium pigmentaire rétinien, altéré par la libération de radicaux libres oxygénés et surchargé de déchets métaboliques.4 Ce mécanisme serait compatible avec la pathogénie de la DMLA.
En clinique humaine, la notion d’exposition à un fort ensoleillement, sans protection a souvent été rapportée dans les antécédents de patients atteints de maladies rétiniennes dégénératives.
Le mécanisme de la phototoxicité rétinienne implique la bande bleue (380-500 nm) du spectre visible (400-700 nm), la plus proche du rayonnement ultraviolet, notamment les longueurs d’onde comprises entre 415 et 455 nm.
Il ne s’agit pas d’un phototraumatisme, comme après l’observation imprudente d’une éclipse solaire ou lors de la manipulation accidentelle d’un rayon laser, mais de lésions photochimiques au niveau cellulaire, sous l’effet d’une exposition chronique au polluant lumineux.
Parmi les mécanismes moléculaires invoqués, certains ciblent directement les photorécepteurs,3 d’autres impliquent l’épithélium pigmentaire rétinien, altéré par la libération de radicaux libres oxygénés et surchargé de déchets métaboliques.4 Ce mécanisme serait compatible avec la pathogénie de la DMLA.
Un dérèglement du cycle veille-sommeil
Le 16 juillet 1962, le spéléologue français Michel Siffre s’isolait dans le gouffre du Scarasson pour un séjour de deux mois sous terre, sans aucun repère temporel ou information de la surface. Il pouvait néanmoins faire connaître ses heures de repas, de lever et de coucher. Quand il revint à l’air libre, le 14 septembre, il se croyait encore le 20 août 1962 !
Il note à son retour : « Mes camarades de surface ont vite constaté que mon rythme biologique se décalait : je me réveillais et me couchais un peu plus tard chaque jour, jusqu’à ce que mon rythme s’inverse totalement, comme si j’avais franchi à grande vitesse les fuseaux horaires dans le sens est-ouest avant de revenir à la normale, et ainsi de suite. » Il en conclut « Sous terre, sans repères, c’est le cerveau qui créele temps. »5 Cette expérience prouve l’existence dans le cerveau d’une horloge endogène. Cependant, cette horloge n’est pas exacte car elle retarde d’environ une demi-heure chaque jour. En trois semaines, ce décalage transforme une activité diurne en une activité nocturne. La lumière intervient donc comme un puissant synchroniseur externe.
Ces constats de désynchronisation ont été corroborés par de nombreuses expériences, en isolement temporel dans des abris antiatomiques pendant la guerre froide, et par l’observation des bouleversements du comportement après traitement de la cécité de nouveau-nés et de patients très âgés grabataires. Ces nouveau-nés trop calmes et indifférents à l’entourage, ces vieillards totalement désorientés, somnolents le jour et agités la nuit, récupèrent immédiatement le cycle veille-sommeil normal après chirurgie de la cataracte.
Cette désynchronisation pourrait expliquer les inconforts causés par le décalage horaire.
fig. 3 ). Elle est sous le contrôle de gènes spécifiques.6
« L’univers m’embarrasse, et je ne puis songer que cette horloge existe et n’ait point d’horloger » (Voltaire).
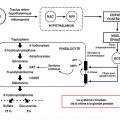
La variabilité individuelle du rythme de l’horloge interne (24 heures ± h) est corrigée par la lumière solaire naturelle, synchroniseur majeur, dont dépend quotidiennement sa remise à l’heure. L’horloge interne reçoit directement de la rétine le signal apporté par la lumière via le tractus rétino-hypothalamique. Dans l’œil, les cellules ganglionnaires rétiniennes intrinsèquement photosensibles (ipRGC) prennent en charge ce signal lumineux grâce à un pigment photosensible, la mélanopsine. Celle-ci contrôle les fonctions non visuelles, comme l’entraînement des rythmes biologiques par la lumière, le cycle veille-sommeil, la vigilance et la constriction pupillaire. Ce photopigment est un OPN-4 photorécepteur particulièrement sensible à la « bande bleue » (380-500 nm) du spectre lumineux (OPN-4 : gène humain de la mélanopsine).
Un organisme est synchronisé lorsque son horloge interne fonctionne en résonance avec les facteurs de l’environnement. Parmi les nombreuses causes de désynchronisation figurent la cécité, les troubles circadiens du sommeil, l’éclairage domestique, l’abus d’alcool ou la prise de certains médicaments.
Le déplacement de phase des rythmes circadiens dépend des heures d’exposition à la lumière : avance de phase le matin, retard de phase en soirée. Dans diverses situations de désynchronisation, comme les troubles du sommeil avec avance ou retard de phase, les protocoles de remise à l’heure de l’horloge se fondent sur cette courbe de réponse de phase. L’exposition des patients à la lumière à des heures adéquates permet de régler l’horloge.
Enfin, les animaux, qu’ils soient proies ou prédateurs nocturnes, sont évidemment perturbés par la diminution des périodes d’obscurité. On a également constaté que le raccourcissement de quatre heures de nuit perturbe la nutrition du chat, le rendant obèse et diabétique.9
La Health Behaviour in School-Aged Children (HBSC) est une enquête internationale de l’Organisation mondiale de la santé (OMS) portant sur des élèves âgés de 11 à 15 ans, réalisée tous les quatre ans dans 41 pays, sur la santé et le vécu scolaire (https://www.ofdt.fr/enquetes-et-dispositifs/hbsc/). En 2014, les adolescents avaient perdu 50 minutes de sommeil au cours des vingt dernières années, 30 % d’entre eux étaient en dette de sommeil, 12 % souffraient d’insomnie chronique, 17 % étaient insatisfaits de leur sommeil. Alors que les besoins en sommeil de l’adolescent se situent aux environs de 9 heures par nuit, 25 % d’entre eux ne dorment que 7 à 8 heures en période scolaire. Les désordres liés à la privation de sommeil sont les mêmes que chez l’adulte, avec en particulier chez l’adolescent une somnolence diurne et l’altération des capacités d’apprentissage. Même la faible intensité lumineuse des LED des écrans est active sur l’horloge, et entraîne un retard de phase.
La baisse des performances scolaires et le repli sur soi de l’adolescent sont deux signaux essentiels qui doivent alerter l’entourage. Il faut souligner que récupérer du sommeil le week-end n’est pas une bonne idée. En réalité, cela ne fait que conforter la désynchronisation.
L’assujettissement à internet ou aux jeux vidéo est un phénomène mondial.10 Près de 50 % des adolescents jouent plus de 3 heures par semaine aux jeux vidéo. Certains auteurs considèrent que 1 à 5 % des adolescents ont une dépendance à ces jeux et 12 % un usage abusif d’internet. Les jeux de rôle en ligne avec plusieurs joueurs comportent le risque de dépendance le plus élevé chez les utilisateurs à risque. L’OMS a reconnu en 2019 une forme d’addiction aux écrans sous le terme de « trouble du jeu vidéo ».
De plus, l’utilisation des écrans (plus de 2 heures chaque jour) par les enfants favorise le développement de la myopie par privation de lumière naturelle et sollicitation permanente de l’accommodation par la vision rapprochée.
Il note à son retour : « Mes camarades de surface ont vite constaté que mon rythme biologique se décalait : je me réveillais et me couchais un peu plus tard chaque jour, jusqu’à ce que mon rythme s’inverse totalement, comme si j’avais franchi à grande vitesse les fuseaux horaires dans le sens est-ouest avant de revenir à la normale, et ainsi de suite. » Il en conclut « Sous terre, sans repères, c’est le cerveau qui créele temps. »5 Cette expérience prouve l’existence dans le cerveau d’une horloge endogène. Cependant, cette horloge n’est pas exacte car elle retarde d’environ une demi-heure chaque jour. En trois semaines, ce décalage transforme une activité diurne en une activité nocturne. La lumière intervient donc comme un puissant synchroniseur externe.
Ces constats de désynchronisation ont été corroborés par de nombreuses expériences, en isolement temporel dans des abris antiatomiques pendant la guerre froide, et par l’observation des bouleversements du comportement après traitement de la cécité de nouveau-nés et de patients très âgés grabataires. Ces nouveau-nés trop calmes et indifférents à l’entourage, ces vieillards totalement désorientés, somnolents le jour et agités la nuit, récupèrent immédiatement le cycle veille-sommeil normal après chirurgie de la cataracte.
Cette désynchronisation pourrait expliquer les inconforts causés par le décalage horaire.
Comment régler l’horloge ?
On sait que cette horloge interne, appelée oscillateur moléculaire circadien, est localisée dans les noyaux suprachiasmatiques, deux petites structures cérébrales médianes de l’hypothalamus antérieur, constituées chacune d’environ 10 000 neurones (« L’univers m’embarrasse, et je ne puis songer que cette horloge existe et n’ait point d’horloger » (Voltaire).
La variabilité individuelle du rythme de l’horloge interne (24 heures ± h) est corrigée par la lumière solaire naturelle, synchroniseur majeur, dont dépend quotidiennement sa remise à l’heure. L’horloge interne reçoit directement de la rétine le signal apporté par la lumière via le tractus rétino-hypothalamique. Dans l’œil, les cellules ganglionnaires rétiniennes intrinsèquement photosensibles (ipRGC) prennent en charge ce signal lumineux grâce à un pigment photosensible, la mélanopsine. Celle-ci contrôle les fonctions non visuelles, comme l’entraînement des rythmes biologiques par la lumière, le cycle veille-sommeil, la vigilance et la constriction pupillaire. Ce photopigment est un OPN-4 photorécepteur particulièrement sensible à la « bande bleue » (380-500 nm) du spectre lumineux (OPN-4 : gène humain de la mélanopsine).
Un organisme est synchronisé lorsque son horloge interne fonctionne en résonance avec les facteurs de l’environnement. Parmi les nombreuses causes de désynchronisation figurent la cécité, les troubles circadiens du sommeil, l’éclairage domestique, l’abus d’alcool ou la prise de certains médicaments.
Le déplacement de phase des rythmes circadiens dépend des heures d’exposition à la lumière : avance de phase le matin, retard de phase en soirée. Dans diverses situations de désynchronisation, comme les troubles du sommeil avec avance ou retard de phase, les protocoles de remise à l’heure de l’horloge se fondent sur cette courbe de réponse de phase. L’exposition des patients à la lumière à des heures adéquates permet de régler l’horloge.
Des métiers et des âges à risque
L’exposition à la lumière artificielle la nuit (LAN), même de faible intensité, comme celle des écrans, bloque la sécrétion nocturne physiologique de mélatonine, qui interviennent sur le sommeil, et entraîne une désynchronisation du rythme veille-sommeil. Il en résulte des troubles mineurs tels que l’insomnie chronique, la fatigue persistante, les troubles de la mémoire, les troubles de l’humeur, jusqu’à la dépression ou l’agressivité, mais aussi une diminution de la vigilance, qui augmente les risques d’accidents de la route et du travail. Les travailleurs de nuit, nombreux dans l’industrie et dans les métiers de service (transport, santé, police, pompiers...), ainsi que les adolescents, grands utilisateurs d’écrans tard la nuit, y sont particulièrement exposés. De plus, cette désynchronisation augmente le risque cardiovasculaire et, chez la femme, augmente significativement le risque relatif (RR) de cancer du sein lorsqu’elle travaille au moins trois nuits par semaine pendant vingt ans, comme cela a été montré chez des infirmières américaines.7, 8 À l’inverse, une diminution de la prévalence du cancer du sein chez les femmes aveugles a été observée, de sorte que le Centre international de recherche sur le cancer (CIRC) a classé en 2007 le travail de nuit dans le groupe 2A des « cancérogènes probables ».Enfin, les animaux, qu’ils soient proies ou prédateurs nocturnes, sont évidemment perturbés par la diminution des périodes d’obscurité. On a également constaté que le raccourcissement de quatre heures de nuit perturbe la nutrition du chat, le rendant obèse et diabétique.9
Désynchronisation des enfants et adolescents face aux écrans
Le sommeil, élément majeur de la bonne santé physique et mentale de l’enfant, est perturbé chez les adolescents, grands utilisateurs, y compris tard le soir, des écrans. La perte, voire la dette de sommeil et le retard de phase qui en résultent sont responsables des troubles de désynchronisation de l’horloge.7 Une enquête barométrique Ipsos de 2017, intitulée JuniorConnect, a porté sur des enfants et des adolescents en France, interrogés via internet. Elle montre que 81 % des 13-19 ans possèdent un smartphone, et déjà 24 % des 7-12 ans. L’appareil est allumé en permanence chez environ 60 % des adolescents ; 5 à 15 % des enfants se réveillent la nuit pour une activité connectée. Le temps hebdomadaire d’accès à internet atteint 4 h 37 pour les 1-6 ans, 6 h 10 pour les 7-12 ans, et 15 h 11 pour les 13-19 ans (https://www.ipsos.com/fr-fr/junior-connect-2017-les-jeunes-ont-toujours-une-vie-derrière-les-écrans).La Health Behaviour in School-Aged Children (HBSC) est une enquête internationale de l’Organisation mondiale de la santé (OMS) portant sur des élèves âgés de 11 à 15 ans, réalisée tous les quatre ans dans 41 pays, sur la santé et le vécu scolaire (https://www.ofdt.fr/enquetes-et-dispositifs/hbsc/). En 2014, les adolescents avaient perdu 50 minutes de sommeil au cours des vingt dernières années, 30 % d’entre eux étaient en dette de sommeil, 12 % souffraient d’insomnie chronique, 17 % étaient insatisfaits de leur sommeil. Alors que les besoins en sommeil de l’adolescent se situent aux environs de 9 heures par nuit, 25 % d’entre eux ne dorment que 7 à 8 heures en période scolaire. Les désordres liés à la privation de sommeil sont les mêmes que chez l’adulte, avec en particulier chez l’adolescent une somnolence diurne et l’altération des capacités d’apprentissage. Même la faible intensité lumineuse des LED des écrans est active sur l’horloge, et entraîne un retard de phase.
La baisse des performances scolaires et le repli sur soi de l’adolescent sont deux signaux essentiels qui doivent alerter l’entourage. Il faut souligner que récupérer du sommeil le week-end n’est pas une bonne idée. En réalité, cela ne fait que conforter la désynchronisation.
L’assujettissement à internet ou aux jeux vidéo est un phénomène mondial.10 Près de 50 % des adolescents jouent plus de 3 heures par semaine aux jeux vidéo. Certains auteurs considèrent que 1 à 5 % des adolescents ont une dépendance à ces jeux et 12 % un usage abusif d’internet. Les jeux de rôle en ligne avec plusieurs joueurs comportent le risque de dépendance le plus élevé chez les utilisateurs à risque. L’OMS a reconnu en 2019 une forme d’addiction aux écrans sous le terme de « trouble du jeu vidéo ».
De plus, l’utilisation des écrans (plus de 2 heures chaque jour) par les enfants favorise le développement de la myopie par privation de lumière naturelle et sollicitation permanente de l’accommodation par la vision rapprochée.
Une question de mésusage
Du fait d’un mésusage, la bienfaisante lumière peut devenir une redoutable pollueuse.
D’une part, l’exposition à de nouvelles sources lumineuses artificielles comportant une forte émission de lumière bleue dans la bande 380-500 nm, proche du rayonnement ultraviolet, est phototoxique pour la rétine et, en particulier, la macula. Elle constitue ainsi, avec l’âge, le tabac et l’hérédité, un des facteurs de risque de la DMLA. D’autre part, l’usage inapproprié de la lumière, la nuit, empêche la régénération nocturne des pigments visuels, opsine et rhodopsine, consommés le jour par les photorécepteurs pour initier le phénomène de la vision.
Par ailleurs, le système circadien, qui comprend la rétine, l’horloge interne et la mélatonine, est très finement régulé par des gènes d’horloge et par des facteurs de l’environnement, dont le plus important est la lumière. L’organisme est synchronisé lorsque cet ensemble fonctionne de façon harmonieuse. À défaut, des troubles de désynchronisation de l’horloge interne apparaissent : chez l’adulte en travail posté ou de nuit, avec une augmentation du risque de cancer du sein chez les infirmières en travail de nuit sur le long cours ; et chez l’enfant qui, en retardant ses heures de coucher, réduit son temps de sommeil, ce qui aboutit à une dette de sommeil très préjudiciable à sa santé et à la qualité de ses apprentissages scolaires.
D’une part, l’exposition à de nouvelles sources lumineuses artificielles comportant une forte émission de lumière bleue dans la bande 380-500 nm, proche du rayonnement ultraviolet, est phototoxique pour la rétine et, en particulier, la macula. Elle constitue ainsi, avec l’âge, le tabac et l’hérédité, un des facteurs de risque de la DMLA. D’autre part, l’usage inapproprié de la lumière, la nuit, empêche la régénération nocturne des pigments visuels, opsine et rhodopsine, consommés le jour par les photorécepteurs pour initier le phénomène de la vision.
Par ailleurs, le système circadien, qui comprend la rétine, l’horloge interne et la mélatonine, est très finement régulé par des gènes d’horloge et par des facteurs de l’environnement, dont le plus important est la lumière. L’organisme est synchronisé lorsque cet ensemble fonctionne de façon harmonieuse. À défaut, des troubles de désynchronisation de l’horloge interne apparaissent : chez l’adulte en travail posté ou de nuit, avec une augmentation du risque de cancer du sein chez les infirmières en travail de nuit sur le long cours ; et chez l’enfant qui, en retardant ses heures de coucher, réduit son temps de sommeil, ce qui aboutit à une dette de sommeil très préjudiciable à sa santé et à la qualité de ses apprentissages scolaires.
NDLR : * Le travail posté correspond à une organisation du travail dans laquelle plusieurs équipes se relaient successivement aux mêmes postes de travail, selon un roulement prédéfini. La forme la plus connue est le 3 × 8, c’est-à-dire 3 équipes différentes qui se relaient sur le même poste pendant 24 heures.** Voir l’entretien avec Jean Leid. « LED et œil ». La Revue du Praticien Médecine générale 2021;35:378-9.
Encadre
En termes de photoprotection
Seuls les verres teintés jaune-orangé filtrent 30 à 60 % de la bande bleue phototoxique, le bleu étant neutralisé par sa complémentaire jaune. Les verres ophtalmiques traités antibleu réfléchissent les rayons et n’en filtrent que 6 à 12 %.
Outre la prise en charge des facteurs généraux de prédisposition, la photoprotection s’avère d’autant plus cruciale que deux des autres facteurs majeurs de DMLA***, l’âge et l’hérédité, sont inaccessibles à une action préventive ou curative. Cette photoprotection s’adresse aussi aux enfants dont les cristallins sont particulièrement transparents et aux opérés de la cataracte dont les implants n’ont pas le pouvoir de filtration des cristallins d’origine.
NDLR : *** Les causes de la DMLA demeurent en grande partie inconnues. Outre l’âge et la composante héréditaire, fumer augmente de 4 à 6 fois son risque d’apparition et semble accélérer sa progression. Les ultraviolets semblent également accélérer son évolution. L’exposition intense à la lumière du jour, par exemple lors d’une vie professionnelle en extérieur dans une région très ensoleillée, augmente le risque de DMLA. Source : Vidal, mars 2020.
Références
1. Lewy AJ, Wehr TA, Goodwin FK, Newsome DA, Markey SP. Light suppresses melatonin secretion in humans. Science 1980; 210:1267-9.
2. Torriglia A. La toxicité rétinienne des diodes électroluminescentes (light emitting diodes). Bull Acad Natle Med 2018;202(3-4):585-96.
3. Krigel A, Berdugo M, Picard E, Levy-Boukris R, Jaadane I, Jonet L, et al. Light-induced retinal phototoxicity damage using different light sources, protocols and rat strains reveals LED phototoxicity. Neuroscience 2016;339:296-307.
4. Moon J, Yun J, Yoon YD, Park SI, Seo YJ, Park WS, et al. Blue light effect on retinal pigment epithelial cells by display devices. Integr Biol 2017;9:436-43.
5. Oléron G, Fraisse P, Siffre M, Zuili N. Les variations circadiennes du temps de réaction et du tempo spontané au cours d’une expérience “hors du temps”. PUF, 1970 ; vol. 70, L’année psychologique ; p. 347-56.
6. Dufier JL, Kaplan J. Œil et génétique. Paris : Masson ; 2005.
7. Touitou Y, Point S. Effects and mechanisms of action of light-emitting diodes on the human retina and internal clock. Environ Res 2020;190:109942.
8. Schernhammer ES, Laden F, Speizer FE, Willett WC, Hunter DJ, Kawachi I, et al. Rotating night shifts and risk of breast cancer in women participating in the Nurse Health Study. J Natl Cancer Inst 2001;93:1563-8.
9. Rosolen SG, Berdugo M. Phototoxicité rétinienne et pollution lumineuse : intérêts et apports de l’ophtalmologie vétérinaire. Bull Acad Vet France 2019;172:1-21.
10. Sussman CJ, Harper JM, Stahl JL, Weigle P. Internet and video game addictions: diagnosis, epidemiology, and neurobiology. Child Adolesc Psychiatric Clin N Am 2018;27:307-26.
2. Torriglia A. La toxicité rétinienne des diodes électroluminescentes (light emitting diodes). Bull Acad Natle Med 2018;202(3-4):585-96.
3. Krigel A, Berdugo M, Picard E, Levy-Boukris R, Jaadane I, Jonet L, et al. Light-induced retinal phototoxicity damage using different light sources, protocols and rat strains reveals LED phototoxicity. Neuroscience 2016;339:296-307.
4. Moon J, Yun J, Yoon YD, Park SI, Seo YJ, Park WS, et al. Blue light effect on retinal pigment epithelial cells by display devices. Integr Biol 2017;9:436-43.
5. Oléron G, Fraisse P, Siffre M, Zuili N. Les variations circadiennes du temps de réaction et du tempo spontané au cours d’une expérience “hors du temps”. PUF, 1970 ; vol. 70, L’année psychologique ; p. 347-56.
6. Dufier JL, Kaplan J. Œil et génétique. Paris : Masson ; 2005.
7. Touitou Y, Point S. Effects and mechanisms of action of light-emitting diodes on the human retina and internal clock. Environ Res 2020;190:109942.
8. Schernhammer ES, Laden F, Speizer FE, Willett WC, Hunter DJ, Kawachi I, et al. Rotating night shifts and risk of breast cancer in women participating in the Nurse Health Study. J Natl Cancer Inst 2001;93:1563-8.
9. Rosolen SG, Berdugo M. Phototoxicité rétinienne et pollution lumineuse : intérêts et apports de l’ophtalmologie vétérinaire. Bull Acad Vet France 2019;172:1-21.
10. Sussman CJ, Harper JM, Stahl JL, Weigle P. Internet and video game addictions: diagnosis, epidemiology, and neurobiology. Child Adolesc Psychiatric Clin N Am 2018;27:307-26.

 Encadrés
Encadrés