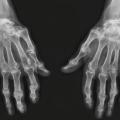
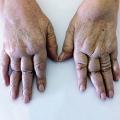
Connaître les principes de la prise en charge pharmacologique et non pharmacologique.
Aspects épidémiologiques
Physiopathologie simplifiée de la polyarthrite rhumatoïde
Différents facteurs favorisent le déclenchement de la polyarthrite rhumatoïde. Il existe, tout d’abord, des terrains génétiques prédisposants. Des polymorphismes de plusieurs gènes, notamment ceux codant pour le HLA-DR, ont été retrouvés associés au risque de survenue de la maladie. Il existe ensuite des facteurs environnementaux : le tabagisme et certaines infections favorisent la survenue de la maladie, par leur capacité à induire une citrullination des peptides. Il existe enfin une influence de facteurs hormonaux, ce qui explique en partie le sex-ratio de la maladie.
La présence d’une quantité importante de peptides citrullinés entraîne, sur un terrain favorable, le déclenchement d’une réponse immunitaire innée et adaptative incontrôlée. Cette réponse se traduit en premier lieu par une réaction inflammatoire exagérée au niveau de la membrane synoviale, marquant le début de la polyarthrite rhumatoïde. La synoviale rhumatoïde est alors infiltrée par de nombreuses cellules du système immunitaire, incluant des macrophages, des lymphocytes T CD4 + et des lymphocytes B. Ces cellules entretiennent une inflammation de la synoviale (synovite), via différents mécanismes incluant la sécrétion de cytokines pro-inflammatoires telles que le TNFα, l’IL-6 et l’IL-1. La sécrétion chronique de ces cytokines est à l’origine des dégâts ostéo-articulaires.
Il s’agit donc d’une pathologie multifactorielle dépendant de facteurs génétiques mais également environnementaux intriqués et encore incomplètement élucidés.
Polyarthrite rhumatoïde débutante
Différents modes de présentation
Cette présentation « classique » est de loin la plus fréquente mais ne doit pas occulter les autres modes de révélation possibles. La polyarthrite rhumatoïde peut toucher l’ensemble des articulations, épargnant cependant toujours le rachis dorsolombaire, les articulations sacro-iliaques et, la plupart du temps, les articulations interphalangiennes distales. Ces dernières notions peuvent aider à orienter le diagnostic dans un contexte de rhumatisme inflammatoire débutant.
La polyarthrite rhumatoïde peut prendre la forme d’une polyarthrite aiguë fébrile s’accompagnant d’une altération de l’état général. Dans ce cas, un état septique constitue le principal diagnostic différentiel, qu’il convient d’éliminer en urgence.
Elle peut également se présenter sous la forme initiale d’un rhumatisme inflammatoire touchant les ceintures (atteinte rhizomélique). Ce mode de début est plus fréquent chez le sujet âgé et peut mimer une pseudopolyarthrite rhizomélique (PPR), dont la stratégie de prise en charge est différente. En pratique, ce sont principalement le bilan immunitaire, les radiographies, l’échographie et surtout l’évolution dans le temps qui permettent de redresser le diagnostic.
La polyarthrite rhumatoïde peut aussi prendre la forme initiale d’un rhumatisme palindromique, caractérisé par la survenue d’accès généralement mono-articulaires, très inflammatoires, d’évolution spontanément régressive en quelques jours, mais récidivants.
La polyarthrite rhumatoïde peut aussi se traduire à la phase de début par de simples polyarthralgies sans signes objectifs. Enfin, elle peut prendre la forme initiale d’une mono-arthrite, d’une oligo-arthrite ou d’une ténosynovite isolée.
Bilan biologique et analyse du liquide synovial
Le bilan immunitaire retrouve la présence de facteur rhumatoïde dans environ 60 % des cas. Celui-ci correspond à une immunoglobuline possédant une activité anticorps dirigée contre les immunoglobulines G. Il est le plus souvent d’isotype IgM et doit être recherché par technique ELISA ou néphélométrique. Il a une spécificité de 75 à 85 % pour la polyarthrite rhumatoïde et peut se rencontrer dans d’autres affections auto-immunes, dans certaines infections et de manière aspécifique chez les sujets âgés ou dans le contexte du tabagisme. Les anticorps antipeptides citrullinés, recherchés par technique ELISA, sont retrouvés dans 60 à 70 % des cas de polyarthrite rhumatoïde débutante. Leur spécificité est forte, proche de 95 %. On sait désormais qu’ils précédent, souvent de nombreuses années, l’entrée dans la phase clinique de la maladie. Dans 15 à 30 % des cas, on retrouve la présence d’anticorps antinucléaires (AAN), à titre faible, qui n’a pas de valeur diagnostique. La présence d’anticorps anti-ADN natif ou d’antigènes nucléaires solubles est beaucoup plus rare et doit faire reconsidérer le diagnostic (maladie lupique, syndrome de chevauchement).
L’analyse du liquide synovial, lorsqu’elle est techniquement possible, montre son caractère inflammatoire (leucocytes > 2 000/mm3), avec une formule à prédominance le plus souvent lymphocytaire. L’analyse du liquide de ponction permet d’éliminer une arthrite septique ou une crise de rhumatisme microcristallin.
Bilan radiologique ostéo-articulaire et radiographie thoracique
Le recours à l’échographie des mains et des pieds ou à l'imagerie par résonance magnétique (IRM) pour le diagnostic précoce est séduisant, mais n’est actuellement pas parfaitement codifié. Lors de la phase diagnostique, l’échographie est parfois très utile pour caractériser sémiologiquement des atteintes cliniques frustes ou douteuses. Celle-ci permet en particulier l'identification d’atteintes inflammatoires caractéristiques de la membrane synoviale (en mode B et en mode Doppler), pouvant contribuer à trancher une situation cliniquement peu claire. La radiographie thoracique, systématique, s’assure de l’absence d’arguments en faveur d’un diagnostic différentiel (hémopathie lymphoïde, sarcoïdose) et évalue le terrain avant la mise en route du traitement de fond (recherche de dilatation des bronches souvent associée à la polyarthrite rhumatoide, image de référence avant introduction du méthotrexate).
Diagnostic positif
La démarche diagnostique du clinicien doit comporter trois grandes étapes :
1) identifier un rhumatisme inflammatoire débutant pouvant correspondre à une polyarthrite rhumatoïde ;
2) éliminer un autre rhumatisme inflammatoire ;
3) rechercher des facteurs prédictifs de sévérité (érosion articulaire, syndrome inflammatoire biologique).
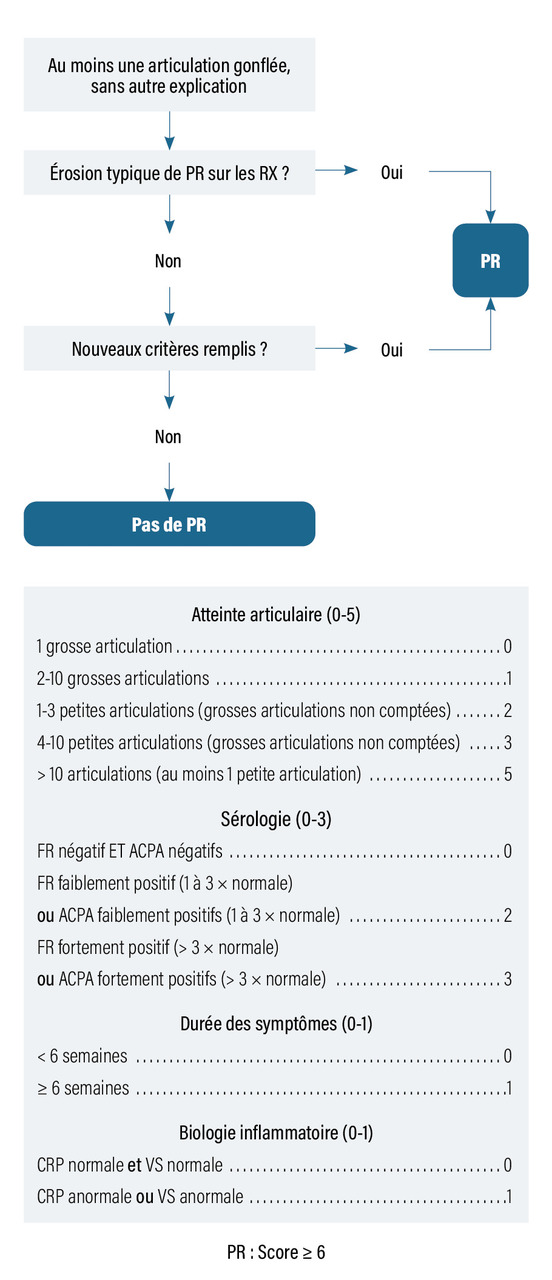
Les critères de classification ACR-EULAR 2010 ont été élaborés dans le but d’aider au diagnostic de polyarthrite rhumatoïde débutante. Ils sont récapitulés, à titre indicatif, dans la
Diagnostics différentiels
Évolution de la polyarthrite rhumatoïde
Manifestations articulaires
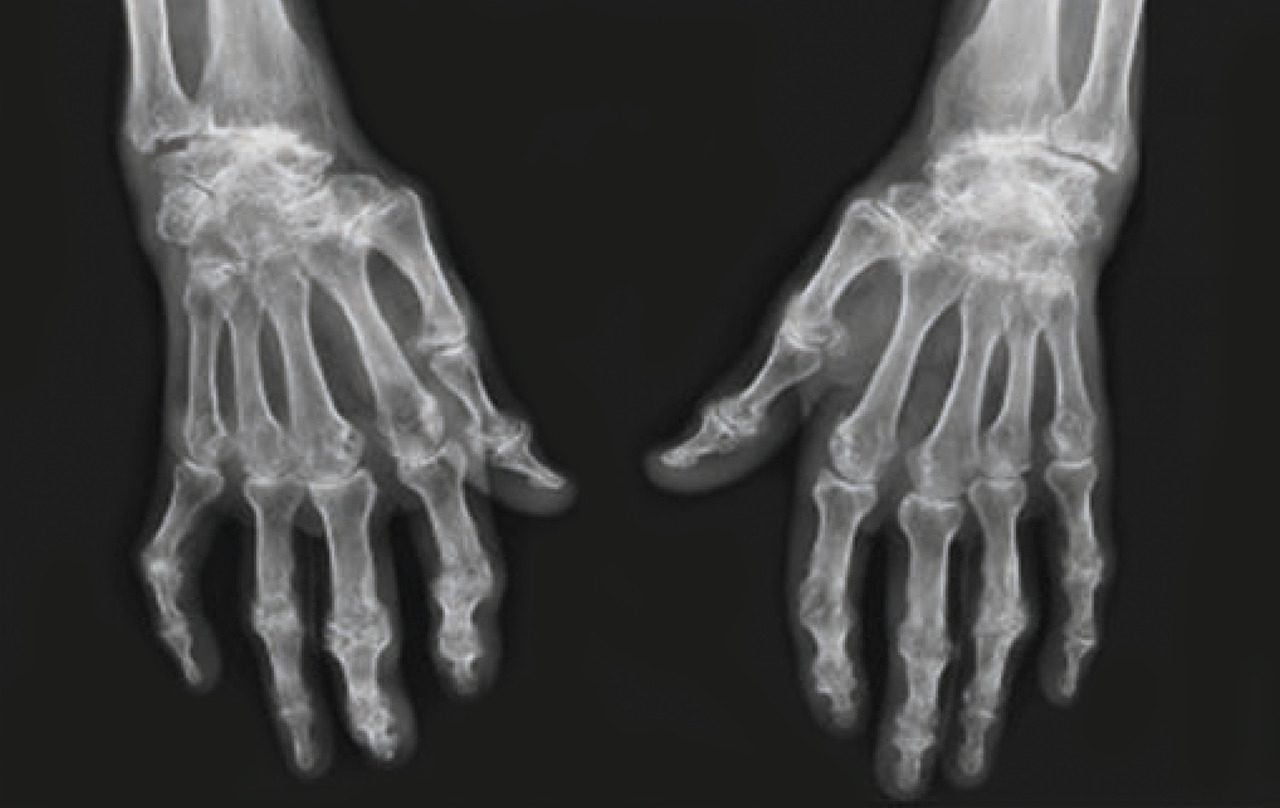
La destruction articulaire est variable d’un patient à l’autre et plus importante au cours des cinq premières années de la maladie. Cependant, chez certains patients, la polyarthrite rhumatoïde n’évolue pas vers une atteinte érosive (polyarthrite rhumatoïde non érosive), alors que d’autres malades ont une atteinte rapidement destructrice. Il est important de savoir reconnaître ces patients, afin d’adapter leurs modalités de traitement et de suivi. Pour cela, différents facteurs prédictifs de la destruction articulaire ont été identifiés (
Parmi les différentes atteintes articulaires de la polyarthrite rhumatoïde à la phase d’état, l’atteinte du rachis cervical doit être connue du fait de sa gravité potentielle. Elle se rencontre dans le cadre de polyarthrites sévères et érosives. Il s’agit le plus souvent d’une arthrite atloïdo-axoïdienne qui peut se traduire par des douleurs cervicales hautes et/ou par une luxation atloïdo-axoïdienne pouvant entraîner une compression médullaire cervicale haute. Le dépistage de l’atteinte cervico-occipitale est nécessaire par une radiographie du rachis cervical de face, bouche ouverte, et de profil avec cliché dynamique à chaque fois qu’il existe une cervicalgie inflammatoire. L’imagerie par résonance magnétique (IRM) peut permettre de préciser les lésions et leur retentissement neurologique.
L’atteinte de la hanche (coxite rhumatoïde) est également à connaître du fait de son important retentissement fonctionnel et de son caractère rebelle aux thérapeutiques locales et générales. Il s’agit d’une atteinte qui reste régulièrement pourvoyeuse de chirurgie malgré les progrès de la stratégie thérapeutique médicamenteuse.
Manifestations extra-articulaires
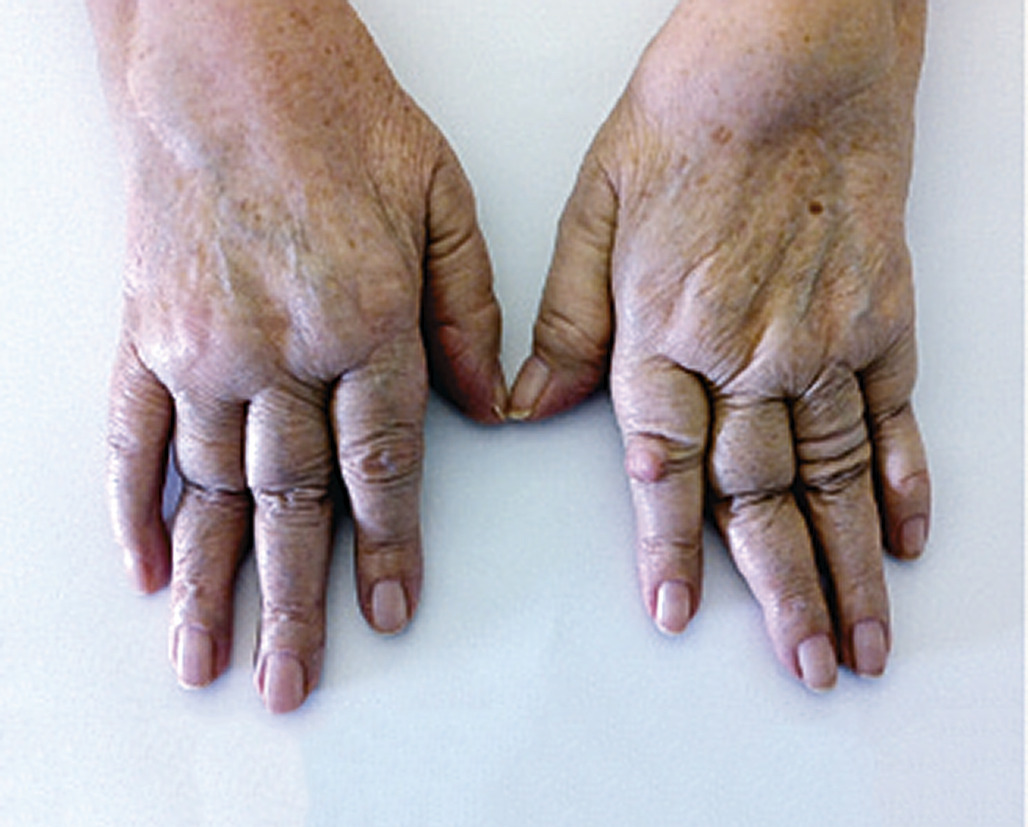
Les nodules rhumatoïdes sont des nodosités sous-cutanées siégeant le plus souvent au niveau des avant-bras, des coudes et des doigts. Ils s’observent chez 10 à 20 % des malades au cours du suivi (
La vascularite rhumatoïde est une complication classique mais rare de la polyarthrite rhumatoïde, liée à des dépôts de complexes immuns dans les parois vasculaires, entraînant principalement des manifestations cutanées mais pouvant être responsables de manifestations viscérales graves nécessitant une thérapeutique intensive.
Un syndrome sec oculaire et buccal dit « secondaire », c’est-à-dire secondaire à la polyarthrite rhumatoïde, est fréquemment décrit chez ces patients. Il est rarement au premier plan et doit être différencié d’un syndrome de Gougerot-Sjögren primitif, associé à la présence d’anticorps anti-SSA et pouvant s’accompagner d’un rhumatisme inflammatoire non destructeur.
De nombreuses autres complications hématologiques, neuromusculaires, pleuropulmonaires, oculaires (sclérite et épisclérite), cardiaques et rénales, plus ou moins spécifiques, sont également possibles. Des adénopathies peuvent accompagner une polyarthrite rhumatoïde active. Il existe également une association fréquente entre la polyarthrite rhumatoïde et la dilatation des bronches. L’amylose AA, favorisée par l’inflammation systémique chronique, est également une complication possible, bien que devenue exceptionnelle. Ces complications étant généralement l’apanage des formes sévères et évoluées de la maladie, elles sont devenues moins fréquentes à mesure que l’arsenal thérapeutique de la polyarthrite rhumatoïde s’est enrichi.
La polyarthrite rhumatoïde est également responsable d’une déminéralisation osseuse précoce, indépendamment du recours à une éventuelle corticothérapie.
Enfin, comme dans d’autres maladies auto-immunes, il existe une augmentation du risque de survenue d’une néoplasie ou d’une hémopathie, notamment de lymphomes malins non hodgkiniens.
Surmortalité au cours de la polyarthrite rhumatoïde
L’augmentation du risque cardiovasculaire est de loin le premier facteur de risque de mortalité chez ces patients. Cela explique que la polyarthrite rhumatoïde soit considérée comme un facteur de risque cardiovasculaire à part entière. Cette notion aide à intégrer l’importance du dépistage et de la prise en charge des autres facteurs de risque cardiovasculaire modifiables au cours de la polyarthrite rhumatoïde.
Suivi du patient au long cours
Grands principes du suivi au long cours
Évaluation standardisée de l’activité de la maladie
Prise en charge thérapeutique
Traitements symptomatiques
Les anti-inflammatoires non stéroïdiens (AINS) sélectifs ou non sélectifs, lorsqu’ils sont tolérés et ne sont pas contre-indiqués, peuvent être suffisants pour soulager les symptômes de la polyarthrite rhumatoïde dans l’attente de l’efficacité du traitement de fond. Leur prescription prolongée doit bien sûr conduire à une surveillance régulière de leur tolérance, principalement digestive, cardiovasculaire et rénale. Contrairement à ce qui est encore parfois enseigné, l’association méthotrexate et AINS n’est pas contre-indiquée, sauf lorsque le méthotrexate est prescrit à de fortes posologies, non rhumatologiques, car il existe alors un risque augmenté de toxicité de ce dernier.
La corticothérapie systémique fait partie de l’arsenal thérapeutique de la polyarthrite rhumatoïde mais est recommandée à des posologies dites faibles, entre 10 et 15 mg/j d’équivalent prednisone. Certaines études suggèrent qu’elle a une efficacité structurale. Son utilisation au long cours est à éviter, en raison de ses nombreux effets indésirables et de l’efficacité des traitements de fond disponibles. Une fois qu’elle a été introduite, il faut avoir pour objectif de diminuer sa posologie puis de l’interrompre le plus rapidement possible, dès que l’efficacité obtenue avec le traitement de fond le permet. En pratique, il semble raisonnable de recourir à la corticothérapie systémique au début de la maladie, afin d’obtenir un soulagement rapide des symptômes, lorsque les autres traitements symptomatiques sont insuffisants pour le faire ou sont contre-indiqués, pour une durée limitée n’excédant pas trois à six mois. Dans les formes sévères de la maladie, le recours à la corticothérapie au long cours est parfois nécessaire pour soulager les patients, en complément des traitements de fond. Lorsqu’une corticothérapie est introduite, il faut avoir pour réflexe de prévenir immédiatement ses effets indésirables, au premier rang desquels la prévention de la déminéralisation osseuse, qui est maximale dans les premiers mois de traitement.
Les infiltrations intra-articulaires de corticoïdes (ou parfois les synoviorthèses), pouvant être réalisées sous contrôle échographique ou radioscopique en fonction de la localisation, sont extrêmement efficaces et sont particulièrement indiquées lorsqu’il existe un nombre limité d’articulations touchées. Elles permettent en effet d’obtenir un soulagement prolongé, dans l’attente de l’efficacité du traitement de fond, tout en diminuant les effets indésirables inhérents à une corticothérapie prolongée par voie systémique.
Les antalgiques classiques font partie de l’arsenal thérapeutique, même si le recours aux morphiniques est assez rare.
Traitements de fond
Traitements de fond synthétiques
Le méthotrexate est le traitement de référence de la polyarthrite rhumatoïde et doit être introduit le plus tôt possible. On parle de traitement pivot dans la prise en charge de la maladie, celui autour duquel l’ensemble de la stratégie thérapeutique s’organise (dans les limites de ses règles de prescription et sous réserve de sa tolérance, bien sûr). Il permet de contrôler l’activité de la maladie chez un grand nombre de patients et de prévenir la destruction articulaire. L’instauration doit être discutée dans tous les cas de polyarthrite rhumatoïde débutante. Son efficacité est décalée de six à huit semaines après sa mise en place. Sa posologie initiale est en général de 10 mg par semaine par voie orale et peut être progressivement augmentée jusqu’à 20-25 mg (0,3 mg/kg) par semaine en fonction de la réponse observée sous traitement. Les principaux problèmes posés par le méthotrexate, qui est un immunosuppresseur, sont sa toxicité digestive, hématologique et hépatique, ainsi que l’immunodépression induite. Ce traitement est tératogène et doit impérativement être stoppé avant une grossesse. La prescription systématique d’acide folique, quarante-huit heures après la prise de méthotrexate, permet de diminuer sa toxicité digestive. Il existe sous forme sous-cutanée, utile chez les patients ne tolérant pas la forme orale, ou lorsqu’il existe une volonté d’optimiser l’efficacité du traitement.Le léflunomide et la sulfasalazine sont des traitements de fond synthétiques qui représentent des alternatives au méthotrexate lorsque celui-ci est contre-indiqué ou mal toléré. Leur efficacité clinique et structurale est globalement moindre que celle du méthotrexate, expliquant leur utilisation en seconde intention.
L’hydroxychloroquine est également parfois utilisée comme traitement de fond de la polyarthrite rhumatoïde. En l’absence d’efficacité structurale démontrée, elle doit cependant être réservée aux formes bénignes et non érosives de la maladie.
Des associations de traitements de fond synthétiques peuvent être proposées, par exemple l’association sulfasalazine + méthotrexate + hydroxychloroquine, qui a une bonne efficacité clinique et structurale mais pose des problèmes de tolérance et d’observance à moyen et long termes.
Traitements de fond biologiques
Les traitements de fond biologiques sont des traitements de seconde intention de la polyarthrite rhumatoïde en cas d’échec des traitements de fond synthétiques. Leur prescription en première intention se discute dans des formes particulièrement sévères de la maladie. Il s’agit de thérapies ciblées visant soit des cytokines, soit des cellules de l’immunité ou des interactions de cellules de l’immunité impliquées dans la physiopathologie de la polyarthrite rhumatoïde. Il s’agit de médicaments d’exception dont la prescription initiale est pour le moment exclusivement hospitalière. La plupart s’utilisent en combinaison avec le méthotrexate.Les anti-TNFα sont les plus utilisés actuellement. Il s’agit d’anticorps monoclonaux et de protéines de fusion ayant en commun d’entraîner une neutralisation du TNFα. Ils permettent le contrôle de l’activité clinique de la maladie et diminuent la progression structurale. Lorsqu’un traitement par anti-TNFα est débuté, le méthotrexate doit être poursuivi à chaque fois que cela est possible, car cette association améliore l’efficacité globale du traitement et diminue le risque d’immunisation contre le biomédicament.
Il existe d’autres classes de biomédicaments qui peuvent également s’utiliser en cas d’échec du méthotrexate ou des anti-TNFα et s’administrent sous forme intraveineuse ou sous-cutanée. Le tocilizumab et le sarilumab ciblent l’interleukine 6 (IL-6), cytokine pro-inflammatoire également impliquée dans la physiopathologie de la polyarthrite rhumatoïde. Ils peuvent être prescrits seuls ou en association au méthotrexate. L’abatacept est un inhibiteur de la costimulation des lymphocytes T. Il est également conseillé de l’associer au méthotrexate lorsque cela est possible. Le rituximab est un anticorps monoclonal visant le CD20, récepteur de surface spécifique de la lignée lymphocytaire B, elle aussi impliquée dans la physiopathologie de la polyarthrite rhumatoïde. Le rituximab a la particularité de pouvoir être administré, au cas par cas, chez les patients ayant des antécédents récents de néoplasie ou d’hémopathie maligne.
Traitements de fond synthétiques ciblés
Les traitements synthétiques ciblés, représentés par différents inhibiteurs de Janus kinase (anti-JAK), constituent la classe thérapeutique ayant le plus récemment renforcé l’arsenal thérapeutique de la polyarthrite rhumatoïde. Ils s’agit de traitements particulièrement efficaces. Leur utilisation est néanmoins associée à un sur-risque d’événements cardiovasculaires, de thrombose et de néoplasies. En conséquence, leurs conditions de prescription sont désormais très encadrées (en particulier chez les patients de plus de 65 ans) et ils doivent n’être envisagés qu’en cas d’échec des autres stratégies thérapeutiques disponibles.Stratégie thérapeutique dans la polyarthrite rhumatoïde
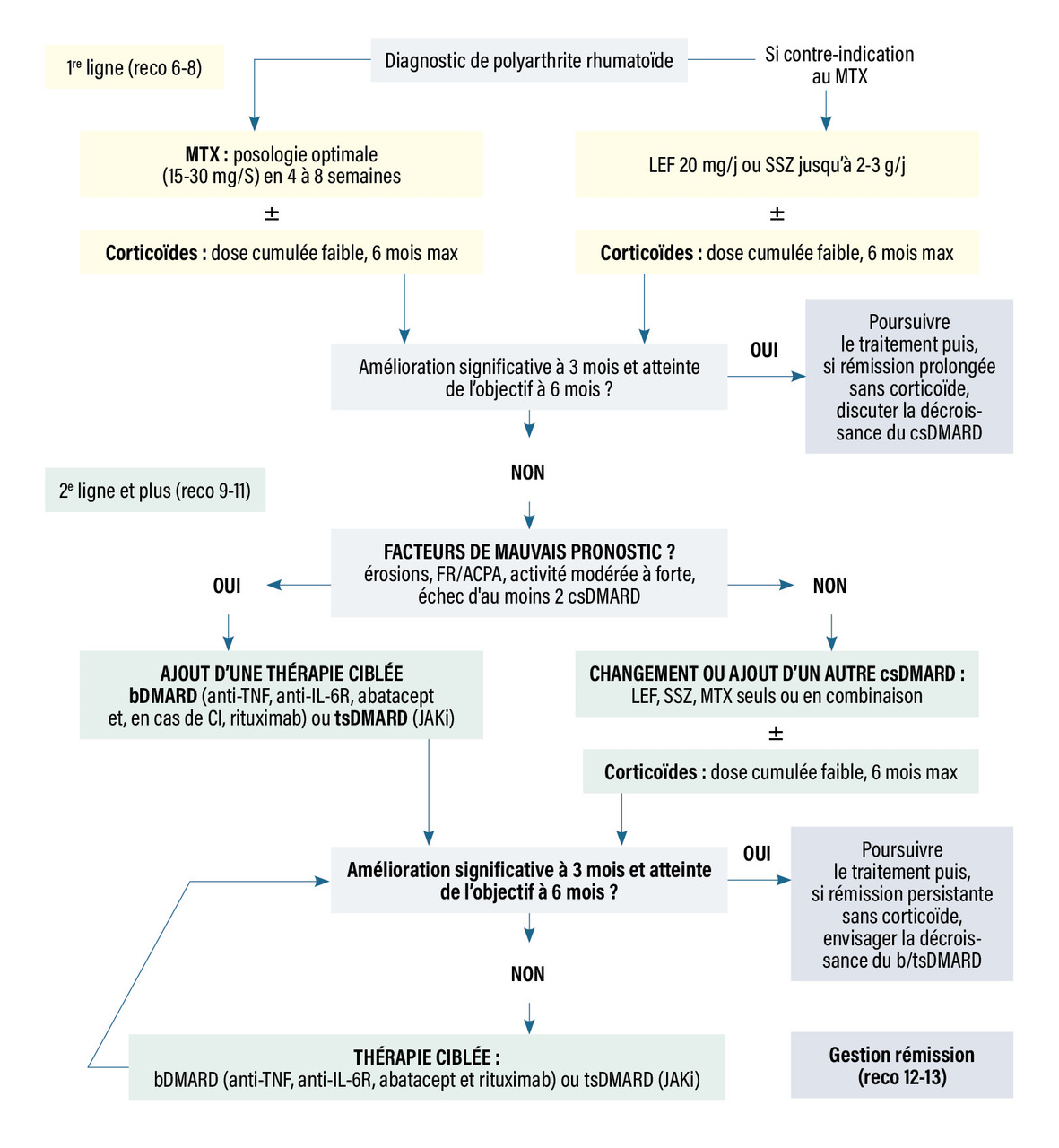
D’après les recommandations de la Société française de rhumatologie pour la prise en charge de la polyarthrite rhumatoïde (2019), l’objectif du traitement est d’atteindre et de maintenir la rémission clinique ou, au minimum, la faible activité pour chaque patient, afin de prévenir la progression structurale et le handicap. La stratégie thérapeutique recommandée pour atteindre cet objectif est résumée dans la
Prise en charge non médicamenteuse
Éducation thérapeutique
L’éducation thérapeutique est primordiale chez les patients traités par immunosuppresseurs classiques ou par thérapies ciblées ; ils doivent être correctement informés sur les situations devant conduire à l’interruption du traitement, à une consultation d’urgence ou à une consultation rapide auprès du médecin généraliste ou du rhumatologue référent.Médecine physique et réadaptation
La physiothérapie antalgique, en particulier par le froid, trouve son indication dans les phases inflammatoires de la maladie, lorsque les thérapeutiques médicamenteuses peinent à soulager le patient. Il en va de même de la prévention des attitudes vicieuses par les attelles de repos. Dans les formes évoluées, une attention particulière est accordée aux préventions des déformations et à l’adaptation du geste, des ustensiles et du domicile par l’ergothérapie. Des semelles orthopédiques ou des chaussures sur mesure sont parfois indispensables, notamment dans les formes avec destruction articulaire sévère.Chirurgie
Depuis l’avènement des thérapies ciblées, les indications chirurgicales sont plus rares. Le remplacement prothétique des grosses articulations se discute dans les atteintes destructrices, dans un but antalgique et/ou de récupération fonctionnelle. Les articulations les plus souvent concernées sont la hanche, le genou et l’épaule. La réalisation d’une arthrodèse permet de soulager et de stabiliser une articulation détruite lorsque le remplacement prothétique est techniquement difficile, comme au poignet, à la cheville et au niveau de l’arrière-pied. Lorsqu’il existe une atteinte évoluée des mains ou des avant-pieds, une prise en charge chirurgicale peut parfois être proposée, consistant le plus souvent en la réalisation de synovectomies et de gestes de réaxation, plus ou moins associés à des remplacements prothétiques. Aux mains, des chirurgies tendineuses peuvent également être proposées dans les atteintes évoluées, dans le but d’améliorer la fonction.Prise en charge médicosociale
La polyarthrite rhumatoïde, dès qu’elle justifie d’un traitement de fond, relève d’une prise en charge à 100 %, au titre d’affection de longue durée exonérante. Les arrêts de travail sont justifiés lors des poussées non contrôlées de la maladie. Dans les formes sévères, le médecin du travail doit être sollicité afin d’envisager des adaptations du poste et/ou un aménagement des horaires de travail. Les formes évoluées peuvent conduire à la reconnaissance de la qualité de travailleur handicapé.Prise en charge psychosociale
Il faut savoir proposer au patient une prise en charge psychosociale. De même, les associations de malades peuvent jouer un rôle bénéfique important.POINTS FORTS À RETENIR
La polyarthrite rhumatoïde est une maladie auto-immune affectant de manière préférentielle la membrane synoviale, conduisant à des destructions articulaires en l’absence de traitement.
Il existe un retentissement systémique de la maladie, et des atteintes extra-articulaires spécifiques sont possibles.
L’objectif du traitement est la rémission clinique ou, au minimum, l’obtention d’un faible niveau d’activité pour chaque patient.
La polyarthrite rhumatoïde doit être considérée comme une « urgence diagnostique ».
Le méthotrexate est le traitement de fond de première intention de la polyarthrite rhumatoïde.
Le méthotrexate et les biomédicaments ont transformé le pronostic à long terme de cette affection.
Polyarthrite rhumatoïde
Du fait de son caractère systémique et des complications liées à ses traitements, la polyarthrite rhumatoïde est un sujet de choix pour la rédaction d’un cas clinique progressif aux EDN. Au cours de notre exposé, nous avons montré comment diagnostiquer une polyarthrite rhumatoïde et éliminer ses principaux diagnostics différentiels, comment évaluer son activité et sa sévérité, et comment conduire le traitement dans ses grandes lignes.
Concernant ces différents points, les pièges principaux d’un dossier peuvent venir de la discussion des diagnostics différentiels selon le mode de présentation et des subtilités de la prise en charge thérapeutique en fonction du terrain. Nous essayons de balayer ici les différents axes que pourrait prendre un dossier transversal sur la polyarthrite rhumatoïde. Nous pensons par ailleurs que cet article didactique aborde (et va parfois au-delà !) les notions importantes de cette maladie, susceptibles de faire l’objet de questions isolées.
Caractère systémique de la polyarthrite rhumatoïde
La polyarthrite rhumatoïde étant un facteur de risque cardiovasculaire indépendant, un sujet ayant pour thème principal la polyarthrite rhumatoïde peut évoluer vers une question de prévention primaire ou secondaire des facteurs de risque. Il convient alors de bien prendre en compte que le contrôle de l’activité de la polyarthrite rhumatoïde fait partie intégrante de cette prise en charge.
La prise en charge de la déminéralisation au cours de la polyarthrite rhumatoïde, traitée ou non par corticoïdes, peut faire l’objet d’une question transversale. Les seuils d’intervention selon le T score, le terrain, les antécédents fracturaires et la dose d’équivalent prednisone reçue doivent être parfaitement connus. La prise en charge d’un événement fracturaire du squelette axial ou périphérique peut également faire l’objet d’une question, éventuellement orientée sur une prise en charge chirurgicale d’une fracture périphérique.
Les atteintes extra-articulaires de la polyarthrite rhumatoïde, telles que la vascularite rhumatoïde, peuvent faire l’objet de questions spécifiques. Il est important de savoir reconnaître ces atteintes et proposer les examens complémentaires adéquats. Les atteintes pulmonaires interstitielles au cours de la polyarthrite rhumatoïde constituent une thématique très active de la recherche clinique (susceptibilité clinique, modalités de prise en charge spécifique). Cela rend probablement plus grande la probabilité d’un sujet transversal abordant des problématiques rhumatismales et pneumologiques.
La survenue d’un épisode infectieux chez un patient présentant une polyarthrite rhumatoïde traitée par méthotrexate et/ou biomédicaments et/ou thérapie ciblée peut faire l’objet de questions transversales. Le méthotrexate et le biomédicament doivent être systématiquement interrompus, et leur reprise à distance de l’épisode infectieux est discutée au cas par cas.
Prise en charge des patients traités par immunomodulateurs
Les décisions de mise en route ou d’interruption d’un traitement de fond par méthotrexate peuvent faire l’objet de questions spécifiques. Pour cela, il est important de connaître les contre-indications (grossesse, allaitement, insuffisance hépatique, insuffisance rénale sévère, insuffisance respiratoire chronique) et les principaux effets indésirables (nausées, vomissements, toux, dyspnée, fièvre, anomalies hépatiques, anomalies hématologiques) de ce traitement. Trois données concernant le méthotrexate et pouvant faire la différence dans un dossier méritent d’être rappelées ici : une contraception efficace chez la femme en âge de procréer est obligatoire, il faut systématiquement coprescrire de l’acide folique, et l’association au triméthoprime-sulfaméthoxazole est strictement contre-indiquée.
Un dossier s’articulant autour d’une polyarthrite rhumatoïde (ou d’une autre affection dysimmunitaire telle qu’une spondylarthrite ankylosante, une entérocolopathie inflammatoire ou un psoriasis) traitée par biomédicament nous semble hautement probable. Nous avons rappelé dans notre exposé la place essentielle de l’éducation thérapeutique ainsi que la nécessité d’interrompre le traitement en cas d’épisode infectieux ou de chirurgie programmée. La survenue d’un événement indésirable grave chez un patient traité par anti-TNFα peut faire l’objet de questions. Il peut s’agir d’un événement auto-immun ou plus probablement d’un événement infectieux. Il faut savoir que toute pneumopathie infectieuse chez un patient sous anti-TNFα justifie la recherche de l’antigénurie légionelle et une imagerie pulmonaire, ainsi que la mise en place d’une antibiothérapie active sur Streptococcus pneumoniae et Legionella pneumophila. Il faut savoir évoquer la possibilité d’une infection opportuniste. On rappelle également ici l’importance des mesures de dépistage des cancers et la nécessité d’interrompre le traitement en cas de découverte d’une néoplasie. Les risques associés à l’utilisation des inhibiteurs de JAK sont, par ailleurs, de mise en évidence assez récente. Encore une fois, ce sujet très actuel peut venir facilement en tête d'un rédacteur !
Les prises en charge orthopédique et de rééducation fonctionnelle des déformations et des atteintes destructrices évoluées peuvent faire l’objet de questions à l'EDN. Ce qu’il faut connaître de ces prises en charge a été détaillé dans l’article. Il s’agit d’un domaine complexe pour lequel il est pertinent de rester très schématique au niveau des EDN.

 Encadrés
Encadrés