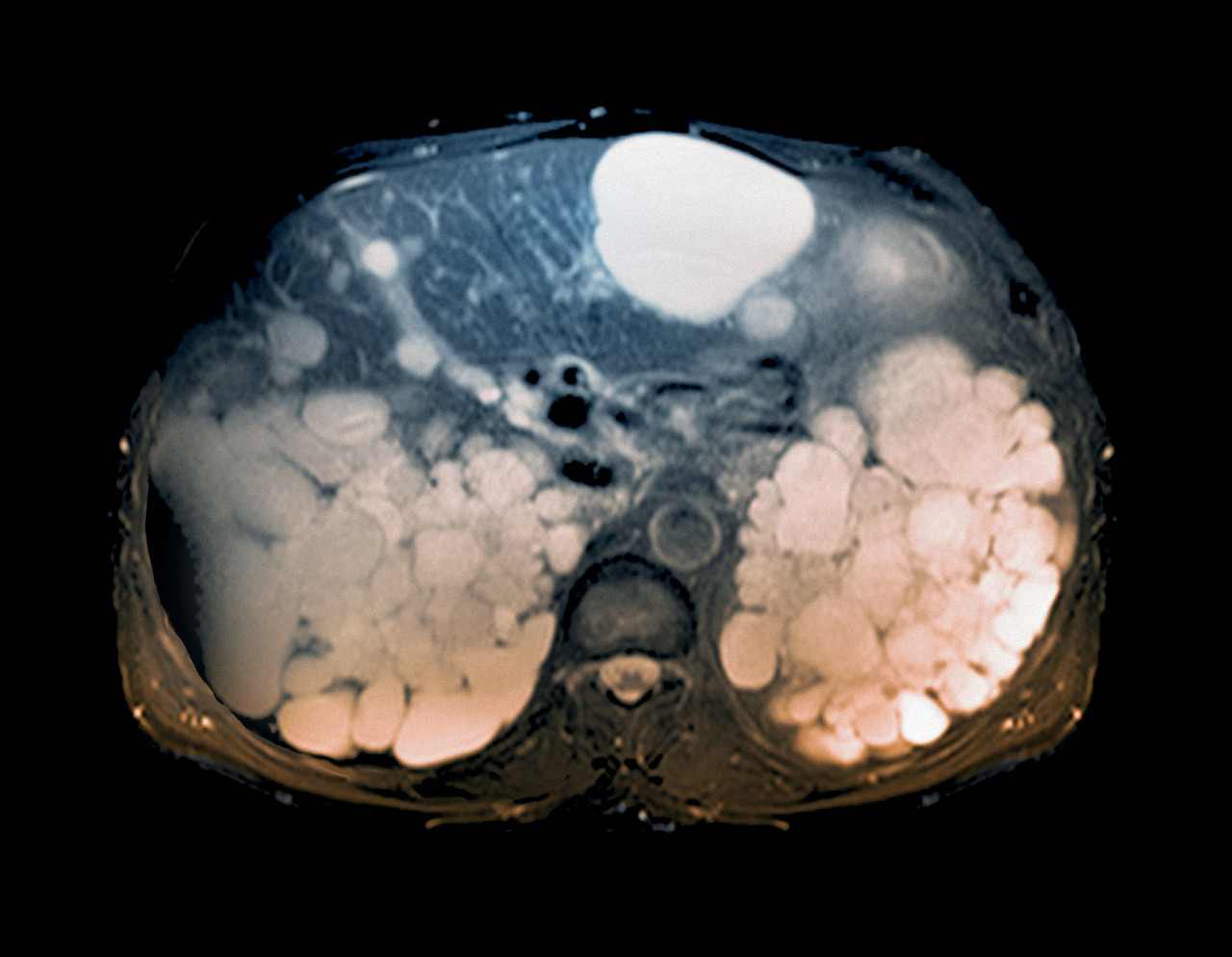
La polykystose rénale autosomique dominante (PKRAD) est la maladie rénale héréditaire la plus fréquente : sa prévalence est estimée autour de 1 pour 2 000 personnes dans le monde. Dans 90 % des cas, elle est liée à des mutations des gènes PKD1 (les plus fréquentes) ou PKD2 (formes moins sévères). Elle se caractérise par le développement progressif de kystes rénaux et une augmentation du volume rénal total (VRT), ce qui entraîne des anomalies de la concentration des urines, une HTA, une polyurie, une nocturie, des douleurs, des lithiases rénales, des épisodes d’hématurie, des infections kystiques et un déclin progressif de la fonction rénale. Elle évolue habituellement vers l’insuffisance rénale chronique terminale (IRCT) : 70 % des patients PKRAD sont dialysés (hémodialyse ou dialyse péritonéale) ou greffés à l’âge de 70 ans.1Jusqu’à récemment, il n’existait pas de traitement spécifique, en dehors de la prise en charge de l’HTA et des consignes hygiénodiététiques : boissons abondantes et bien réparties sur 24 heures, limitation des apports alimentaires sodés (NaCl < 6 g/j) et protéiques (0,8 g/kg/j). Depuis quelques années, de nouvelles molécules sont à l’étude, avec l’objectif de ralentir le développement des kystes et l’évolution de l’insuffisance rénale.
Prendre en charge l’HTA
elle est associée à un volume rénal plus important et à un ris-que d’évolution plus rapide vers l’IRCT et de complications cardiovasculaires. Les recommandations de prévention habituelles – sevrage tabagique, perte de poids si nécessaire, exercice physique, limitation des apports en sel – sont à appliquer.
La pression artérielle (PA) est idéalement mesurée à domicile, en auto- mesure. L’HTA doit être traitée dès son apparition : en 1re intention, on préconise un inhibiteur du système rénine- angiotensine, soit un IEC soit un ARA II, qui a également l’intérêt de diminuer l’albuminurie. Si besoin, une autre classe thérapeutique est associée (diurétique, antagoniste calcique, ß-bloquant) afin d’atteindre les objectifs tensionnels. Selon les recommandations internationales, la cible est ≤ 140/90 mmHg et ≤ 130/90 mmHg en cas d’albuminurie.
La pression artérielle (PA) est idéalement mesurée à domicile, en auto- mesure. L’HTA doit être traitée dès son apparition : en 1re intention, on préconise un inhibiteur du système rénine- angiotensine, soit un IEC soit un ARA II, qui a également l’intérêt de diminuer l’albuminurie. Si besoin, une autre classe thérapeutique est associée (diurétique, antagoniste calcique, ß-bloquant) afin d’atteindre les objectifs tensionnels. Selon les recommandations internationales, la cible est ≤ 140/90 mmHg et ≤ 130/90 mmHg en cas d’albuminurie.
Ralentir la croissance kystique
Parmi les classes pharmacologiques évaluées, seul le tolvaptan (Jinarc, Otsuka Pharmaceutical) a obtenu une AMM européenne dans cette indication. La vasopressine (ADH, hormone antidiurétique) agit sur les récepteurs V2 des tubes collecteurs et contribue – via une production excessive d’AMP cyclique – à la formation et à la croissance des kystes rénaux. Cet antagoniste spécifique du récepteur V2 de la vasopressine empêche la concentration des urines et augmente fortement la diurèse.
Il a fait l’objet de l’étude de phase III TEMPO 3:4, publiée en 2012 ;2 chez 1 445 patients PKRAD jeunes (âge moyen de 39 ans), ayant une fonction rénale conservée (débit de filtration glomérulaire estimé [DFGe] > 60 mL/min/1,73 m2) et un VRT important (> 750 mL), il induisait sur 3 ans un ralentissement signifi- catif de la progression du VRT (de 49 %) et de la baisse du DFGe (26 %) versus placebo. Une diminution des douleurs rénales sévères, des infections urinaires et des épisodes d’hématurie a été également décrite. Toutefois, les effets indésirables étaient importants, liés à l’action aquarétique de la molécule (soif, polyurie, nocturie) ainsi qu’à une toxicité hépatique significative : augmentation des trans- aminases hépatiques (ALAT) > 2,5 fois la limite supérieure de la normale dans 4,9 % des cas (vs 1,2 % sous placebo), résolutive à l’arrêt du traitement. Le taux d’interruption était élevé, de 23 %, principalement en raison de l’effet aquarétique et de la polyurie majeure.
Au vu de ces résultats, les recommandations proposent de limiter le traitement aux patients de moins de 50 ans ayant un DFGe > 45 mL/min/1,73 m2 et à risque de dégradation rapide.3 Ce dernier est estimé via des scores prédictifs validés fondés sur des critères cliniques, génétiques et/ou radiologiques (le modèle de la Mayo Clinic prend en compte le VRT ajusté à l’âge du patient ; le PROPKD des données cliniques et génétiques).
Un autre essai contrôlé randomisé, REPRISE,4 publié fin 2017, a évalué l’effet du tolvaptan chez des patients plus âgés (jusqu’à 65 ans) ayant une fonction rénale plus altérée à l’inclusion (DFGe > 25 mL/min/1,73 m2), traités pendant 1 an.
Les résultats confirment son efficacité dans cette population particulière, au prix d’effets indésirables et d’une toxicité hépatique pouvant conduire à l’arrêt du traitement et nécessitant une surveillance biologique rapprochée. Ainsi, il est possible que les recommandations sur ce médicament évoluent prochainement.
Dans ces 2 études, la réduction de la baisse de DFGe était autour de 1 mL/min/1,73 m2 par an ; cet effet peut paraître modeste, mais il se traduirait par un retard à l’initiation de la dialyse de 1 an tous les 4 ans de traitement.4
La prescription initiale de cette molécule est hospitalière, son renouvellement est réservé aux néphrologues. Elle est administrée de façon fractionnée, 2 fois par jour, en augmentant progressivement sa posologie (la dose peut être réduite en fonction de la tolérance). En raison des altérations fréquentes de la fonction hépatique, un bilan complet est indispensable (transaminases hépatiques, bilirubine) à l’initiation, puis mensuellement pendant 18 mois, et tous les 3 mois par la suite.
D’autres classes thérapeutiques sont actuellement en essai clinique de phase III, dont les analogues de la somatostatine.
Il a fait l’objet de l’étude de phase III TEMPO 3:4, publiée en 2012 ;2 chez 1 445 patients PKRAD jeunes (âge moyen de 39 ans), ayant une fonction rénale conservée (débit de filtration glomérulaire estimé [DFGe] > 60 mL/min/1,73 m2) et un VRT important (> 750 mL), il induisait sur 3 ans un ralentissement signifi- catif de la progression du VRT (de 49 %) et de la baisse du DFGe (26 %) versus placebo. Une diminution des douleurs rénales sévères, des infections urinaires et des épisodes d’hématurie a été également décrite. Toutefois, les effets indésirables étaient importants, liés à l’action aquarétique de la molécule (soif, polyurie, nocturie) ainsi qu’à une toxicité hépatique significative : augmentation des trans- aminases hépatiques (ALAT) > 2,5 fois la limite supérieure de la normale dans 4,9 % des cas (vs 1,2 % sous placebo), résolutive à l’arrêt du traitement. Le taux d’interruption était élevé, de 23 %, principalement en raison de l’effet aquarétique et de la polyurie majeure.
Au vu de ces résultats, les recommandations proposent de limiter le traitement aux patients de moins de 50 ans ayant un DFGe > 45 mL/min/1,73 m2 et à risque de dégradation rapide.3 Ce dernier est estimé via des scores prédictifs validés fondés sur des critères cliniques, génétiques et/ou radiologiques (le modèle de la Mayo Clinic prend en compte le VRT ajusté à l’âge du patient ; le PROPKD des données cliniques et génétiques).
Un autre essai contrôlé randomisé, REPRISE,4 publié fin 2017, a évalué l’effet du tolvaptan chez des patients plus âgés (jusqu’à 65 ans) ayant une fonction rénale plus altérée à l’inclusion (DFGe > 25 mL/min/1,73 m2), traités pendant 1 an.
Les résultats confirment son efficacité dans cette population particulière, au prix d’effets indésirables et d’une toxicité hépatique pouvant conduire à l’arrêt du traitement et nécessitant une surveillance biologique rapprochée. Ainsi, il est possible que les recommandations sur ce médicament évoluent prochainement.
Dans ces 2 études, la réduction de la baisse de DFGe était autour de 1 mL/min/1,73 m2 par an ; cet effet peut paraître modeste, mais il se traduirait par un retard à l’initiation de la dialyse de 1 an tous les 4 ans de traitement.4
La prescription initiale de cette molécule est hospitalière, son renouvellement est réservé aux néphrologues. Elle est administrée de façon fractionnée, 2 fois par jour, en augmentant progressivement sa posologie (la dose peut être réduite en fonction de la tolérance). En raison des altérations fréquentes de la fonction hépatique, un bilan complet est indispensable (transaminases hépatiques, bilirubine) à l’initiation, puis mensuellement pendant 18 mois, et tous les 3 mois par la suite.
D’autres classes thérapeutiques sont actuellement en essai clinique de phase III, dont les analogues de la somatostatine.
Dépister les atteintes extrarénales
Des kystes hépatiques se développent chez plus de 80 % des patients, de façon plus marquée chez les femmes que chez les hommes, surtout après 45 ans (effet probable des hormones féminines).5 Les symptômes les plus fréquents sont liés à la compression des organes de voisinage avec, à l’extrême, des tableaux de cholestase, d’hypertension portale, de compression cave, de dyspnée chronique sur syndrome restrictif liée au volume hépatique. Les kystes se compliquent parfois d’infection ou d’hémorragie. La prise en charge, spécialisée, est décidée au cas par cas.
La prévalence des anévrismes intra- crâniens est 4 à 5 fois plus élevée que dans la population générale. La principale complication est l’hémorragie méningée par rupture d’anévrisme (environ 2 cas/ 1 000 années-patients),6 grevée d’une très lourde morbi-mortalité. Cet accident doit être évoqué devant toute céphalée brutale non migraineuse chez un patient PKRAD. Dans la grande majorité des cas, aucun antécédent familial n’est retrouvé. Le dépistage systématique des anévrismes non rompus est donc recommandé par certains, en vue d’une surveillance étroite ou d’un éventuel traitement prophylactique. Il fait appel à l’angio-IRM cérébrale sans injection de gadolinium (séquence time of flight) qui explore le réseau artériel intracranien de l’artère carotide primitive jusqu’au corps calleux. Une angio-TDM est proposée en 2e intention. En cas de négativité, l’imagerie est réitérée tous les 5 à 10 ans, entre 20 et 55-60 ans.6
La prévalence des anévrismes intra- crâniens est 4 à 5 fois plus élevée que dans la population générale. La principale complication est l’hémorragie méningée par rupture d’anévrisme (environ 2 cas/ 1 000 années-patients),6 grevée d’une très lourde morbi-mortalité. Cet accident doit être évoqué devant toute céphalée brutale non migraineuse chez un patient PKRAD. Dans la grande majorité des cas, aucun antécédent familial n’est retrouvé. Le dépistage systématique des anévrismes non rompus est donc recommandé par certains, en vue d’une surveillance étroite ou d’un éventuel traitement prophylactique. Il fait appel à l’angio-IRM cérébrale sans injection de gadolinium (séquence time of flight) qui explore le réseau artériel intracranien de l’artère carotide primitive jusqu’au corps calleux. Une angio-TDM est proposée en 2e intention. En cas de négativité, l’imagerie est réitérée tous les 5 à 10 ans, entre 20 et 55-60 ans.6
Encadre
Comment fait-on le diagnostic ?
La PKRAD est évoquée le plus souvent chez un adulte jeune, devant une symptomatologie rénale (douleur, hématurie, lithiase, HTA, IR) ou lors de la découverte de kystes rénaux bilatéraux à l’échographie, soit lors d’une enquête familiale, soit de façon fortuite. Pour faire le diagnostic, l’echographie rénale est l’examen de 1re intention. Elle peut être faussement négative jusqu’à 30-40 ans. L’IRM rénale et le dépistage génétique sont parfois proposés. Un patient PKRAD a 50% de risque de transmettre la maladie à son enfant (quel que soit son sexe).
Associations de patients
1. Lanktree MB, Chapman AB. New treatment paradigms for ADPKD: moving towards precision medicine. Nat Rev Nephrol 2017;13:750-68.
2. Torres VE, Chapman AB, Devuyst O, et al.; TEMPO 3:4 Trial Investigators. Tolvaptan in patients with autosomal dominant polycystic kidney disease. N Engl J Med 2012;367:2407-18.
3. Gansevoort RT, Arici M, Benzing T, et al. Recommendations for the use of tolvaptan in autosomal dominant polycystic kidney disease: a position statement on behalf of the ERA-EDTA Working Groups on Inherited Kidney Disorders and European Renal Best Practice. Nephrol Dial Transplant 2016;31:337-48.
4. Torres VE, Chapman AB, Devuyst O, et al.; REPRISE Trial Investigators. Tolvaptan in Later-Stage Autosomal Dominant Polycystic Kidney Disease. N Engl J Med 2017;377:1930-42.
5. Schrier RW, Abebe KZ, Perrone RD, et al.; HALT-PKD Trial Investigators. Blood pressure in early autosomal dominant polycystic kidney disease. N Engl J Med 2014;371:2255-66.
6. Flahault A, Trystram D, Nataf F, et al. Screening for intracranial aneurysms in autosomal dominant polycystic kidney disease is cost-effective. Kidney Int 2018;93:716-26.
PKD France : http://www.polykystose.org/
Renaloo : www.renaloo.com
2. Torres VE, Chapman AB, Devuyst O, et al.; TEMPO 3:4 Trial Investigators. Tolvaptan in patients with autosomal dominant polycystic kidney disease. N Engl J Med 2012;367:2407-18.
3. Gansevoort RT, Arici M, Benzing T, et al. Recommendations for the use of tolvaptan in autosomal dominant polycystic kidney disease: a position statement on behalf of the ERA-EDTA Working Groups on Inherited Kidney Disorders and European Renal Best Practice. Nephrol Dial Transplant 2016;31:337-48.
4. Torres VE, Chapman AB, Devuyst O, et al.; REPRISE Trial Investigators. Tolvaptan in Later-Stage Autosomal Dominant Polycystic Kidney Disease. N Engl J Med 2017;377:1930-42.
5. Schrier RW, Abebe KZ, Perrone RD, et al.; HALT-PKD Trial Investigators. Blood pressure in early autosomal dominant polycystic kidney disease. N Engl J Med 2014;371:2255-66.
6. Flahault A, Trystram D, Nataf F, et al. Screening for intracranial aneurysms in autosomal dominant polycystic kidney disease is cost-effective. Kidney Int 2018;93:716-26.
PKD France : http://www.polykystose.org/
Renaloo : www.renaloo.com

 Encadrés
Encadrés