Le terme « polype de vessie » est une expression impropre généralement utilisée pour décrire les tumeurs n’infiltrant pas le muscle (tumeurs de vessie non invasives du muscle, TVNIM). Il cache en réalité une maladie toujours cancéreuse et parfois grave. La découverte d’un polype de vessie doit conduire à une prise en charge urologique spécialisée.
Modes de découverte principaux : hématurie et signes irritatifs vésicaux
Les tumeurs vésicales sont diagnostiquées dans 80 % des cas sur une hématurie macroscopique. La survenue de ce signe doit toujours conduire à la réalisation d’un bilan rapide, et ce quel que soit l’âge du patient. Dans l’étude IDENTIFY, conduite au Royaume-Uni sur plus de 10 000 patients adressés pour hématurie, le risque d’avoir un cancer de l’appareil urinaire était de 24 % au total. S’agissant spécifiquement du cancer de la vessie, le risque de le retrouver était de 22 % en cas d’hématurie macroscopique versus 5 % en cas d’hématurie microscopique.1 Les principaux facteurs de risque de cancer de la vessie dans cette population étaient le sexe masculin, l’âge et le tabagisme.
Les signes irritatifs vésicaux (pollakiurie, urgenturies, brûlures mictionnelles) sont le deuxième mode de révélation le plus fréquent. La présence de signes urinaires de la phase de stockage, en particulier chez un patient tabagique, doit conduire à la réalisation d’une fibroscopie au moindre doute.
Dans de rares cas, les tumeurs de vessie sont diagnostiquées devant des signes cliniques en rapport avec l’évolution locale de la maladie (douleurs lombaires, insuffisance rénale aiguë obstructive, évolutivité métastatique…).
Quelques rares situations bénignes
Les polypes sont en très grande majorité des cancers de la vessie. Cependant, il existe quelques diagnostics différentiels bénins. Les principaux sont (liste non exhaustive) :
- le lobe médian prostatique, qui est parfois très difficile à différencier d’une tumeur vésicale du col ;
- l’endométriose, qui concerne principalement la femme jeune avec une hématurie macroscopique survenant pendant les règles ;
- la bilharziose ;
- le calcul de vessie, qui est théoriquement facilement identifiable en raison du cône d’ombre postérieur qui le caractérise et de sa mobilité au changement de position ;
- le léiomyome, qui est une tumeur musculaire détrusorienne bénigne rare.
Quels sont les examens d’imagerie indiqués ?
En médecine générale, le polype de vessie est le plus souvent diagnostiqué sur une échographie de l’appareil urinaire, réalisée pour des troubles mictionnels ou une hématurie.
La découverte d’une tumeur de vessie peut parfois être fortuite sur une imagerie en coupe réalisée pour une autre cause, mais cette situation est beaucoup plus rare.
Il convient toujours de s’assurer de la qualité de l’exploration vésicale décrivant le polype ou l’épaississement pariétal vésical. Ainsi, une imagerie vésicale doit toujours être réalisée en réplétion car la paroi vésicale « plisse » et s’épaissit physiologiquement lorsque la vessie est vide, donnant parfois de fausses images alarmantes. En cas de doute, l’imagerie doit être renouvelée la vessie pleine ou en semi-réplétion (au moins 250 mL).
Consensus pour le bilan de première intention
Le bilan urologique de première intention devant une suspicion de tumeur de la vessie comprend une fibroscopie, une cytologie urinaire (frottis urinaire) et un uroscanner.
La fibroscopie est réalisée en consultation d’urologie, sous anesthésie locale (gel de lidocaïne). Elle doit être précédée d’un contrôle de la stérilité des urines par un examen cytobactériologique des urines (ECBU). En cas de colonisation bactérienne, une antibiothérapie est le plus souvent proposée quarante-huit heures avant le geste ; celle-ci doit être adaptée à l’antibiogramme et il faut éviter autant que possible les fluoroquinolones.
La cytologie urinaire (frottis urinaire) est très importante pour sensibiliser la fibroscopie. S’agissant d’un examen anatomopathologique, le délai d’obtention du résultat est souvent de quatre semaines. Il ne faut pas hésiter à la demander dès l’adressage en consultation spécialisée, afin que l’urologue dispose du résultat précocement. Il existe souvent une confusion entre l’ECBU et la cytologie urinaire lors du prélèvement ; l’utilisation du terme « frottis urinaire » permet le plus souvent de clarifier la demande.
L’uroscanner est un scanner abdomino-pelvien avec injection et temps tardif excrétoire à huit minutes. Le risque d’avoir une tumeur synchrone du haut appareil urinaire lors du diagnostic de tumeur de la vessie est de 2 %. Ceci concerne principalement les tumeurs trigonales, multifocales ou de haut grade. L’uroscanner réalise aussi le premier temps du bilan d’extension, qu’il convient de compléter par un scanner thoracique en cas de tumeur invasive du muscle.
Place de l’IRM dans le bilan initial
La place de l’IRM est en cours d’évaluation pour le bilan initial du cancer de la vessie.
Par analogie avec l’IRM prostatique, une équipe italienne a développé un score appelé VIRADS, pour Vesical Imaging-Reporting and Data System.2 Ce score, coté de 1 à 5, établit le risque d’une tumeur vésicale d’être invasive du muscle détrusor.
La réalisation de l’IRM de vessie est technique car, comme déjà évoqué, le remplissage vésical doit être bien contrôlé pour optimiser l’interprétation.
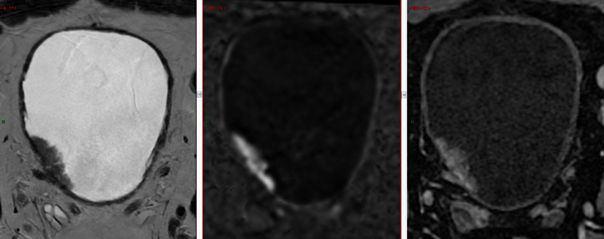
Il s’agit d’une IRM multiparamétrique, comprenant des séquences T2, diffusion et avec injection de gadolinium.
Les informations apportées par cet examen d’imagerie vont bien au-delà de la simple prédiction de l’invasion musculaire puisqu’il précise aussi la taille de la tumeur, sa localisation, la multiplicité éventuelle, les rapports avec les uretères et les organes de voisinage, et réalise enfin la première étape du bilan d’extension – l’IRM étant plus sensible que le scanner pour la détection des petites métastases ganglionnaires (figure).
Les dernières recommandations de l’Association française d’urologie (AFU), datant de 2022, proposent de réaliser une IRM vésicale multiparamétrique avant toute résection de tumeur de vessie à condition que les délais d’obtention de l’examen ne retardent pas la prise en charge du patient.3
Résection transurétrale indispensable pour la suite de la prise en charge
Une fois la tumeur vésicale confirmée par la fibroscopie, une résection transurétrale de vessie (RTUV) est organisée.
Cette étape indispensable de la prise en charge doit répondre à un cahier des charges précis :
- être réalisée dans des délais courts (4 semaines au maximum). En cas de tumeur de vessie invasive du muscle, un intervalle maximal de trois mois doit être respecté entre le début de la prise en charge diagnostique et le traitement curatif (chimiothérapie néoadjuvante ou traitement local radical) ;
- être complète, c’est-à-dire réaliser l’exérèse de toute la tumeur jusqu’au muscle. La présence de muscle sur l’examen anatomopathologique est un critère de qualité significativement associé à l’expérience de l’opérateur, à la qualité de la résection et au risque de récidive.4 Le caractère complet de la résection conditionne le pronostic des patients, quel que soit le degré d’infiltration en profondeur. En aucun cas, il ne doit être réalisé qu’une simple biopsie ;
- être suivie d’une deuxième résection dite de « second look » en cas de tumeur de stade T1. En effet, le risque de tumeur résiduelle après résection première d’une tumeur de stade T1 est de 50 %, même si la première résection est jugée complète.5 Par ailleurs, le risque de retrouver finalement une tumeur invasive du muscle est de 10 %. Cette deuxième résection doit avoir lieu au plus tard six semaines après la première RTUV.
Classification anatomopathologique et disparité pronostique
L’essentiel des cancers de la vessie sont des carcinomes urothéliaux développés aux dépens de l’urothélium de revêtement de la paroi vésicale. Les tumeurs de la vessie sont réparties en deux groupes selon l’examen anatomopathologique de la pièce de RTUV : les tumeurs de vessie non invasives du muscle (TVNIM ; Ta ou T1) et les tumeurs de vessie invasives du muscle (TVIM ; T2 ou plus) [tableau 1].
Le franchissement du chorion pour envahir le muscle détrusor est un critère pronostique majeur : le risque d’évolutivité métastatique d’une TVIM localisée est de 50 % à cinq ans alors qu’il est inférieur à 10 % pour une TVNIM.
Pour autant, il existe également d’énormes disparités pronostiques au sein des TVNIM. Afin d’adapter les traitements à cette réalité pronostique, les TVNIM sont elles-mêmes sous-stratifiées en tumeurs à bas risque, risque intermédiaire et haut risque (exemple de la classification des recommandations de l’AFU) :6,7
- bas risque : première tumeur Ta, de bas grade, unifocale, taille < 3 cm ;
- risque intermédiaire : Ta de bas grade, récidivante, multifocale ou taille > 3 cm ;
- haut risque : tous les T1, tous les hauts grades et toutes les tumeurs associées à un carcinome in situ (CIS) ;
- très haut risque : tumeurs de haut risque combinant des critères de mauvais pronostic, comme le CIS, la multifocalité, la taille supérieure à 3 cm, les emboles vasculaires. Il semble par ailleurs que l’âge supérieur à 70 ans soit fortement associé à un pronostic péjoratif en cas de tumeur de vessie agressive, conduisant les recommandations européennes à intégrer l’âge comme un critère majeur à prendre en compte dans la décision thérapeutique, au-delà des considérations purement gériatriques.8
En prenant en compte la classification la plus récente de l’European Association of Urology (EAU), le risque de progression à cinq ans d’une TVNIM vers une tumeur infiltrante ou vers une maladie métastatique varie de moins de 1 % pour les tumeurs à bas risque à 40 % pour les tumeurs à très haut risque, rapprochant ces dernières du pronostic des TVIM (tableau 2).8
Prise en charge thérapeutique et modalités de surveillance
La stratégie thérapeutique des TVNIM est conditionnée par le groupe de risque.
Les TVNIM sont traitées par résection transurétrale de la tumeur avec ou sans instillations endovésicales de mitomycine C ou de bacille de Calmette et Guérin (BCG).9
Dans certains cas exceptionnels de TVNIM à très haut risque, une cystectomie d’emblée peut être envisagée.
Les recommandations de traitement des TVNIM en fonction des groupes de risque sont résumées dans le tableau 3.
Après RTUV, le traitement dépend du groupe de risque
La diversité pronostique des TVNIM est un élément parfois difficile à expliquer au patient. Les tumeurs Ta de bas grade, type histologique le plus fréquent, ont un risque de progression et de dissémination métastatique quasi nul. A contrario, les tumeurs de stade T1, quasi exclusivement de haut grade, ont un risque élevé de progression locale et métastatique à terme. Le traitement des TVNIM doit donc être adapté à leur nature.
Dans le cas d’une tumeur à bas risque, la réalisation d’une instillation postopératoire précoce de mitomycine C (dans les 24 heures suivant la RTUV) diminue significativement le risque de récidive.
Par analogie avec le cancer de la prostate, les recommandations 2022 de l’AFU proposent désormais une surveillance active des tumeurs Ta de bas grade afin de limiter les RTUV et de réduire l’agressivité des soins.
Les TVNIM de stade T1 ou de haut grade, en particulier en cas de carcinome in situ associé, peuvent engager le pronostic vital du patient à moyen terme. L’instillation de BCG est le seul traitement endovésical à avoir prouvé son intérêt pour réduire le risque de progression vers une maladie invasive du muscle ou métastatique, et ce uniquement si elle est est entretenue de façon prolongée, sur trois ans.9
Rythme de surveillance variable
La surveillance doit être rapidement allégée en cas de TVNIM à faible risque alors qu’elle doit rester très rapprochée et prolongée pour les tumeurs à haut risque.
En cas de tumeur à bas risque, une endoscopie à trois mois confirme l’absence de tumeur. En l’absence de récidive, une fibroscopie annuelle est suffisante jusqu’à cinq ans. Les recommandations anglaises vont plus loin, en proposant d’interrompre le suivi endoscopique à un an en l’absence de récidive.
En cas de TVNIM à haut risque, les endoscopies sont à réaliser tous les trois mois pendant deux ans, puis tous les six mois pendant trois ans, puis annuellement à vie. La surveillance d’une évolutivité à distance ne doit pas être omise pour ces tumeurs, avec un uroscanner annuel, au moins en début de suivi.
2. Panebianco V, Narumi Y, Altun E, et al. Multiparametric Magnetic Resonance Imaging for Bladder Cancer: Development of VI-RADS (Vesical Imaging-Reporting And Data System). Eur Urol 2018;74:294-306.
3. Neuzillet Y, Audenet F, Loriot Y, et al. French AFU Cancer Committee Guidelines - Update 2022-2024: Muscle-Invasive Bladder Cancer (MIBC). Prog Urol 2022;32:1141-63.
4. Mariappan P, Zachou A, Grigor KM, Edinburgh Uro-Oncology G. Detrusor muscle in the first, apparently complete transurethral resection of bladder tumour specimen is a surrogate marker of resection quality, predicts risk of early recurrence, and is dependent on operator experience. Eur Urol 2010;57:843-9.
5. Naselli A, Hurle R, Paparella S, et al. Role of Restaging Transurethral Resection for T1 Non-muscle invasive Bladder Cancer: A Systematic Review and Meta-analysis. Eur Urol Focus 2018;4:558-67.
6. Rouprêt M, Pignot G, Masson-Lecomte A, et al. Recommandations françaises du comité de cancérologie de l’AFU - actualisation 2020-2022 : tumeur de la vessie. Association française d’urologie, 2022.
7. Neuzillet Y, Pradere B, Xylinas E, et al. French AFU Cancer Committee Guidelines - Update 2022-2024: Non-muscle-invasive bladder cancer (NMIBC). Prog Urol 2022;32:1102-40.
8. Babjuk M, Burger M, Capoun O, et al. European Association of Urology Guidelines on Non-muscle-invasive Bladder Cancer (Ta, T1, and Carcinoma in Situ). Eur Urol 2022;81:75-94.
9. Lamm DL, Blumenstein BA, Crissman JD et al. Maintenance bacillus Calmette-Guerin immunotherapy for recurrent TA, T1 and carcinoma in situ transitional cell carcinoma of the bladder: A randomized Southwest Oncology Group Study. J Urol 2000;163:1124-9.
Dans cet article
- Modes de découverte principaux : hématurie et signes irritatifs vésicaux
- Quelques rares situations bénignes
- Quels sont les examens d’imagerie indiqués ?
- Résection transurétrale indispensable pour la suite de la prise en charge
- Classification anatomopathologique et disparité pronostique
- Prise en charge thérapeutique et modalités de surveillance