Types et fréquence
Trois types selon la dernière classification OMS : polypes hyperplasiques (PH) [jamais dysplasiques] ; polypes/adénomes festonnés sessiles (P/AFS) et adénomes festonnés traditionnels (AFT), généralement pédiculés et plus rares.1
Localisation préférentielle : distale pour les PH et les AFT, proximale (côlon droit) pour les AFS.2
Zone de prolifération au sein des cryptes festonnées :3
– AFS : décalée sur les côtés des cryptes, entraînant une dilatation de leur base ;
– AFT : multiples petites ectopies cryptiques issues des bords latéraux des cryptes originales.
- – pour les PH : située à la base des cryptes de manière identique à la muqueuse normale ;
– AFS : décalée sur les côtés des cryptes, entraînant une dilatation de leur base ;
– AFT : multiples petites ectopies cryptiques issues des bords latéraux des cryptes originales.
– la grande majorité sont des PH ;
– AFT : moins de 1 % des polypes coliques ; touchent autant les femmes que les hommes et sont vraisemblablement favorisés par le tabagisme ;
– AFS : entre 1 et 9 % de l’ensemble des polypes ; facteurs de risque : âge, sexe féminin, tabagisme et obésité.
- – entre 13 et 40 % dans la population générale ;
– la grande majorité sont des PH ;
– AFT : moins de 1 % des polypes coliques ; touchent autant les femmes que les hommes et sont vraisemblablement favorisés par le tabagisme ;
– AFS : entre 1 et 9 % de l’ensemble des polypes ; facteurs de risque : âge, sexe féminin, tabagisme et obésité.
Détection
AFT : souvent plus volumineux et parfois pédiculés, endoscopiquement similaires à des polypes non festonnés.
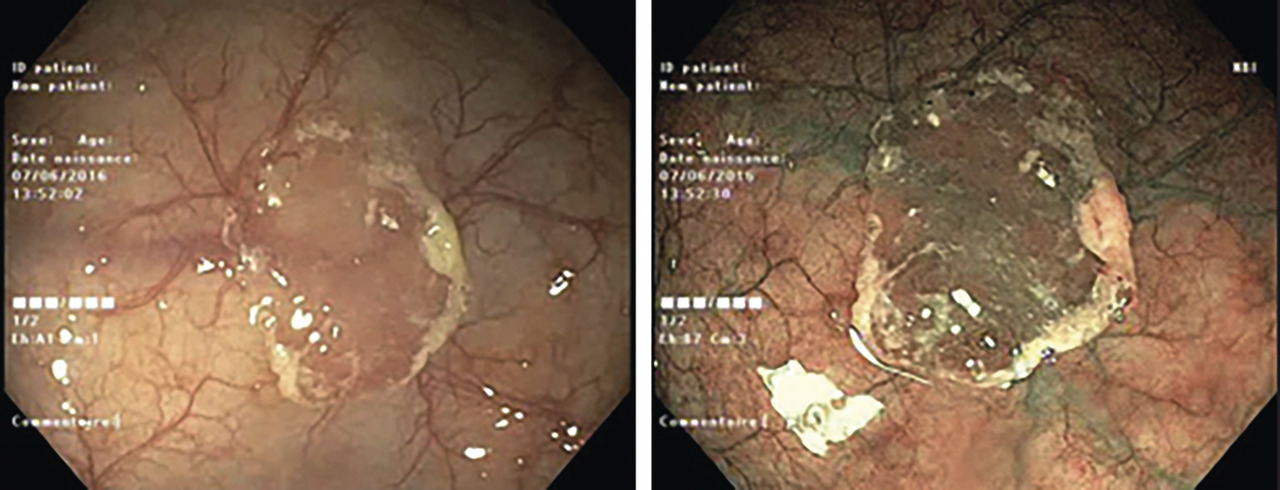
AFS : plus difficiles à dépister, ils sont volontiers plans et ont la même coloration que la muqueuse normale (fig. 1) ; ils sont fréquemment recouverts d’une couche adhérente de mucus qui peut les faire apparaître jaunâtres en lumière blanche, rouges en coloration électronique. Leur différence de structure architecturale se situe dans la partie profonde des cryptes.
Prise en charge
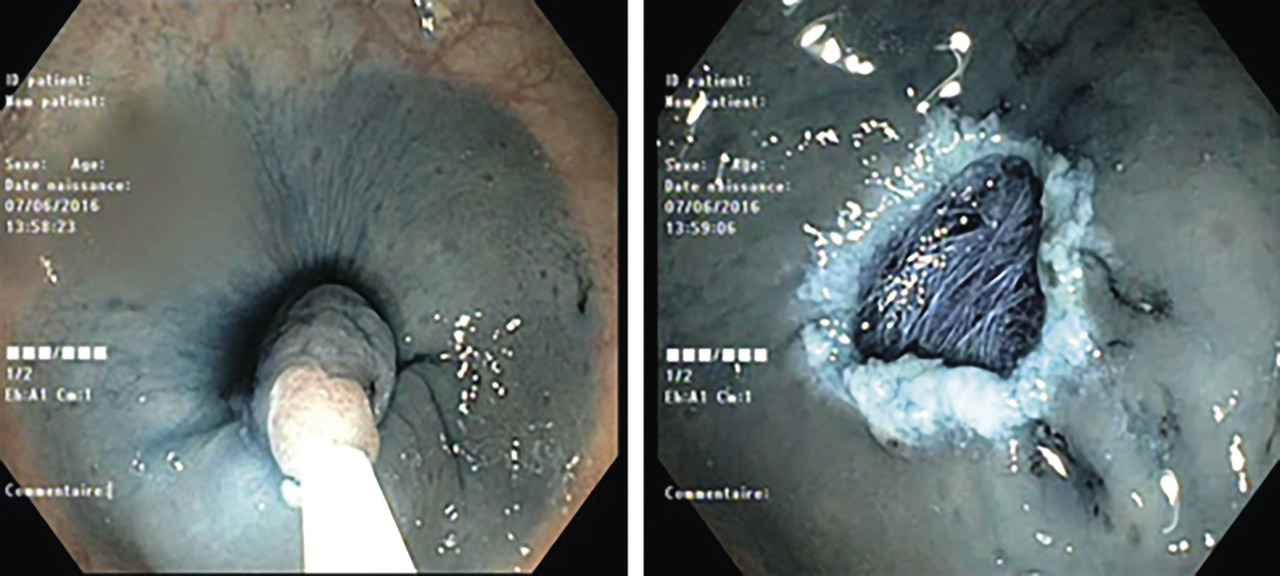
– la détection peut être améliorée par la chromo-endoscopie, la coloration électronique ou l’injection sous-muqueuse d’un liquide coloré.
- – pas spécifique, mis à part les difficultés de repérage des berges des lésions les plus planes ;
– la détection peut être améliorée par la chromo-endoscopie, la coloration électronique ou l’injection sous-muqueuse d’un liquide coloré.
En cas d’impossibilité ou d’échec du traitement endoscopique, discuter la chirurgie.
Surveillance
– si dysplasie : à 3 ans quel que soit le grade (on considère le polype à haut risque).
- – en l’absence de dysplasie : contrôle à 5 ans ;
– si dysplasie : à 3 ans quel que soit le grade (on considère le polype à haut risque).
Des précurseurs des cancers d’intervalle ?
Le rôle protecteur de la coloscopie vis-à-vis des cancers colorectaux est bien établi pour les lésions distales, beaucoup moins pour les proximales. Près de deux tiers des cancers d’intervalle sont situés dans le côlon proximal. Les anomalies moléculaires de type MSI et CIMP sont sur-représentées parmi ces cancers, leur fréquence étant multipliée environ par 3.5 Ces arguments indirects suggèrent l’implication des polypes festonnés (PF) dans leur survenue.
La chronologie de la carcinogenèse des P/AFS est probablement différente de celle des autres lésions prénéoplasiques du côlon et du rectum. Les PF pourraient rester très longtemps bénins, pendant une dizaine d’années, avant d’accumuler suffisamment de mutations pour se transformer en adénocarcinomes. Une fois ce processus enclenché, l’évolution pourrait être accélérée, notamment en raison de la fréquence des mutations induisant un phénotype MSI
2. Rosty C, Hewett DG, Brown IS, et al. Serrated polyps of the large intestine: current understanding of diagnosis, pathogenesis and clinical management. J Gastroenterol 2013;48:287-302.
3. Torlakovic EE, Gomez JD, Driman DK, et al. Sessile serrated adenoma (SSA) vs. traditional serrated adenoma (TSA). Am J Surg Pathol 2008;32:21-9.
4. Buecher B, Bezieau S, Dufilhol C, et al. Les polypes festonnés colorectaux : une entité revisitée. Gastroenterol Clin Biol 2007;31:39-54.
5. Arain MA, Sawhney M, Sheikh S, et al. CIMP status of interval colon cancers: another piece to the puzzle. Am J Gastroenterol 2010;105:1189-95.

 Encadrés
Encadrés