Les maladies allergiques incluent les allergies alimentaires, certaines formes d’asthme, la rhinite, la conjonctivite, certaines urticaires, l’eczéma, les allergies aux médicaments et aux venins d’insectes et la forme la plus grave, l’anaphylaxie. L’Organisation mondiale de la santé les place en quatrième position des maladies infantiles au vu du nombre de cas dans le monde.1 L’asthme est la maladie chronique la plus fréquente de l’enfance, avec une prévalence en France estimée à 11 %2. Outre les facteurs intrinsèques (génétique notamment), les expositions environnementales et l’évolution du mode de vie (alimentation, sédentarité, tabagisme…) favorisent la survenue d’allergies.
Physiopathologie du mécanisme allergique
Le terme « allergie » a évolué depuis la classification de Gell et Coombs de 1963 qui décrivait quatre types immunologiques, dont le type I, dépendant des immunoglobulines E (IgE), et qui représente aujourd’hui ce que l’on appelle communément les « manifestations allergiques ».
Allergies
Parler d’allergie, c’est le plus souvent se référer à l’hypersensibilité de type I ou allergie médiée par les IgE. Il s’agit en effet de la forme la plus fréquente, mais il existe d’autres types d’allergie : leur point commun est l’existence d’un mécanisme immunologique prouvé. Seuls les plus fréquents sont ici détaillés.
Hypersensibilité de type I ou immédiate
L’hypersensibilité dite « immédiate » (HSI), médiée par les IgE, est le mécanisme le plus fréquemment en cause dans les réactions allergiques. Elle comporte deux phases.3
Une phase de sensibilisation (asymptomatique) qui correspond au premier contact avec l’allergène. Cette étape survient le plus souvent dans l’enfance, voire pendant la vie intra-utérine. L’allergène est pris en charge par les cellules présentatrices d’antigènes, et présenté aux lymphocytes T CD4+, qui se différencient alors en lymphocytes T2, avec production d’interleukines (IL-4, IL-5, IL-13). Ces interleukines provoquent la synthèse d’IgE spécifiques de l’allergène par les lymphocytes B. Ces IgE se fixent par leur fragment constant aux mastocytes et polynucléaires basophiles par leur récepteur de haute affinité FcεRI ; aux macrophages, aux polynucléaires éosinophiles, aux lymphocytes B, aux plaquettes par leur récepteur de basse affinité FcεRII/CD23.
Une phase effectrice qui correspond à la survenue des manifestations allergiques. Lors d’un nouveau contact avec l’allergène, celui-ci ponte les IgE préformées, se trouvant à la surface des mastocytes et basophiles, et active ainsi la cellule inflammatoire. À la phase aiguë, le pontage des IgE provoque une dégranulation brutale avec libération de médiateurs préformés (histamine, tryptase, cytokines) et néoformés (leucotriènes, prostaglandines), responsables des signes cliniques de l’HSI : vasodilatation, œdème et hypersécrétion de mucus, bronchoconstriction. La phase tardive ou inflammatoire est due au recrutement local d’éosinophiles, secondaire à la libération de cytokines et de chimiokines par les lymphocytes T CD4, les mastocytes et les basophiles. Cette deuxième phase survient quelques heures après la première. Son expression clinique est variable.
Hypersensibilité de type IV ou « retardée »
Dans ce mécanisme, l’allergène est reconnu par des lymphocytes T entraînant une réaction cytotoxique de façon retardée (48 à 72 heures).
Hypersensibilités non allergiques
Il s’agit de mécanismes non immunologiques (toxique, pharmacologique, chimique), donc sans reconnaissance spécifique d’allergène (absence de sensibilisation préalable à un allergène). Par exemple, l’intolérance au lactose est due à un déficit partiel en lactase.
Cependant, ces mécanismes peuvent activer de manière non spécifique les mêmes effecteurs que l’hypersensibilité allergique avec dans, ce cas, des symptômes cliniques très proches. Le médiateur principal peut aussi être l’histamine, on parle alors d’histaminolibération non spécifique.
Devant quels symptômes doit-on évoquer une allergie ?
Principales manifestations cliniques de l’allergie IgE-médiée
Il existe un continuum anatomique et physiopathologique entre la rhinite et l’asthme.
Rhinite allergique
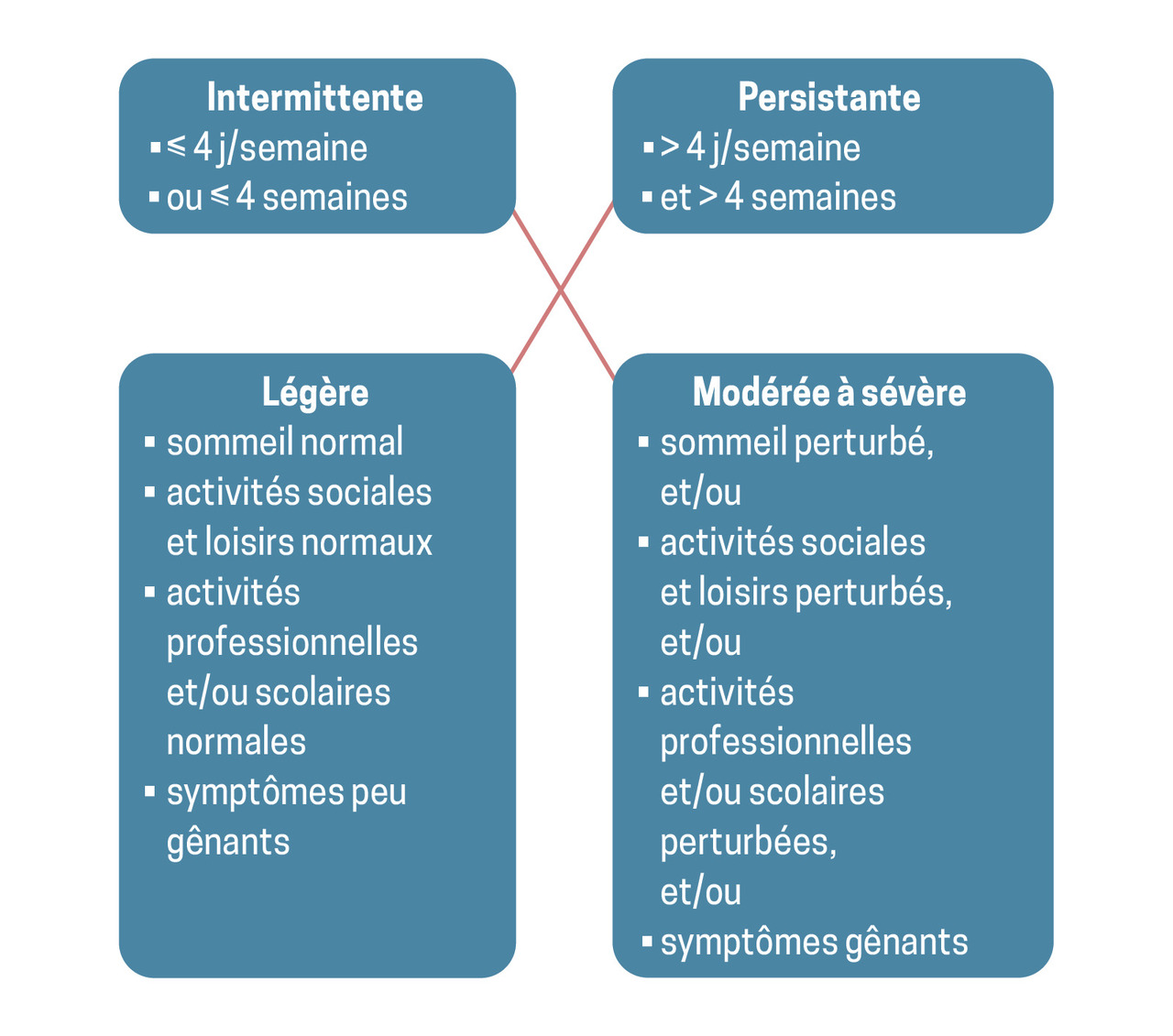
Les recommandations Allergic Rhinitis and its Impact on Asthma (ARIA)4 décrivent les signes et les critères cliniques, ainsi que la sévérité des manifestations de la rhinite allergique (fig. 1). Les principaux symptômes sont les éternuements, le prurit, la rhinorrhée et l’obstruction nasale, mais une anosmie ou des signes de syndrome d’apnée obstructive du sommeil sont aussi possibles.
Asthme allergique
En cas d’asthme connu, il convient de rechercher d’éventuels facteurs allergiques déclenchants (respiratoires, alimentaires) à l’aide d’un interrogatoire précis sur les circonstances de survenue – répétition des situations, activités, loisirs, travail, etc. – afin de répertorier les potentielles expositions. Les explorations sont orientées en fonction de ce recueil, quel que soit l’âge du patient. Un bilan allergologique est systématique pour tout asthme au-delà de l’âge de 3 ans ; il est indiqué selon les données de l’interrogatoire, les expositions et les critères de sévérité pour les enfants âgés de moins de 3 ans.
L’asthme professionnel est une entité particulière avec exposition à des allergènes spécifiques à chaque type de métier, la périodicité étant alors liée au travail. L’exploration doit être réalisée par un praticien formé à cette pratique spécifique. Les adolescents asthmatiques doivent être informés des éventuels risques lors du choix de leur orientation professionnelle.
Conjonctivite allergique
Elle est la plus fréquente des maladies allergiques et est le plus souvent associée à une rhinite (rhinoconjonctivite allergique). Les principaux signes sont le larmoiement, l’érythème conjonctival et le prurit oculaire. Une forme plus sévère mais rare est la kératoconjonctivite vernale, avec possible baisse de l’acuité visuelle dans sa forme la plus grave.
Symptômes digestifs
Douleurs abdominales, diarrhées, nausées et vomissements sont autant de signes survenant le plus souvent dans les deux heures suivant l’exposition.
Le syndrome oral se caractérise par un œdème labial, un prurit oral ou pharyngé, parfois une urticaire péribuccale.
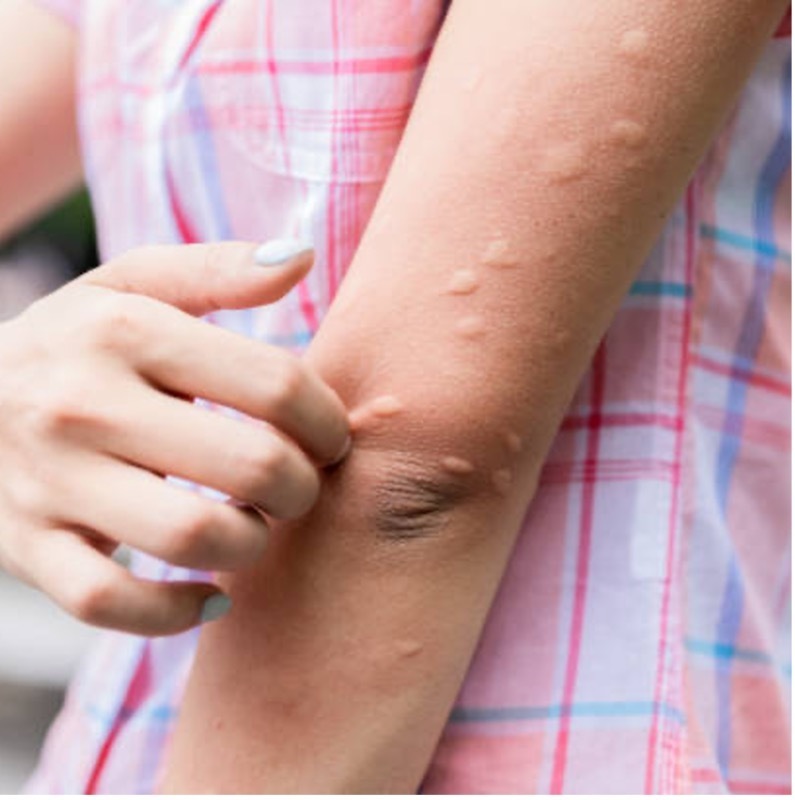
Urticaire allergique
Cette atteinte cutanéo-muqueuse (fig. 2) peut toucher n’importe quelle région du corps avec des angiœdèmes muqueux. La chronologie après l’exposition à l’allergène est rapide : en général, la réaction survient dans les trois heures qui suivent. L’efficacité des traitements anti-allergiques sur l’urticaire allergique permet de la différencier des angiœdèmes héréditaires.
Angiœdème laryngé
Atteinte allergique grave, il peut mettre en cause le pronostic vital par l’œdème laryngé asphyxiant. Les premiers signes sont généralement une raucité de la voix, un cornage, une toux rauque puis une dyspnée inspiratoire. Les allergènes peuvent être alimentaires, respiratoires ou médicamenteux. Les principaux diagnostics différentiels sont les angiœdèmes héréditaires tels que les déficits en C1-inhibiteur.
Choc anaphylactique
Le choc anaphylactique correspond à la forme la plus sévère de réaction allergique médiée par les IgE.
Le pronostic vital est engagé et la prise en charge doit être immédiate. Les allergènes peuvent être alimentaires, respiratoires, médicamenteux, ou provenir du venin d’hyménoptères.
Les définitions ont évolué et la prise en charge standardisée, avec le recours à l’adrénaline le plus rapidement possible, a été établie dans les recommandations de l’Académie européenne d’allergie et d’immunologie clinique (EAACI).4
Symptômes de l’allergie non médiée par les IgE
Les tableaux cliniques sont différents et la chronologie est retardée :
- atteinte dermatologique : eczéma, toxidermie médicamenteuse ;
- atteinte digestive : entéropathie allergique…
Existe-t-il des terrains favorables à l’allergie ?
Les manifestations atopiques (respiratoires, alimentaires…) sont influencées par le sexe (masculin chez l’enfant), l’origine ethnique (enfants d’origines asiatique et africaine), la génétique (associations familiales, HLA et gènes spécifiques), l’environnement et ses interactions avec le génome, y compris les effets épigénétiques.
Rôle de l’alimentation
Plusieurs études ont suggéré des relations épidémiologiques entre une carence en vitamine D et l’augmentation des risques de diverses pathologies dont l’atopie, ce qui est concordant avec les gradients nord-sud observés pour ces maladies.
Notre régime alimentaire a énormément changé dans les dernières décennies, ce qui exerce une influence certaine sur le développement des maladies atopiques. Plusieurs de nos habitudes alimentaires, comme la consommation d’acides gras de type oméga-3 (poissons gras), ont un effet protecteur sur la survenue de l’asthme en particulier.
Les liens entre obésité, état inflammatoire et asthme sont maintenant bien étayés .5 Elle semble également favoriser les allergies alimentaires.
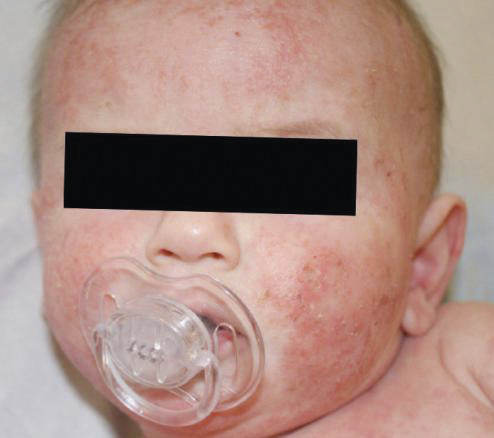
Dermatite atopique : facteur de risque d’allergies alimentaires
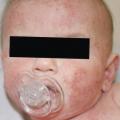
La dermatite atopique (fig. 3)est la première manifestation de la marche atopique, conduisant à une altération de la barrière cutanée. L’organisme stimulé produit dans un premier temps des IgE non spécifiques, puis après exposition, des IgE spécifiques.6
L’existence d’une dermatite atopique est donc un facteur de risque de développer des allergies alimentaires, de même que le moment et la voie d’exposition aux aliments : ainsi, l’exposition par voie orale est classiquement considérée comme tolérogène, la voie cutanée comme allergisante.
Pathologies respiratoires à tout âge
Les maladies virales sifflantes survenant au cours des deux à trois premières années de vie sont un facteur de risque de développement d’asthme chez l’enfant et de sensibilisation aux aéroallergènes.
Chez l’adulte, pour les pathologies respiratoires, notamment d’origine professionnelle, le niveau d’exposition aux sensibilisants (allergènes de poids moléculaires élevé et faible) et aux irritants sont des facteurs clé du développement de la rhinite et de l’asthme. Le tabagisme est également un facteur de risque pour le développement d’allergies.
Rôle du microbiome
Le rôle du microbiome est essentiel : l’exposition à un environnement microbien riche et diversifié protège des maladies allergiques. À l’inverse, la diminution des maladies infectieuses liée à l’amélioration des conditions d’hygiène permettrait le développement de lymphocytes d’un phénotype Th2 et donc des maladies allergiques qui lui sont associées. De nombreuses observations vont dans le sens de cette hypothèse : augmentation de prévalence des allergies associée au mode de vie occidental ; relation inverse entre taille de la fratrie et risque d’allergie ; moindre risque de sensibilisation chez des personnes ayant eu des animaux domestiques dans l’enfance ; diminution du risque d’allergie observé chez des enfants vivant dans une ferme (en effet, l’exposition précoce – avant 1 an – aux endotoxines bactériennes présentes dans l’environnement des animaux de la ferme apparaît très protectrice vis-à-vis des maladies allergiques, dont l’asthme).
Les examens à ne pas faire !
Le diagnostic de l’allergie en médecine générale reste avant tout clinique, avec la mise en évidence d’une réaction allergique (urticaire, atteinte digestive, respiratoire…) à chaque exposition à l’allergène.
Allergies médiées par les IgE
Allergies respiratoires
La rhinite allergique peut être évoquée devant la triade classique (obstruction nasale, rhinorrhée et éternuements) qui peut être associée à un prurit nasal et des symptômes de conjonctivite. Elle reste rare avant 5 ans.
Il n’est donc pas pertinent de prescrire un test multi-allergénique d’orientation (mélange de pneumallergènes, Phadiatop) chez le nourrisson âgé de moins de 12 mois, car l’allergie respiratoire est extrêmement rare dans cette tranche d’âge. Le Phadiatop n’est pas non plus indiqué lorsque l’histoire clinique permet d’identifier facilement l’allergène en cause ou devant l’apparition de nouveaux symptômes dans le cadre d’une allergie déjà connue. En revanche, la réalisation de ce type de dépistage peut permettre d’écarter l’origine allergique d’une rhinite chronique, fréquente chez les enfants, avant une orientation chez un médecin spécialiste.
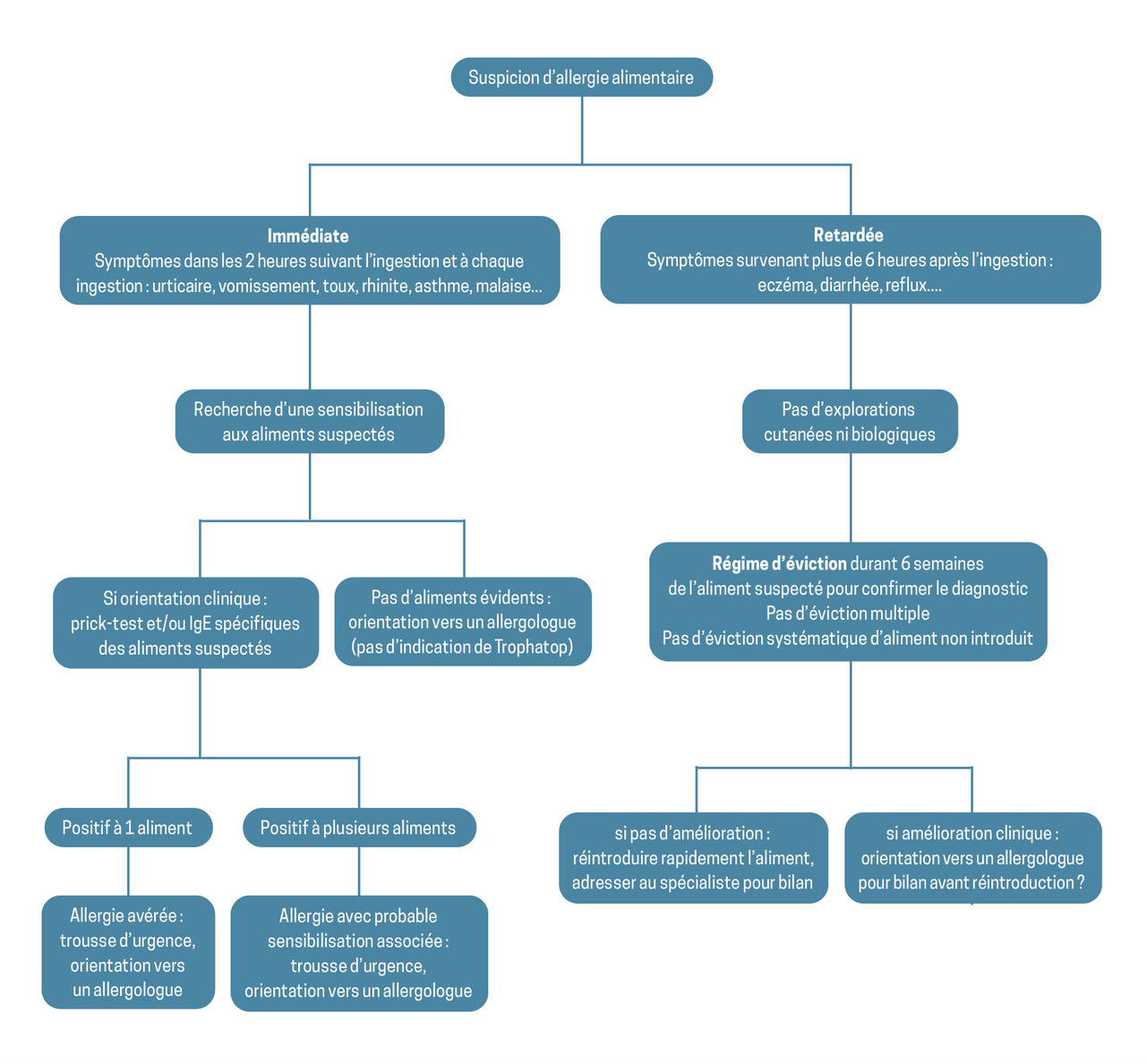
Allergies alimentaires
Il est très important de réaliser une anamnèse la plus précise possible afin d’identifier l’allergène responsable des réactions. Il convient d’écarter les réactions non spécifiques (notamment péribuccales) ou une urticaire chronique. En attendant l’orientation vers un spécialiste, le médecin généraliste peut réaliser le dosage des IgE spécifiques vis-à-vis de l’allergène qu’il suspecte.7 La sensibilisation découverte lors d’un dosage d’IgE spécifiques est utile mais non suffisante pour le diagnostic.
Les examens biologiques d’allergie peuvent être réalisés à tout âge.
D’autres examens existent, comme le test d’activation des basophiles (TAB) ou les puces multi-allergéniques, mais ils ne sont pas recommandés en première intention. Le TAB est un test fonctionnel avec une excellente spécificité et une valeur prédictive négative supérieure à celles des prick-test et des IgE spécifiques dans l’allergie alimentaire. Il est donc utile en cas de discordance entre ces examens, et pour le suivi des allergies, notamment des inductions de tolérance orale ; cependant, il n’est disponible que dans des centres d’expertises. Les biopuces ISAC et ALEX* ne sont pas non plus indiquées en routine ; elles sont utiles pour l’exploration des patients multi-allergiques avec des profils complexes. Elles permettent également d’évaluer la sensibilisation à des recombinants non disponibles en unitaire.8-10
Il n’est ni pertinent ni recommandé de réaliser chez l’enfant ni l’adulte le dosage d’IgE spécifiques de mélanges d’aliments non ciblés par l’interrogatoire, comme le Trophatop. En effet, les tests ou méthodes utilisés autres que les IgE spécifiques n’ont pas fait la preuve de leur efficacité et peuvent conduire à un diagnostic et à un traitement inapproprié telle qu’une éviction alimentaire non justifiée, pouvant être elle-même responsable du développement d’allergie médiée par les IgE.8-10
Le dosage des IgE totales n’est pas non plus recommandé pour établir un diagnostic d’allergie. Il est rarement utile car la sensibilité et la spécificité du test sont insuffisantes en ce qui concerne le terrain allergique. Par ailleurs, cet examen ne permet pas de déterminer l’allergène en cause dans la symptomatologie du patient. Par conséquent, le dosage des IgE totales sériques n’est pas pris en charge par l’Assurance maladie s’il est prescrit avec des tests multi-allergéniques de dépistage ou des dosages d’IgE spécifiques.8-10
Le dosage des éosinophiles sanguins n’est pas suffisant pour le diagnostic d’allergie. C’est un marqueur peu sensible et non spécifique pour la recherche d’un terrain allergique.8-10
Enfin, le dosage des IgG anti-aliment n’est pas recommandé. Ces anticorps ont une spécificité insuffisante, leur prévalence étant élevée parmi les sujets sains. De plus, la standardisation et la reproductibilité de ces techniques sont insuffisantes.8-10
Allergies retardées non médiées par les IgE
Il n’existe pas de tests biologiques ou cutanés permettant d’explorer les allergies retardées non médiées par les IgE. Lorsque celles-ci sont suspectées, comme pour le lait de vache chez le nourrisson, il convient de réaliser une éviction de l’aliment au maximum 6 semaines afin d’évaluer cliniquement l’efficacité du régime d’éviction, sans risquer un passage à la forme médiée par les IgE.
La réalisation de patch-tests est à proscrire en raison de leur manque de fiabilité, le Diallertest n’est d’ailleurs plus commercialisé. En effet, leur interprétation n’est pas normalisée, leur reproductibilité est incertaine et, surtout, les réactions d’irritation pourraient être interprétées comme des résultats faussement positifs lorsque le patient est atteint de dermatite atopique. Dans l’exploration des allergies avec des manifestations très variées, l’étude de Caglayan-Sozmen et coll. a ainsi montré que les patch-tests avaient une mauvaise sensibilité et une valeur prédictive positive seulement d’environ 20 %.11
Quand et à qui adresser ?
Quelle que soit la pathologie allergique dont est atteint le patient, il s’agit d’une maladie chronique nécessitant une coordination entre le médecin généraliste, l’allergologue et le pneumologue et/ou le dermatologue (fig. 4).
Concernant la dermatite atopique, le patient doit bénéficier d’une consultation chez un allergologue en cas de de forme sévère et résistante à un traitement par dermocorticoïde bien conduit et une bonne application quotidienne des émollients.12
Pour l’asthme, les recommandations de la Haute Autorité de santé restent valables : il faut orienter vers un pédiatre, pneumopédiatre ou allergologue un enfant asthmatique de moins de 36 mois ne répondant pas à un traitement d’épreuve bien conduit.13 Un bilan allergologique systématique est recommandé chez tout patient asthmatique de plus de 3 ans.
Si les rhinoconjonctivites saisonnières sont souvent contrôlées par un traitement médicamenteux local instauré par le médecin traitant, il faut penser à adresser le patient vers le spécialiste en cas de rhinite persistante, modérée à sévère avec prise continue de médicaments. Un bilan allergologique s’impose afin d’évaluer l’indication d’une immunothérapie allergénique. De même, si la rhinite allergique s’accompagne d’un asthme (qu’il faut rechercher à chaque consultation), une exploration allergologique et fonctionnelle respiratoire chez un pneumologue ou allergologue doit être envisagée.
Pour les allergies alimentaires, bien qu’il n’existe pas de recommandations officielles, l’orientation vers un allergologue pour confirmer le diagnostic ou devant une suspicion reste essentielle. Outre le diagnostic, la consultation spécialisée permet de revoir l’éducation thérapeutique sur la prise en charge des accidents et l’utilisation du stylo d’adrénaline auto-injectable initiée en médecine générale. De plus, il permet d’orienter le patient vers une prise en charge adaptée s’il peut être candidat à une immunothérapie orale ou de réaliser un test de provocation orale en milieu hospitalier suivant l’évolution de l’allergie.
Devant une urticaire aiguë récidivante, une consultation allergologique est utile avant de réaliser des évictions alimentaires. En effet, 60 à 80 % des urticaires chroniques restent idiopathiques.14
Quelles mesures de prévention ?
L’exposition à plusieurs facteurs environnementaux est étroitement liée à la survenue des maladies allergiques.
L’exposition aux allergènes alimentaires ou inhalés ne peut être totalement évitée, et les études observationnelles et interventionnelles sur l’éviction ou la réduction de l’exposition n’ont pas montré de résultats convaincants.15
En revanche, l’éviction du tabagisme passif est indispensable : plusieurs études ont montré que la fumée dans l’environnement augmente le risque de sensibilisation et d’asthme allergiques chez les enfants.16
Les autres évictions, notamment celles des animaux, sont encore controversées. Si certaines études montrent un bienfait de l’exposition précoce avant 3 mois aux animaux à poils,17 les preuves ne sont pas suffisantes pour justifier l’acquisition d’un animal à des fins préventives, d’autant que d’autres données ont montré une altération de la fonction pulmonaire dès l’apparition d’une sensibilisation.18
Pour les allergies alimentaires, la supplémentation en vitamine D, le traitement de la dermatite atopique – en luttant contre la corticophobie – et l’introduction précoce des allergènes alimentaires chez le nourrisson sont essentiels. Les recommandations européennes actuelles de l’EAACI proposent en effet une diversification précoce avec une fenêtre optimale de tolérance entre 4 et 6 mois, y compris pour les aliments comme l’œuf cuit ou l’arachide (sous forme adaptée à l’âge, comme la poudre ou le beurre de cacahuète). Une diversification tardive pourrait être un facteur de risque d’allergie en raison du contournement de la tolérance orale pendant une période d’exposition cutanée sensibilisante.
Différences entre sensibilisation et allergie
Après contact avec un allergène, le développement par l’organisme d’IgE spécifiques de cet allergène est appelé « sensibilisation». Autrement dit, il y a sensibilisation lorsqu’un test allergologique est positif, qu’il s’agisse d’un test cutané ou du dosage d’IgE spécifiques. Une sensibilisation peut exister sans symptôme clinique associé, donc sans allergie vraie.
L’allergie, quant à elle, correspond à une hypersensibilité spécifique à un allergène, de mécanisme immunologique prouvé (médiation humorale ou cellulaire), avec des conséquences cliniques. L’allergie médiée par les IgE associe donc une sensibilisation objectivable à des signes cliniques reproductibles. En cas d’allergie non médiée par les IgE, la sensibilisation peut ne pas toujours être mise en évidence, mais les signes cliniques sont reproductibles, ils peuvent être objectivés par une épreuve d’éviction/réintroduction par exemple.
Que dire à vos patients ?
Il est nécessaire de diagnostiquer précisément les allergies, afin de les traiter efficacement (éviction de l’allergène responsable en premier lieu).
Les allergies vraies occasionnent des symptômes à chaque consommation de l’aliment et non de façon intermittente.
En cas d’allergie alimentaire médiée par les IgE, le port d’une trousse d’urgence contenant de l’adrénaline peut être nécessaire.
La dermatite atopique est exceptionnellement d’origine allergique.
1. Pawankar R, Canonica GW, Holgate ST, et al. WAO white book on allergy. Milwaukee, WI: World Allergy Organization 2011;3:156-7.
2. Delmas MC, Guignon N, Leynaert B, et al. Augmentation de la prévalence de l’asthme chez le jeune enfant en France. Rev Mal Resp 2017;34(5):525-34.
3. Akdis CA, Agache I (éd.). Global Atlas of Allergy. European Academy of Allergy and Clinical Immunology, 2014.
4. Muraro A, Roberts G, Worm M, et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy 2014;69(8):1026-45.
5. Peters U, Dixon AE, Forno E. Obesity and asthma. J Allergy Clin Immunol 2018;141(4):1169.
6. Yang L, Fu J, Zhou Y. Research Progress in Atopic March. Front Immunol 2020;11:1907.
7. Haute Autorité de la Santé. Indications du dosage des IgE spécifiques dans le diagnostic et le suivi des maladies allergiques. Mai 2005.
8. Chabane H, Klingebiel C, Dalampira G, et al. Recommandations pour la prescription et l’interprétation des examens biologiques utilisables dans le cadre du diagnostic ou du suivi des allergies, disponibles en France. Texte court. Rev Fr Allergol 2021;61(7):436‑58.
9. Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, et al. EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol 2016;27 Suppl 23:1‑250.
10. Raffard M, Partouche H. Allergologie en pratique. EMC Traité de Médecine Akos 2008;3(1).
11. Caglayan Sozmen S, Povesi Dascola C, Gioia E, et al. Diagnostic accuracy of patch test in children with food allergy. Pediatr Allergy Immunol 2015;26(5):416-22.
12. Conférence de consensus. Prise en charge de la dermatite atopique de l’enfant. Ann Dermatol Venereol 2005;132:1S9-18.
13. Société pédiatrique de pneumologie et allergologie, Haute Autorité de santé. Recommandations professionnelles. Asthme de l’enfant de moins de 36 mois : diagnostic, prise en charge et traitement en dehors des épisodes aigus. Mars 2009.
14. Conférence de consensus. Prise en charge de l’urticaire chronique. Ann Dermatol Venereol 2003;130:1S182-1S192.
15. Halken S, Muraro A, de Silva D, et al. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol 2021;32: 843-58.
16. Lannerö E, Wickman M, van Hage M, et al. Exposure to environmental tobacco smoke and sensitization in children. Thorax 2008;63(2):172‑6.
17. Portnoy JM, Kennedy K, Sublett JL, et al. Environmental assessment and exposure control: a practice parameter–furry animals. Ann Allergy Asthma Immunol 2012;108(4):223.e1-15.
18. Ownby DR, Johnson CC, Peterson EL.Exposure to dogs and cats in the first year of life and risk of allergic sensitization at 6 to 7 years of age. JAMA 2002;288:963-72.

 Encadrés
Encadrés