objectifs
Prescrire et surveiller un traitement anti-infectieux.
Partie : Antibiotiques
Évaluer la pertinence d’une prescription d’antibiotiques. Exposer les enjeux d’une utilisation des antibiotiques non conforme aux recommandations de bonne pratique clinique.
Préciser les critères de choix d’une antibiothérapie probabiliste. Connaître les principales indications thérapeutiques et les principaux effets indésirables d’au moins un représentant des familles d’antibiotiques suivantes : pénicillines du groupe G ou V, pénicillines du groupe A ; associations comportant un inhibiteur des bêtalactamases ; pénicillines du groupe M ; céphalosporines de deuxième et troisième générations ; macrolides, lincosamides, aminosides ; cotrimoxazole, quinolones ; les glycopeptides et les pénèmes. Analyser les causes d’échec d’une antibiothérapie ; savoir réévaluer une antibiothérapie.
Généralités sur les antibiotiques (rang A)
Produits par des micro-organismes, ou par synthèse, les antibiotiques sont définis par leur capacité à inhiber ou détruire certaines espèces bactériennes.
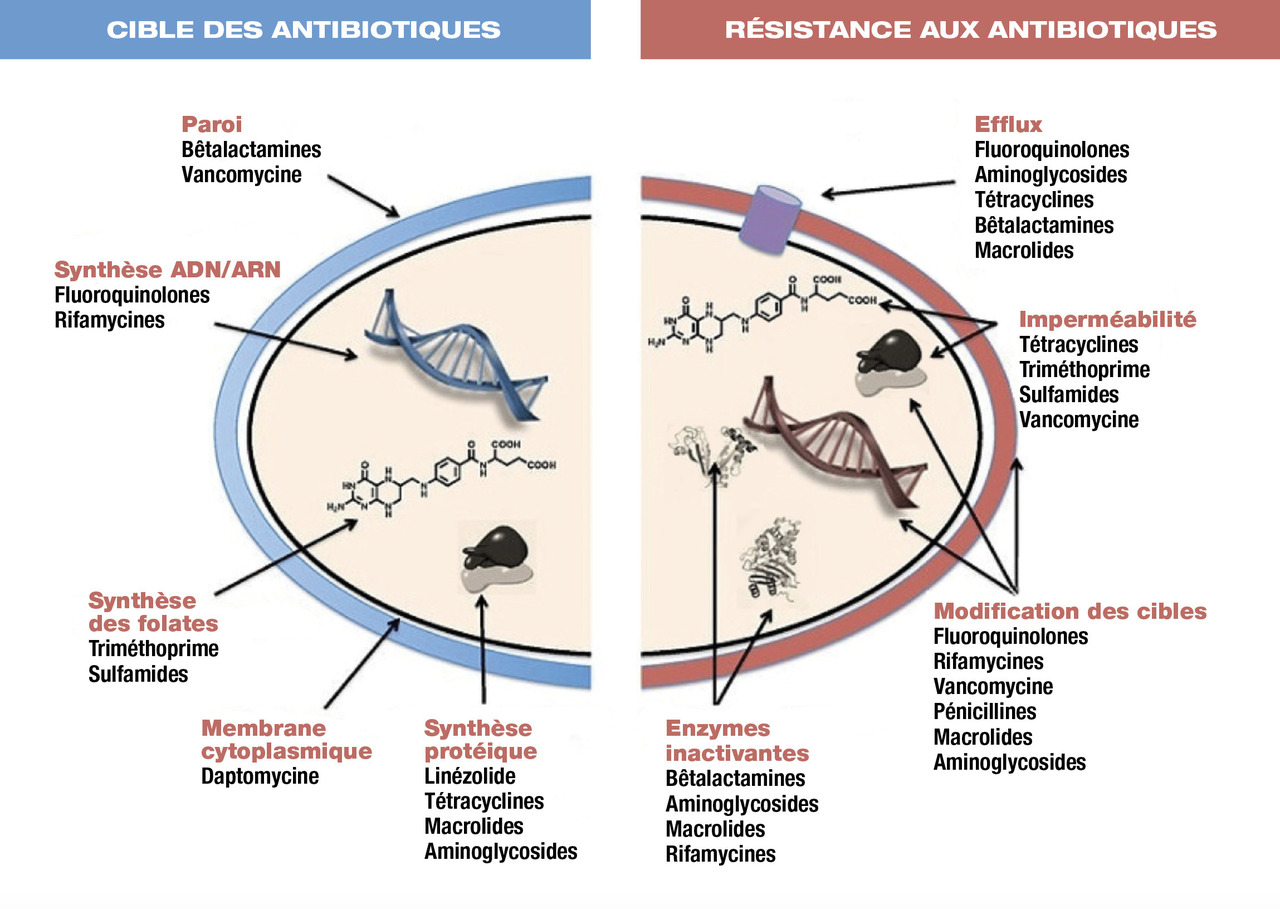
Notions de sensibilité, résistance et spectre d’un antibiotique
Concentration minimale inhibitrice (CMI) et concentration minimale bactéricide (CMB)
La CMI d’un antibiotique pour une bactérie correspond à la concentration minimale nécessaire pour inhiber sa croissance. Elle est donc le reflet de la bactériostase.
La CMB d’un antibiotique pour une bactérie correspond à la concentration minimale nécessaire pour la tuer. Elle est donc le reflet de la bactéricidie.
Spectre antibactérien et résistances
Le spectre d’un antibiotique regroupe les bactéries sur lesquelles il est habituellement efficace.
La notion de résistance regroupe 2 composantes (
- la résistance naturelle : toutes les bactéries de l’espèce sont résistantes (par exemple les mycoplasmes, qui ne possèdent pas de paroi, sont naturellement résistants aux antibiotiques qui agissent sur la paroi bactérienne) ;
- la résistance acquise : elle concerne des souches qui ont développé un ou des mécanisme(s) de résistance.
L’émergence des résistances dépend :
- de la pression de sélection des antibiotiques (la destruction des espèces sensibles favorise leur remplacement par des espèces résistantes) ;
- du support de la résistance, avec 2 catégories :
° la résistance chromosomique : transmission uniquement verticale (à la descendance), le plus souvent liée à des mutations ;
° la résistance extrachromosomique : gènes de résistance hébergés sur des plasmides (éléments génétiques mobiles) ; transmission horizontale (aux bactéries voisines) ; coexistence fréquente de plusieurs mécanismes, conférant des résistances croisées à plusieurs classes d’antibiotiques.
Les principaux mécanismes de résistance sont :
- l’inactivation de l’antibiotique : production d’enzymes qui détruisent l’antibiotique (par exemple pénicillinase, céphalosporinase, carbapénémase) ;
- la modification de la cible (par exemple, les protéines de liaison à la pénicilline [PLP]) ;
- l’imperméabilité ± l’efflux, empêchant l’antibiotique d’atteindre sa cible.
Pharmacocinétique
Quatre paramètres déterminent les concentrations d’antibiotiques que l’on obtient selon la posologie, la voie d’administration, la fréquence des prises et le terrain.
Absorption digestive
Mesurée par la biodisponibilité : fraction du médicament retrouvée dans le sang après une prise orale.
Diffusion (tableau 1 )
Évaluée globalement par le volume de distribution. Certains sites anatomiques sont difficiles d’accès (cerveau, œil, prostate, os). Les molécules liposolubles diffusent mieux que les hydrosolubles dans certains compartiments (prostate, os, système nerveux central).
Demi-vie sérique
C’est le temps pour que la concentration d’un médicament dans le sérum soit divisée par 2. Il conditionne le rythme d’administration. L’insuffisance rénale peut augmenter radicalement la demi-vie (par exemple : vancomycine, 6 heures si reins fonctionnels ; > 7 jours si insuffisance rénale terminale).
Élimination
Elle est majoritairement rénale ou hépatobiliaire, avec comme conséquences :
- l’adaptation nécessaire des posologies chez les insuffisants rénaux ou hépatocellulaires ;
- la prise en compte de la voie d’élimination pour le traitement de certains sites infectieux.
Pharmacodynamie
C’est l’étude de l’action d’une molécule sur sa cible.
Le mécanisme d’action des antibiotiques est à la base de leur classification :
- action sur la paroi de la bactérie :
° bêtalactamines,
° glycopeptides,
° fosfomycine ;
- action sur la synthèse protéique :
° macrolides,
° aminoglycosides (sous-unité 30S du ribosome bactérien),
° cyclines (sous-unité 50S),
° acide fusidique ;
- action sur l’ADN bactérien :
° rifampicine,
° fluoroquinolones,
° imidazolés,
° sulfamides, triméthoprime (inhibition de l’acide folique).
Les antibiotiques sont également différenciés en fonction de leur pouvoir bactéricide ou bactériostatique (
- activité temps-dépendante :
° un contact prolongé antibiotique-bactérie est nécessaire,
° le paramètre pharmacologique le mieux corrélé à l’efficacité est la durée pendant laquelle la concentration d'antibiotique est supérieure à la CMI. Ce paramètre est estimé par le dosage des concentrations résiduelles (juste avant l’injection suivante, en cas d’administration discontinue) ou des concentrations à l’équilibre en cas d’administration continue ;
- activité concentration-dépendante :
° l’efficacité est corrélée à l’obtention d’une forte concentration d’antibiotiques au contact de la bactérie, même transitoire,
° ces antibiotiques ont souvent un effet post-antibiotiques,
° le paramètre pharmacologique le mieux corrélé à l’efficacité est le rapport concentration maximale d’antibiotique (pic)/CMI = quotient inhibiteur.
Principales règles de prescription des antibiotiques (rang A)
Règles communes à l’ensemble des médicaments
Prendre en compte le terrain (âge, allergie, insuffisance hépatique ou rénale).
Informer le patient des éventuels effets indésirables.
Préférer les molécules à moindre coût.
Privilégier les traitements courts et simples.
Règles spécifiques à l’antibiothérapie
Indications d’une antibiothérapie
1. S’assurer qu’une antibiothérapie est indiquée (ce qui n’est pas le cas pour la plupart des infections des voies aériennes supérieures).
2. Définir la(les) cible(s) bactérienne(s) : par exemple pneumocoque pour une pneumopathie franche lobaire aiguë (PFLA), streptocoque A pour l’érysipèle, entérobactéries pour les infections urinaires.
3. Selon le site infecté et le terrain, sélectionner la molécule la mieux adaptée en termes de spectre, de diffusion et de tolérance.
Le plus souvent, l’antibiothérapie est probabiliste (empirique, présomptive), c’est-à-dire qu’elle est débutée en l’absence de documentation. La prescription se fonde sur la pathologie (conférence de consensus), en privilégiant pour les infections peu sévères des molécules dont la tolérance est bonne, tandis qu’on priorise l’efficacité pour les infections graves.
En présence de critères de gravité :
- l’antibiothérapie est systématique et urgente, après la réalisation de prélèvements microbiologiques ;
- par voie parentérale, en privilégiant les molécules bactéricides d’action rapide ;
- en ciblant initialement un large spectre en l’absence d’orientation ;
- l’adaptation est secondaire aux données microbiologiques.
En l’absence de critères de gravité :
- si une infection bactérienne nécessitant une antibiothérapie est suspectée, prescription d’un antibiotique de spectre étroit, actif sur la(les) bactérie(s) suspectée(s) ;
- sinon, pas d’antibiothérapie empirique : celle-ci sera initiée secondairement selon les résultats des prélèvements à visée microbiologique et/ou l’évolution clinique.
Lorsqu’une documentation microbiologique est disponible, le choix de l’antibiothérapie est plus simple. Cependant, un antibiotique ne doit être prescrit que dans les situations où son intérêt est démontré : il ne faut pas traiter systématiquement toutes les bactéries isolées chez un patient.
Prélèvements microbiologiques
Les prélèvements doivent être réalisés avant le début de l’antibiothérapie, sauf exceptions (cystite aiguë non compliquée de la femme jeune, purpura fulminans pris en charge à domicile, pathologies courantes de diagnostic clinique [par exemple érysipèle, PFLA, sinusites, otites]).
Surveillance et réévaluation d’une antibiothérapie
On doit surveiller :
- l’efficacité : elle sera toujours jugée sur l’amélioration clinique (régression des signes liés à l’infection), parfois complétée d’un contrôle biologique (syndrome inflammatoire, hyperleucocytose), voire microbiologique (négativation des hémocultures). La plupart des infections ne nécessitent pas de contrôle biologique quand l’évolution clinique est satisfaisante ;
- la tolérance.
Une réévaluation de l’antibiothérapie doit être réalisée 48-72 heures après son initiation afin de :
- s’assurer que l’évolution est favorable ;
- vérifier que l’antibiothérapie est adaptée ;
- évaluer la tolérance.
Il est important de simplifier le traitement en fonction de l’antibiogramme, en cas de documentation microbiologique :
- choisir une molécule à spectre étroit ;
- passer à une administration orale si possible.
Principales classes d’antibiotiques (rang A)
Bêtalactamines
Mécanisme d’action
Les bêtalactamines inhibent la synthèse du peptidoglycane en se fixant sur les protéines de liaison de la pénicilline (PLP). Bactéricidie temps-dépendante.
Mécanismes de résistance
Modification des protéines cibles (PLP) :
- Staphylococcus aureus résistant à la méticilline (SARM) ;
- pneumocoque de sensibilité diminuée aux pénicillines (PSDP).
Sécrétion de bêtalactamases, enzymes dégradant les bêtalactamines : c’est le principal mécanisme de résistance aux bêtalactamines, dont le support génétique peut être chromosomique (céphalosporinase) ou plasmidique (bêtalactamase à spectre élargi [BLSE]).
L’activité des bêtalactamines sur les bactéries qui sécrètent des bêtalactamases peut être restaurée par un inhibiteur de bêtalactamases (acide clavulanique, tazobactam, avibactam) :
- pas d’intérêt de ces inhibiteurs sur les céphalosporinases ;
- intérêt parfois limité (ex. l’association de l’acide clavulanique à l’amoxicilline ne permet de récupérer une activité que sur 10 % des Escherichia coli) ;
- ces inhibiteurs gardent un intérêt sur les anaérobies, les staphylocoques sensibles à la méticilline et certains bacilles à Gram négatif.
Imperméabilité de la membrane bactérienne : principalement décrite chez les bacilles à Gram négatif (par exemple Pseudomonas aeruginosa).
Pharmacocinétique
- Biodisponibilité en général médiocre.
- Diffusion bonne, sauf système nerveux central (variable selon l’inflammation méningée), œil, prostate.
- Demi-vie brève, imposant plusieurs administrations par jour (sauf pour la ceftriaxone).
- Élimination le plus souvent par voie urinaire.
Effets indésirables
Dominés par les phénomènes allergiques, surtout avec les pénicillines :
- éruption morbilliforme ou urticarienne ;
- fièvre ;
- œdème de Quincke, choc anaphylactique.
NB. Le risque d’allergie croisée avec les autres classes de bêtalactamines, longtemps surestimé, est < 1 % avec les monobactames (pas de noyau bêtalactame), < 5 % avec les céphalosporines. Par ailleurs, de nombreuses situations étiquetées « allergie » ne sont pas liées à des manifestations allergiques, et ne contre-indiquent pas la reprise du traitement.
Les effets indésirables digestifs sont fréquents, ainsi que les effets collatéraux sur les flores du patient (candidose oropharyngée, colite à Clostridium difficile).
Les autres effets secondaires sont plus rares :
- encéphalopathie, convulsions (pénicilline G ou imipénème à fortes doses) ;
- anémie, leucopénie, thrombopénie ;
- hépatite (le plus souvent cytolytique, choléstatique avec l’acide clavulanique) ;
- néphropathies tubulo-interstitielles (pénicillines A et M).
Spectre, molécules et indications (tableaux 4 et 5)
Plusieurs remarques.
Les bêtalactamines sont toutes inactives sur les bactéries intracellulaires.
Les pénicillines G et A sont inactives sur 95 % des staphylocoques.
Une pénicilline M (oxacilline, cloxacilline) ou la céfazoline sont à privilégier en cas d'infection grave à staphylocoque sensible à la méticilline.
L’association d’un inhibiteur de bêtalactamases à une pénicilline confère une bonne activité sur les anaérobies stricts, y compris Bacteroides fragilis.
Les céphalosporines sont :
- inactives sur Listeria monocytogenes et les entérocoques ;
- très actives sur les bactéries à Gram négatif ;
- la ceftazidime possède un spectre préférentiel orienté vers P. aeruginosa. Elle est peu active sur les bactéries à Gram positif.
Les carbapénèmes sont les bêtalactamines au spectre le plus large.
L’aztréoname n’est actif que sur les bactéries à Gram négatif.
Bêtalactamines, nouveautés
La commercialisation de deux céphalosporines actives sur les staphylocoques résistants à la méticilline (dont Staphylococcus aureus résistant à la méticilline [SARM]) : ceftaroline et ceftobiprole. Il s’agit d’un progrès thérapeutique important, puisque les autres bêtalactamines sont inactives sur les SARM.
L’apparition de nouvelles combinaisons de bêtalactamines à large spectre associées à des bêtalactamases, pour répondre à l’émergence des résistances au sein des bacilles à Gram négatif : ceftolozane-tazobactame, ceftazidime-avibactame, imipénème-vaborbactame.
La découverte d’une nouvelle céphalosporine, sidérophore (entrée dans la bactérie par l’intermédiaire des systèmes de transport du fer) : céfidérocol, actif sur les bacilles à Gram négatif multirésistants.
Macrolides et apparentés (tableau 6)
Mécanisme d’action
Fixation à la sous-unité 50S du ribosome bactérien.
Inhibent la synthèse protéique, bactériostatiques.
Pharmacocinétique
Absorption digestive satisfaisante.
Bonne diffusion dans les tissus, sauf système nerveux central ; pénétration intracellulaire excellente.
Demi-vie variable, prolongée pour l’azithromycine.
Élimination hépatique prédominante.
Effets indésirables
Interactions :
Associations formellement contre-indiquées :
- de tous les macrolides avec l’ergotamine et ses dérivés en raison du risque d’ergotisme (vasoconstriction avec nécrose des extrémités) ;
- de érythro-, clarythro- et josamycine avec les anti-histaminiques H1 en raison du risque de torsades de pointes.
Associations déconseillées de la plupart des macrolides avec la théophylline.
Associations à surveiller de près :
- immunosuppresseurs ;
- bromocriptine (majoration des effets indésirables) ;
Troubles digestifs.
Fluoroquinolones (tableau 7)
Mécanisme d’action
Inhibent la synthèse d’ADN bactérien, via l’ADN gyrase ou topo-isomérase II.
Activité bactéricide, concentration-dépendante.
Mécanismes de résistance
Par mutation chromosomique, affectant principalement la cible (ADN gyrase).
Cette résistance impose de traiter en bithérapie initialement (lorsque l’inoculum est élevé), dans les situations suivantes :
- sites avec difficultés de pénétration (os) ;
- infections à Staphylococcus aureus ou Pseudomonas aeruginosa.
Pharmacocinétique
Excellente absorption digestive, sauf si prise simultanée d’antiacide.
Très bonne diffusion.
Demi-vie longue.
Élimination essentiellement urinaire.
Effets indésirables
Photosensibilisation.
Tendinopathies (risque majoré si corticothérapie, traitement prolongé, sujet âgé).
Hépatite.
Encéphalopathie chez le sujet âgé.
Troubles de conduction cardiaque (allongement QT).
Tératogénicité.
Aminosides
Mécanisme d’action
Fixation à la sous-unité 30S du ribosome.
Activité bactéricide puissante, concentration-dépendante.
Mécanisme de résistance
Inactivation enzymatique.
Pharmacocinétique
Pas d’absorption digestive.
Diffusion mauvaise.
Demi-vie brève (2 h), mais effet post-antibiotique prolongé permettant 1 administration par jour.
Élimination urinaire.
Effets indésirables
Toxicité rénale, surtout si néphropathie sous-jacente, utilisation prolongée, néphrotoxiques associés, hypovolémie, administration pluriquotidienne.
Toxicité cochléovestibulaire.
Tératogénicité.
Glycopeptides
Mécanisme d’action
Inhibent la synthèse de la paroi bactérienne.
Bactéricidie lente, temps-dépendante.
Mécanisme de résistance
Modification de la cible.
Pharmacocinétique
Aucune absorption digestive.
Demi-vie longue, autorisant 2 administrations par jour (vancomycine), voire une seule (teicoplanine).
Diffusion médiocre.
Élimination urinaire.
Effets secondaires
Toxicité rénale et auditive.
Réaction cutanée (red man syndrome) si perfusion trop rapide de vancomycine.
Autres familles d’antibiotiques
Certaines classes antibiotiques ne comportent qu’une seule molécule d’usage courant.
Cyclines (doxycycline)
Mécanisme d’action
Fixation à la sous-unité 30S du ribosome de la bactérie, bactériostatique.
Pharmacocinétique
Absorption digestive excellente, diminuée si prise concomitante de calcium ou antiacide.
Bonne diffusion, sauf système nerveux central.
Demi-vie longue, permettant une prise quotidienne unique.
Élimination hépatique prédominante.
Indications
Infections génitales ou pneumopathies à mycoplasme ou à Chlamydophila sp.
Fièvre Q.
Rickettsioses.
Pasteurellose.
Infections à spirochètes (Lyme, syphilis, leptospirose).
Traitement préventif du paludisme.
Effets indésirables
Photosensibilisation.
Troubles osseux et dentaires (enfant de moins de 8 ans).
Tératogénicité.
Contre-indications
Femme enceinte ou allaitante.
Enfant de moins de 8 ans.
Rifamycines (rifampicine)
Mécanisme d’action
Bloquent la transcription par action sur la sous-unité bêta de l’ARN polymérase bactérienne.
Bactéricides.
Indications
À prescrire en association à un autre antibiotique pour les traitements curatifs, en raison du risque d’émergence rapide de résistance sous traitement :
- tuberculose et autres mycobactéries ;
- infections à staphylocoques sur matériel étranger (prothèses ostéo-articulaires, valvulaires, vasculaires) ;
- chimiprophylaxie après exposition au méningocoque.
Pharmacocinétique
Biodisponibilité bonne si prise à jeun.
Excellente diffusion.
Demi-vie longue.
Élimination hépatique.
Effets indésirables
Hépatotoxicité si autres hépatotoxiques.
Hypersensibilité (fièvre, thrombopénie, insuffisance rénale).
Tolérance digestive
=> Précautions à prendre :
- avertir le patient de la coloration orangée systématique des liquides biologiques (urines, larmes), réversible ;
- prévenir les interactions, la rifampicine étant un inducteur puissant du métabolisme hépatique de nombreux médicaments.
° risque d’inefficacité de la contraception orale imposant l’utilisation d’une contraception mécanique durant le traitement par rifampicine,
° anticoagulants oraux : coprescription possible seulement avec antivitamine-K (AVK), avec un suivi rapproché de l’international normalized ratio (INR) lors de l’introduction et lors de l’arrêt de la rifampicine,
° surveillance rapprochée des médicaments à indice thérapeutique étroit (anticonvulsivants, immunosuppresseurs).
Inhibiteurs de la synthèse d’acide folique (triméthoprime-sulfaméthoxazole)
Mécanisme d’action
Inhibent la synthèse d’ADN bactérien par blocage de la synthèse d’acide folique.
Pharmacocinétique de l’association
Bonne biodisponibilité.
Excellente diffusion (système nerveux central, prostate, os).
Demi-vie longue (9-12 heures).
Élimination urinaire.
Indications
Infections à S. aureus (y compris SARM).
Pneumocystose, toxoplasmose cérébrale.
Antibioprophylaxie pour les immunodépressions cellulaires prolongées, en raison de son spectre large : antibactérien, antiparasitaire, et antifongique (pneumocystose).
Effets indésirables
Allergies, parfois mortelles (Lyell).
Cytopénies.
Hépatites.
Autres
Lipopeptides (daptomycine)
Agit sur la membrane bactérienne, bactéricide.
Bonne diffusion, demi-vie longue, uniquement par voie intraveineuse.
Indications : infections à staphylocoques multirésistants.
Effets indésirables : rhabdomyolyse.
Oxazolidinone (linézolide, tédizolide)
Inhibent la synthèse protéique, bactériostatiques.
Bonne diffusion, demi-vie longue.
Indications : infections à staphylocoques multirésistants, tuberculose multirésistante.
Effets indésirables : cytopénies, neuropathie périphérique, acidose lactique (linézolide surtout, si traitements prolongés).
Imidazolés (métronidazole)
Inhibent la synthèse protéique (bactériostatique).
Bonne diffusion, demi-vie moyenne.
Indications : infections à bactéries anaérobies, amœbose, giardiose, trichomonose.
Effets indésirables : neuropathie périphérique, effet antabuse.
POINTS FORTS À RETENIR
Les antibiotiques ont tous des effets collatéraux : ils ont toujours un impact sur des bactéries qui ne sont pas responsables de l’infection que l’on souhaite traiter. Pour limiter cet impact sur les flores du patient (son microbiote), il ne faut prescrire des antibiotiques que lorsque leur bénéfice est probable, avec une cible la plus étroite possible.
Les bêta-lactamines sont les principaux antibiotiques prescrits chez l’Homme, avec un spectre très variable, de la pénicilline G (spectre le plus étroit) aux carbapénèmes (spectre le plus large).
Les fluoroquinolones présentent de nombreux atouts pour la prescription en routine (excellente biodisponibilité, bonne diffusion, demi-vie permettant 1 à 2 prises/jour, activité sur la plupart des bactéries sauvages pathogènes chez l’Homme). Par contre, la sélection de résistance est particulièrement rapide dans cette classe : leur prescription doit donc être limitée aux situations où il n’existe pas d’alternative satisfaisante
Les macrolides et la doxycycline sont principalement utilisées pour leur activité sur les bactéries intra-cellulaires, notamment dans le traitement des pneumopathies atypiques et des infections sexuellement transmissibles (IST).

 Encadrés
Encadrés