objectifs
Prescrire et surveiller un traitement anti-infectieux.
Antiviraux Connaître les principales molécules antivirales anti-Herpesviridae. Connaître les principales indications et modalités d’utilisation des antiviraux au cours de la grippe. Connaître les classes d’antirétroviraux disponibles et leurs principaux effets indésirables.
Antiparasitaires Connaître les principales molécules antiparasitaires et leurs indications.
Antifongiques Connaître les principales molécules antifongiques, leurs indications et modalités d’utilisation.
Bon usage des anti-infectieux Connaître les principales situations cliniques nécessitant une documentation microbiologique. Connaître l’impact écologique des anti-infectieux et les facteurs d’émergence de la résistance aux anti-infectieux. Connaître les principales situations cliniques en infectiologie ne relevant pas d’une prescription d’anti-infectieux. Connaître les recommandations de prise en charge des patients porteurs ou susceptibles de porter des bactéries hautement résistantes. Préciser les critères de choix de l’antibioprophylaxie dans le cadre chirurgical. Connaître l’organisation de la lutte contre les infections associées aux soins dont la surveillance des infections du site opératoire. Expliquer les mesures de prévention des principales infections associées aux soins (v. item 4).
Antiviraux (rang B)
Généralités sur les antiviraux
Les antiviraux sont virostatiques, en inhibant la réplication virale. Peu d’infections virales sont accessibles à un traitement spécifique : Herpes simplex virus (HSV), cytomégalovirus (CMV), virus varicelle-zona (VZV), virus de l’hépatite B (VHB), virus de l’hépatite C (VHC), virus de l’immunodéficience humaine (VIH) et virus influenza.
Des résistances aux antiviraux peuvent émerger, le plus souvent par mutation des cibles virales. Ces mutations sont favorisées par la réplication du virus en présence de concentrations infrathérapeutiques (dose insuffisante, mauvaise observance, malabsorption).
Principales classes d’antiviraux
Anti-Herpes virus : HSV, VZV, CMV (tableau 1)
Mécanismes d’action
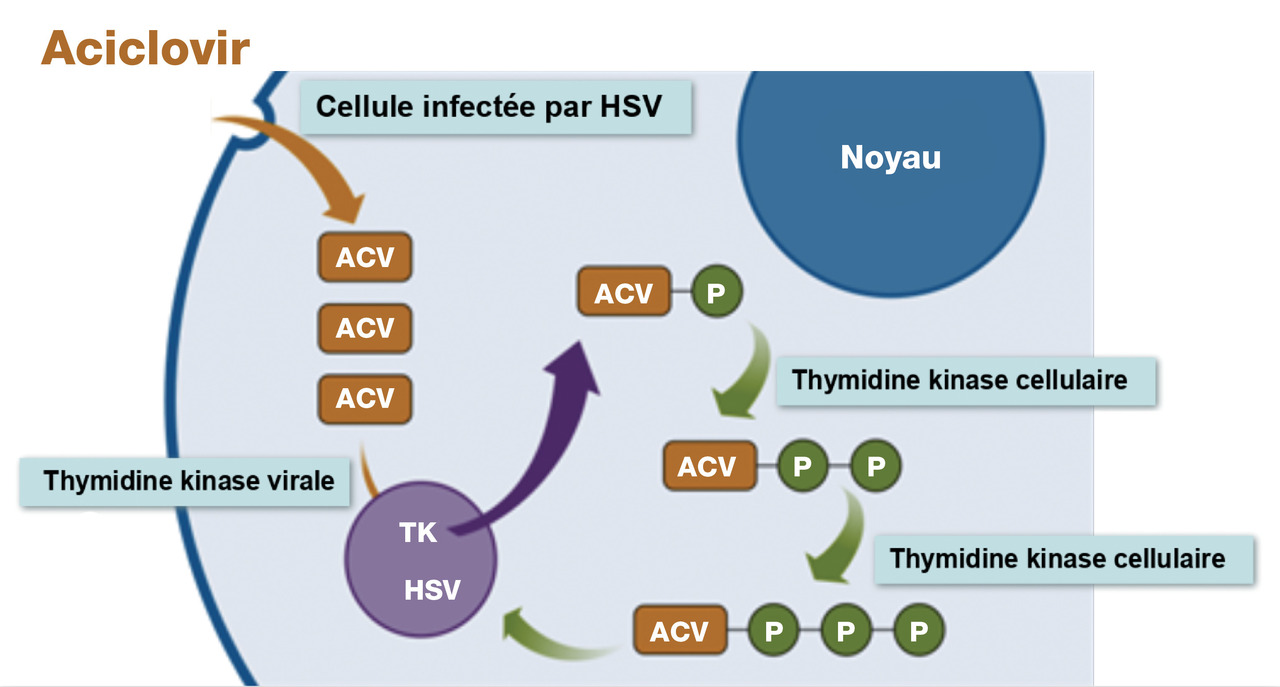
Ils ont pour cible l’ADN polymérase et bloquent la synthèse de l’ADN viral :
- par compétition avec les nucléosides naturels (analogues nucléosidiques) :
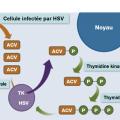
° l’aciclovir nécessite une triple phosphorylation pour être actif, la première étant réalisée par la thymidine kinase virale, les deux suivantes par des enzymes cellulaires (
° le valaciclovir est une prodrogue de l’aciclovir,
° le ganciclovir est transformé en forme triphosphatée par la phosphotransférase UL97 virale, puis par les enzymes cellulaires, puis s’incorpore à l’ADN et inhibe sa synthèse,
° le valganciclovir est une prodrogue du ganciclovir ;
- par inhibition directe, sans phosphorylation préalable : le foscarnet.
Pharmacocinétique
Aciclovir, ganciclovir et foscarnet ont une biodisponibilité médiocre qui impose une utilisation parentérale.
Les prodrogues valaciclovir et valganciclovir ont des biodisponibilités de 50-60 %.
Élimination urinaire, nécessitant une adaptation en cas d’insuffisance rénale.
Effets indésirables
Aciclovir : insuffisance rénale par cristallurie, surtout en cas de déshydratation, surdosage, ou autres néphrotoxiques. Prévention par une hydratation suffisante et une perfusion prolongée.
Ganciclovir : toxicité hématologique dose-dépendante dominée par la neutropénie ; effet mutagène.
Foscarnet : néphrotoxicité, troubles hydroélectolytiques, ulcérations génitales.
Antigrippaux
Mécanismes d’action
Inhibiteurs de la neuraminidase : oséltamivir et zanamivir bloquent la libération des virions à partir des cellules infectées, actifs sur virus influenza A et B.
Inhibiteurs de la protéine M2 : amantadine, empêche la décapsidation et la libération des acides nucléiques viraux, active seulement sur virus influenza A.
Pharmacocinétique
La biodisponibilité de l’oséltamivir est de 75 %. Le zanamivir est utilisé par voie inhalée.
Effets indésirables
Oséltamivir : troubles gastro-intestinaux transitoires.
Zanamivir : bronchospasme.
Amantadine : troubles neurologiques (vertiges, insomnie) et digestifs.
Spectre, molécules et indications (tableau 2)
L’oséltamivir est privilégié compte-tenu de sa simplicité, de sa tolérance, d’une activité sur influenza A et B, et d’un faible risque de résistance. Néanmoins, son efficacité reste modérée, principalement documentée en cas d’instauration précoce (avant 48 heures à partir du début des signes). Sa prescription n’est pas systématique.
Antirétroviraux (tableau 3)
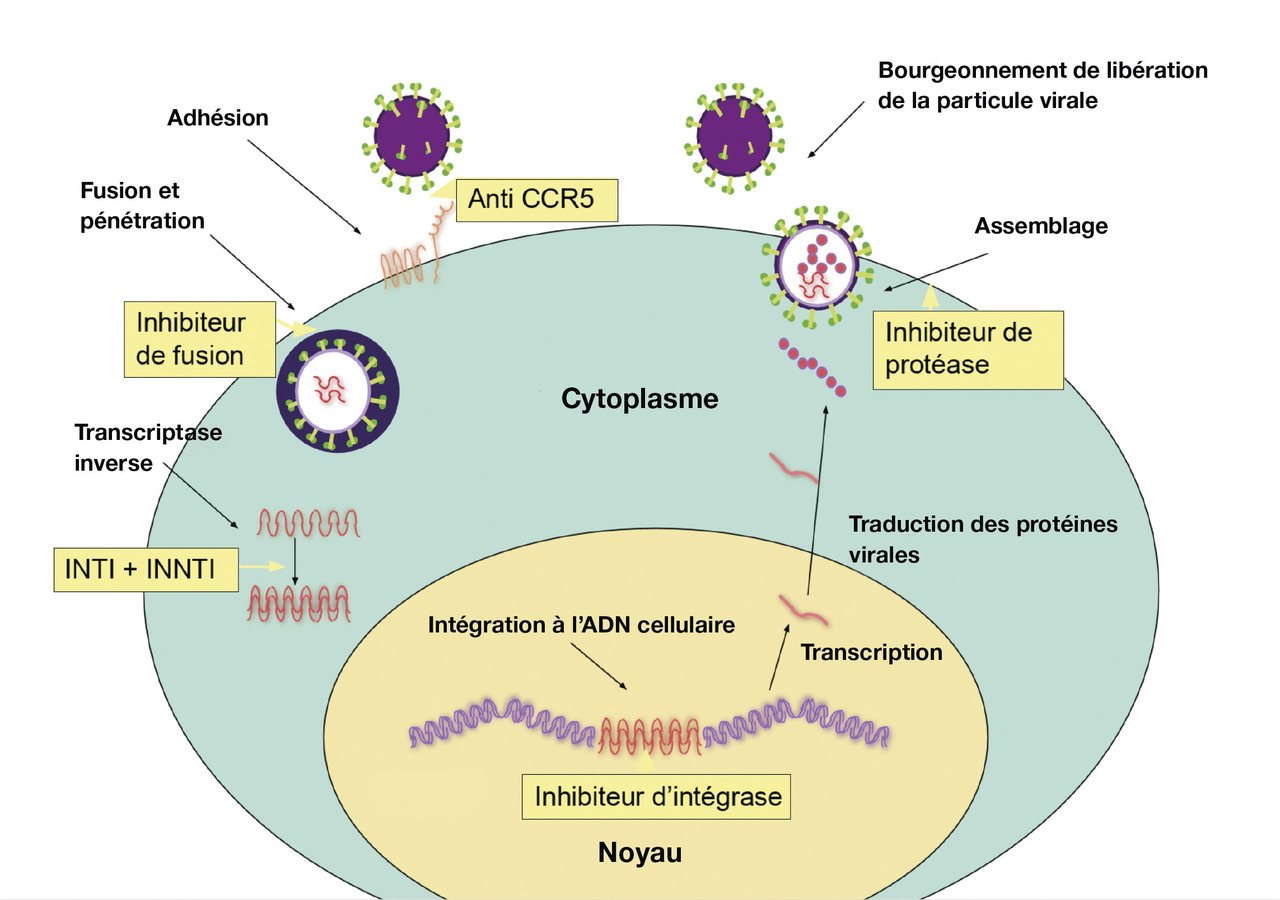
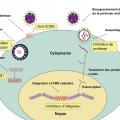
Les antirétroviraux (ARV) inhibent la réplication à différentes étapes du cycle de réplication du VIH (
- inhibiteurs de la transcriptase inverse, nucléosidiques (INTI), ou non nucléosidiques (INNTI) ;
- inhibiteurs de protéases (IP) ;
- inhibiteurs d’intégrases (INI).
Inhibiteurs de la transcriptase inverse
On distingue deux sous-classes :
- les inhibiteurs nucléosidiques ou nucléotidiques de la transcriptase inverse (INTI) : ils inhibent l’élongation de l’ADN proviral par incorporation à la chaîne d’ADN ;
- les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI) : ils sont inactifs sur VIH-2 et sur les VIH-1 du groupe O. Leur barrière génétique est faible.
Antiprotéases ou inhibiteurs de protéase (IP)
Les inhibiteurs de protéase se fixent sur le site catalytique de la protéase, empêchant la formation de particule virale infectieuse. Ils ont une puissance antirétrovirale importante, et leur barrière génétique est élevée (moindre risque d’émergence de résistance). Le seul IP qui est recommandé en 2021 est le darunavir, associé à un « booster » (ritonavir, ou cobicistat), qui inhibe le métabolisme du darunavir, permettant de garantir des concentrations thérapeutiques avec une prise par jour. Les effets secondaires généraux sont essentiellement digestifs et métaboliques (hyperlipidémie, lipodystrophie). Les interactions médicamenteuses sont à surveiller.
Inhibiteurs d’intégrase (INI)
Ils inhibent l’intégration de l’ADN proviral au génome cellulaire. Le raltégravir, l’elvitégravir (associé au cobicistat), le dolutégravir et le bictégravir sont les 4 INI disponibles en France en 2021. Le cabotégravir, qui s’administre sous forme d’une injection sous-cutanée toutes les 4 semaines, devrait être le premier ARV « retard » disponible en thérapeutique. Les INI entraînent une baisse de la charge virale très rapide et sont bien tolérés, avec peu d’interactions médicamenteuses.
Le traitement antirétroviral est recommandé chez toutes les sujets infectées par le VIH, quel que soit le nombre de T CD4+ du fait :
- d’un meilleur pronostic à long terme chez les patients qui n’ont jamais présenté de baisse des lymphocytes T CD4+ ;
- du bon profil de tolérance et de la simplicité des combinaisons d’ARV disponibles ;
- d’un effet majeur du traitement sur le risque de contamination : un patient avec une charge virale plasmatique indétectable grâce au traitement n’est plus contagieux.
Le traitement recommandé en 1re ligne, en France, en 2021, comporte deux inhibiteurs nucléosidiques de la transcriptase inverse : ténofovir + emtricitabine ou abacavir + lamivudine, associés à :
- soit un INI : bictégravir, dolutégravir, elvitégravir ou raltégravir ;
- soit un INNTI : rilpivirine ;
- soit un IP boosté par le ritonavir : darunavir-ritonavir.
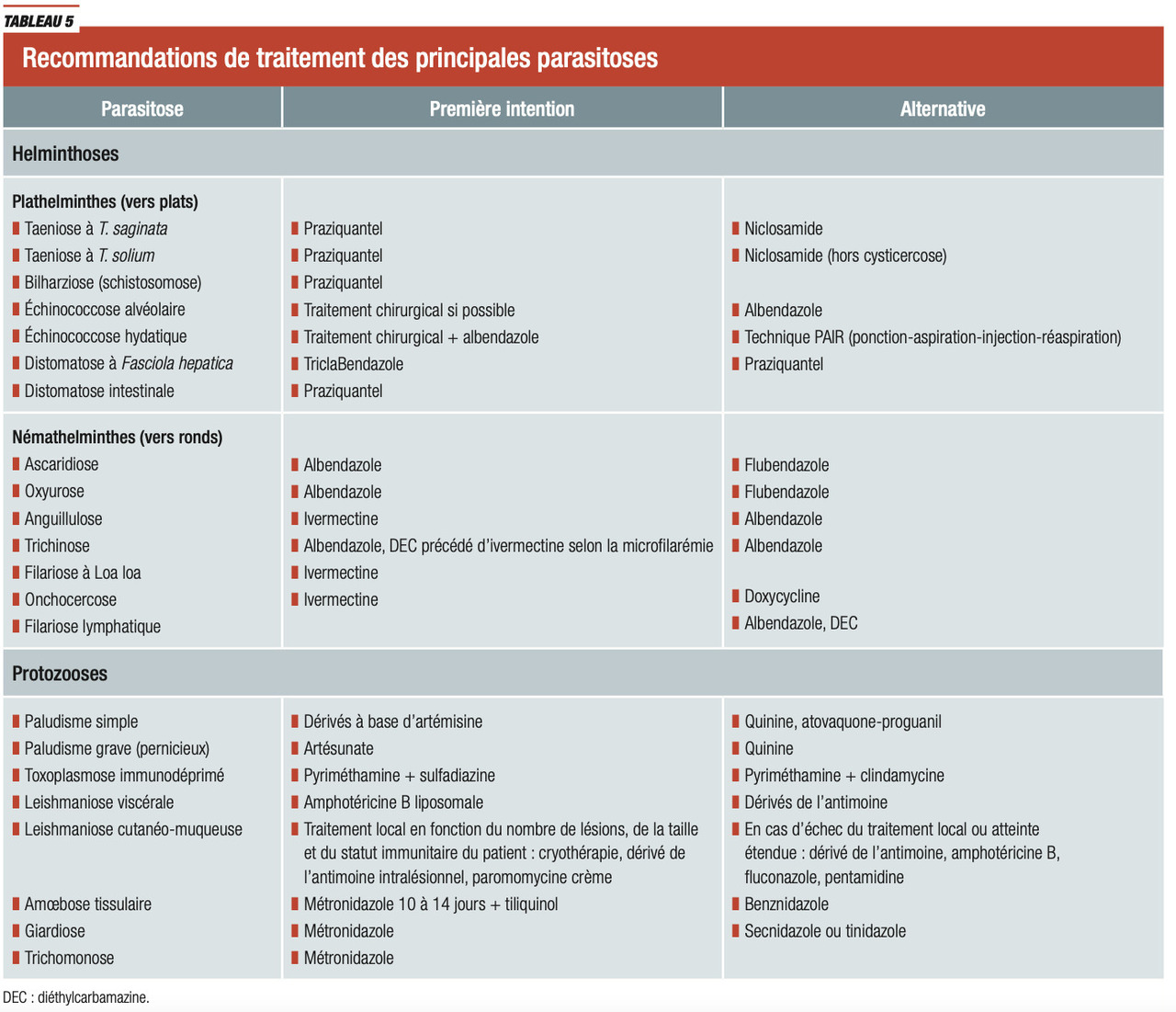
Antiparasitaires (rang B)
La prévalence des maladies parasitaires est importante au niveau mondial, et souvent négligée. En France, les antiparasitaires se prescrivent essentiellement dans le cadre des maladies d’importation. Les antipaludéens ne seront pas détaillés dans ce chapitre, puisqu’un item spécifique est dédié à cette pathologie.
Certains antibiotiques ont une action antiparasitaire :
- cotrimoxazole, actif sur la toxoplasmose et l’isosporose ;
- métronidazole, actif sur les giardioses et amœboses ;
- sulfadiazine, clindamycine et macrolides, actifs sur la toxoplasmose.
Les principaux antiparasitaires et leurs indications sont résumés dans les
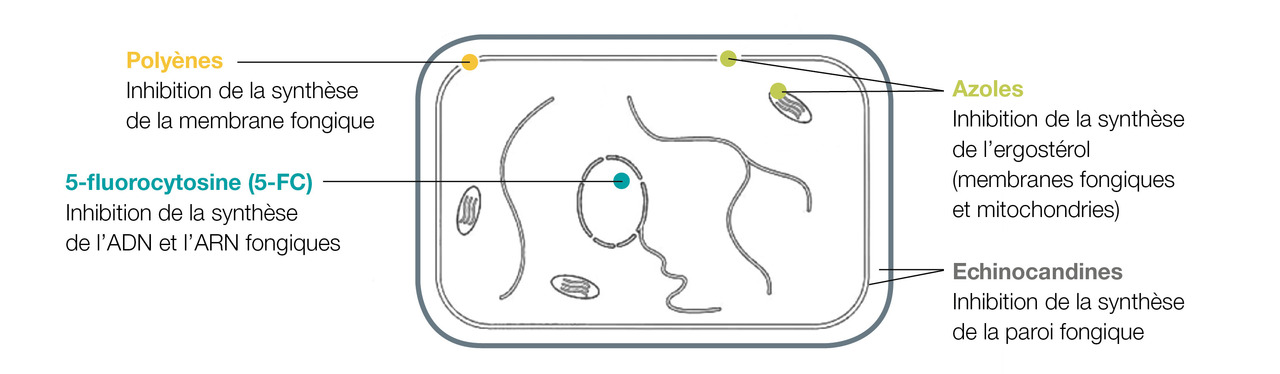
Antifongiques systémiques (rang B)
Il existe 4 classes d’antifongiques (
Les polyènes : amphotéricine B désoxycholate (AmB), ou liposomale (L-AmB) inhibent la synthèse de la membrane fongique en se fixant sur l’ergostérol.
Les azolés : fluconazole, itraconazole, voriconazole, posaconazole, isavuconazole inhibent la synthèse de l’ergostérol.
La 5-fluorocytosine (5-FC) inhibe la synthèse des acides nucléiques fongiques
Les échinocandines : caspofungine, micafungine et anidulafungine inhibent la synthèse du bêta-(1,3)-D-glucane, constituant de la paroi fongique de la plupart des champignons (absent chez cryptocoque).
Disponible en ligne
Plusieurs quiz (questions ouvertes et QCM) https://www.larevuedupraticien.fr/les-tests
POINTS FORTS À RETENIR
Cette question peut paraître rébarbative et accessoire, car elle fait le catalogue de traitements anti-infectieux hétérogènes dans leurs indications, mécanismes d’action, et modalités de surveillance. Paradoxalement, les items correspondant aux maladies sont en général peu exigeants sur la partie thérapeutique, où l’étudiant est censé connaître les principes de traitement, sans rentrer dans le détail des posologies ou des surveillances.
Les points qui nous semblent importants à retenir sont ceux pour lesquels les recommandations ont changé au cours des dernières années : – le traitement de référence du paludisme grave n’est plus la quinine : c’est désormais l’artésunate injectable qui est recommandé en première intention (Haut Conseil de la santé publique, 2013) ; – un traitement antirétroviral doit être proposé à toute personne infectée par le VIH, quels que soient son taux de lymphocytes CD4+ et sa charge virale VIH (rapport du groupe d’experts, sous la direction du Pr Morlat, 2013).
Il faut par ailleurs bien connaître : – les indications des traitements antiviraux hors VIH (oséltamivir pour la grippe, aciclovir ou valaciclovir pour les HSV-1, HSV-2 et VZV ; ganciclovir ou valganciclovir pour le CMV) ; – les chimioprophylaxies qu’on peut proposer en vue d’un séjour en zone 3 de chloroquinorésistance (doxycycline, méfloquine, ou atovaquone-proguanil) ; – les grandes classes d’antifongiques indiqués pour le traitement des mycoses invasives (azolés, échinocandines, et polyènes).

 Encadrés
Encadrés