Objectifs
Faire la prescription et la surveillance des classes de médicaments les plus courantes chez l’adulte et chez l’enfant.
Connaître pour chacune les mécanismes d’action de classe et des produits individuels, les principes du bon usage, les critères de choix d’un médicament en première intention, les causes d’échec, les principaux effets indésirables et interactions.
Voir aussi : items 291/294
Introduction
L’histoire du traitement médical des cancers remonte au XIXe siècle, avec les premières tentatives de chirurgie ablative dans les cancers hormonosensibles : ovariectomie pour les cancers du sein, pulpectomie dans les cancers de la prostate. Secondairement, au cours du XX siècle, les progrès de l’endocrinologie vont aboutir à l’utilisation thérapeutique d’hormones, comme les estrogènes dans le cancer de la prostate. L’hormonothérapie moderne débute ensuite, avec, par exemple, la mise au point d’antagonistes comme le tamoxifène pour le cancer du sein dans les années 1970, encore prescrit de nos jours.
La chimiothérapie se développe au décours de la Seconde Guerre mondiale, initialement dans les hémopathies malignes. Les premiers cytotoxiques sont des dérivés des moutardes azotées (agents alkylants ayant pour propriété de former des liaisons covalentes avec l’ADN) initialement utilisées comme gaz de combat. Viendront ensuite les antimétabolites (dont le méthotrexate, qui est un antifolique), puis les autres classes thérapeutiques qui seront progressivement utilisées dans les tumeurs solides, en pédiatrie puis chez l’adulte, dans les décennies suivantes.
Depuis le début du XXe siècle, on assiste au développement des thérapeutiques ciblées, qui sont des médicaments anticancéreux ciblant un récepteur ou un mécanisme précis de la tumeur, préalablement identifié. Ces traitements n’ont pas les toxicités classiques des chimiothérapies et sont souvent considérés comme mieux tolérés. Enfin, l’immunothérapie, après de multiples tentatives infructueuses (BCG-thérapie, interleukine 2, interféron), connaît un développement majeur avec la découverte récente des protéines PD1 et CTLA4 (qui ont valu à James P. Allison et Tasuku Honjo le prix Nobel de médecine en 2018).
En France, seuls les médecins titulaires d’un diplôme d’études spécialisées (DES) en oncologie médicale ou d’un diplôme d’études spécialisées complémentaires (DESC) de cancérologie – ce dernier remplacé depuis la réforme du 3e cycle des études médicales par la formation spécialisée transversale en cancérologie (FST) – sont autorisés à prescrire les traitements cytotoxiques. En revanche, la prescription des chimiothérapies locales (par exemple intravésicales pour les tumeurs urothéliales de petit stade) et des hormonothérapies reste accessible aux spécialistes d’organes.
Compte tenu de la prévalence des cancers dans la population générale, tout médecin sera cependant confronté dans sa pratique aux effets secondaires des traitements antitumoraux, qu’il importe donc de connaître dans les grandes lignes.
Chimiothérapie (agents cytotoxiques)
Principes d’action
L’instabilité génétique fait partie des caractéristiques propres aux cellules tumorales. Elle est source de mutations qui peuvent conduire à une altération des systèmes de réparation de l’ADN et de l’apoptose, ou encore favoriser la prolifération et la survie.
La sensibilité des cellules tumorales à la chimiothérapie est en partie expliquée par :
- leurs difficultés à réparer les altérations de l’ADN induites par la chimiothérapie ;
- leurs taux de division souvent plus élevés que pour le tissu sain dont elles dérivent.
Principes d’administration
Concernant les protocoles de chimiothérapie :
- association de cytotoxiques : l’histoire de la chimiothérapie anticancéreuse repose sur les associations de drogues ou polychimiothérapies. En théorie, ces associations sont plus efficaces en termes de réponse, en permettant de contourner les problématiques d’hétérogénéité tumorale et de résistance. En multipliant le nombre de drogues, on augmente aussi les toxicités ;
- répétition des séances : fondé sur l’effet différentiel, le délai entre chaque chimiothérapie étant fait pour recouvrer des toxicités, en particulier hématologiques ;
- durée de traitement : déterminée par les toxicités et la durée nécessaire à l’obtention d’une réponse tumorale.
- dose-intensité : pour la plupart des tumeurs, une diminution de dose de chimiothérapie par unité de temps conduit à une diminution d’efficacité.
Classification des anticancéreux cytotoxiques
Les cytotoxiques (
L’ADN tumoral, avec :
- ajout d’un groupement soit par ajout d’un groupe alkyl (alkylant, par exemple le cyclophosphamide), sels de platine (par exemple le cisplatine) ;
- inducteur ou stabilisateur des agents de cassures de l’ADN : les topo-isomérases induisant des lésions simple brin (topo-isomérase I, par exemple l’irinotécan) ou double brin (topo-isomérase II, par exemple l’anthracycline) que les inhibiteurs de topo-isomérase stabilisent ;
- inhibiteur de la synthèse des acides nucléiques : antimétabolites :
- par inhibition de synthèse des bases : antifolate (méthotrexate),
- par analogues non fonctionnels antipuriques et antipyrimidiques (gemcitabine, 5-FU, fludarabine).
Le fuseau mitotique :
- inhibiteur de la polymérisation des microtubules (vinca-alcaloïdes, par exemple la vincristine) ;
- inhibiteur de la dépolymérisation des microtubules (taxanes, par exemple le docétaxel).
Mécanisme de résistance
La résistance aux traitements est malheureusement toujours une réalité dans le traitement médical des cancers. Elle peut être primaire ou secondaire induite par une sélection de clones résistants.
On peut distinguer plusieurs mécanismes.
Liés au patient : essentiellement associés à une diminution des concentrations actives de la drogue : pharmacogénomique individuelle modifiant le métabolisme « normal » de la drogue, interactions médicamenteuses, barrières physiologiques telles que les jonctions serrées de la barrière hémato-encéphalique.
Liés à la tumeur : mécanismes multifactoriels, avec une résistance d’emblée ou acquise et dépassant largement le cadre de cet article. On peut citer le défaut d’entrée intracellulaire, l’efflux cellulaire (pompe « multidrug resistance » ou MDR), l’inactivation intracellulaire, la surexpression de la cible, l’hyperactivation des mécanismes de réparation et l’altération des voies de mort cellulaire.
Indications
Maladies macro-métastatiques, dans un but essentiellement palliatif (sauf parfois si une chirurgie des métastases est réalisable, ou dans le cas de certaines tumeurs chimiosensibles : tumeurs germinales et certains cancers pédiatriques).
Association à un traitement local pour permettre la chirurgie, ou à visée d’épargne fonctionnelle autorisant une chirurgie moins mutilante pour certaines tumeurs localement évoluées (chimiothérapie dite première ou néo-adjuvante).
Complément de traitement après traitement local pour traiter la maladie micrométastatique et donc augmenter les chances de guérison en réduisant le risque de survenue de métastases (chimiothérapie adjuvante).
Objectifs
Curatif : l’objectif est d’éradiquer la maladie micrométastatique (habituellement après traitement local, cas des traitements adjuvants), plus difficilement macrométastatique (souvent alors en association avec d’autres modalités).
Palliatif : dès lors qu’il n’est plus possible d’éradiquer la maladie, on est dans une situation palliative où l’objectif est d’obtenir un contrôle durable de la maladie. Les lignes successives de chimiothérapie permettent alors d’améliorer la survie de quelques mois à plusieurs années et d’améliorer la qualité de vie en contrôlant les symptômes liés au cancer.
Complications
Les complications seront dépendantes du protocole de chimiothérapie, de l’état général et des comorbités du patient. On sépare classiquement les effets précoces (immédiats et < 1 mois), souvent réversibles, et les complications différées, parfois définitives.
Les toxicités sont gradées de I à IV dans le système CTCAE (Common Terminology Criteria for Adverse Events), les toxicités de grades I et II étant minimes à modérées, de grade III sévères et nécessitant l’hospitalisation, de grade IV mettant en jeu le pronostic vital (
Aiguës (< 1 mois)
La majorité des agents de chimiothérapie sont actifs sur les cellules en division. Les toxicités sont donc d’autant plus marquées pour les cellules saines qu’elles se divisent rapidement, comme les cellules des muqueuses et les cellules hématopoïétiques. Les symptômes suivants sont les plus fréquemment rencontrés et font appel à des mesures adaptées et spécifiques.
Allergies
Les réactions allergiques ou d’hypersensibilité sont plus fréquentes avec certaines drogues, parfois létales en cas de choc anaphylactique (paclitaxel, oxaliplatine). Elles sont prévenues par des prémédications prévues dans le protocole d’administration du traitement.
Nausées et vomissements chimio-induits
On distingue les nausées et vomissements chimio-induits aigus, survenant au cours du traitement et dans les 24 premières heures après celui-ci, et les nausées et vomissements chimio-induits retardés survenant dans les jours qui suivent. Les nausées et vomissements chimio-induits aigus sont liés à l’activation de la voie sérotoninergique (récepteurs 5-HT3) et sont prévenus par les anti-5-HT3 (classe des sétrons), alors que les nausées et vomissements chimio-induits retardés sont liés à l’activation des récepteurs NK1, inhibés par l’aprépitant ou le nétupitant commercialisé plus récemment. Les sétrons ont une efficacité très limitée dans les nausées et vomissements chimio-induits retardés.
Les chimiothérapies sont classées selon leur caractère émétogène (
Les corticoïdes (dexaméthasone ou prednisone) potentialisent les antiémétiques.
Les indications de traitement préventif sont résumées dans le
Hématotoxicité
Les chimiothérapies sont toxiques sur les trois lignées sanguines :
- la neutropénie est une complication fréquente qui est observée vers le J8 post-chimiothérapie. Elle est considérée comme sévère si les polynucléaires neutrophiles (PNN) sont < 500/mm3, induisant un risque élevé de fièvre (on parle alors de neutropénie fébrile, qui est une urgence oncologique) ;
- l’anémie survient au cours des semaines suivant le début du traitement. Elle est observée plus fréquemment avec certaines chimiothérapies (organoplatines). Elle est généralement multifactorielle car il s’y associe souvent une carence martiale et une composante inflammatoire ;
- la thrombopénie est plus rare dans le traitement des tumeurs solides qu’en hématologie. Elle survient un peu plus tardivement que la neutropénie, souvent après le J10, et peut nécessiter des transfusions plaquettaires (selon le contexte et le risque hémorragique, habituellement si les plaquettes sont < 20 000/mm3 ou en cas de saignement actif).
La toxicité hématologique des chimiothérapies est une indication aux traitements symptomatiques.
Neutropénie :
- prophylaxie primaire par G-CSF à partir du J2 postchimiothérapie (pendant 8-10 j ou en une injection unique si prescription d’un G-CSF à longue durée d’action) ;
- en cas de risque de neutropénie sévère > 20 % (par exemple, bithérapie par sels de platine et étoposide pour le traitement des cancers bronchiques à petites cellules) ;
- à discuter selon le contexte clinique (pathologies associées, sujet âgé, isolement…) en cas de risque compris entre 10 et 20 % :
- prophylaxie secondaire en cas de neutropénie < 500/mm3 ou de neutropénie fébrile au cycle précédent,
- en cas de fièvre > 38,5 °C, il s’agit d’une neutropénie fébrile qui doit être prise en charge en urgence : antibiothérapie probabiliste à large spectre (bêtalactamine ± aminoside ou quinolone) sans attendre les résultats des prélèvements bactériologiques (à adapter secondairement selon les résultats de l’antibiogramme, mais il est fréquent que les prélèvements reviennent négatifs).
Anémie :
- dans tous les cas, il faut au préalable dépister et corriger une carence martiale (dosage de la ferritinémie) ;
- chez les patients traités pour cancer, les réserves en fer sont habituellement élevées (ferritinémie haute ou normale) du fait notamment du syndrome inflammatoire, sauf en cas de saignement chronique ou de chirurgie « lourde ». Le cas de figure habituel associe à une anémie inflammatoire une carence fonctionnelle avec un coefficient de saturation de la transferrine (CST) < 20 % liée à un défaut de mobilisation des réserves en fer. La correction de la carence martiale se fait préférentiellement avec du fer IV (carboxymaltose ferrique) qui est plus commode, mieux toléré et plus rapidement efficace que le fer oral ;
- en cas d’anémie mal tolérée peut se discuter un traitement par érythropoïétine recombinante (EPO) ou une transfusion. L’EPO n’est pas indiquée chez les patients ne recevant pas de chimiothérapie ; son utilisation doit tenir compte de son rapport risque-bénéfice, notamment en situation de curabilité, car elle augmente le risque thromboembolique et a été responsable dans certains essais cliniques d’une légère surmortalité ;
- de façon schématique, l’EPO est instaurée lorsque l’Hb est < 10 g/dL avec un taux cible de 12 g/dL (elle doit augmenter de 1 g/dL au bout d’un mois de traitement) ;
- les anémies sévères (< 8 g/dL) ont besoin d’être corrigées rapidement et sont des indications transfusionnelles.
Attention ! la tolérance de l’anémie (et donc les indications d’EPO ou de transfusion) s’évalue cliniquement (une anémie à 8 g/dL d’installation progressive peut être bien mieux tolérée qu’une anémie à 9 g/dL d’apparition rapide).
Fatigue chronique
C’est une plainte fonctionnelle majeure au même titre que la douleur. Elle concerne, suivant les localisations et les stades, entre 50 et 80 % des patients.
Les causes curables doivent être éliminées, au premier rang desquelles figurent l’anémie et la carence martiale.
Les autres causes qui doivent être recherchées sont :
- un syndrome dépressif ;
- une hypothyroïdie, classiquement fréquente après traitement d’un cancer du sein ou oto-rhino-laryngé (ORL) ;
- une altération du statut nutritionnel ou une carence vitaminique (ne pas oublier les carences en vitamine D, qui sont fréquentes dans la population générale).
Dans un grand nombre de cas, aucune cause évidente n’est retrouvée. La physiopathologie de ce syndrome reste mal comprise (syndrome inflammatoire, désadaptation à l’effort après une inactivité prolongée). Un programme d’activité physique adaptée peut apporter une amélioration significative.
Toxicités cutanéomuqueuses
Il s’agit essentiellement de l’alopécie, induite par certaines chimiothérapies, et de la mucite (inflammation des muqueuses ± aphtes). Ces effets secondaires sont expliqués par l’effet des cytotoxiques sur les tissus à renouvellement rapide.
L’alopécie peut être prévenue dans certains cas par le port d’un casque réfrigérant pendant la séance de chimiothérapie ; il agit par le biais d’une vasoconstriction du cuir chevelu qui réduit la diffusion des cytotoxiques. Il ne faut pas oublier la prescription d’une prothèse capillaire dont une partie est prise en charge par les organismes de Sécurité sociale.
Les mucites peuvent être sévères et gêner l’alimentation, ce qui contribue à la détérioration du statut nutritionnel. Elles sont prévenues par une hygiène bucco-dentaire rigoureuse (dans certains cas, notamment en cas de radiothérapie pour une tumeur ORL, des soins dentaires doivent être pratiqués avant de débuter le traitement) et par des bains de bouche bicarbonatés (sans que l’ajout d’un antiseptique, voire d’un antifongique, au bicarbonate n’ait une efficacité démontrée). Les aphtes sont généralement secondaires à une surinfection fongique sur une muqueuse fragilisée ; ils sont traités par des antifongiques locaux. Il ne faut pas méconnaître les récurrences herpétiques fréquentes.
Chronique (> 1 mois)
Neurologique : neuropathie périphérique définitive (paclitaxel, sels de platine, vinca-alcaloïde), ototoxicité (cisplatine).
Hématologique : potentiel leucémogène des alkylants et des anthracyclines.
Néphrologique : toxicité du cisplatine, pouvant être aiguë avec une atteinte tubulaire, diminuée par une hyperhydratation encadrant l’administration de la drogue et chronique avec l’accumulation des doses.
Cardiaque : insuffisance cardiaque, en particulier avec les anthracyclines. Elle peut être prévenue en évitant d’atteindre les doses cumulatives.
Complications liées à l’abord veineux
Certaines chimiothérapies ont un potentiel vésicant (anthracyclines, vinca-alcaloïdes) et doivent être administrées exclusivement à l’aide d’une voie centrale afin de limiter ce risque. En cas d’extravasation, le potentiel vésicant doit être évalué en urgence et peut nécessiter une prise en charge chirurgicale.
La chambre implantable est, de par les manipulations répétées, à risque d’infection. La présence d’un corps étranger intravasculaire peut aussi se compliquer de thrombose.
Thérapies ciblées
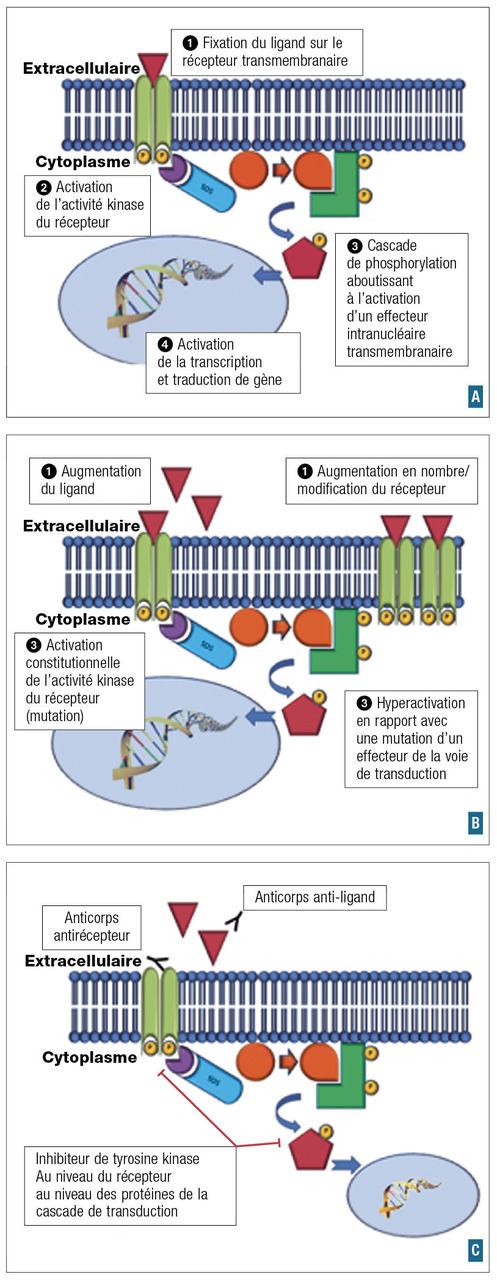
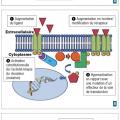
La meilleure compréhension des mécanismes de la cancérogenèse a permis d’identifier des anomalies moléculaires impliquées dans la progression tumorale. Les traitements visant à contrer les conséquences de ces anomalies moléculaires sont appelés « thérapies ciblées ».
Schématiquement, la transduction du signal fait intervenir un ligand (par exemple facteur de croissance), un récepteur et un effecteur secondaire. Le récepteur transmembranaire comprend une partie intracellulaire qui va s’activer lors de la fixation du ligand. S’ensuit l’activation d’un second messager (par exemple protéine kinase et cascade de phosphorylation) qui va aboutir, au niveau nucléaire, à la transcription de gènes et à la production de protéines effectrices.
L’activation d’une voie de l’oncogenèse va pouvoir se situer à chaque niveau (
Dans certains cas, l’anomalie moléculaire est aussi un facteur prédictif de réponse à un traitement ciblant cette anomalie. C’est ainsi qu’on parle de thérapie ciblée : par exemple, la surexpression de HER2 liée à l’amplification du gène HER2 dans le cancer du sein, et la réponse aux anticorps monoclonaux anti-HER2.
Un point important est à souligner : ces anomalies ne sont pas nécessairement spécifiques d’un type de cancer, et l’on va de plus en plus s’orienter vers des traitements en fonction d’anomalies moléculaires et non du site primitif où se développe la tumeur : ainsi, la surexpression de HER2, retrouvée dans 15 % des cancers du sein, peut se voir aussi dans les cancers gastriques, et se traduit par la même efficacité des anticorps anti-HER2.
Deux familles de traitements peuvent être utilisées pour cibler ces anomalies moléculaires : les anticorps monoclonaux et les inhibiteurs de tyrosine kinase.
Anticorps monoclonaux (« -ab »)
Ce sont des molécules de haut poids moléculaire qui ciblent le ligand ou la partie extracellulaire du récepteur membranaire. Elles peuvent être en partie ou totalement humanisées (-umab) ou utiliser une base animale (-imab).
Le trastuzumab est un exemple classique : il s’agit d’un anticorps monoclonal qui cible HER2 et a bouleversé le pronostic de certaines formes de cancers du sein.
Inhibiteurs de tyrosine kinase (TKI)
Molécules de bas poids moléculaire. Elles pénètrent à l’intérieur de la cellule, ciblant la partie intracellulaire du récepteur ou d’autres protéines intracellulaires. On peut notamment citer :
- les inhibiteurs de tyrosine kinase de l’EGFR : erlotinib, géfitinib (par exemple cancer bronchique présentant une mutation activatrice de l’EGFR) ;
- les inhibiteurs de tyrosine kinase d’ALK : crizotinib (par exemple cancer bronchique avec remaniement d’ALK) ;
- les inhibiteurs de tyrosine kinase de BCR-ABL : imatinib, dasatinib (par exemple leucémie myéloïde chronique) ;
- les inhibiteurs de tyrosine kinase de Braf : vémurafénib, dabrafénib (par exemple traitement des mélanomes avec mutation de Braf).
Hormonothérapie
Certaines cellules cancéreuses sont dépendantes de signaux de croissance hormonaux.
Il existe deux principaux moyens de supprimer ce signal : soit en bloquant la production, soit en bloquant la fixation de l’hormone sur son récepteur.
Les deux cancers les plus fréquents, le cancer de la prostate et le cancer du sein, sont des cancers hormonodépendants.
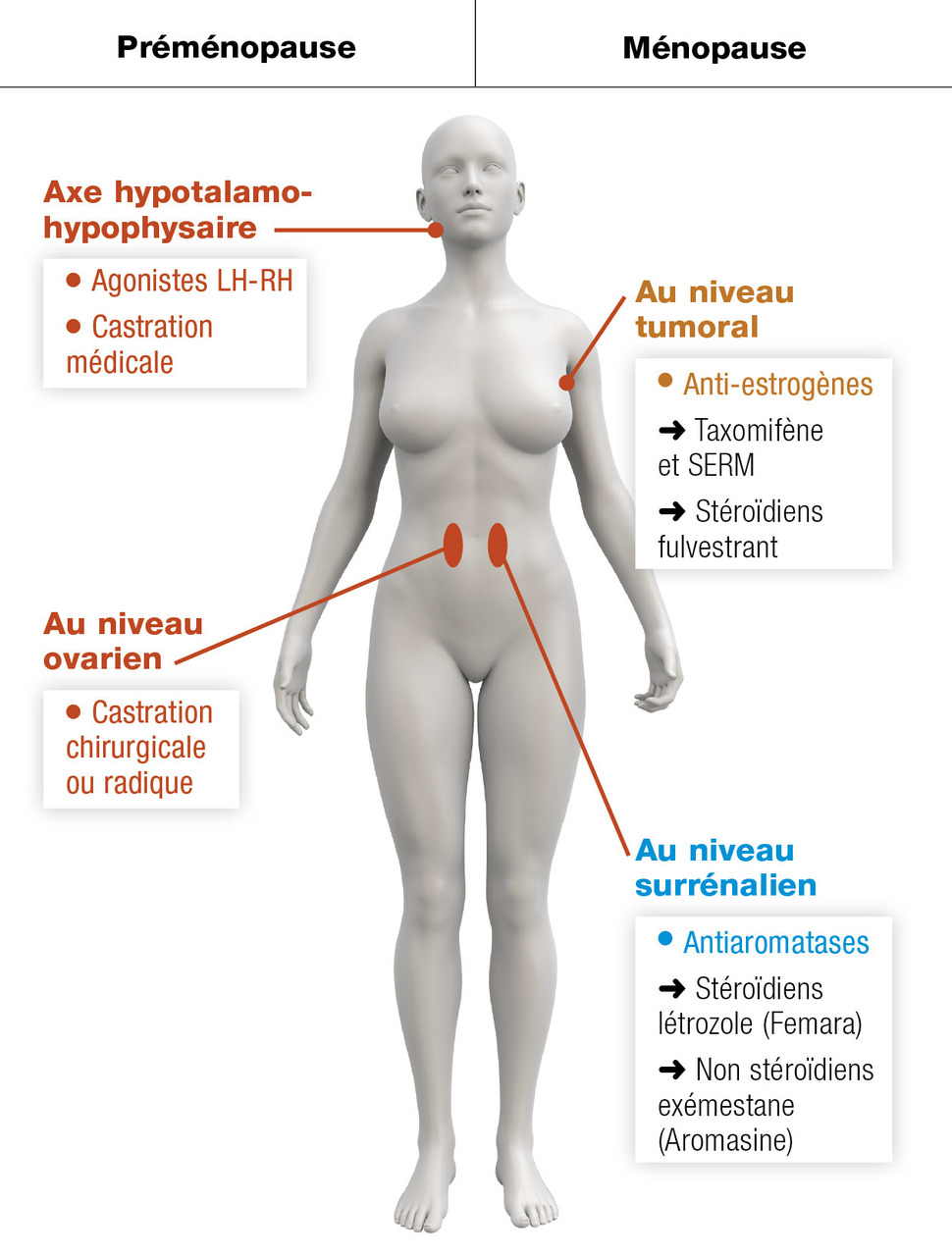
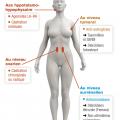
Cancer du sein
Un point majeur à retenir : l’efficacité des traitements hormonaux peut être prédite par l’expression des récepteurs hormonaux au niveau tumoral (notamment des récepteurs à l’estradiol) [
Blocage de la production estrogénique
Avant la ménopause, la production est essentiellement ovarienne, elle est ensuite assurée par la conversion périphérique des androgènes en estrone par les aromatases surrénaliennes.
En cas de production ovarienne, un traitement radical par ovariectomie ou irradiation est envisageable, rapide, peu coûteux et irréversible. La castration chimique est fondée sur l’utilisation d’agonistes de la LH-RH (Zoladex, Enantone), qui suppriment la production ovarienne d’estrogène en inhibant la production cyclique de LH-RH. L’effet est rapide, en quelques semaines, l’administration sous-cutanée ou intramusculaire s’effectue tous les 1 à 3 mois, les effets secondaires sont identiques à la ménopause.
Après la ménopause, les androgènes de production surrénalienne peuvent être transformés en estrogènes par des aromatases. Ces aromatases sont produites dans les cellules adipeuses. Dans cette situation, le blocage chimique est obtenu par les antiaromatases (létrozole, anastrozole, exémestane). L’administration se fait par voie orale. Les effets secondaires doivent être anticipés et prévenus (ostéoporose par dépistage et bisphosphonate, arthralgies).
Blocage de la fixation aux récepteurs estrogéniques
Les anti-estrogènes peuvent être utilisés quel que soit le statut ménopausique.
Certains ont un effet agoniste partiel sur des tissus normaux autres que les cellules cancéreuses, ce qui limite leur action ostéoporotique mais majore le risque de cancer de l’endomètre et le risque thromboembolique (tamoxifène, per os). D’autres ont un effet antagoniste pur (fulvestrant, voie intramusculaire).
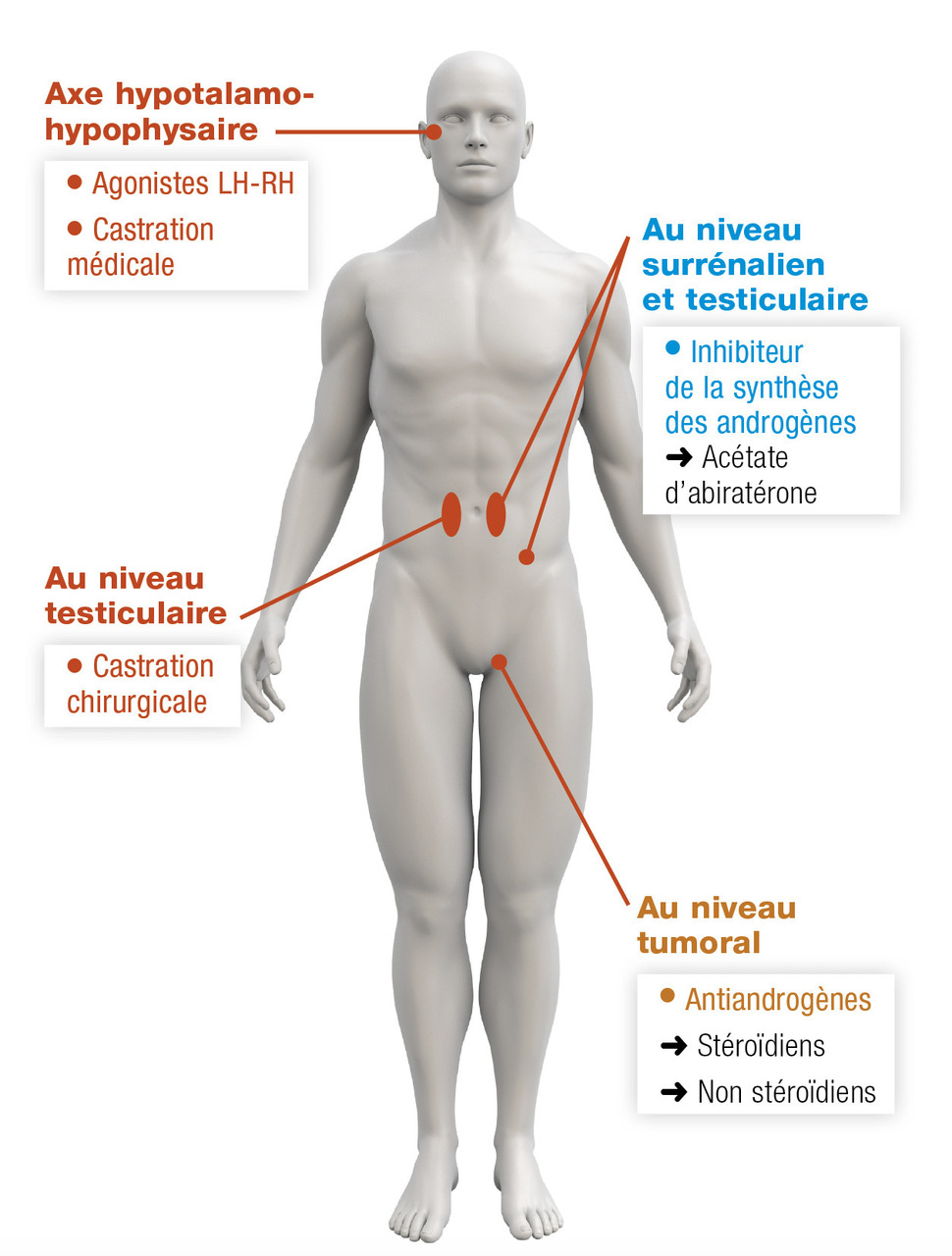
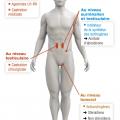
Prostate
La grande majorité des cancers de prostate sont hormonosensibles (85 %), et on ne connaît pas de biomarqueur prédictif de la réponse au traitement (
Blocage de la production androgénique
La production est majoritairement testiculaire. Les options sont donc la castration chirurgicale (pulpectomie). Les méthodes médicamenteuses utilisent les agonistes de la LH-RH (goséréline, leuproréline). Ils sont associés durant les premières semaines avec un antiandrogène pour éviter la remontée initiale de la testostérone liée à l’action de la LH-RH (effet « flare up »). L’efficacité est rapide, en quelques semaines, les effets secondaires sont dominés par les troubles de la libido et les bouffées de chaleur. L’acétate d’abiratérone est une nouvelle hormonothérapie inhibant la synthèse des androgènes en inhibant le complexe CYP-17 testiculaire et surrénalien.
Blocage de la fixation sur les récepteurs aux androgènes
Stéroïdiens (acétate de cyprotérone) ou non (bicalutamide). L’enzalutamide est une hormonothérapie de nouvelle génération qui inhibe la liaison des androgènes à leur récepteur, sans effet agoniste.
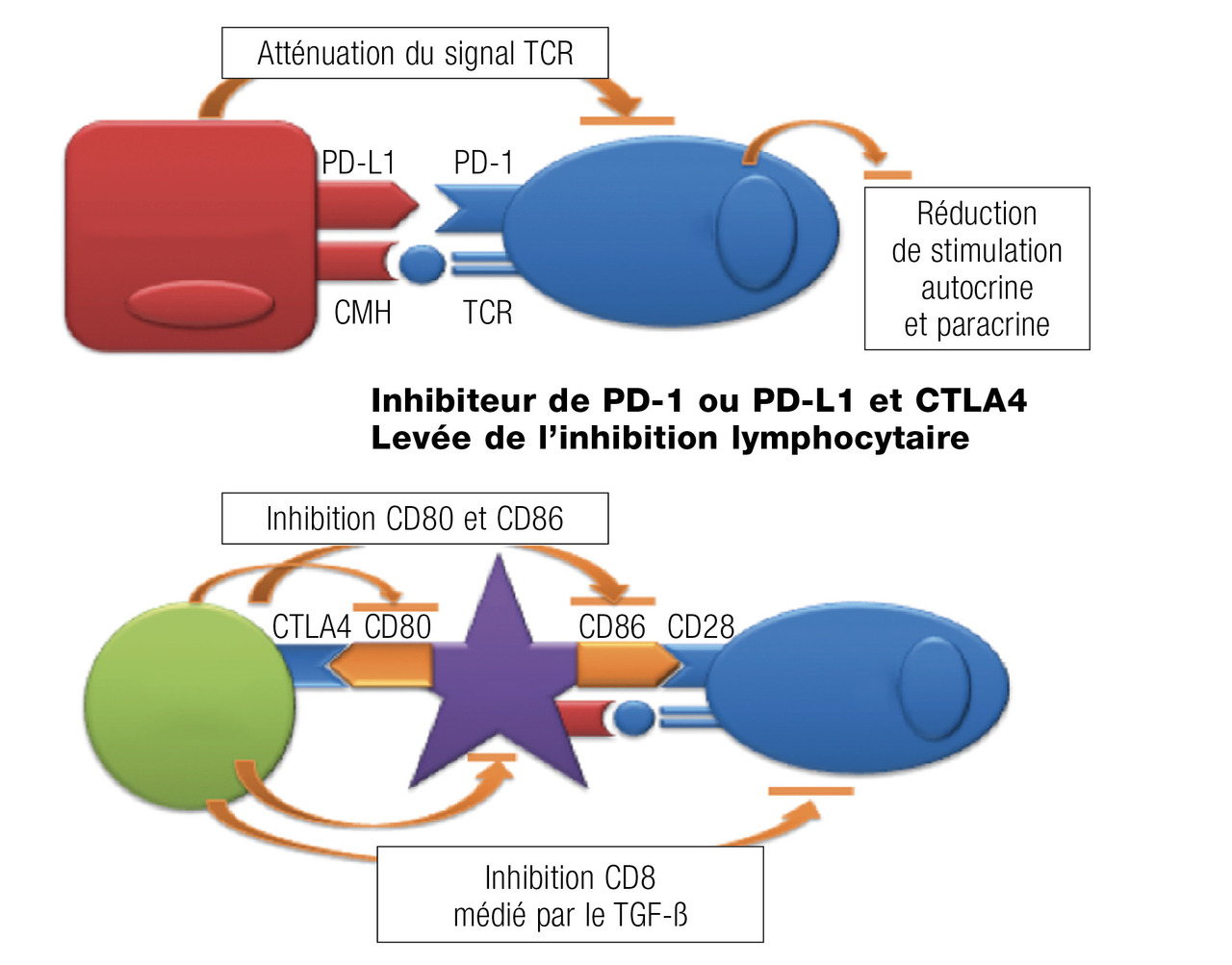
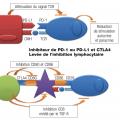
Immunothérapie
Il existe plusieurs types de traitements utilisant le système immunitaire comme base. Les résultats les plus probants ont été obtenus en ciblant l’immunité adaptative (
Les cellules tumorales ont pour caractéristiques de pouvoir échapper au système immunitaire du patient, induisant une tolérance immune en particulier vis-à-vis des lymphocytes effecteurs. La levée des signaux inhibiteurs par des anticorps permet de réactiver l’immunité antitumorale et d’obtenir un contrôle du cancer. Les effets secondaires sont différents de ceux des cytotoxiques, en rapport avec une activation inadaptée du système immunitaire conduisant au développement de pathologies immunologiques (thyroïdite, hypophyse, colite inflammatoire, pneumopathie inflammatoire). Elles sont actuellement validées dans de nombreux organes (mélanomes, poumons) dans les stades métastatiques et en développement précoces :
- ipilimumab : inhibiteur de CTLA4 ;
- anticorps anti-PD-L1 : nivolumab.
Les toxicités les plus fréquentes des principales classes de chimiothérapie utilisées dans les localisations tumorales les plus fréquentes (sein, poumon, côlon et prostate) doivent être connues.
Parmi celles-ci, la toxicité hématologique (touchant les trois lignées) est une des plus fréquentes ; la neutropénie mérite une mention particulière car, lorsqu’elle s’accompagne de fièvre, il s’agit d’une urgence cancérologique.
L’hormonothérapie est responsable de divers effets secondaires, qui imposent une surveillance particulière (suivi gynécologique pour le tamoxifène, densitométrie osseuse pour les inhibiteurs de l’aromatase). Une augmentation du risque cardiovasculaire est possible chez certains patients.
Deux classes thérapeutiques connaissent un développement rapide depuis deux décennies :
– les thérapeutiques ciblées indiquées dans certaines tumeurs présentant un biomarqueur prédictif d’efficacité, et dont les effets secondaires sont multiples ;
– l’immunothérapie, d’apparition plus récente, qui est habituellement bien tolérée mais présente un risque de complications auto-immunes parfois graves.
Le traitement médical des cancers est un sujet complexe, l’utilisation de la plupart des médicaments étant réservée aux spécialistes qualifiés, après décision validée par une réunion de concertation pluridisciplinaire. Seuls ces derniers ont donc besoin d’une connaissance détaillée des modalités de prescription et de la gestion des effets secondaires. En revanche, du fait de la prévalence des pathologies tumorales, tout médecin sera à un moment ou à un autre de sa pratique quotidienne en présence de patients recevant ce type de traitement, que ce soit dans le cadre de l’urgence en cas de complications aiguës ou dans d’autres situations comme le suivi d’un patient présentant une pathologie intercurrente sous hormonothérapie au long cours ou sous thérapeutique ciblée orale. Par ailleurs, les grands principes thérapeutiques des cancers les plus fréquents doivent être connus, ce qui comporte donc les grandes familles de traitements médicaux et leurs effets secondaires les plus habituels.
Ceci inclut : les quatre grandes classes de chimiothérapie avec leur mode d’action schématique, ainsi que les principaux cytotoxiques, avec pour chacune d’entre elles leurs complications les plus fréquentes (v. Focus). La gestion des complications classiques (hématologiques et nausée-vomissements) doit être connue, notamment la neutropénie fébrile, qui est une urgence.
Pour l’hormonothérapie, il s’agit de traitement souvent prescrit au long cours. En plus des effets secondaires classiques, il faut prêter attention à la prévention tertiaire en raison du risque de syndrome métabolique et de complications vasculaires, et ne pas omettre de rappeler les règles hygiénodiététiques : alimentation, lutte contre la sédentarité et sevrage tabagique.
Les effets secondaires des thérapeutiques ciblées sont très variés, dépendant de la classe thérapeutique. Le nombre de traitements augmente d’année en année et, dans le cadre de l’ECN, il faut se limiter aux thérapeutiques ciblées majeures prescrites dans les localisations tumorales les plus fréquentes (en particulier anti-HER2 pour le cancer du sein et anti-EGFR dans les cancers du poumon et du côlon, et antiangiogéniques [bévacizumab] dans les cancers du côlon).
Le mode d’action des diverses immunothérapies est comparable, par blocage de PD-L1 (ou de CTLA4). Il s’agit de thérapeutiques pour l’instant utilisées dans des cancers avancés mais dont les indications s’élargissent rapidement. Il faut en retenir le risque de complications auto-immunes, parfois aiguës et pouvant menacer le pronostic vital.
POINTS FORTS À RETENIR
Les toxicités les plus fréquentes des principales classes de chimiothérapie utilisées dans les localisations tumorales les plus fréquentes (sein, poumon, côlon et prostate) doivent être connues.
Parmi celles-ci, la toxicité hématologique (touchant les trois lignées) est une des plus fréquentes ; la neutropénie mérite une mention particulière car, lorsqu’elle s’accompagne de fièvre, il s’agit d’une urgence cancérologique.
L’hormonothérapie est responsable de divers effets secondaires, qui imposent une surveillance particulière (suivi gynécologique pour le tamoxifène, densitométrie osseuse pour les inhibiteurs de l’aromatase). Une augmentation du risque cardiovasculaire est possible chez certains patients.
Deux classes thérapeutiques connaissent un développement rapide depuis deux décennies :
– les thérapeutiques ciblées indiquées dans certaines tumeurs présentant un biomarqueur prédictif d’efficacité, et dont les effets secondaires sont multiples ;
– l’immunothérapie, d’apparition plus récente, qui est habituellement bien tolérée mais présente un risque de complications auto-immunes parfois graves.
Prescription et surveillance des classes de médicaments les plus courantes chez l’adulte et chez l’enfant, hors anti-infectieux (voir item 177). Connaître le bon usage des principales classes thérapeutiques
Le traitement médical des cancers est un sujet complexe, l’utilisation de la plupart des médicaments étant réservée aux spécialistes qualifiés, après décision validée par une réunion de concertation pluridisciplinaire. Seuls ces derniers ont donc besoin d’une connaissance détaillée des modalités de prescription et de la gestion des effets secondaires. En revanche, du fait de la prévalence des pathologies tumorales, tout médecin sera à un moment ou à un autre de sa pratique quotidienne en présence de patients recevant ce type de traitement, que ce soit dans le cadre de l’urgence en cas de complications aiguës ou dans d’autres situations comme le suivi d’un patient présentant une pathologie intercurrente sous hormonothérapie au long cours ou sous thérapeutique ciblée orale. Par ailleurs, les grands principes thérapeutiques des cancers les plus fréquents doivent être connus, ce qui comporte donc les grandes familles de traitements médicaux et leurs effets secondaires les plus habituels.
Ceci inclut : les quatre grandes classes de chimiothérapie avec leur mode d’action schématique, ainsi que les principaux cytotoxiques, avec pour chacune d’entre elles leurs complications les plus fréquentes (v. Focus). La gestion des complications classiques (hématologiques et nausée-vomissements) doit être connue, notamment la neutropénie fébrile, qui est une urgence.
Pour l’hormonothérapie, il s’agit de traitement souvent prescrit au long cours. En plus des effets secondaires classiques, il faut prêter attention à la prévention tertiaire en raison du risque de syndrome métabolique et de complications vasculaires, et ne pas omettre de rappeler les règles hygiénodiététiques : alimentation, lutte contre la sédentarité et sevrage tabagique.
Les effets secondaires des thérapeutiques ciblées sont très variés, dépendant de la classe thérapeutique. Le nombre de traitements augmente d’année en année et, dans le cadre de l’ECN, il faut se limiter aux thérapeutiques ciblées majeures prescrites dans les localisations tumorales les plus fréquentes (en particulier anti-HER2 pour le cancer du sein et anti-EGFR dans les cancers du poumon et du côlon, et antiangiogéniques [bévacizumab] dans les cancers du côlon).
Le mode d’action des diverses immunothérapies est comparable, par blocage de PD-L1 (ou de CTLA4). Il s’agit de thérapeutiques pour l’instant utilisées dans des cancers avancés mais dont les indications s’élargissent rapidement. Il faut en retenir le risque de complications auto-immunes, parfois aiguës et pouvant menacer le pronostic vital.
Dossier. Inhibiteurs du contrôle immunitaire. Rev Prat 2021;71:371-412.

 Encadrés
Encadrés