objectifs
Connaître pour chacune les mécanismes d'action de classe et des produits individuels, les principes du bon usage, les critères de choix d’un médicament en première intention, les causes d’échec, les principaux effets indésirables et interactions.
L’item 326 est vaste et couvre les principales classes thérapeutiques à maîtriser pour l’ECN du fait de leur usage fréquent et/ou de modalités d’usages spécifiques. Par souci de clarté et de concision, le présent article n’est pas exhaustif mais aborde les points essentiels de la prescription des anti-inflammatoires stéroïdiens et non stéroïdiens ainsi que des antithrombotiques, qui n’ont pas d’item spécifique dans le programme de l’ECN. Pour les autres classes, on pourra se référer aux items (cités dans le titre) leur étant dédiés.
Anti-inflammatoires stéroïdiens et non stéroïdiens
Corticoïdes
Les anti-inflammatoires stéroïdiens ou corticoïdes sont une classe thérapeutique dérivée des glucocorticoïdes naturels. Les corticoïdes sont utilisés pour leur action anti-inflammatoire et immunosuppressive dans un nombre très important de pathologies, comme les maladies inflammatoires et auto-immunes systémiques, certains cancers et hémopathies, mais aussi en substitution des insuffisances surrénaliennes, en prévention du rejet de greffe…
De manière physiologique, la corticosurrénale synthétise deux principales hormones stéroïdiennes. L’aldostérone est issue de la voie des minéralocorticoïdes, et a pour fonction principale la rétention hydrosodée et l’augmentation de la kaliurèse. Le cortisol est issu de la voie des glucocorticoïdes et possède une action sur de nombreux métabolismes (glucidique, lipidique, protéique, hématopoïèse…). Il possède une activité minéralocorticoïde par son affinité avec le récepteur de l’aldostérone, toutefois limitée in vivo par sa transformation en cortisone en périphérie. Les corticoïdes de synthèse développés depuis les années 1950 visent à optimiser l’activité anti-inflammatoire des molécules, tout en limitant les effets minéralocorticoïdes. La diversité des voies d’action de ces hormones explique la présence de nombreux effets indésirables, surtout en cas de traitement prolongé.
Mécanismes d'action
Le cortisol circule lié à la transcortine (ou corticosteroid binding globuline) avec une forte affinité, ou bien à l’albumine (affinité plus faible). La fraction libre va diffuser à travers la membrane pour exercer son action dans le cytoplasme de la cellule.
Le principal mécanisme d’action des corticoïdes fait intervenir le récepteur aux glucocorticoïdes, présent de manière quasi ubiquitaire dans l’organisme et appartenant à la famille des récepteurs aux stéroïdes avec domaine de liaison à l’ADN en doigt de zinc. Ce récepteur est « piégé » dans le cytoplasme de la cellule par un complexe protéique qui se dissocie après la liaison avec son ligand, et entraîne sa migration dans le noyau. Là, le complexe récepteur-hormone va interagir avec l’ADN au niveau de sites nommés « glucocorticoid-responsive elements », pour favoriser la transcription de protéines anti-inflammatoires et inhiber la transcription de protéines pro-inflammatoires. Le complexe récepteur- hormone va également inhiber directement des facteurs de transcription pro-inflammatoires majeurs comme AP-1, NF-kB et NF-IL6. Il possède également des propriétés de régulation épigénétique (dé-acétylation). Parallèlement, les corticoïdes peuvent agir de manière plus directe et plus rapide sur la cellule via des effets membranaires et post-transcriptionnels.
Principes d’usage et choix de la molécule
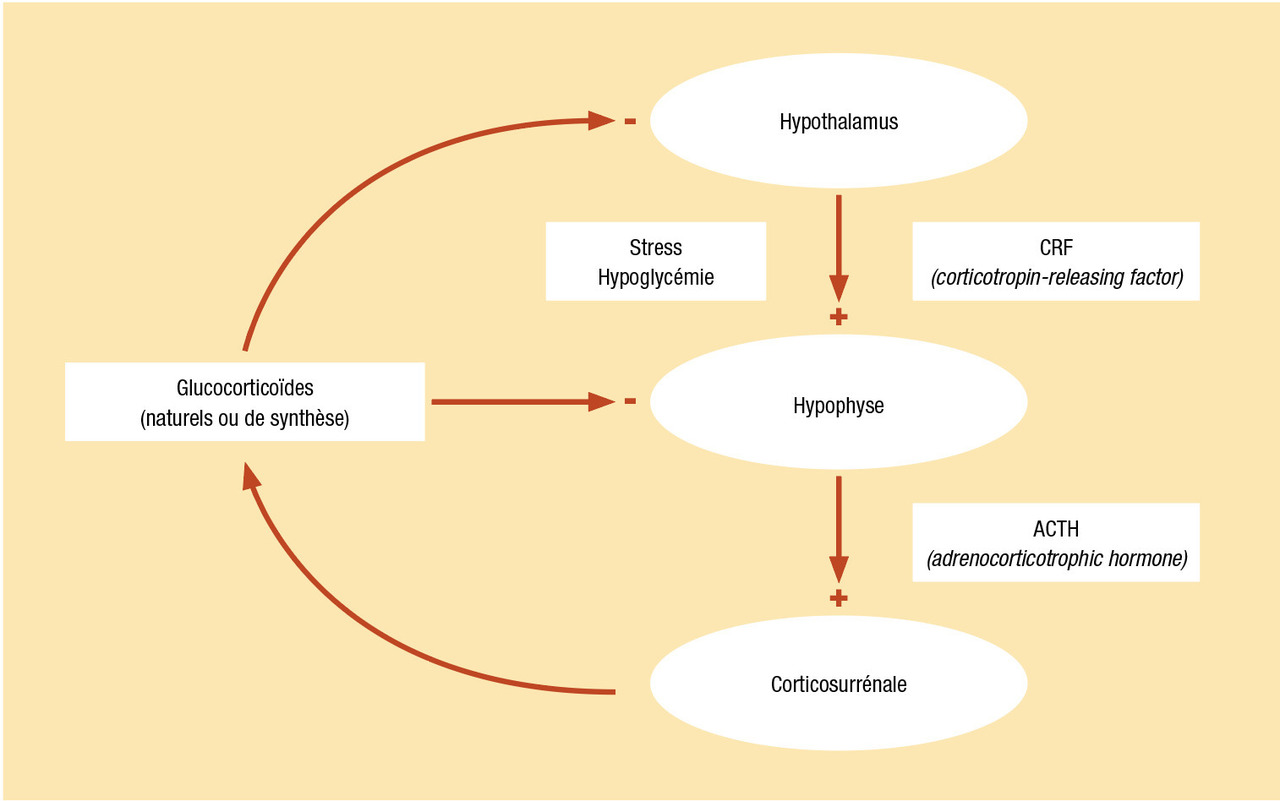
Le cortisol a un effet de rétrocontrôle négatif sur l’axe hypothalamo-hypophysaire (
Modes d’administration
La bonne biodisponibilité des corticoïdes permet leur prise per os dans la majorité des indications. La prednisone subit ensuite une transformation en prednisolone, métabolite actif. Il faut cependant noter que la prednisone doit être privilégiée par rapport à la prednisolone pour une prise per os, car sa biodisponibilité est meilleure. Les corticoïdes sont métabolisés au niveau hépatique avant d’être éliminés par voie rénale. La voie parentérale est généralement réservée aux cas d’impossibilité de prise per os, ou bien en cas de nécessité d’administration de fortes doses ou bolus. Les bolus sont réalisés sous surveillance hospitalière et font appel à des posologies allant de 1 à 15 mg/kg de méthylprednisolone. Le but recherché est d’obtenir un effet anti-inflammatoire plus rapide et plus puissant qu’avec une prise classique dans des situations où le pronostic vital ou fonctionnel est engagé, bien que l’efficacité de cette stratégie ne soit pas démontrée.
Du fait de la bonne diffusion tissulaire des corticoïdes, l’administration locale est possible (cutanée, articulaire, oculaire, inhalation, lavement…) mais n’évite pas tout passage systémique, surtout en cas de fort dosage.
Les posologies utilisées varient selon l’indication. On les exprime chez l’adulte en dose rapportée au poids d’équivalent prednisone (les équivalences posologiques sont indiquées dans le
Du fait du rétrocontrôle négatif sur l’axe hypothalamo-hypophysaire (
Lors des corticothérapies prolongées, une dose substitutive d’hydrocortisone est prescrite à l’arrêt du traitement ou une fois la décroissance arrivée à la dose de 5 mg de prednisone (soit 20 mg d’hydrocortisone, dose équivalente à la sécrétion physiologique quotidienne de glucocorticoïdes (
Principaux effets indésirables et interactions
Les corticoïdes ont de nombreux effets indésirables variant selon la dose et la durée du traitement, résumés dans le
Il n’y a pas de contre-indication absolue à la mise en route d’une corticothérapie si celle-ci est requise en urgence. Il est en revanche utile de la différer si cela est possible en cas d’infection active, de vaccination récente par un vaccin vivant, ou de pathologie psychiatrique non contrôlée. La grossesse et l’allaitement ne sont pas des contre-indications. Il est important de noter qu’une corticothérapie prolongée ne doit jamais être interrompue brutalement en cas de survenue d’un effet indésirable (une infection, par exemple).
Les principales précautions d’emploi à prendre en compte sont liées à la prise de traitements hypokaliémiants ou présentant un risque d’allongement de l’intervalle QT (majoration du risque d’hypokaliémie par les corticoïdes), ainsi que les médicaments influant sur la glycémie (risque d’intolérance au glucose ou décompensation diabétique sous corticoïdes à anticiper). Les interactions médicamenteuses concernent essentiellement les inducteurs enzymatiques (rifampicine, barbituriques, phénitoïne, carbamazépine) qui réduisent l’efficacité du traitement.
Mesures associées à la corticothérapie
Elles ont pour but de limiter les effets indésirables du traitement, notamment si celui-ci est prolongé, et doivent être adaptées et expliquées au patient. Les règles hygiéno-diététiques sont basées sur le maintien d’une activité physique régulière pour lutter contre l’amyotrophie, l’ostéoporose et la prise de poids, et un régime normocalorique (les corticoïdes ont un effet orexigène), contrôlé en sel et pauvre en sucres et en graisses. Il faudra y associer une substitution en calcium et vitamine D (sauf en cas de sarcoïdose), et éventuellement en potassium en cas de fortes doses et/ou d’hypokaliémie.
Le traitement anti-ostéoporotique n’est pas systématique. La Haute Autorité de santé (cf. référence) propose de réaliser une ostéodensitométrie en cas de corticothérapie prolongée (> 3 mois à plus de 7,5 mg/j) et de débuter un traitement anti-ostéoporotique en cas de T-score < -1,5 (sauf pour les femmes ménopausées ayant déjà eu une fracture pour lesquelles le traitement est d’emblée indiqué). Le groupe de recherche et d’information sur les ostéoporoses (GRIO) propose un traitement anti-ostéoporotique selon un arbre décisionnel prenant en compte les facteurs de risque de fracture (cf. référence).
Une infection doit être systématiquement recherchée à l’examen clinique avant le début du traitement, et quelques examens simples (bandelette urinaire, radiographie thoracique…) pourront être demandés selon l’orientation. La prévention de l’anguillulose maligne par ivermectine doit être systématiquement appliquée en cas de séjour en zone d’endémie, quelle qu’en soit l’ancienneté, car le parasite peut persister grâce à des cycles d’auto-infestation. L’examen parasitologique des selles avec méthode de Baermann est inutile dans ce contexte car insuffisamment sensible.
La surveillance du traitement prend en compte l’efficacité de celui-ci (corticosensibilité, corticodépendance ou corticorésistance), la recherche d’effets indésirables (particulièrement hyperglycémie en cas de fortes doses), et l’observance, souvent mauvaise en raison de la crainte des effets indésirables.
Anti-inflammatoires non stéroïdiens
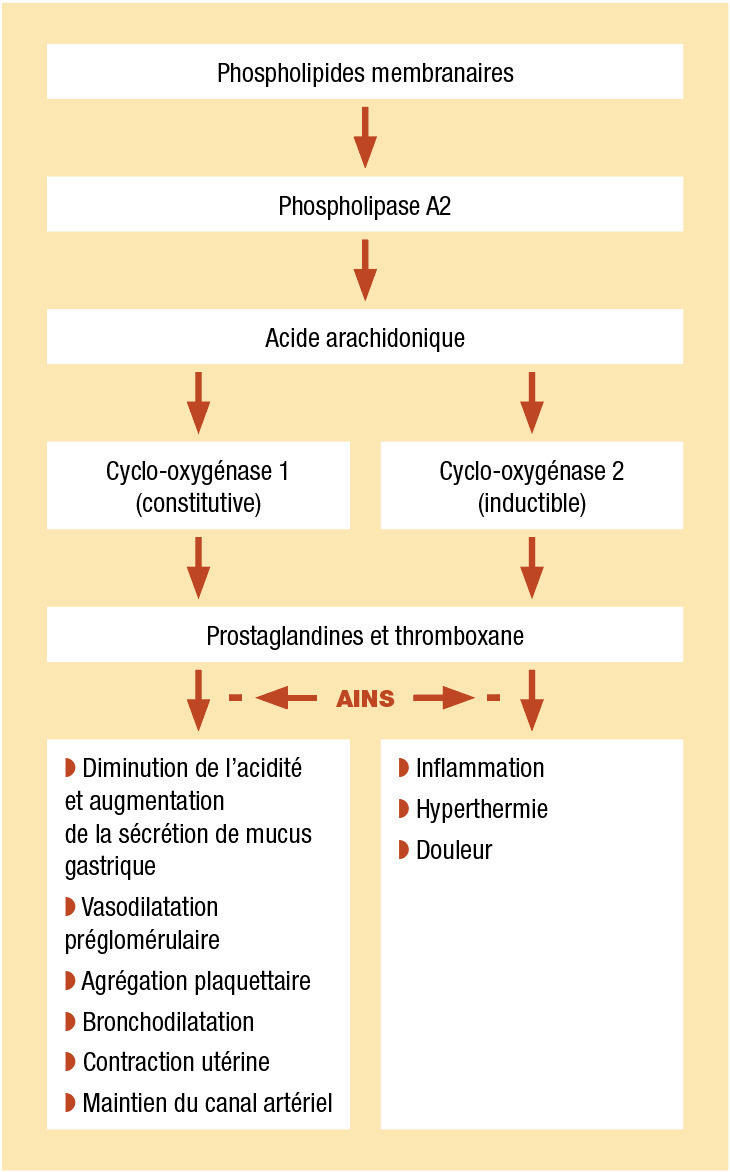
Les AINS sont couramment employés pour leur action anti-inflammatoire, antalgique et antipyrétique. Celle-ci est obtenue via l’inhibition de la cyclo-oxygénase, enzyme nécessaire à la synthèse des prostaglandines. Cette inhibition a néanmoins des conséquences néfastes dans de nombreux tissus. Ainsi, si les AINS sont l’une des classes thérapeutiques les plus consommées dans le monde, ils occupent également l’une des premières places en matière d’iatrogénie.
Mécanismes d’action
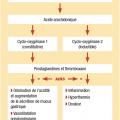
Il existe deux types de cycloxygénase (Cox) sensibles à l’inhibition des AINS. La Cox 1 est présente de manière constitutive dans de nombreux tissus et contribue à la synthèse de prostaglandines dont les principales fonctions sont rappelées dans la
Principes d’usage, choix de la molécule et modes d’administration
Les principales familles comprennent les dérivés salicylés (acide acétylsalicylique ou aspirine), arylpropioniques (kétoprofène, naproxène, ibuprofène), arylcarboxyliques (diclofénac), indolés (indométacine), pyrazolés (phénylbutazone), les oxycams (piroxicam) et les coxibs (célécoxib). On peut également classer les molécules par demi-vie courte (2-6 h : la plupart des dérivés propioniques, le diclofénac, l’indométacine), intermédiaire (10-18 h) et longue (> 24 h : phénylbutazone, oxicams et formes à libération prolongée).
Avant de débuter un traitement par AINS, il convient de bien peser la balance bénéfices/risques, particulièrement dans les populations à risque. Dans la majorité des indications, le traitement se fait en cures courtes et à dose minimale efficace. Du fait d’une bonne biodisponibilité, l’administration per os est à privilégier sur la voie injectable, celle-ci n’étant pas plus efficace (bien que le délai d’action soit plus rapide). L’application locale est utile en cas de pathologie abarticulaire. Il est important de noter que l’administration systémique par une voie autre que per os (injectable, suppositoire…) ne réduit en aucun cas le risque de complications digestives. Le métabolisme est hépatique et l’élimination est rénale pour la grande majorité des molécules.
Principaux effets indésirables et interactions
Les effets indésirables des AINS sont fréquents et potentiellement sévères (
Les effets vasoconstricteurs des AINS peuvent déséquilibrer une hypertension artérielle, et entraîner une diminution de la perfusion rénale pouvant se traduire par une insuffisance rénale aiguë fonctionnelle chez des patients à risque (sujets âgés ou insuffisants rénaux, déshydratation ou hypovolémie relative, traitement par IEC/ARAII/diurétiques, sténose de l’artère rénale). Les AINS sont également responsables de néphrite interstitielle d’origine immuno-allergique. De manière générale, ils sont contre-indiqués chez l’insuffisant rénal chronique. Le risque cardiovasculaire est augmenté aussi bien avec les coxibs qu’avec les AINS classiques, de manière dépendante de la dose et de la durée de traitement.
Terrains particuliers
Chez le sujet âgé, du fait du risque gastrique accru et des comorbidités, la survenue de complications est fréquente et la balance bénéfices-risques rarement favorable. Les AINS sont à éviter de manière générale durant la grossesse (risque tératogène), et formellement contre-indiqués durant le dernier trimestre (risque de fermeture prématurée du canal artériel).
Interactions
La liaison des AINS à l’albumine est forte, et peut être à l’origine d’interactions avec d’autres médicaments liés à l’albumine, notamment les antagonistes de la vitamine K (AVK). L’association des deux est strictement contre-indiquée (risque hémorragique majeur par potentialisation des AVK). Les AINS réduisent l’élimination urinaire du lithium et peuvent conduire à des surdosages. L’association avec un autre AINS ou une corticothérapie est généralement peu utile et majore le risque digestif.
Antithrombotiques
Antiagrégants plaquettaires
Les différentes familles d’antiagrégants plaquettaires ont en commun l’inhibition de l’activation et/ou de l’agrégation des plaquettes par différents mécanismes rappelés dans le
Leurs principales indications sont le traitement ainsi que la prévention des événements thrombo-emboliques artériels.
L’aspirine est la molécule la plus utilisée en première intention, l’effet antiagrégant étant obtenu avec des doses inférieures (de 75 à 325 mg/j) à celles nécessaires pour son activité anti-inflammatoire (de 500 mg à 3 g/j). Les autres molécules sont présentées dans le
Anticoagulants
Les anticoagulants inhibent l’hémostase secondaire et sont principalement utilisés en traitement ou prévention des événements thromboemboliques veineux et/ou artériels. On parle généralement de doses préventives (pour la prévention de la maladie thromboembolique veineuse) ou bien curatives (pour le traitement d’un événement thromboembolique, ou bien la prévention d’un événement thromboembolique artériel chez un patient à risque [fibrillation atriale, valve mécanique]). Quel que soit le traitement utilisé, l’éducation du patient est primordiale pour limiter les accidents hémorragiques qui restent une complication fréquente et potentiellement sévère.
Héparines
On distingue les héparines non fractionnées (HNF, mucopolysaccharides d’origine naturelle de taille variable, inhibant les facteurs Xa et IIa), et les héparines de bas poids moléculaire (HBPM, chaînes courtes obtenues par fragmentation et inhibant le facteur Xa). Elles agissent via leur fixation à l’antithrombine III en potentialisation son effet anticoagulant. Les HNF ont une activité sur d’autres protéines de la coagulation responsable d’une grande variation de l’effet anticoagulant selon la dose utilisée, et nécessitant impérativement une surveillance biologique en cas de traitement curatif (
En dehors des accidents hémorragiques (voir Focus), l’un des effets indésirables majeurs bien que rare des héparines est la survenue d’une thrombopénie de mécanisme immuno-allergique. Elle survient 5 à 15 jours après la mise en route du traitement (plus rapidement en cas d’exposition préalable) et est à distinguer d’une thrombopénie plus précoce et transitoire souvent mineure par lyse plaquettaire. Le tableau associe une thrombopénie de consommation (plaquettes < 100 000/mm3 ou baisse > 40 %) à des thromboses artérielles et/ou veineuses pouvant mettre en jeu le pronostic vital. Le diagnostic peut être confirmé par la présence d’anticorps anti-PF4, éventuellement complété par des tests fonctionnels. Cette complication est souvent sévère et impose un arrêt immédiat et définitif de tout type d’héparine, ainsi qu’une anticoagulation par danaparoïde ou antithrombine. Elle est plus fréquente avec les HNF et en cas de contexte péri-opératoire, justifiant la surveillance de la numération plaquettaire dans ces conditions. De manière générale, le traitement prolongé par héparine est à éviter pour limiter ce risque.
Antivitamine-K (AVK)
Les AVK inhibent le cycle d’oxydation/réduction de la vitamine K et ainsi la synthèse des facteurs vitamine K dépendants (II, VII, IX, X, protéines C et S). La biodisponibilité est bonne et permet une administration orale, mais le délai d’action est long (lié à la demi-vie des facteurs de la coagulation circulants). La coprescription d’héparine lors de la mise en route du traitement est donc nécessaire pour obtenir une anticoagulation immédiate et pourra être arrêtée une fois l’INR cible atteint. Il existe de nombreuses interactions médicamenteuses expliquées par une fixation protéique importante (notamment avec les AINS) et une élimination majoritairement hépatique (traitements inducteurs ou inhibiteurs enzymatiques). La liste complète des interactions ne pouvant être détaillée ici, on insiste sur la contre-indication de l’association AVK-AINS à très haut risque hémorragique. La surveillance biologique par l’INR est indispensable de manière régulière afin d’adapter les posologies. L’éducation du patient sur les effets des AVK, les interactions (y compris avec traitements en automédication comme les AINS), et la conduite à tenir en cas d’INR hors cible est primordiale pour limiter le risque hémorragique.
Anticoagulants oraux directs (AOD)
Les variations de l’INR sous AVK et la contrainte de la surveillance biologique ont conduit au développement d’anticoagulants oraux avec des caractéristiques pharmacocinétiques stables. Les AOD sont des inhibiteurs directs du facteur IIa ou Xa (
FIGURE 2 Voie des prostaglandines.
Fiche bon usage du médicament, les médicaments de l’ostéoporose, HAS, juin 2014.
https://www.has-sante.fr/portail/upload/docs/application/pdf/2014-06/fs_osteoporose_v2.pdf
Actualisation 2014 des recommandations sur la prévention et le traitement de l’ostéoporose cortico-induite, Revue du Rhumatisme, Vol. 81, Issue 5, Octobre 2014, pages 385-94.
http://www.grio.org/documents/page500/boite-a-outils-osteoporose500-1415788202.pdf