Les ARO ayant une autorisation de mise sur le marché (AMM) dans ces indications appartiennent à quatre classes thérapeutiques : les bisphosphonates (BP), les anti-RANKL (receptor activator of nuclear factor kappa B ligand), le raloxifène et le tériparatide (agent de la formation osseuse répondant aux mêmes indications).1
Les BP et les anti-RANKL (
Risque d'ostéonécrose de la mâchoire
Étant donné le service médical rendu par les ARO dans la prévention du risque de fractures pathologiques chez les patients atteints d’ostéoporose ou de pathologies malignes avec complications osseuses, leur prescription est fréquente. Le vieillissement de la population a pour conséquence, d’une part, l’augmentation de l’incidence et de la prévalence de ces maladies et, d’autre part, la dégradation de la santé orale en lien avec des modifications physiologiques et pathologiques de la sphère oro-faciale. Dans cette population âgée, le risque d’ostéonécrose des maxillaires augmente, surtout dans un contexte de mauvaise hygiène orale et d’absence de suivi bucco-dentaire.
Actions sur les ostéoclastes inhibant la résorption osseuse
Les bisphosphonates induisent l’apoptose des ostéoclastes
Le dénosumab inhibe formation, fonction et survie des ostéoclastes
Complications orales liées au traitement par antirésorbeurs osseux
En 2014, l’American Association of Oral and Maxillofacial Surgeons (AAOMS) a défini l’ONM liée au traitement par ARO comme la présence d’une exposition osseuse maxillo-faciale persistant depuis au moins huit semaines, chez un patient traité ou ayant été traité par ARO et/ou molécules antiangiogéniques anticancéreuses et ne présentant ni métastase ni antécédent d’irradiation de la région.10 De plus, elle recommande l’utilisation du terme MRONJ (medication-related osteonecrosis of the jaw, ostéonécrose de la mâchoire liée aux médicaments) en remplacement de BRONJ (bisphosphonate-related osteonecrosis of the jaw, ostéonécrose de la mâchoire liée aux bisphosphonates) en raison de l’accroissement du nombre de cas d’ostéonécrose des maxillaires apparaissant avec diverses molécules antirésorbeuses et/ou antiangiogéniques. En effet, en dehors des BP et du dénosumab, des thérapies ciblées anticancéreuses ayant un effet antiangiogénique (sunitinib, inhibiteur des récepteurs de tyrosine-kinase ; bévacizumab, anticorps monoclonal dirigé contre le facteur de croissance de l’endothélium vasculaire ; temsirolimus, inhibiteur sélectif de la protéine mTOR ; etc.) semblent être responsables d’ONM, surtout lorsqu’elles sont associées aux ARO.10
Physiopathologie de l’ostéonécrose des maxillaires multifactorielle
Le fort taux de renouvellement osseux du maxillaire et de la mandibule, et en particulier de l’os alvéolaire supportant les dents, explique pourquoi les complications osseuses se limitent généralement à la sphère oro-faciale.11
D’autres hypothèses incriminent des traumatismes répétés et des microfractures osseuses lors de la mastication mais également la présence de foyers infectieux bucco-dentaires, la réalisation d’actes invasifs nécessitant un remodelage osseux important, comme les avulsions dentaires ou les chirurgies osseuses, les maladies parodontales et les microtraumatismes provoqués notamment par le port d’une prothèse dentaire amovible mal adaptée.12
Les autres structures osseuses de la région céphalique ne semblent concernées qu’exceptionnellement. Une quinzaine de publications rapportent des cas d’ostéonécrose uni- ou bilatérale du conduit auditif externe chez des patients sous dénosumab ou BP.13
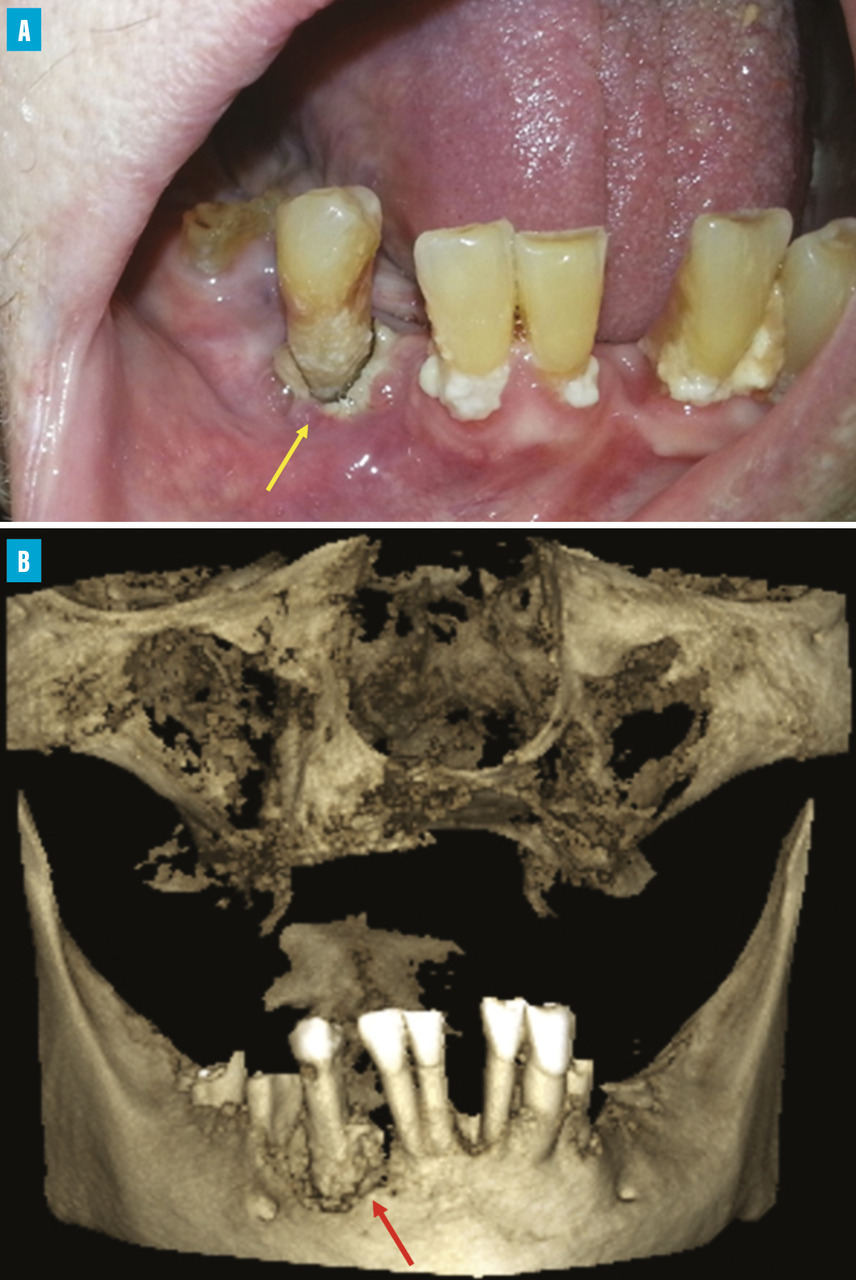
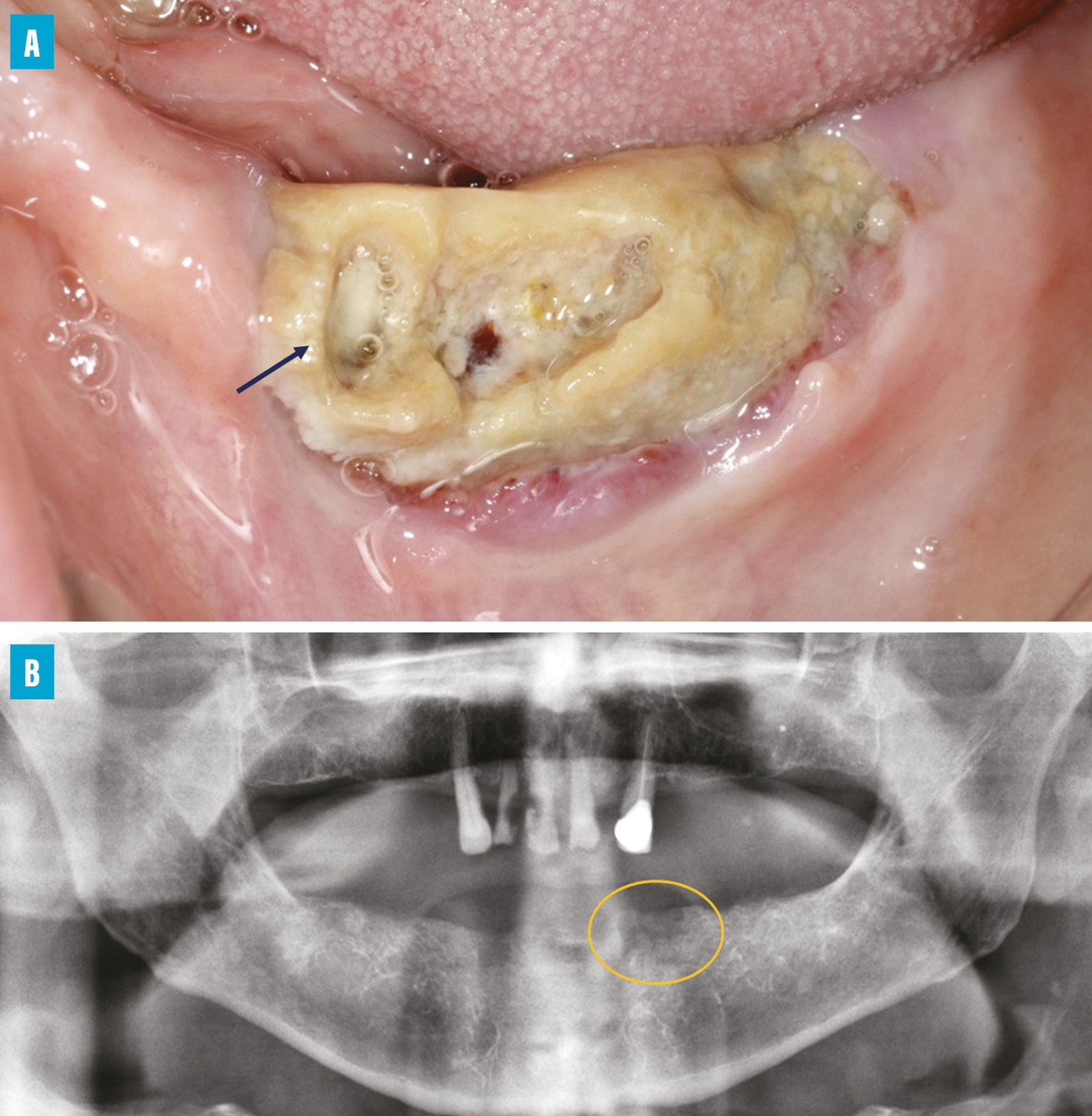
L’aspect clinique de l’ONM est variable (
L’imagerie évalue l’étendue de la lésion osseuse et la dépiste précocement
O’Ryan et al., en 2009, ont mené une étude rétrospective sur des patients traités par BP par voie intraveineuse (IV) pour des pathologies malignes et ayant développé une ONM.16 Sur 35 patients asymptomatiques ayant bénéficié d’une scintigraphie osseuse, l’examen a mis en évidence une captation positive du traceur dans des zones qui allaient développer une ONM dans les semaines suivantes pour 23 patients (67,5 %). Les modifications fonctionnelles osseuses précédant les altérations structurelles, la scintigraphie osseuse permet d’établir un diagnostic précoce chez des patients à risque de développer une ONM.17
Multiples facteurs de risque d’apparition d’une ONM
Chez les patients traités par ARO, l’ONM survient généralement après une avulsion dentaire, une chirurgie muqueuse (à lambeaux, parodontale…) ou osseuse (régularisation osseuse, exérèse de kyste ou de tumeur osseuse…) ou une blessure provoquée par une prothèse dentaire amovible iatrogène.
Cependant, de nombreux cas d’ONM spontanée sont rapportés dans la littérature.18
La synergie entre plusieurs facteurs de risque et une diminution du remodelage osseux provoquée par le traitement par ARO semblent être déterminantes dans l’apparition d’une ONM.
Plusieurs facteurs de risque d’apparition d’une ONM ont été identifiés dans la littérature.
Facteurs liés au traitement par ARO
Les ARO administrés par voie intraveineuse (BP) ou sous-cutanée (dénosumab) tous les mois pour une pathologie maligne sont plus fréquemment impliqués dans l’apparition d’une ONM, contrairement aux BP par voie orale (une fois par semaine) ou intraveineuse (une fois par an) ou au dénosumab par voie sous-cutanée (tous les 6 mois) pour l’ostéoporose.
Bisphosphonates
L’incidence de l’ONM chez les patients traités par BP pour une pathologie bénigne reste faible. Dans le cas d’un traitement de l’ostéoporose par BP, le risque d’ONM est inférieur à 0,001 % par voie orale et de 0,005 % par voie intraveineuse.18 Cependant, ce risque augmente sensiblement avec la durée du traitement et la dose cumulée. Le délai moyen de survenue d’une ONM après le début du traitement par BP oraux pour une pathologie bénigne est de cinq ans.19Le zolédronate est le BP le plus puissant actuellement commercialisé et le plus fréquemment impliqué dans la survenue d’une ONM. Chez les patients traités par zolédronate pour une pathologie maligne, l’incidence de l’ONM est 1 000 fois plus élevée (de 1 à 1,3 % dans les deux premières années de traitement), l’incidence moyenne de l’ONM avec des BP par voie intraveineuse (toutes molécules confondues) étant de 0,186 %.18,20 Chez ces patients traités par BP par voie intraveineuse, 40 % des cas d’ONM surviennent dans les deux premières années après l’instauration du traitement, avec un délai d’apparition moyen de vingt et un mois pour le zolédronate et de trente-six mois pour le pamidronate.21
Dénosumab
Le dénosumab est utilisé par voie sous-cutanée (SC) pour traiter l’ostéoporose post-ménopausique chez les femmes à risque élevé de fracture. Dans cette indication, le risque de survenue d’une ONM reste très faible.22 Il est comparable à celui des BP pour la même indication.Cette molécule est également utilisée dans le traitement préventif des fractures chez les patients présentant une tumeur solide avec métastase osseuse, notamment les cancers du sein et de la prostate à des stades avancés. Chez ces patients, le risque d’apparition d’une OMN est comparable à celui des patients traités par zolédronate, soit 0,7 à 1,9 % (70 à 190 cas pour 10 000 patients).23
Antiangiogéniques
Certaines molécules anticancéreuses qui ont des effets antiangiogéniques sont impliquées dans l’apparition d’ONM : le sunitinib (inhibiteur de récepteurs de tyrosine kinase) et le bévacizumab (anticorps anti-VEGF) sont indiqués respectivement dans le traitement des cancers avancés non accessibles à la chirurgie et des cancers métastatiques des côlon, rectum, pancréas, sein, poumon et rein.24L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et l’Agence européenne du médicament (EMA) ont rapporté 55 cas d’ONM chez des patients atteints de cancer et traités par bévacizumab ayant reçu précédemment ou de façon concomitante des BP par voie intraveineuse.
Le traitement par antiangiogéniques, associé ou non à des ARO, augmente le risque de survenue d’une ONM.25
Facteurs généraux associés
Les maladies systémiques inflammatoires (polyarthrite rhumatoïde), la corticothérapie, la chimiothérapie, l’obésité et le tabagisme sont également considérés comme des facteurs de risque associés.20
Un âge supérieur à 65 ans et le sexe féminin sont mentionnés comme de possibles facteurs de risque mais restent discutés à ce jour.
Facteurs locaux
Dans une étude rétrospective menée sur des patients traités par ARO pour une pathologie maligne, Soutome et al. ont montré que les lésions radiculaires périapicales supérieures à 3 mm ou les poches parodontales supérieures à 4 mm sont significativement corrélées au risque d’apparition d’une ONM.26
Les gestes chirurgicaux à risque, communément admis, sont les suivants : avulsion dentaire, ostéoplastie, exérèse d’un kyste, résection apicale et pose d’un implant. Parmi les patients présentant une ONM, l’avulsion dentaire est retrouvée comme facteur précipitant dans 52 à 61 % des cas.10 Le risque de développer une ONM à la suite des autres actes de chirurgie dentaire est moins bien connu. Cependant, l’AAOMS considère que le risque de tout acte nécessitant une exposition de l’os est comparable au risque associé à l’avulsion dentaire.23
Le port de prothèses dentaires amovibles est associé à un risque accru d’ONM en raison des blessures muqueuses qu’elles sont susceptibles d’engendrer. Chez les patients traités par zolédronate par voie intraveineuse pour une pathologie maligne, ce risque est deux fois plus élevé chez les porteurs de prothèses par rapport aux patients non appareillés.27
Quatre stades définissent la prise en charge de l’ONM
La prise en charge nécessite une collaboration étroite entre le chirurgien-dentiste/chirurgien oral/chirurgien maxillo-facial et le médecin prescripteur. Elle est réalisée exclusivement en milieu hospitalier.
Le
Les séquestres osseux mobiles ou radiologiquement bien délimités doivent être éliminés afin de faciliter la cicatrisation des tissus mous environnants. De même, l’avulsion des dents touchées par l’os nécrosé doit être envisagée.10 Dans le même temps opératoire, un curetage de l’os nécrotique jusqu’à l’os sain et une régularisation des bords osseux tranchants permettent de limiter le risque de blessure des tissus mous et facilitent le recouvrement de l’os atteint par la muqueuse.
Il est conseillé de soumettre le séquestre osseux retiré à une analyse anatomopathologique, notamment chez les patients ayant des antécédents de pathologie maligne afin d’exclure une métastase osseuse des maxillaires.10
Au stade 3, après résection de l’os nécrotique ayant conduit à l’interruption de la continuité de la mandibule, une reconstruction immédiate peut être envisagée, par exemple par lambeau libre micro-anastomosé de fibula, cette technique étant considérée comme la technique de choix dans la reconstruction de pertes osseuses de grande étendue.28,29
La prise en charge de l’ONM est complexe, longue, avec beaucoup d’échecs et fait appel à des moyens chirurgicaux dont la complexité augmente avec la sévérité de la maladie.
Cette complication conduit à une perte de la qualité de vie des patients, à des préjudices esthétiques oro-faciaux (résections osseuses étendues, fistules oro-faciales, fractures pathologiques…) qui nécessitent une réhabilitation orale complexe et difficile. C’est la raison pour laquelle la prévention de l’ONM est essentielle. Elle doit commencer en amont de la prescription des ARO, se poursuivre pendant toute la durée du traitement et ensuite tout au long de la vie du patient du fait de la rémanence intra-osseuse très longue des BP.
Prévention de l’ostéonécrose de la mâchoire
Un suivi bucco-dentaire régulier et des actions de prévention doivent impérativement être mis en place chez ces patients afin de maintenir une bonne santé orale.
Quelles que soient la voie d’administration et la molécule prescrite, le patient doit être clairement informé du risque d’ONM et des signes d’appel de cette complication afin de consulter le plus rapidement possible.
Avant de débuter un traitement par ARO
Remettre en état la cavité orale
Des examens bucco-dentaires cliniques et radiologiques doivent être réalisés par un chirurgien-dentiste, avant le traitement par ARO.10 Un cliché panoramique permet de détecter des foyers infectieux et peut être complété au besoin par des examens d’imagerie plus précis, de type cliché rétroalvéolaire ou CBCT.La cavité orale doit être remise en état : les lésions carieuses doivent être traitées, les racines résiduelles et les dents non conservables ou mobiles doivent être extraites. Il est également important d’identifier les foyers infectieux actifs ou latents (foyers d’origine parodontale ou endodontique comme les dents présentant des lésions périapicales, dents en désinclusion…) mais aussi les situations à risque infectieux potentiel susceptibles de devenir des foyers infectieux dans un futur plus ou moins proche, une fois le traitement instauré (dents mobiles).
Un contrôle de l’adaptation et de la stabilité des prothèses dentaires amovibles permet de prévenir le risque de blessure des muqueuses.
Une antibiothérapie prophylactique ou curative est prescrite en fonction du risque infectieux du patient (diabète, immunodépression…) et de l’acte pratiqué (acte invasif ou non), conformément aux recommandations émises par l’ANSM en 2011.30
À ce stade, il est important d’informer le patient du risque d’ONM inhérent au traitement et de le sensibiliser à l’hygiène orale, aux consultations régulières chez le chirurgien-dentiste et à l’arrêt de la consommation d’alcool ou de tabac.
Dès la mise en place du traitement, il est primordial de recommander au patient de signaler toute douleur ou tout événement inhabituel qui surviendrait dans la cavité orale (mobilité dentaire, tuméfaction, ulcération, saignement…) et de prendre contact avec le chirurgien-dentiste traitant sans attendre.
Délai de mise en route du traitement par ARO ajusté en fonction de la pathologie sous-jacente
Si l’état du patient le permet, le traitement par ARO et/ou antiangiogénique ne doit être débuté qu’une fois la cavité orale assainie et, si possible, après cicatrisation complète du site opératoire le cas échéant, soit quatorze à vingt et un jours, délai moyen pour la cicatrisation muqueuse et le recouvrement du site osseux.10 Ce délai concerne les extractions dentaires et actes chirurgicaux (pas les soins de caries, par exemple), surtout chez les patients traités par ARO pour une pathologie maligne car ce sont les patients à risque plus élevé d’ostéonécrose.Cette décision doit être prise conjointement par le médecin prescripteur, le chirurgien-dentiste et les autres professionnels médicaux impliqués dans la prise en charge du patient.
Cependant, devant le risque de fracture pathologique en cas de métastases osseuses ou d’hypercalcémie maligne, très souvent, l’instauration du traitement ne peut pas être reportée.
Idéalement, il faut respecter le même délai chez les patients traités pour une pathologie bénigne, mais le risque d’ONM est très faible.
Dans le cadre d’un traitement pour ostéoporose, la mise en état de la cavité orale ne doit pas retarder l’instauration du traitement chez les patients ayant un risque de fracture élevé.
Dans les autres situations, la remise en état de la cavité orale doit être entreprise avant la mise en place du traitement par ARO.
Patients traités ou ayant eu un traitement par ARO
L’éventuel arrêt d’un ARO ne concerne pas les soins dentaires conservateurs (soins des caries) mais seulement les actes chirurgicaux invasifs touchant l’os (donc à haut risque d’ONM) et les patients ayant eu plus de quatre ans de traitement et/ou ayant des comorbidités. Si l’état du patient le permet, l’arrêt des BP oraux peut être discuté avec le médecin prescripteur pendant une période de deux mois avant et trois mois après une chirurgie touchant l’os. Pour les patients traités par BP oraux depuis moins de quatre ans et qui ne présentent pas de facteur de risque, il n’est pas nécessaire de retarder une chirurgie osseuse de type avulsion dentaire. Si le patient est sous zolédronate par voie intraveineuse ou dénosumab par voie sous-cutanée, l’acte peut être effectué dans l’intervalle entre deux injections (par exemple 3 mois après l’injection précédente, ce qui laisse 3 mois de cicatrisation osseuse avant l’injection suivante). Chez le patient à risque faible (moins de quatre ans de traitement, pas de comorbidités), l’arrêt n’est pas nécessaire.
Des rendez-vous rapprochés doivent permettre au patient de signaler rapidement tout symptôme oral évocateur d’ONM (apparition d’une mobilité dentaire, blessure non cicatrisée, douleur ou suppuration…).
Chez les patients traités pour une pathologie maligne
Kajizono et al. ont montré qu’un suivi bucco-dentaire régulier diminue significativement le risque d’apparition d’une ONM chez les patients traités par BP ou dénosumab pour des pathologies malignes, même si la dose cumulée est importante.12En cours de traitement, les actes bucco-dentaires invasifs doivent être évités. Une coronectomie des dents non restaurables peut être envisagée. L’objectif de cette technique est de retirer la partie coronaire de la dent en laissant en place la ou les racines, après avoir effectué un traitement endodontique de celle(s)-ci. La coronectomie permet ainsi d’éviter l’avulsion et de préserver le tissu osseux. La mise en place d’implants dentaires est contre-indiquée.32
Toutefois, si des actes chirurgicaux ne peuvent pas être reportés, il est recommandé de les réaliser sous antibioprophylaxie et à la suite de mesures d’hygiène professionnelle (détartrage).2
Chez les patients traités pour une pathologie non maligne
La prévalence de l’ONM chez les patients traités par ARO par voie orale reste faible mais augmente lorsque la durée du traitement dépasse quatre ans.33 Ce délai diminue en cas de cotraitement par corticostéroïdes ou antiangiogéniques.34 Chez ces patients, une ONM peut apparaître spontanément ou à la suite d’un microtraumatisme répété mais est généralement peu sévère.10 Les actes invasifs ne sont pas contre-indiqués.Si l’état du patient le permet, l’arrêt des BP oraux peut être discuté avec le médecin prescripteur pendant une période de deux mois avant et trois mois après une chirurgie touchant l’os. Pour les patients traités par BP oraux depuis moins de quatre ans et qui ne présentent pas de facteur de risque, il n’est pas nécessaire de retarder une chirurgie osseuse de type avulsion dentaire.10
La pose d’implants dentaires doit être réalisée après l’évaluation de la balance bénéfice-risque d’ONM, seulement chez des patients observants pour le suivi régulier, ayant une bonne hygiène bucco-dentaire et pas d’autres comorbidités contre-indiquant la pose d’implants.32 Cependant, des études menées sur l’animal suggèrent une altération de l’ostéo-intégration des implants à long terme. La pose d’implant doit donc être envisagée sous réserve, chez un patient coopérant et motivé, et avec consentement éclairé.35 Le médecin prescripteur peut, à l’occasion des différentes consultations, sensibiliser et rappeler au patient l’importance de la surveillance des implants.
D’après le position paper de l’Association américaine des chirurgiens oraux et maxillo-faciaux, chez les patients traités à la fois par BP oraux depuis moins de quatre ans et par corticostéroïdes ou antiangiogéniques, l’arrêt du traitement par BP peut être envisagé au moins deux mois avant la chirurgie si les conditions le permettent. L’arrêt doit être maintenu jusqu’à cicatrisation complète du site opératoire.10
Ce dernier protocole doit également être appliqué chez les patients ayant été traités par BP oraux pendant plus de quatre ans.10
Éléments fondamentaux du suivi
– avant la mise en place du traitement, afin de mettre en état la cavité orale et d’instaurer une hygiène bucco-dentaire rigoureuse ;
– en consultation de suivi deux fois par an ;
– en urgence, devant tout signe d’alerte (saignement, mobilité dentaire, abcès, douleur intra-orale…).
À l’occasion des prescriptions, le médecin traitant doit rappeler au patient le risque de survenue d’une ONM, la nécessité d’avoir une hygiène orale correcte et de consulter régulièrement son chirurgien-dentiste. Le patient doit être averti des signes d’alerte nécessitant une consultation en urgence.
Précautions lors des actes bucco-dentaires chez les patients traités par antirésorbeurs osseux
Pour tous les patients traités par bisphosphonates/dénosumab, les actes bucco-dentaires doivent être réalisés en respectant quelques recommandations :20
– informer le patient sur les éventuels risques associés aux soins à réaliser ;
– prendre contact avec le médecin traitant ;
– adopter des mesures d’hygiène professionnelle (détartrage) avant les soins, notamment avant les gestes chirurgicaux ;
– prescrire des bains de bouche antiseptiques avant l’intervention et poursuivre plusieurs jours après (par exemple, chlorhexidine 0,12 % trois fois par jour après le brossage) ;
– en fonction de l’acte réalisé (invasif ou non invasif) et du terrain à risque infectieux, prescrire des antibiotiques (amoxicilline 2 g/j ou clindamycine 1,2 g/j) avant l’intervention et poursuivre jusqu’à cicatrisation muqueuse complète ;
– procéder par secteur en cas d’extractions multiples et espacer les séances de deux mois (afin d’éviter de multiplier les sites où une ostéonécrose de la mâchoire peut survenir);
– adopter des techniques les moins traumatisantes possibles (lever un lambeau a minima, régulariser les bords osseux...) ;
– fermer les plaies chirurgicales de manière étanche et sans tension ;
– surveiller la cicatrisation des tissus mous et osseuse.
2. Maillard S. Introduction métastases osseuses. Données épidémiologiques. Bilan à réaliser. https://www.oncomel.org/fichs/19304.pdf
3. Rogers MJ, Mönkkönen J, Munoz MA. Molecular mechanisms of action of bisphosphonates and new insights into their effects outside the skeleton. Bone 2020;139:115493.
4. Cremers S, Drake MT, Hal Ebetino F, Bilezikian JP, Graham R, Russell G. Pharmacology of bisphosphonates. Br J Clin Pharmacol 2019;85(6):1052-62.
5. Lesclous P. Pharmacologie pratique des antirésorptifs osseux. Info Dent 2021;21/22(103):20-4.
6. Deeks ED. Denosumab: A review in postmenopausal osteoporosis. Drugs Aging 2018;35(2):163-73.
7. Kostenuik PJ, Nguyen HQ, McCabe J, Warmington KS, Kura- Hara C, Sun N, et al. Denosumab, a fully human monoclonal antibody to RANKL, inhibits bone resorption and increases BMD in knock-in mice that express chimeric (murine/human) RANKL. J Bone Miner Res 2009;24:182-95.
8. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: A growing epidemic. J Oral Maxillofac Surg 2003;61(9):1115-7.
9. De Boissieu P, Gaboriau L, Morel A, Trenque T. Bisphosphonate-related osteonecrosis of the jaw: Data from the french national pharmacovigilance database. Fundam Clin Pharmacol 2016;30(5):450‑8.
10. Ruggiero SL, Dodson TB, Fantasia J, Goodday R, Aghaloo T, Mehrotra B, et al. American Association of Oral and Maxillofacial Surgeons position paper on medication-related osteonecrosis of the jaw-2014 update. J Oral Maxillofac Surg 2014;72(10):1938-56.
11. Abi Najm S, Lesclous P, Lombardi T, Bouzouita I, Carrel JP, Samson J. Ostéonécrose des maxillaires dues aux bisphosphonates : mise au point. Med Buccale Chir Buccale 2008;14(1):5-18.
12. Kajizono M, Sada H, Sugiura Y, Soga Y, Kitamura Y, Matsuoka J, et al. Incidence and risks factors of osteonecrosis of the jaw in advanced cancer patients after treatment with zoledronic acid or denosumab: A retrospective cohort study. Biol Pharm Bull 2015;38(12):1850-5.
13. McCadden L, Leonard CG, Primrose WJ. Bisphosphonate-induced osteonecrosis of the ear canal: Our experience and a review of the litterature. J Laryngol Otol 2018;132(4):372-4.
14. Orlandini F, Bossard D, Blanc G, Bodard AG, Gourmet R. Ostéonécrose de la mâchoire sous bisphosphonates : aspects radiologiques. J Radiol 2009;90:199-205.
15. Salmon B. Cone Beam CT en pratique dentaire. Du chirurgien-dentiste au radiologue. Montpellier: Sauramps Médical, 2014.
16. O’Ryan FS, Khour S, Liao W, Han MM, Hui RL, Baer D, et al. Intravenous bisphosphonate-related osteonecrosis of the jaw: Bone scintigraphy as an early indicator. J Oral Maxillofac Surg 2009;67(7):1363-72.
17. Sanchez-Lopez J-D, Cariati P, Cambil-Martin J, Villegas-Calvo M, Moreno-Martin L. Use of bone scintigraphy in the early diagnosis of bisphosphonate related osteonecrosis of the jaw. Case report and review of the literature. J Clin Exp Dent 2018;10(12):e1235-7.
18. Khan AA, Morrison A, Hanley DA, Felsenberg D, McCauley LK, O’Ryan F, et al. Diagnosis and management of osteonecrosis of the jaw: A systematic review and international consensus. J Bone Miner Res 2015;30(1):3-23.
19. Fleisher K E, Jolly A, Chippada Venkata UD, Norman RG, Saxena D, Glickman RS. Osteonecrosis of the jaw onset times are based on the route of bisphosphonate therapy. J Oral Maxillofac Surg 2012;0278-2391(12)01090-7.
20. Société française de stomatologie, chirurgie maxillo-faciale et chirurgie orale. Ostéonécrose des mâchoires en chirurgie oromaxillo-faciale et traitements médicamenteux à risque (antirésorbeurs osseux, anti-angiogéniques). Recommandations de bonne pratique, juillet 2013.
21. Watters AL, Hansen HJ, Williams T, Chou JF, Riedel E, Halpern J, et al. Intravenous bisphosphonate-related osteonecrosis of the jaw: Long-term follow-up of 109 patients. Oral Surg Oral Med Oral Pathol Oral Radiol 2013;115(2):192-200.
22. Papapoulos S, Chapurlat R, Libanati C, Brandi ML, Brown JP, Czerwinski E, et al. Five years of denosumab exposure in women with postmenopausal osteoporosis: Results from the first two years of the FREEDOM extension. J Bone Miner Res 2012;27(3):694-701.
23. Jung S, Kim J, Park JH, Kim K-Y, Kim HJ, Park W. A 5-years retrospective cohort study of denosumab induced medication related osteonecrosis of the jaw in osteoporosis patients. Sci Rep 2022;12(1):8641.
24. Van Poznak C, Reynolds EL, Estilo CL, Hu M, Schneider BP, Hertz DL, et al. Osteonecrosis of the jaw risk factors in bisphosphonate-treated patients with metastatic cancer. Oral Dis 2022;28(1):193-201.
25. Aminoshariae A, Donaldson M, Horan M, Mackey SA, Kulild J, Baur D. Emerging antiresorptive medications and their potential implications for dental surgeries. J Am Dent Assoc 2022;153(7):649-58.
26. Soutome S, Otsuru M, Murata M, Morishita K, Omori K, Suyama K, et al. Risk factors for developing medication-related osteonecrosis of the jaw when preserving the tooth that can be a source of infection in cancer patients receiving high-dose antiresorptive agents: A retrospective study. Support Care Cancer 2022;30:7241-8.
27. Vahtsevanos K, Kyrgidis A, Verrou E, Katodritou E, Triaridis S, Andreadis CG, et al. Longitudinal cohort study of risk factors in cancer patients of bisphosphonate-related osteonecrosis of the jaw. J Clin Oncol 2009;27(32):5356-62.
28. Kaoutzanis C, Yu JW, Lee ZH, Davary A, Fleisher K, Levine JP. Mandibular reconstruction with free fibula flap for medication-related osteonecrosis of the jaw in patients with multiple myeloma. Plast Reconstr Surg Glob Open 2020;8(10):e3186.
29. Bozec A, Poissonnet G, Converste S, Lattes L, Chamorey E, Vallicioni J, et al. Mandibular reconstruction with osseous free flaps: Functional results. Ann Otolaryngol Chir Cervicofac 2007;124(1):16-24.
30. Agence nationale de sécurité du médicament et des produits de santé (ANSM). Prescription des antibiotiques en odontologie et stomatologie. Recommandations, 2011.
31. Société française de chirurgie orale. Prise en charge des foyers infectieux bucco-dentaires. Recommandations de bonne pratique, 2012.
32. Société française de stomatologie et chirurgie maxillo-faciale. Implantologie et bisphosphonates. Recommandations de bonne pratique, juillet 2012.
33. Lo JC, O’Ryan FS, Gordon NP, Yang J, Hui RL, Martin D, et al. Prevalence of osteonecrosis of the jaw in patients with oral bisphosphonate exposure. J Oral Maxillofac Surg 2010;68(2):243-53.
34. Tsao C, Darby I, Ebeling PR, Walsh K, O’Brien-Simpson N, Reynolds E, et al. Oral health risk factors for bisphosphonate-associated jaw osteonecrosis. J Oral Maxillofac Surg 2013;71(8):1360-6.
35. InSoo K, HyungChun K, Won L, Heesung K, Jun-Beom P. The effect of systemically administered bisphosphonates on bony healing after tooth extraction and osseointegration of dental implants in the rabbit maxilla. Int J Oral Maxillofac Implants 2013 ;28(5):1194-200.
Dans cet article
- Risque d'ostéonécrose de la mâchoire
- Actions sur les ostéoclastes inhibant la résorption osseuse
- Complications orales liées au traitement par antirésorbeurs osseux
- Multiples facteurs de risque d’apparition d’une ONM
- Quatre stades définissent la prise en charge de l’ONM
- Prévention de l’ostéonécrose de la mâchoire
- Éléments fondamentaux du suivi

 Encadrés
Encadrés