La mise en place d’une stratégie de prévention du risque cardiovasculaire (CV) n’est pas toujours aisée. Nous proposons une démarche en accord avec les recommandations des Société européennes de cardiologie et d’athérosclérose.1
Notions indispensables
Facteurs de risque ou causals ?
L’âge, le sexe et l’hérédité (27 allèles génétiques favorisent l’athérosclérose ; ATH) sont des paramètres majeurs, qui interviennent dans l’estimation du risque, mais ils ne sont pas modifiables. En revanche, les facteurs corrigeables sont accessibles à une intervention préventive.
INTERHEART2 est l’étude qui offre la meilleure estimation de leur poids respectif dans la survenue d’un infarctus du myocarde (IDM). Le risque est multiplié par 2 en cas de tabagisme, diabète, HTA, mais il est quadruplé pour chaque doublement du rapport ApoB/ApoA. Ce rapport est utilisé, dans cette étude, pour évaluer la dyslipidémie, combinant la notion de risque lié au LDL-cholestérol (ApoB) et de protection CV associée au HDL-cholestérol (ApoA). Si un taux élevé de ce dernier est protecteur, son élévation par les mesures hygiénodiététiques ou médicamenteuses n’a pas montré d’effet : il a donc le même intérêt que les facteurs non modifiables. Ce n’est pas le cas du LDL-c, dont le caractère « causal » dans l’ATH est indéniable.3 Ainsi, sans négliger les autres facteurs de risque, il doit être la cible principale des traitements de prévention primaire et secondaire de l’athérosclérose.
INTERHEART2 est l’étude qui offre la meilleure estimation de leur poids respectif dans la survenue d’un infarctus du myocarde (IDM). Le risque est multiplié par 2 en cas de tabagisme, diabète, HTA, mais il est quadruplé pour chaque doublement du rapport ApoB/ApoA. Ce rapport est utilisé, dans cette étude, pour évaluer la dyslipidémie, combinant la notion de risque lié au LDL-cholestérol (ApoB) et de protection CV associée au HDL-cholestérol (ApoA). Si un taux élevé de ce dernier est protecteur, son élévation par les mesures hygiénodiététiques ou médicamenteuses n’a pas montré d’effet : il a donc le même intérêt que les facteurs non modifiables. Ce n’est pas le cas du LDL-c, dont le caractère « causal » dans l’ATH est indéniable.3 Ainsi, sans négliger les autres facteurs de risque, il doit être la cible principale des traitements de prévention primaire et secondaire de l’athérosclérose.
Courbe en J : le mieux est l’ennemi du bien ?
Une corrélation de ce type a été initialement observée entre IDM et abaissement de la pression artérielle diastolique. En effet, une PA diastolique trop basse chez les hypertendus augmente le risque. Ce phénomène a été rapporté dans d’autres situations cliniques où l’atteinte de valeurs extrêmes se révèle délétère. En prévention CV, il est décrit pour la PA ou la glycémie. D’autres facteurs, comme le tabac, peuvent être totalement éliminés sans danger. Pour le LDL-c, un effet courbe en J a été suggéré par l’observation d’une augmentation de la mortalité associée à des valeurs très basses de cholestérol.
Cette hypothèse est actuellement abandonnée : les conditions de fragilité extrême sont responsables d’une réduction massive du LDL-c, mais ce sont ces dernières qui sont dangereuses et non la valeur du cholestérol. Inversement, des taux naturellement (génétiquement) faibles sont protecteurs vis-à-vis des maladies CV et associés à une plus grande longévité. Les études interventionnelles n’ont pas montré d’impact « en J », mais au contraire une corrélation entre baisse du LDL-c et risque CV, sans limite inférieure.4 Sur le plan physiologique, les valeurs basses induites par des statines, l’ézétimibe ou les inhibiteurs de PCSK9 correspondent à une clairance accélérée des particules de LDL-c ; les fonctions de distribution et échanges du cholestérol restent assurées.
Le rôle du LDL-c dans l’athérosclérose, l’efficacité et la sécurité d’un abaissement massif expliquent l’orientation des dernières recommandations, avec en particulier la cible ambitieuse pour les patients à très haut risque CV (suivant la devise « lower is better »).
Cette hypothèse est actuellement abandonnée : les conditions de fragilité extrême sont responsables d’une réduction massive du LDL-c, mais ce sont ces dernières qui sont dangereuses et non la valeur du cholestérol. Inversement, des taux naturellement (génétiquement) faibles sont protecteurs vis-à-vis des maladies CV et associés à une plus grande longévité. Les études interventionnelles n’ont pas montré d’impact « en J », mais au contraire une corrélation entre baisse du LDL-c et risque CV, sans limite inférieure.4 Sur le plan physiologique, les valeurs basses induites par des statines, l’ézétimibe ou les inhibiteurs de PCSK9 correspondent à une clairance accélérée des particules de LDL-c ; les fonctions de distribution et échanges du cholestérol restent assurées.
Le rôle du LDL-c dans l’athérosclérose, l’efficacité et la sécurité d’un abaissement massif expliquent l’orientation des dernières recommandations, avec en particulier la cible ambitieuse pour les patients à très haut risque CV (suivant la devise « lower is better »).
Impact clinique de la baisse du LDL-c
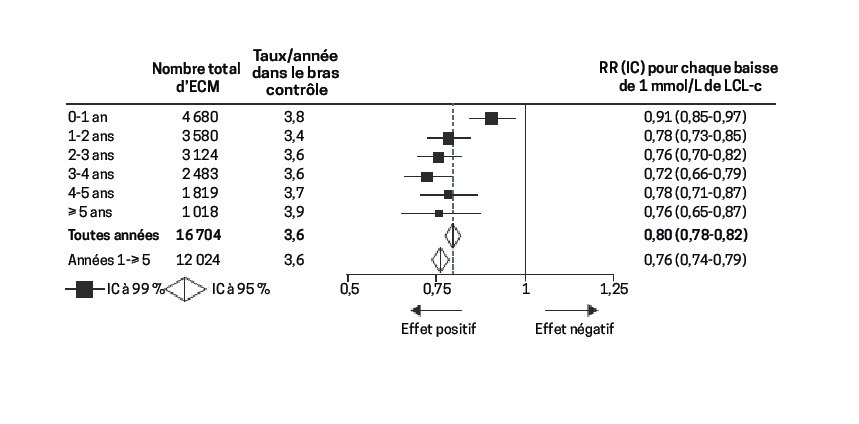
Avec plus de 300 000 patients inclus dans des études randomisées, il est particulièrement bien connu, surtout avec les statines. Pour chaque réduction de 1 mmol/L (38 mg/dL), le risque relatif diminue de 20 % par an (fig. 1 ). Avec cette formule, on comprend que l’impact clinique sera d’autant plus marqué que la baisse du LDL-c est importante, que la durée du traitement est longue et que le niveau de risque est élevé. En pratique : l’efficacité est grande chez les patients à haut risque CV, chez ceux ayant un LDL-c basal élevé (qu’on peut abaisser de façon importante) et lorsque le traitement est prolongé.
Par quelles méthodes ?
Les mesures diététiques sont universellement reconnues et préconisées pour réduire les niveaux de lipides athérogènes : régime alimentaire de type méditerranéen (riche en fruits, légumes, huiles végétales, poissons gras : 2 ou 3 fois par semaine), peu salé, pauvre en graisse et en sucre rapide ; pratique d’une activité physique régulière ; sevrage complet et durable du tabac et lutte contre le taba- gisme passif. Toutefois, si elles sont efficaces pour baisser les triglycérides, leur effet est limité sur le LDL-c : 5 à 10 % de diminution.1 En complément, 3 classes thérapeutiques ont une efficacité biologique et clinique démontrée, avec un bon profil de sécurité.
Les statines sont considérées comme des médicaments « essentiels » par l’OMS. Leur mécanisme suit une règle écologique : produire moins, recycler plus ! En effet, leur mode d’action limite la synthèse de la molécule de cholestérol, ce qui entraîne une augmentation de la captation du LDL-c circulant par les récepteurs. Le contenu en cholestérol du LDL-c est restitué à la circulation dans des particules non athérogènes. L’effet biologique est important : 50 % de baisse pour les statines de forte intensité (par exemple, atorva- statine, fortes doses, 40 à 80 mg/j) ; 35 % pour les intensités moyennes (par exemple, simvastatine, 20 à 40 mg/j) et 25 % pour les faibles (par exemple, pravastatine, 10 à 20 mg/j).
L’ézétimibe inhibe l’absorption intestinale du cholestérol, induisant une réduction complémentaire du LDL-c de 20 %. Il est commercialisé seul ou en association à diverses statines (avec la simvastatine, l’atorvastatine et la rosuvastatine).
Les inhibiteurs de PCSK9 (proprotéine convertase subtilisine/kexine de type 9) – évolocumab (Repatha) et alirocumab (Praluent) – augmentent l’expression des récepteurs hépatiques au LDL-c, ce qui abaisse le LDL-c sanguin d’environ 50 % en plus de l’action des statines/ézétimibe. Leur remboursement est actuellement limité aux patients ayant une hypercholestérolémie familiale sévère nécessitant une prise en charge par LDL-aphérèse. C’est-à-dire ceux qui, sous traitement par statines, gardent un LDL-c > 2,0 g/L en prévention secondaire ou > 3,0 g/L en prévention primaire. D’autres possibilités de remboursement sont en cours de discussion pour les patients en prévention secondaire.
Les statines sont considérées comme des médicaments « essentiels » par l’OMS. Leur mécanisme suit une règle écologique : produire moins, recycler plus ! En effet, leur mode d’action limite la synthèse de la molécule de cholestérol, ce qui entraîne une augmentation de la captation du LDL-c circulant par les récepteurs. Le contenu en cholestérol du LDL-c est restitué à la circulation dans des particules non athérogènes. L’effet biologique est important : 50 % de baisse pour les statines de forte intensité (par exemple, atorva- statine, fortes doses, 40 à 80 mg/j) ; 35 % pour les intensités moyennes (par exemple, simvastatine, 20 à 40 mg/j) et 25 % pour les faibles (par exemple, pravastatine, 10 à 20 mg/j).
L’ézétimibe inhibe l’absorption intestinale du cholestérol, induisant une réduction complémentaire du LDL-c de 20 %. Il est commercialisé seul ou en association à diverses statines (avec la simvastatine, l’atorvastatine et la rosuvastatine).
Les inhibiteurs de PCSK9 (proprotéine convertase subtilisine/kexine de type 9) – évolocumab (Repatha) et alirocumab (Praluent) – augmentent l’expression des récepteurs hépatiques au LDL-c, ce qui abaisse le LDL-c sanguin d’environ 50 % en plus de l’action des statines/ézétimibe. Leur remboursement est actuellement limité aux patients ayant une hypercholestérolémie familiale sévère nécessitant une prise en charge par LDL-aphérèse. C’est-à-dire ceux qui, sous traitement par statines, gardent un LDL-c > 2,0 g/L en prévention secondaire ou > 3,0 g/L en prévention primaire. D’autres possibilités de remboursement sont en cours de discussion pour les patients en prévention secondaire.
Étape 1 : quel est le risque CV de votre patient ?
Déterminer le niveau de risque est la première étape de la prévention. En effet, il ne faut traiter que les patients qui pourront en tirer un bénéfice. On l’a vu, chaque baisse du LDL-c de 38 mg/dL réduit de 20 % le risque relatif d’événement CV majeur. Traduite en valeurs absolues, cette diminution est insignifiante quand le risque est faible, mais très importante quand il est élevé.
L’estimation du risque CV global s’est substituée au simple dénombrement des facteurs de risque en raison du poids respectif inégal de chacun d’entre eux ; deux ne sont pas modifiables : l’âge et le sexe.
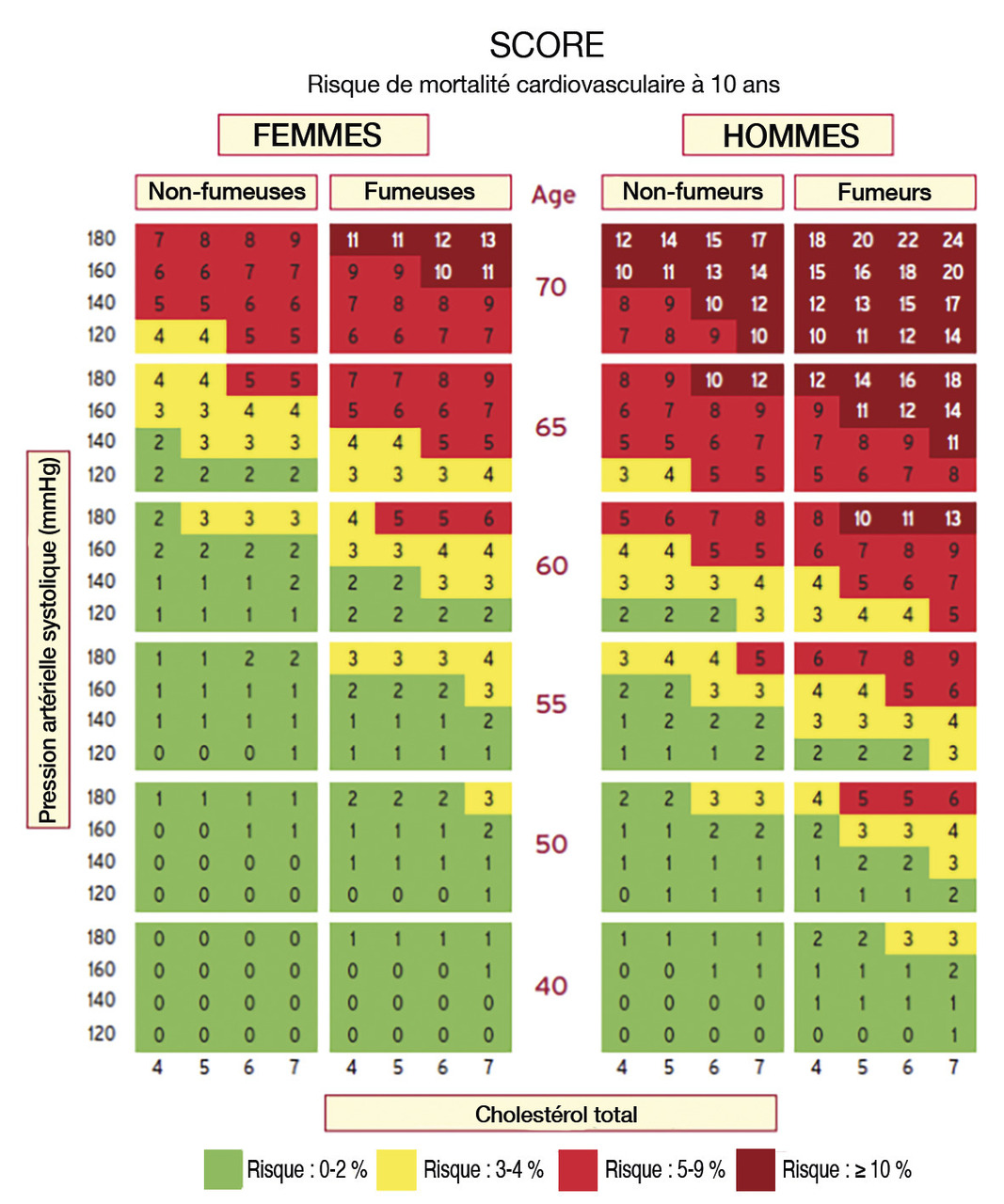
En pratique, il faut s’aider soit de calculateurs informatiques (MESA, Framingham, QRISK…), soit d’une simple charte de couleur (abaque SCORE). Les calculateurs fournissent une estimation précise car ils acceptent de nombreuses variables, au détriment toutefois de la simplicité. Les chartes de couleur sont faciles à appréhender et directement interprétables par le patient. Elles indiquent le risque de décès CV à 10 ans en fonction de la tranche d’âge, du sexe, du tabagisme, de la pression artérielle systolique et du cholestérol total (fig. 2 ). Si l’on souhaite être plus précis, il est également possible de tenir compte du niveau de HDL-c, de 12 facteurs environnementaux et d’éventuelles plaques d’athérome visibles en écho-Doppler ou des calcifications coronaires (score calcique).1 Ce dernier est mesuré à l’aide d’un scanner sans injection, peu irradiant. Une valeur très élevée (> 400) témoigne d’une charge importante en plaques athéromateuses calcifiées et sous-entend la présence de lésions non calcifiées multiples (sténosantes ou non), indiquant un haut risque CV.
À partir de la probabilité de décès obtenue, on classe le patient dans une des 4 catégories : risque faible (0-1 %), modéré (2-4 %), élevé (5-9 %) ou très élevé (10 % et plus). Chez les moins de 40 ans, l’estimation de la mortalité à 10 ans est presque toujours basse ; dans ce cas, il convient de considérer le surrisque par rapport à une personne du même âge n’ayant pas de facteur de risque. Par exemple, une femme de 45 ans, fumeuse, ayant une pression systolique de 160 mmHg et un cholestérol total de 6 mmol/L (soit 2,32 g/L) a un risque de décès CV à 10 ans de moins de 1 %. Mais, projeté à l’âge de 60 ans, elle a un risque multiplié par 4. Inversement, passé 75 ans, le risque CV est toujours élevé : les recommandations proposent de ne pas exclure systématiquement ces patients d’une prévention qui reste efficace quel que soit l’âge et de décider en fonction de l’état général, l’espérance de vie et du souhait du sujet.
L’hypercholestérolémie familiale et le diabète augmentent le risque CV indépendamment des autres paramètres. L’évaluation de ces patients ne peut pas être faite de la même manière.
Selon les recommandations de l’ESC, il faut classer les diabétiques en fonction de l’ancienneté de la pathologie, de l’atteinte d’organes cibles ou de l’existence d’autres facteurs de risque :
– diabète depuis moins de 10 ans sans autre facteur : risque modéré ;
– diabète depuis 10 à 20 ans ou associé à 1 ou 2 facteurs : risque élevé ;
– ancienneté supérieure à 20 ans ou atteinte d’organe (microalbuminurie, rétinopathies ou neuropathie) ou associé au moins 3 autres facteurs de risque : risque très élevé.
Quant aux patients ayant une hypercholestérolémie familiale, ils sont à risque élevé, voire très élevé si un facteur de risque est présent.
Après une revascularisation coronaire, un infarctus ou un AVC, les sujets sont considérés à très haut risque CV (prévention secondaire). Est assimilé à ces événements l’observation, sur une coronarographie, un scanner ou un écho-Doppler carotidien, d’une sténose > 50 % sur 2 vaisseaux coronaires ou sur les carotides.
L’estimation du risque CV global s’est substituée au simple dénombrement des facteurs de risque en raison du poids respectif inégal de chacun d’entre eux ; deux ne sont pas modifiables : l’âge et le sexe.
En pratique, il faut s’aider soit de calculateurs informatiques (MESA, Framingham, QRISK…), soit d’une simple charte de couleur (abaque SCORE). Les calculateurs fournissent une estimation précise car ils acceptent de nombreuses variables, au détriment toutefois de la simplicité. Les chartes de couleur sont faciles à appréhender et directement interprétables par le patient. Elles indiquent le risque de décès CV à 10 ans en fonction de la tranche d’âge, du sexe, du tabagisme, de la pression artérielle systolique et du cholestérol total (
À partir de la probabilité de décès obtenue, on classe le patient dans une des 4 catégories : risque faible (0-1 %), modéré (2-4 %), élevé (5-9 %) ou très élevé (10 % et plus). Chez les moins de 40 ans, l’estimation de la mortalité à 10 ans est presque toujours basse ; dans ce cas, il convient de considérer le surrisque par rapport à une personne du même âge n’ayant pas de facteur de risque. Par exemple, une femme de 45 ans, fumeuse, ayant une pression systolique de 160 mmHg et un cholestérol total de 6 mmol/L (soit 2,32 g/L) a un risque de décès CV à 10 ans de moins de 1 %. Mais, projeté à l’âge de 60 ans, elle a un risque multiplié par 4. Inversement, passé 75 ans, le risque CV est toujours élevé : les recommandations proposent de ne pas exclure systématiquement ces patients d’une prévention qui reste efficace quel que soit l’âge et de décider en fonction de l’état général, l’espérance de vie et du souhait du sujet.
L’hypercholestérolémie familiale et le diabète augmentent le risque CV indépendamment des autres paramètres. L’évaluation de ces patients ne peut pas être faite de la même manière.
Selon les recommandations de l’ESC, il faut classer les diabétiques en fonction de l’ancienneté de la pathologie, de l’atteinte d’organes cibles ou de l’existence d’autres facteurs de risque :
– diabète depuis moins de 10 ans sans autre facteur : risque modéré ;
– diabète depuis 10 à 20 ans ou associé à 1 ou 2 facteurs : risque élevé ;
– ancienneté supérieure à 20 ans ou atteinte d’organe (microalbuminurie, rétinopathies ou neuropathie) ou associé au moins 3 autres facteurs de risque : risque très élevé.
Quant aux patients ayant une hypercholestérolémie familiale, ils sont à risque élevé, voire très élevé si un facteur de risque est présent.
Après une revascularisation coronaire, un infarctus ou un AVC, les sujets sont considérés à très haut risque CV (prévention secondaire). Est assimilé à ces événements l’observation, sur une coronarographie, un scanner ou un écho-Doppler carotidien, d’une sténose > 50 % sur 2 vaisseaux coronaires ou sur les carotides.
Étape 2 : quel seuil d’intervention ?
Dans tous les cas, si un facteur de risque CV modifiable est retrouvé, on conseille de tenter de le contrôler (ou de le faire disparaître). Tabagisme, surpoids et sédentarité relèvent du « mode de vie » et donc de la décision du patient, sachant que les changements de comportements ne sont pas toujours faciles à obtenir. D’autres, comme l’HTA ou le diabète, justifient une intervention médicamenteuse complémentaire.
La place du LDL-c est particulièrepuisque, s’il faut envisager de le réduire quand le taux est élevé, son abaissement même s’il est dans « la norme » est efficace. On peut donc proposer un traitement pour réduire le LDL-c à des patients dont le niveau n’est pas forcément élevé et jusqu’à des valeurs très inférieures aux moyennes observées dans la population.
Les seuils d’intervention sont déterminéspar la catégorie de risque et son niveau basal. Chez les patients à faible risque (moins de 1 % de mortalité CV à 10 ans), il n’est proposé d’intervenir (par diététique ou, si insuffisant, par médicaments) que si le LDL-c est > 190 mg/dL (4,9 mmol/L). Inversement, chez les sujets à très haut risque (plus de 10 % de mortalité CV), une statine est proposée systématiquement.
Le choix du seuil est crucial car il débouche (ou pas) sur un traitement à durée indéterminée. Il est indispensable de se référer à un tableau pour intégrer les 4 niveaux de risque et les niveaux de LDL-c correspondants (tableau 1 ). Les « pocket guidelines » en version papier ou électronique (application smartphone) permettent d’y avoir accès rapidement.
La place du LDL-c est particulièrepuisque, s’il faut envisager de le réduire quand le taux est élevé, son abaissement même s’il est dans « la norme » est efficace. On peut donc proposer un traitement pour réduire le LDL-c à des patients dont le niveau n’est pas forcément élevé et jusqu’à des valeurs très inférieures aux moyennes observées dans la population.
Les seuils d’intervention sont déterminéspar la catégorie de risque et son niveau basal. Chez les patients à faible risque (moins de 1 % de mortalité CV à 10 ans), il n’est proposé d’intervenir (par diététique ou, si insuffisant, par médicaments) que si le LDL-c est > 190 mg/dL (4,9 mmol/L). Inversement, chez les sujets à très haut risque (plus de 10 % de mortalité CV), une statine est proposée systématiquement.
Le choix du seuil est crucial car il débouche (ou pas) sur un traitement à durée indéterminée. Il est indispensable de se référer à un tableau pour intégrer les 4 niveaux de risque et les niveaux de LDL-c correspondants (
Étape 3 : quelles cibles thérapeutiques ?
Des objectifs ont été établis pour chaque facteur de risque, mais leur justification scientifique est variable ainsi que les moyens et la facilité de les atteindre. Dans le cas des mesures diététiques, de l’activité physique et du tabagisme, les cibles se décident avec le patient. Lorsque ces modifications du style de vie sont insuffisantes, il faut alors envisager des thérapies médicamenteuses.
Chez les hypertendus comme chez les diabétiques, la diététique, le contrôle du poids et les médicaments doivent souvent être associés, et la difficulté à atteindre les objectifs se traduit finalement par une escalade thérapeutique. Dans ce contexte, le choix de cibles trop rigoureuses risque de faire apparaître les effets négatifs de la courbe en J : hypotension et hypoglycémies. Par ailleurs, à niveau tensionnel ou glycémique égal, les moyens médicamenteux n’ont pas le même impact sur l’évolution clinique.
Ainsi, les IEC/ARA2 se placent généralement en première ligne du traitement de l’HTA, suivis par les diurétiques ou les antagonistes calciques, alors que les bêtabloquants ne procurent pas la même protection.
De même, dans le diabète, les 2 classes qui semblent offrir la meilleure efficacité (notamment perte de poids et protection CV) selon les dernières études sont les analogues du GLP-1 et les inhibiteurs du SGLT2, associés à la metformine (aucune preuve de bénéfice clinique de cette ampleur n’existe pour les autres antidiabétiques).
Les cibles lipidiques se résument au taux de LDL-c, même si les triglycérides ou la Lp(a) doivent être surveillés. Pour réduire le taux, les moyens efficaces sont la diététique, les statines, l’ézétimibe ou les inhibiteurs de PCSK9.
À partir du moment où le traitement est instauré, la cible est d’autant plus basse que le niveau de risque est élevé : ≤ 116 mg/dL en cas de risque faible, < 100 mg/dL s’il est modéré, < 70 mg/dL si élevé et < 55 mg/dL si très élevé (et avec une baisse de plus de 50 % par rapport au taux initial dans les 2 derniers cas ;tableau 2 ).
La valeur (très) basse pour cette dernière catégorie a suscité des polémiques, mais elle s’appuie sur les résultats d’études randomisées démontrant que les niveaux de LDL-c les plus bas sont ceux qui confèrent la meilleure protection.
Chez les hypertendus comme chez les diabétiques, la diététique, le contrôle du poids et les médicaments doivent souvent être associés, et la difficulté à atteindre les objectifs se traduit finalement par une escalade thérapeutique. Dans ce contexte, le choix de cibles trop rigoureuses risque de faire apparaître les effets négatifs de la courbe en J : hypotension et hypoglycémies. Par ailleurs, à niveau tensionnel ou glycémique égal, les moyens médicamenteux n’ont pas le même impact sur l’évolution clinique.
Ainsi, les IEC/ARA2 se placent généralement en première ligne du traitement de l’HTA, suivis par les diurétiques ou les antagonistes calciques, alors que les bêtabloquants ne procurent pas la même protection.
De même, dans le diabète, les 2 classes qui semblent offrir la meilleure efficacité (notamment perte de poids et protection CV) selon les dernières études sont les analogues du GLP-1 et les inhibiteurs du SGLT2, associés à la metformine (aucune preuve de bénéfice clinique de cette ampleur n’existe pour les autres antidiabétiques).
Les cibles lipidiques se résument au taux de LDL-c, même si les triglycérides ou la Lp(a) doivent être surveillés. Pour réduire le taux, les moyens efficaces sont la diététique, les statines, l’ézétimibe ou les inhibiteurs de PCSK9.
À partir du moment où le traitement est instauré, la cible est d’autant plus basse que le niveau de risque est élevé : ≤ 116 mg/dL en cas de risque faible, < 100 mg/dL s’il est modéré, < 70 mg/dL si élevé et < 55 mg/dL si très élevé (et avec une baisse de plus de 50 % par rapport au taux initial dans les 2 derniers cas ;
La valeur (très) basse pour cette dernière catégorie a suscité des polémiques, mais elle s’appuie sur les résultats d’études randomisées démontrant que les niveaux de LDL-c les plus bas sont ceux qui confèrent la meilleure protection.
Observance : un enjeu crucial
L’observance du traitement est un autre objectif thérapeutique, plus difficile à atteindre et plus exigeant pour le médecin que la prescription. L’intolérance musculaire est un des premiers facteurs d’arrêt des traitements hypolipémiants, statines en particulier. Survenant plus volontiers en début du traitement, elle est localisée aux grands groupes musculaires.
Mais typiques ou non, les myalgies déclarées par le patient imposent une écoute attentive, un dosage des CPK et une stratégie d’interruption-réintroduction à dose plus faible et/ou de changement de molécule. En compensant la perte d’efficacité (de la dose réduite) par l’ajout d’ézétimibe (ou d’un inhibiteur de PCSK9), on peut le plus souvent trouver un compromis entre tolérance et efficacité.
L’autre grande cause d’interruption est liée à la désinformation massive, mensongère et malheureusement délétère véhiculée par les médias et internet. Des explications sur le mécanisme de l’athérome, le risque personnel du patient, sur l’efficacité et la sécurité des médicaments sont essentielles.
Mais typiques ou non, les myalgies déclarées par le patient imposent une écoute attentive, un dosage des CPK et une stratégie d’interruption-réintroduction à dose plus faible et/ou de changement de molécule. En compensant la perte d’efficacité (de la dose réduite) par l’ajout d’ézétimibe (ou d’un inhibiteur de PCSK9), on peut le plus souvent trouver un compromis entre tolérance et efficacité.
L’autre grande cause d’interruption est liée à la désinformation massive, mensongère et malheureusement délétère véhiculée par les médias et internet. Des explications sur le mécanisme de l’athérome, le risque personnel du patient, sur l’efficacité et la sécurité des médicaments sont essentielles.
Tolérance des traitements de prévention cardiovasculaire
Des effets secondaires ou une intolérance peuvent compliquer tous les traitements, mais quand ils font partie d’une stratégie de prévention, leurs effets indésirables, même minimes, sont généralement mal acceptés, d’autant que les médicaments sont supposés être pris au long cours et pour un bénéfice qui n’est pas toujours cliniquement perçu.
La perception des effets secondaires n’est pas la même selon le facteur de risque. Ainsi le traitement de l’HTA associe parfois des molécules aux effets secondaires fréquents : les IEC sont susceptibles d’occasionner une toux, les bêtabloquants de l’asthme, une bradycardie, une fatigue musculaire ou une dysfonction érectile ; les diurétiques polyurie, fatigue ou crampes, et les inhibiteurs calciques des œdèmes des membres inférieurs. Ces manifestations sont connues des médecins et ne posent généralement pas de problème ; les patients étant assez soucieux de leur niveau de pression artérielle pour ne pas remettre en cause le bien-fondé de la prescription, il suffit de modifier les thérapeutiques en cause.
Si les mêmes constatations peuvent être faites pour le diabète, il en va différemment avec les statines. Cette classe médicamenteuse est habituellement très bien supportée, mais elle induit 2 types d’effets secondaires.
Un risque de diabète, attendu à une fréquence de 1/1 000 sujets traités par an, le plus souvent chez les patients en situation de « prédiabète ». Pour ces personnes, il est établi que la protection apportée dépasse largement le risque lié au diabète, et la règle est de prendre des mesures pour contrôler la glycémie sans interrompre les statines.
Le second est l’intolérance musculaire. La myosite ou rhabdomyolyse, aussi grave que rare (1/100 000 patients par an) associe douleurs musculaires intenses et très forte élévation des CPK et de la myosine. Dans cette situation, l’arrêt des statines est la règle.
L’intolérance musculaire « banale » est au contraire bénigne (elle disparaît sans séquelles à l’arrêt du traitement) et fréquente (10-15 % des cas), mais souvent responsable d’arrêt prolongé ou définitif du médicament.
Chez des patients sous statines, tout symptôme musculaire doit être considéré comme étant potentiellement une intolérance, sachant que celle-ci se manifeste généralement dans les premières semaines et intéresse les grands groupes musculaires. Même si ces conditions ne sont pas réunies, l’arrêt temporaire des statines permet de vérifier si les symptômes leur sont associés (disparition des myalgies quelques jours après l’arrêt du traitement), et le dosage des CPK renseigne sur l’importance de l’intolérance.
Si elle est avérée, il est conseillé de rediscuter avec le patient du bien-fondé de la prévention et de négocier avec lui une tentative de reprise d’une statine différente et/ou à dose moins intense, la perte d’efficacité pouvant être plus ou moins compensée par l’ajout d’ézétimibe.
Prétendre que la prévention cardiovasculaire est simple, c’est possiblement avouer qu’on n’a pas tout compris. Entre une estimation approximative du risque, le choix inadapté d’un traitement (par excès ou par défaut) ou l’absence d’information compréhensible, le risque de « rater » la prévention est important.
La médecine moderne se veut « individualisée », ce qui ne veut pas dire que des connaissances générales ne s’appliquent pas à un patient particulier. Les faits scientifiques sont le point de départ du raisonnement. L’estimation la plus précise du risque, le choix d’un seuil d’intervention guidé par les recommandations les plus récentes (celles de l’ESC en 2019,tableau 2 ) et la recherche de l’atteinte de cibles individualisées sont les trois étapes d’une médecine « de précision », qui reste une médecine« basée sur les preuves ».
La perception des effets secondaires n’est pas la même selon le facteur de risque. Ainsi le traitement de l’HTA associe parfois des molécules aux effets secondaires fréquents : les IEC sont susceptibles d’occasionner une toux, les bêtabloquants de l’asthme, une bradycardie, une fatigue musculaire ou une dysfonction érectile ; les diurétiques polyurie, fatigue ou crampes, et les inhibiteurs calciques des œdèmes des membres inférieurs. Ces manifestations sont connues des médecins et ne posent généralement pas de problème ; les patients étant assez soucieux de leur niveau de pression artérielle pour ne pas remettre en cause le bien-fondé de la prescription, il suffit de modifier les thérapeutiques en cause.
Si les mêmes constatations peuvent être faites pour le diabète, il en va différemment avec les statines. Cette classe médicamenteuse est habituellement très bien supportée, mais elle induit 2 types d’effets secondaires.
Un risque de diabète, attendu à une fréquence de 1/1 000 sujets traités par an, le plus souvent chez les patients en situation de « prédiabète ». Pour ces personnes, il est établi que la protection apportée dépasse largement le risque lié au diabète, et la règle est de prendre des mesures pour contrôler la glycémie sans interrompre les statines.
Le second est l’intolérance musculaire. La myosite ou rhabdomyolyse, aussi grave que rare (1/100 000 patients par an) associe douleurs musculaires intenses et très forte élévation des CPK et de la myosine. Dans cette situation, l’arrêt des statines est la règle.
L’intolérance musculaire « banale » est au contraire bénigne (elle disparaît sans séquelles à l’arrêt du traitement) et fréquente (10-15 % des cas), mais souvent responsable d’arrêt prolongé ou définitif du médicament.
Chez des patients sous statines, tout symptôme musculaire doit être considéré comme étant potentiellement une intolérance, sachant que celle-ci se manifeste généralement dans les premières semaines et intéresse les grands groupes musculaires. Même si ces conditions ne sont pas réunies, l’arrêt temporaire des statines permet de vérifier si les symptômes leur sont associés (disparition des myalgies quelques jours après l’arrêt du traitement), et le dosage des CPK renseigne sur l’importance de l’intolérance.
Si elle est avérée, il est conseillé de rediscuter avec le patient du bien-fondé de la prévention et de négocier avec lui une tentative de reprise d’une statine différente et/ou à dose moins intense, la perte d’efficacité pouvant être plus ou moins compensée par l’ajout d’ézétimibe.
Prétendre que la prévention cardiovasculaire est simple, c’est possiblement avouer qu’on n’a pas tout compris. Entre une estimation approximative du risque, le choix inadapté d’un traitement (par excès ou par défaut) ou l’absence d’information compréhensible, le risque de « rater » la prévention est important.
La médecine moderne se veut « individualisée », ce qui ne veut pas dire que des connaissances générales ne s’appliquent pas à un patient particulier. Les faits scientifiques sont le point de départ du raisonnement. L’estimation la plus précise du risque, le choix d’un seuil d’intervention guidé par les recommandations les plus récentes (celles de l’ESC en 2019,
Encadre
Comment prescrire en pratique ?
Les études observationnelles montrent que les objectifs thérapeutiques sont rarement atteints et que le traitement proposé est souvent insuffisant même en absence d’intolérance.
La démarche classique de débuter par une dose faible de statines et d’augmenter l’intensité du traitement en fonction du résultat biologique est logique, mais ne fonctionne pas en pratique. Alternativement, il est proposé de sélectionner l’intensité du traitement sur son effet prévisible.
Cela revient souvent à débuter par un traitement de forte intensité, éventuellement associé à l’ézétimibe, qu’il sera toujours possible de diminuer si la cible est dépassée ou le traitement mal toléré.
Références
1. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020;41:111-88.
2. Yusuf S, Hawken S, Ounpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004;364:937-52.
3. Ference BA. Causal Effect of Lipids and Lipoproteins on Atherosclerosis: Lessons from Genomic Studies. Cardiol Clin 2018;36:203-11.
4. Giugliano RP, Pedersen TR, Park JG, et al. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet 2017;390:1962-71.
2. Yusuf S, Hawken S, Ounpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004;364:937-52.
3. Ference BA. Causal Effect of Lipids and Lipoproteins on Atherosclerosis: Lessons from Genomic Studies. Cardiol Clin 2018;36:203-11.
4. Giugliano RP, Pedersen TR, Park JG, et al. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet 2017;390:1962-71.

 Encadrés
Encadrés