Définir et évaluer le bon usage du médicament, selon l’autorisation de mise sur le marché (AMM) et hors AMM (y compris recommandations temporaires d’utilisation [RTU] ; autorisations temporaires d’utilisation [ATU]).
Définir les bases du suivi thérapeutique médicamenteux : quelle surveillance et quel rythme, pour quels médicaments ?
Connaître les étapes de la prise en charge médicamenteuse en ville et en établissements et les acteurs de cette prise en charge.
Détecter, déclarer et prendre en compte un effet indésirable.
Identifier les médicaments essentiels (liste de l’OMS).
Définir et évaluer le bon usage du médicament
Démarche institutionnelle de bon usage du médicament
Autorisation de mise sur le marché
C’est le prérequis indispensable à l’utilisation des médicaments. La plupart des autorisations de mise sur le marché (AMM) sont désormais délivrées d’emblée au niveau européen par l’European Medicines Agency (EMA). Les démarches au niveau seulement national (auprès de l’Agence nationale de sécurité du médicament et des produits de santé [ANSM]) ne concernent plus que des modifications d’AMM pour des médicaments anciens qui ne bénéficiaient que d’une AMM nationale.L’AMM précise les caractéristiques du médicament à partir des études scientifiques
L’AMM permet d’affirmer que le médicament est indiqué pour une pathologie précise, avec une forme galénique précise, à une dose précise et pendant une durée déterminée. Sont aussi indiqués notamment les précautions d’emploi, les conditions d’utilisation (adaptation posologique) dans certaines populations (insuffisants rénaux, insuffisants hépatiques, sujets âgés, enfants…), les contre-indications absolues ou relatives, les effets indésirables, les caractéristiques pharmacodynamiques et pharmacocinétiques : tous ces éléments figurent dans le résumé des caractéristiques du produit (RCP).
L’AMM précise les conditions d’utilisation du médicament
Situations exceptionnelles d’utilisation avant l’obtention d’AMM
Pour certaines pathologies particulièrement graves et sans alternative thérapeutique, il peut être envisagé d’utiliser un nouveau médicament évalué scientifiquement mais qui ne bénéficie pas encore d’une AMM (celle-ci étant demandée). On procède alors à une utilisation temporaire d’utilisation (ATU) pour un patient (ATU nominative) ou un groupe de patients (ATU de cohorte) sous le contrôle de l’ANSM. Cette dernière établit aussi des recommandations temporaires d’utilisation (RTU) pour des médicaments ayant déjà une AMM mais utilisés pour une autre indication pour laquelle il n’y a pas d’alternative thérapeutique.Place du nouveau médicament dans la stratégie thérapeutique
En aval de l’AMM, la Commission de la transparence de la Haute Autorité de santé (HAS) détermine l’importance du nouveau médicament par rapport à la pathologie traitée (service médical rendu [SMR]) et par rapport aux autres médicaments existant déjà (amélioration du service médical rendu [ASMR]). Ces deux notions ont un impact direct sur la détermination du prix accordé au nouveau médicament et sur son remboursement par l’Assurance maladie.Réévaluation du rapport bénéfice-risque du médicament
L’AMM est réévaluée tous les cinq ans mais aussi systématiquement en cas de signalement d’un effet indésirable grave.Démarche individuelle de bon usage du médicament
Décision thérapeutique
Elle doit prendre en compte de nombreux facteurs : le contexte pathologique (degré de gravité de la maladie, degré d’incertitude du diagnostic) ; la demande du patient ; les facteurs réglementaires (AMM, recommandations professionnelles) et leur extrapolation (fréquente) aux caractéristiques du patient (comorbidité) ; les facteurs individuels du patient (expériences antérieures, idées reçues, influence de son entourage). À ce stade peuvent interférer certains éléments individuels (expérience personnelle du prescripteur), professionnels (lobbying de l’industrie pharmaceutique) ou sociétaux (aspect économique, informations transmises par les médias).Bien que les conditions de prescription soient précisées dans le cadre de l’AMM, des ATU et des RTU dans la grande majorité des cas, il existe de rares cas particuliers où le médecin peut être amené à envisager une prescription « hors AMM ». Il s’agit de situations atypiques où le prescripteur estime, à partir de la connaissance exacte de la situation médicale particulière du malade et à l’aide des données de la littérature scientifique, que la seule possibilité de traiter un malade le plus efficacement possible (et au moindre risque) impose le recours à un médicament en dehors des conditions de l’AMM. Cette prescription doit être impérativement explicitée au malade et signalée sur l’ordonnance. Dans ce cas, l’Assurance maladie peut ne pas rembourser le médicament.
Prescription médicamenteuse proprement dite
Il est indispensable de bien connaître le malade et sa (ses) maladie(s) : degré de gravité potentielle de la maladie (enjeu vital, retentissement sur la qualité de vie) ; maladies associées ainsi que leurs traitements susceptibles d’interférer, situation physiologique particulière (femme enceinte, enfant, sujet âgé, terrain atopique) ; objectif thérapeutique à court et moyen termes ; existence d’une automédication ; capacité du malade à adhérer au traitement.Il est aussi indispensable de connaître les caractéristiques du médicament envisagé (RCP du Dictionnaire Vidal) avec notamment : les indications validées et les contre-indications ; la posologie, les précautions d’emploi, la(les) voie(s) d’élimination, la demi-vie plasmatique d’élimination, le degré de fixation aux protéines, l’existence ou non de métabolites actifs, les principales interactions et les principaux effets indésirables.
Le patient a-t-il une maladie associée (insuffisance rénale ou hépatique, déshydratation, dénutrition) qui modifie les paramètres pharmacocinétiques du médicament ?
À partir de ces informations, il faut tenter d’évaluer a priori le rapport bénéfice-risque du médicament pour le patient, c’est-à-dire le bénéfice escompté (bénéfice objectif et bénéfice attendu par le malade) par rapport au risque du médicament (prévisible ? évitable ? acceptable ?) en comparaison au risque évolutif de la maladie traitée.
La nouvelle prescription doit s’accompagner d’une évaluation de l’indication et de la posologie des autres médicaments du malade afin notamment d’éviter les interactions ou la prescription de médicaments d’une même classe thérapeutique ou qui ont des propriétés pharmacologiques communes. La voie d’administration doit être sûre et pertinente. Une prescription précise, lisible et expliquée au patient (sans oublier les principaux effets indésirables potentiels) favorise l’observance. Fixer d’emblée la durée du traitement et les modalités de surveillance aide à déterminer quand et comment en évaluer l’efficacité et la tolérance.
Surveillance du traitement
La surveillance porte sur son efficacité et sa tolérance : l’objectif attendu est-il atteint ? L’inefficacité thérapeutique est-elle due à une erreur d’observance ? La situation initiale a-t-elle changé (pathologie intercurrente) ? La bonne tolérance initiale à un médicament n’exclut pas le risque d’effet indésirable tardif, favorisé par une affection aiguë intercurrente : le « réflexe iatrogène » conduit à considérer tout nouveau symptôme comme un effet indésirable possible. Le traitement est-il toujours nécessaire ? Savoir « déprescrire » est aussi important que savoir prescrire ! Revoir la prescription lors de chaque consultation ultérieure permet d’éliminer certains médicaments devenus inutiles.Suivi thérapeutique : quelle surveillance, quel rythme, pour quels médicaments ?
Suivi clinique et paraclinique standard
Concernant l’efficacité, il doit s’assurer de l’amélioration voire de la disparition des symptômes de la pathologie traitée, de la normalisation des paramètres cliniques (température, pression artérielle, fréquence cardiaque…) ou encore du changement de scores d’évolutivité (échelle visuelle analogique [EVA] ou échelle verbale numérique [EVN] pour la douleur, le systemic lupus erythematosus disease activity index [SLEDAI] dans le lupus systémique ou encore le disease activity score [DAS] dans la polyarthrite rhumatoïde) tout en prenant en compte le ressenti du patient et sa qualité de vie. Il doit également être attentif à la tolérance du traitement et rechercher l’apparition de symptômes qui n’étaient pas présents au moment de la prescription initiale en s’aidant éventuellement de la liste des effets indésirables présente dans le RCP. Cependant, tout symptôme ou syndrome peut être un effet indésirable médicamenteux même s’il n’a jamais été rapporté jusqu’alors (réflexe iatrogénie).
De nombreux médicaments nécessitent également une surveillance paraclinique biologique et/ou électrocardiographique. Cette surveillance peut avoir pour objectif d’apprécier l’efficacité du traitement (hémoglobine glyquée [HbA1c] pour les traitements antidiabétiques, international normalized ratio [INR] pour les anticoagulants antivitamine-K, thyréostimuline [TSH] pour les traitements de l’hyper- ou hypothyroïdie) mais aussi sa tolérance. À titre d’exemple, sous clozapine, la numération formule leucocytaire doit être contrôlée une fois par semaine pendant les 18 premières semaines et au moins toutes les 4 semaines tout au long du traitement. De même, pour les médicaments allongeant l’intervalle QT, notamment les antidépresseurs et les antipsychotiques, une surveillance de l’électrocardiogramme est nécessaire.
Suivi thérapeutique pharmacologique
Ce suivi n’est pas systématique, mais certaines situations nécessitent le recours à un dosage sanguin du médicament.1
Pour quel médicament un dosage est-il utile ?2
Réponse insuffisante au traitement : le recours au dosage permet de faire la part des choses entre résistance pharmacologique (concentration suffisante), appelant un changement de traitement, et défaut d’exposition (concentration insuffisante) appelant une adaptation posologique. Par exemple : crises convulsives persistant malgré un taux d’acide valproïque dans la fourchette thérapeutique.Suspicion de toxicité : les dosages permettent de confirmer le diagnostic d’intoxication (involontaire ou volontaire) et au besoin d’adapter la posologie. Par exemple : survenue de symptômes gastro-intestinaux sous digoxine.
Manifestations cliniques ambiguës : le STP permet de faire la part des choses entre réponse insuffisante et toxicité. Par exemple : augmentation de créatinine chez un greffé rénal traité par ciclosporine.
Dysfonction d’organe : l’objectif du STP est de prévenir les conséquences de l’imprégnation médicamenteuse en adaptant la posologie. Par exemple : adaptation de la dose de gentamicine selon la fonction rénale.
Interactions médicamenteuses : le STP permet d’adapter la posologie. Par exemple : suivi des antirétroviraux chez un patient infecté par le virus de l’immunodéficience humaine [VIH] recevant de la rifampicine.
Vérification de l’adéquation d’une posologie : l’objectif est de viser une concentration cible en l’absence de moyen efficace de détection d’une dérive dangereuse des concentrations (inefficacité ou toxicité). Ce cas de figure concerne principalement les médicaments à marge thérapeutique étroite. Par exemple : suivi des immunosuppresseurs chez les patients transplantés.
Économie de médicament : le STP peut permettre de limiter à l’indispensable la prescription d’un produit cher ou disponible en faible quantité. C’est le cas des facteurs de la coagulation chez l’hémophile substitué.
Contrôle de l’observance : le STP permet d’évoquer un problème d’observance devant une absence ou une insuffisance de réponse thérapeutique. Par exemple : concentration indétectable d’antirétroviraux chez un patient infecté par le VIH avec une virémie non contrôlée.
Pour quel médicament un STP est-il inutile ?2
Il est généralement inutile de doser les médicaments dans les cas suivants.L’effet clinique est rapidement observable ; ainsi, il n’y a pas lieu de mesurer les concentrations sanguines d’un antihypertenseur dont l’efficacité est facilement contrôlable par la mesure de la pression artérielle.
L’effet peut être évalué par une constante biologique (mesure de la glycémie pour l’insuline ou les antidiabétiques oraux ; mesure de l’INR pour les antagonistes de la vitamine K).
Le STP se justifierait, mais la zone cible des concentrations de ce médicament est encore mal connue (la plupart des antidépresseurs, neuroleptiques ou certains antiépileptiques). En effet, la mesure des concentrations sanguines d’un médicament n’a de sens que si ce dernier possède certaines caractéristiques pharmacocinétiques et pharmacodynamiques qui ne sont toutefois le plus souvent pas toutes réunies pour les médicaments qu’il est possible de doser.
Quels sont les patients concernés ?
Si le STP est utile chez tous les patients pour quelques médicaments, il l’est, dans des populations à risque, pour la plupart des médicaments (nouveau-nés, sujets âgés, femmes enceintes, insuffisants rénaux et hépatiques, patients polymédicamentés) et dans des groupes particuliers pour certains médicaments (patients obèses et médicaments lipophiles).Quand et comment effectuer un prélèvement ?
La décision de doser un médicament implique diverses contraintes relatives au prélèvement sanguin à respecter afin de permettre une bonne interprétation du dosage (v. RCP du produit ou contacter le laboratoire de pharmacologie). Certains exemples sont présentés dans le tableau ci-contre.Conclusion
Prise en charge médicamenteuse en ville et en établissement
Prise en charge médicamenteuse en établissement de santé
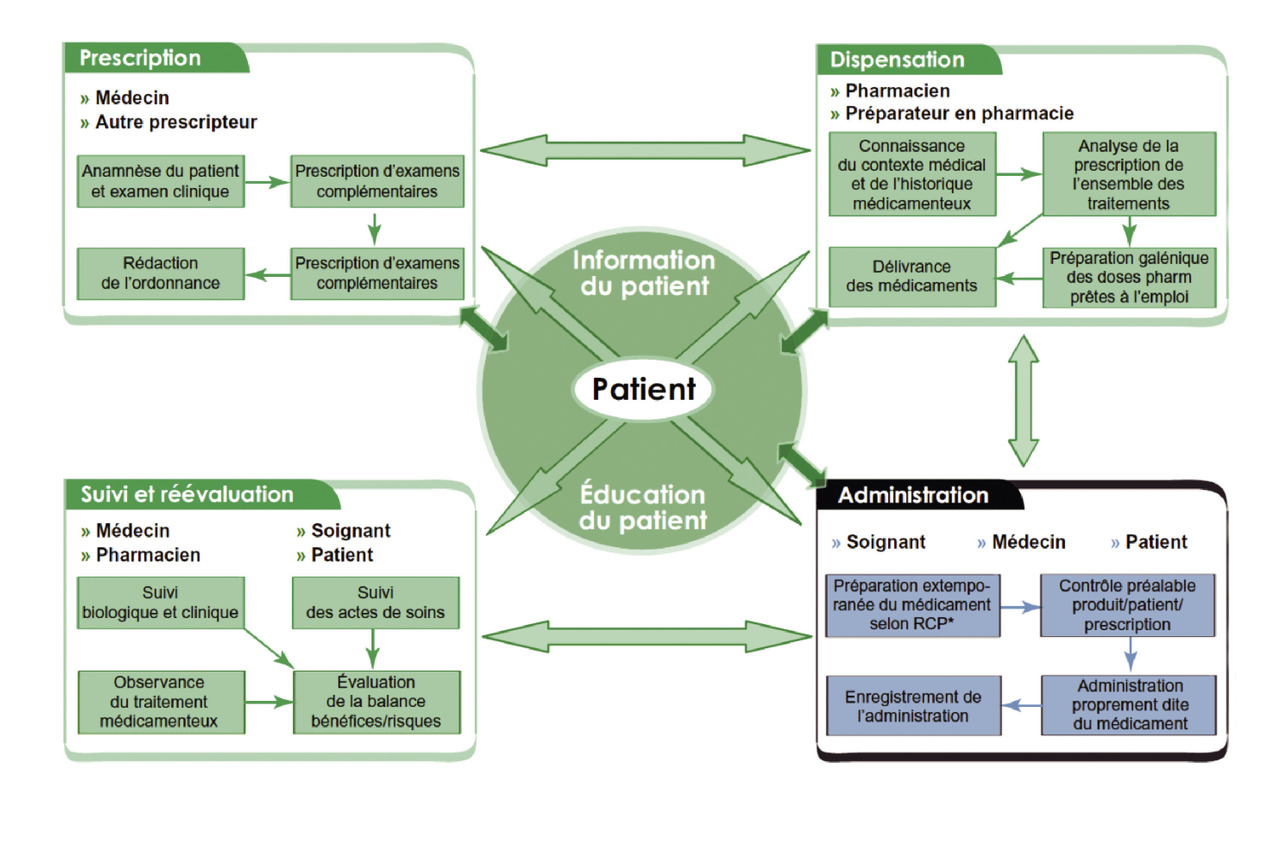
Le circuit du médicament est un processus comportant 4 phases majeures et successives impliquant différents acteurs (figure).
La première étape du processus est la prescription émanant d’un médecin ou d’un autre prescripteur (sage-femme par exemple). Cette prescription est fondée sur l’anamnèse du patient, ses antécédents médico-chirurgicaux doivent être recherchés, l’historique médicamenteux doit être réalisé non seulement sur les traitements actuels mais aussi sur les traitements passés avec en particulier l’efficacité et la tolérance de ces derniers ; l’examen clinique, les résultats d’éventuels examens complémentaires, l’analyse des coprescriptions donnent lieu à la rédaction d’une ordonnance.
La deuxième étape est celle de la dispensation. Les acteurs de cette étape sont les pharmaciens et préparateurs en pharmacie. En connaissance du contexte médical et de l’historique médicamenteux, ils analysent la prescription de l’ensemble des traitements puis délivrent les médicaments.
La troisième étape est celle de l’administration. Cette étape peut être effectuée par différents acteurs (médecins, soignants, patients) et peut se décomposer en plusieurs étapes : tout d’abord, la préparation extemporanée du médicament selon le résumé des caractéristiques du produit, puis le contrôle du triptyque produit-prescription-patient, puis l’administration du médicament et enfin l’enregistrement de l’administration.
La quatrième étape est celle du suivi et de la réévaluation. Les acteurs de cette étape sont tous les acteurs des étapes précédentes. L’objectif est alors d’évaluer la balance bénéfice/risque de la prescription.
Chaque acteur participe donc à la sécurité du processus. Le prescripteur prend une décision thérapeutique, prescrit les médicaments conformément à la réglementation, aux référentiels scientifiques et de manière adaptée à l’état du patient. Il informe le patient et s’assure de son consentement. En fin de processus, le prescripteur évalue l’efficacité du traitement et sa tolérance, il réévalue ainsi la balance bénéfice-risque. Par ailleurs, le prescripteur doit échanger avec les autres professionnels de santé impliqués dans la prise en charge du patient.
Le pharmacien analyse et valide la prescription, si nécessaire il émet une opinion. Il prépare et fabrique ensuite les médicaments nécessaires à l’exécution de la prescription, il délivre les médicaments en s’assurant de la maîtrise des stocks, et enfin il assure la mise à disposition des informations nécessaires aux professionnels de santé et au patient.
L’infirmière vérifie la prescription, prépare les doses à administrer extemporanément, vérifie la concordance entre la prescription, le médicament et le patient. Le patient est informé de l’administration du médicament, et donne son consentement. L’infirmière administre le médicament au patient, enregistre l’acte d’administration et enfin suit les effets attendus et les réactions éventuelles. L’aide- soignant(e) aide à la prise du médicament sous la responsabilité de l’infirmière, l’informe de toute modification de l’état du patient et participe au maintien de l’autonomie et à l’éducation du patient.
Le patient est lui aussi un acteur à part entière du processus de prise en charge médicamenteuse. Il informe l’ensemble des acteurs de ses traitements habituels, il doit communiquer l’ensemble des éléments de facteurs de risque et allergies connues. Le patient s’informe sur son traitement et les effets indésirables éventuels et il observe les indications de bon usage du médicament.
La phase la plus critique selon les rapports des études sur l’erreur médicamenteuse est la phase d’administration. Selon le guichet des erreurs médicamenteuses de l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS devenue ANSM), un événement indésirable grave sur deux est une erreur médicamenteuse et 57 % des erreurs médicamenteuses déclarées sont des erreurs d’administration. L’interruption de tâche est une des causes d’erreurs d’administration : 6,7 interruptions de tâche par heure par infirmière.6
Prise en charge médicamenteuse en ville
En ambulatoire, l’étape cruciale est donc celle de la prescription, en effet l’étude EVISA a mis en évidence les éléments en cause dans les effets indésirables liés aux soins extrahospitaliers :7 par ordre de fréquence, les erreurs de choix thérapeutique par défaut de connaissance des recommandations, la difficulté à remettre en cause une prescription faite par un spécialiste (hospitalier ou non), les problèmes de communication entre médecin traitant et soignants extrahospitaliers, les problèmes de traçabilité des informations (consignes orales laissées aux patients, avis spécialisés par téléphone, suivi de patients uniquement à domicile).
Conclusion
Détecter, déclarer et prendre en compte un effet indésirable [J. Benevent, J.-L. Montastruc]
Quelques définitions
Effet indésirable
Un effet indésirable est une réaction nocive et non voulue à un médicament, que ce soit dans les conditions normales « recommandées » d’utilisation (posologie, durée, etc.) ou en cas de mésusage (hors des conditions prévues dans le RCP), de surdosage, d’abus ou d’erreur médicamenteuse.Un effet indésirable peut présenter plusieurs caractéristiques : il peut être « grave » (létal, ou susceptible de mettre en jeu le pronostic vital, entraînant une invalidité ou une incapacité, provoquant ou prolongeant une hospitalisation, se manifestant par une anomalie ou une malformation congénitale), de type A, c’est-à-dire « augmenté » (lié aux propriétés pharmacologiques du médicament) ou au contraire de type B pour « bizarre » (non lié aux propriétés pharmacologiques). On différencie aussi les effets « attendus » (listés dans le RCP) des « inattendus » (non listés dans le RCP).
Pharmacovigilance
Bien qu’évaluée préalablement lors d’essais cliniques, la sécurité des médicaments reste peu connue au moment de leur mise sur le marché. Plusieurs raisons, aussi appelées les « 5 trop des essais cliniques », concourent à cette connaissance limitée de leurs effets indésirables : 1) le nombre de sujets inclus dans les essais cliniques est trop faible, ce qui ne permet pas de mettre en évidence des effets peu fréquents qui peuvent néanmoins être graves ; 2) la population est très sélectionnée, donc trop simple (pas de patient polypathologique ou polymédiqué) ; 3) ces essais concernent trop souvent des patients d’âge moyen (exclusion des personnes âgées et des enfants) ; 4) ils sont trop étroits (critères d’inclusion et d’exclusion très stricts) ; et 5) la durée des essais est trop courte par rapport à la pratique clinique, ce qui limite la possibilité d’évaluer les effets à long terme. En fait, les essais cliniques sont adaptés à la mise en évidence du bénéfice mais pas des effets indésirables des médicaments.Le but de la pharmacovigilance est d’améliorer la balance bénéfices-dommages des médicaments, à la fois au niveau individuel (traitement d’un malade donné) et au niveau collectif (santé publique).
Ainsi, il est nécessaire de mettre en œuvre une surveillance permanente des effets indésirables des médicaments qui, par centralisation des informations collectées, permet l’identification de risques non détectés lors des essais cliniques. Ce système de notification spontanée constitue une des bases du système de pharmacovigilance. Cette notification repose sur les professionnels de santé et les patients. Les firmes pharmaceutiques participent également, en transmettant les cas qui leur sont notifiés.
Centres régionaux de pharmacovigilance
Responsabilité des acteurs de santé
Professionnels de santé
D’après l’ANSM,9 « La pharmacovigilance repose sur le signalement, sans délai, par les professionnels de santé, des effets indésirables susceptibles d’être dus à un médicament. Dès qu’ils soupçonnent un lien, même s’il n’est pas certain, une déclaration doit être effectuée auprès du centre régional de pharmacovigilance ». En France, la déclaration est obligatoire pour les médecins, les sages-femmes et les pharmaciens pour tous les effets indésirables, et particulièrement lorsqu’il s’agit d’effets graves et/ou inattendus.Autorités sanitaires
Ces déclarations sont ensuite validées et évaluées, puis enregistrées par les CRPV dans une base nationale de pharmacovigilance (BNPV), située à l’ANSM qui coordonne l’ensemble du système. Les cas sont ensuite transmis à l’EMA qui les enregistre à son tour dans la base de données européenne de pharmacovigilance (Eudravigilance), puis enfin à l’Organisation mondiale de la santé (OMS), qui les enregistre dans Vigibase, la base de données mondiale de pharmacovigilance.Cette agrégation de l’ensemble des cas permet de détecter de nouveaux risques, notamment rares et parfois graves. La gravité de certains effets identifiés peut modifier la balance bénéfices-dommages de certains médicaments, dont le bénéfice apporté n’est plus à la hauteur du risque nouvellement détecté. Dans une telle situation, les autorités sanitaires, EMA ou ANSM, peuvent prendre des mesures pour limiter les préjudices pour les patients, comme par exemple la suspension de l’AMM, les restrictions d’usage (nouvelles contre-indications, précautions d’emploi…) et bien sûr la diffusion d’informations aux professionnels de santé ou aux patients, par exemple par courrier aux prescripteurs ou encore au travers de leur site internet (appelées Lettres aux prescripteurs ou Dear Doctor Letter).
Patients
Les patients, ainsi que leur entourage, ont aussi un rôle important à jouer en pharmacovigilance. Depuis juillet 2012, dans toute l’Europe, les patients peuvent notifier les effets indésirables. En France, cette notification est faite au CRPV dont dépend le patient. Les professionnels de santé doivent considérer avec attention les effets indésirables rapportés par les patients, en particulier quand ces effets indésirables sont inattendus.Évaluation des effets indésirables des médicaments
Imputabilité
L’imputabilité en pharmacovigilance est l’estimation du lien de causalité entre la prise d’un médicament et la survenue d’un effet indésirable. Cette estimation est réalisée par le CRPV pour chaque effet indésirable, à partir des informations cliniques disponibles dans les observations. L’imputabilité est d’autant plus précise que les informations disponibles sont détaillées.La méthode française d’imputabilité10 envisage séparément l’imputabilité intrinsèque et l’imputabilité extrinsèque. L’imputabilité intrinsèque utilise deux types de critères pour évaluer les cas d’effets indésirables : des critères chronologiques (délai de survenue, évolution à l’arrêt du médicament, réadministration éventuelle du médicament) et des critères sémiologiques (facteurs favorisants, autre explication possible, sémiologie évocatrice, examen complémentaire en faveur de la responsabilité du médicament). La combinaison de ces critères aboutit à un score d’imputabilité intrinsèque (Ii). Cette analyse du cas est complétée par l’imputabilité extrinsèque (Ie), c’est-à-dire les données bibliographiques (effet décrit ou non dans la littérature).
Identification d’effets indésirables
L’évaluation des effets indésirables par une méthode d’imputabilité peut suffire pour identifier de nouveaux effets et pour prendre des décisions réglementaires (restriction des indications, arrêt de la commercialisation du médicament, etc.). Cependant, l’interprétation des données de notification spontanée doit être très prudente, car la notification n’est ni exhaustive (sous-notification) ni forcément représentative de l’ensemble des cas survenus.Il est donc parfois nécessaire, avant de prendre une décision, d’engager des études spécifiques pour évaluer plus précisément la sécurité d’emploi des médicaments en conditions courantes d’utilisation. Les études pharmaco-épidémiologiques complètent également ces analyses. Il en existe deux principaux types : les études de cohorte et les études cas-témoins. Ces études permettent de quantifier l’importance de l’association entre médicaments et effets indésirables par mesure du « risque relatif » qui correspond au facteur multiplicatif du risque de survenue de l’effet indésirable. Il n’est pas la preuve d’une relation de causalité directe entre ces deux événements, même si l’analyse prend en compte de nombreux biais de confusion. Néanmoins, si les critères proposés par sir Austin Bradford Hill sont vérifiés (risque relatif élevé [> 3] et statistiquement significatif, existence d’une relation dose-effet, concordance des résultats observés avec les données de la littérature, cohérence des observations avec des données biologiques ou cliniques), l’hypothèse d’une relation de causalité entre l’exposition au médicament et la survenue de l’effet indésirable est renforcée. Ainsi, la pharmaco-épidémiologie permet la confirmation du risque et surtout sa quantification populationnelle. Les études de « fouille de données » (data mining) réalisées sur les grandes bases de pharmacovigilance complètent ces approches en permettant de mettre en évidence de façon précoce un signal d’effet indésirable médicamenteux.
Identifier les médicaments essentiels [D. Orlikowski]
Depuis lors, le comité d’experts de la LME s’est réuni tous les deux ans pour actualiser la liste en suivant un processus transparent. La 20e édition pour les adultes et la 6e édition de la liste pédiatrique ont été mises à jour en mars 2017.
Un concept matérialisé par une liste de médicaments essentiels de référence
La liste* principale correspond aux besoins minimaux en médicaments d’un système de soins de santé de base et indique les médicaments qui ont la meilleure efficacité, la meilleure innocuité et le meilleur rapport coût-efficacité concernant les maladies prioritaires. Ces maladies sont sélectionnées en fonction de leur importance actuelle et future estimée pour la santé publique, ainsi que de l’existence éventuelle d’un traitement sans danger et d’un bon rapport coût-efficacité. La liste complémentaire présente des médicaments essentiels pour des maladies prioritaires pour lesquelles des moyens de diagnostic ou de surveillance spécifiques et/ou des soins médicaux spécialisés et/ou une formation spécialisée sont nécessaires. En cas de doute, des médicaments peuvent également être rangés dans la liste complémentaire en raison de leur coût systématiquement plus élevé et/ou de leur rapport coût-efficacité moins bon dans certains contextes.
Le critère de besoin thérapeutique est pris en compte. Selon les recommandations de l’OMS publiées en 1977, les nouveaux médicaments peuvent être inclus s’ils présentent un net avantage par rapport aux substances sélectionnées antérieurement.
N’importe quelle entité peut proposer une inscription : des personnes individuelles, des gouvernements, des laboratoires pharmaceutiques ou des associations médicales. Mais il faut fournir des preuves de l’innocuité, de l’efficacité et du rapport coût-efficacité du médicament proposé. Il faut également montrer que le médicament est à la fois essentiel pour satisfaire des besoins sanitaires prioritaires et disponible en quantités suffisantes.
« Ces dernières décennies, les modifications de la liste ont reflété l’évolution des défis de la santé publique, avec l’inscription par exemple des médicaments antirétroviraux pour le VIH et de formulations pour le traitement de maladies non transmissibles. »12
Une liste pour les enfants
Conclusion
Ils devraient être disponibles en permanence dans le cadre de systèmes de santé opérationnels, en quantité suffisante, sous la forme galénique qui convient, avec une qualité assurée et à un prix abordable au niveau individuel comme à celui de la communauté. La liste est adaptée pour chaque pays permettant de garantir ainsi le droit à la santé.
Cet item a été élaboré grâce à la participation de nombreux membres de la thérapeutique et de la pharmacologie qui ont abordé les différents aspects du bon usage. Ce ne sont cependant que les grandes lignes qui sont rapportées pour baliser la réflexion car les situations sont complexes et une individualisation de la prise en charge est nécessaire, même si les référentiels sont là pour faire une synthèse de l’art que le médecin n’a pas le temps d’effectuer. Il s’agit en effet d’éviter une perte de chance pour un patient qui doit être traité de la même façon sur tout le territoire. Bonne lecture !
Le « bon usage du médicament » concerne les principes de prescription, de dispensation, d’administration et de surveillance du traitement médicamenteux.
Toute prescription médicamenteuse impose un suivi de l’efficacité et de la tolérance du traitement.
Quatre périodes à connaître composent le circuit du médicament.
Il est nécessaire de mettre en œuvre une surveillance permanente des effets indésirables des médicaments qui, par centralisation des informations collectées, permet l’identification de risques non détectés lors des essais cliniques.
Le concept de base des médicaments essentiels fait appel à un constat simple : un nombre limité de médicaments, efficaces et sûrs, de bonne qualité et à des prix raisonnables permet de répondre aux besoins de santé prioritaires du plus grand nombre.
1Bon usage du médicament
➥ Qu’est-ce qu’une AMM ?
➥ En quoi une AMM favorise le bon usage ? À partir de quels éléments détermine-t-on une AMM ?
➥ Bien connaître le circuit de l’AMM, les différents SMR et ASMR et leurs modalités d’attribution
➥ Pour prescrire un médicament hors AMM : connaître les risques et les obligations d’information
➥ Qu’est-ce qu’une ATU et comment est-elle mise en œuvre ?
➥ Qu’est-ce qu’une RTU et comment est-elle mise en œuvre ?
2Bases du suivi thérapeutique médicamenteux : quelle surveillance, à quel rythme ? Pour quels médicaments ?
➥ Savoir analyser une ordonnance et identifier les prescriptions : indiquées, utiles, antagonistes, contre-indiquées, redondantes, inutiles
➥ Pour les médicaments à connaître à l’ECN, y compris les classes thérapeutiques de l’UE10 (item 326)
➥ Identifier les effets indésirables fréquents et en déduire la surveillance
➥ Connaître les médicaments inducteurs et inhibiteurs enzymatiques qui influencent le métabolisme et donc le suivi des thérapeutiques
➥ Connaître les interactions médicamenteuses fréquentes (UE 10, item 322)
3Prise en charge médicamenteuse en ville et en établissements
➥ Identifier le circuit du médicament avant dispensation
➥ Connaître les conséquences du dysfonctionnement de la prise en charge médicamenteuse : mauvaise dispensation, inobservance…
4Détecter, déclarer et prendre en compte un effet indésirable
➥ Bien posséder les notions de la question 2.
➥ Savoir identifier les terrains à risque : sujet âgé, insuffisant rénal, insuffisant hépatique, obèse, femme enceinte
➥ Connaître les données épidémiologiques des effets indésirables (incidence des effets indésirables liés aux thérapeutiques médicamenteuses et non médicamenteuses)
➥ Devant tout nouveau symptôme/maladie : savoir évoquer un effet indésirable médicamenteux
➥ Connaître les règles d’imputabilité médicamenteuse pour identifier un éventuel effet indésirable
➥ Connaître les modalités de déclaration en pharmacovigilance d’un effet indésirable
5Identifier les médicaments essentiels (liste de l’OMS)
➥ Identifier les médicaments à connaître pour les ECN avec leurs posologies (v. site officiel CNCI)
➥ Connaître les médicaments les plus pourvoyeurs d’effets secondaires : anti-inflammatoires non stéroïdiens, anticoagulants, psychotropes… (v. supra question 4)
Une collaboration thérapeutique-pharmacologie
Cet item a été élaboré grâce à la participation de nombreux membres de la thérapeutique et de la pharmacologie qui ont abordé les différents aspects du bon usage. Ce ne sont cependant que les grandes lignes qui sont rapportées pour baliser la réflexion car les situations sont complexes et une individualisation de la prise en charge est nécessaire, même si les référentiels sont là pour faire une synthèse de l’art que le médecin n’a pas le temps d’effectuer. Il s’agit en effet d’éviter une perte de chance pour un patient qui doit être traité de la même façon sur tout le territoire. Bonne lecture !
POINTS FORTS À RETENIR
Le « bon usage du médicament » concerne les principes de prescription, de dispensation, d’administration et de surveillance du traitement médicamenteux.
Toute prescription médicamenteuse impose un suivi de l’efficacité et de la tolérance du traitement.
Quatre périodes à connaître composent le circuit du médicament.
Il est nécessaire de mettre en œuvre une surveillance permanente des effets indésirables des médicaments qui, par centralisation des informations collectées, permet l’identification de risques non détectés lors des essais cliniques.
Le concept de base des médicaments essentiels fait appel à un constat simple : un nombre limité de médicaments, efficaces et sûrs, de bonne qualité et à des prix raisonnables permet de répondre aux besoins de santé prioritaires du plus grand nombre.
Qu'est-ce qui peut tomber à l'examen ?
1Bon usage du médicament
De nombreuses questions peuvent être posées en « questions isolées ».
➥ Qu’est-ce qu’une AMM ?
➥ En quoi une AMM favorise le bon usage ? À partir de quels éléments détermine-t-on une AMM ?
➥ Bien connaître le circuit de l’AMM, les différents SMR et ASMR et leurs modalités d’attribution
➥ Pour prescrire un médicament hors AMM : connaître les risques et les obligations d’information
➥ Qu’est-ce qu’une ATU et comment est-elle mise en œuvre ?
➥ Qu’est-ce qu’une RTU et comment est-elle mise en œuvre ?
2Bases du suivi thérapeutique médicamenteux : quelle surveillance, à quel rythme ? Pour quels médicaments ?
Idéal pour un dossier transversal impliquant le suivi d’un traitement (par exemple une corticothérapie)
➥ Savoir analyser une ordonnance et identifier les prescriptions : indiquées, utiles, antagonistes, contre-indiquées, redondantes, inutiles
➥ Pour les médicaments à connaître à l’ECN, y compris les classes thérapeutiques de l’UE10 (item 326)
➥ Identifier les effets indésirables fréquents et en déduire la surveillance
➥ Connaître les médicaments inducteurs et inhibiteurs enzymatiques qui influencent le métabolisme et donc le suivi des thérapeutiques
➥ Connaître les interactions médicamenteuses fréquentes (UE 10, item 322)
3Prise en charge médicamenteuse en ville et en établissements
De nombreuses questions peuvent être posées en « questions isolées »
➥ Identifier le circuit du médicament avant dispensation
➥ Connaître les conséquences du dysfonctionnement de la prise en charge médicamenteuse : mauvaise dispensation, inobservance…
4Détecter, déclarer et prendre en compte un effet indésirable
Question la plus exploitable dans un dossier car implique la notion de transversalité et une vraie problématique de santé publique
➥ Bien posséder les notions de la question 2.
➥ Savoir identifier les terrains à risque : sujet âgé, insuffisant rénal, insuffisant hépatique, obèse, femme enceinte
➥ Connaître les données épidémiologiques des effets indésirables (incidence des effets indésirables liés aux thérapeutiques médicamenteuses et non médicamenteuses)
➥ Devant tout nouveau symptôme/maladie : savoir évoquer un effet indésirable médicamenteux
➥ Connaître les règles d’imputabilité médicamenteuse pour identifier un éventuel effet indésirable
➥ Connaître les modalités de déclaration en pharmacovigilance d’un effet indésirable
5Identifier les médicaments essentiels (liste de l’OMS)
Éventuellement exploitable en dossier très transversal, mais souvent en lien avec la question 4
➥ Identifier les médicaments à connaître pour les ECN avec leurs posologies (v. site officiel CNCI)
➥ Connaître les médicaments les plus pourvoyeurs d’effets secondaires : anti-inflammatoires non stéroïdiens, anticoagulants, psychotropes… (v. supra question 4)
2. Annuaire et liste des analyses du groupe de travail « suivi thérapeutique pharmacologique et personnalisation des traitements » de la Société française de pharmacologie et thérapeutique.
3. Mise au point sur le bon usage des aminosides administrés par voie injectable : gentamicine, tobramycine, nétilmicine, amikacine. ANSM, mars 2011. http://ansm.sante.fr ou https://bit.ly/2HKusd9
4. Michel P, Minodier C, Lathelize M, et al. Les événements indésirables graves associés aux soins observés dans les établissements de santé. Résultats des enquêtes nationales menées en 2009 et 2004. Doss Solidarité Santé 2010;17 :1-18.
5. Haute Autorité de santé. Outils de sécurisation et d’auto-évaluation de l’administration des médicaments. Guide HAS, mars 2013. https://www.has-sante.fr ou https://bit.ly/2qGuf38
6. Agence française de sécurité sanitaire des produits de santé. Guichet erreurs médicamenteuses, bilan d’activité 2009. AFFSAPS, juillet 2010. http://ansm.sante.fr ou https://bit.ly/2H9Xm59
7. Michel P, Quenon JL, Djihoud A, Bru Sonnet R. Les événements indésirables liés aux soins extrahospitaliers : fréquence et analyse approfondie des causes (étude EVISA). Bordeaux, 2008.
8. Étapes de la prise en charge médicamenteuse en ville et dans les établissements et acteurs de cette prise en charge. Stéphane Mouly. Le bon usage du médicament et des thérapeutiques non médicamenteuses, MedLine, 2016.
9. http://solidarites-sante.gouv.fr/soins-et-maladies/signalement-sante-gouv-fr/article/signaler-les-effets-indesirables-d-un-medicament
10. Miremont-Salamé G, Théophile H, Haramburu F, Bégaud B. Imputabilité en pharmacovigilance : de la méthode française originelle aux méthodes réactualisées. Thérapie 2016;71:179-86.
11. Médicaments essentiels : un concept toujours d’actualité. Rev Prescrire 2001;21:226-9.
12. http://www.who.int/medicines/fr/
Dans cet article
- Définir et évaluer le bon usage du médicament
- Suivi thérapeutique : quelle surveillance, quel rythme, pour quels médicaments ?
- Prise en charge médicamenteuse en ville et en établissement
- Détecter, déclarer et prendre en compte un effet indésirable [J. Benevent, J.-L. Montastruc]
- Identifier les médicaments essentiels [D. Orlikowski]
- Conclusion
- 1Bon usage du médicament
- 2Bases du suivi thérapeutique médicamenteux : quelle surveillance, à quel rythme ? Pour quels médicaments ?
- 3Prise en charge médicamenteuse en ville et en établissements
- 4Détecter, déclarer et prendre en compte un effet indésirable
- 5Identifier les médicaments essentiels (liste de l’OMS)

 Encadrés
Encadrés