La maladie cancéreuse est une des premières causes de décès dans le monde. Néanmoins, des progrès considérables ont été réalisés dans tous les domaines de sa prise en charge, que ce soit dans celui de la détection précoce, des techniques chirurgicales, de la radiothérapie ou de l’utilisation de nouvelles molécules pharmacologiques (thérapies ciblées, immunothérapies…). De nouvelles stratégies de combinaison de ces thérapeutiques ont amélioré le pronostic et les taux de survie. La survie à 5 ans de la plupart des cancers a fortement augmenté entre 1989 et 2010. Ainsi, par exemple, l’amélioration a été respectivement de 22 % pour les cancers de la prostate, de 9 % pour le cancer colorectal et de 7 % pour le cancer du sein avec des survies à 5 ans respectivement de 94 % pour les cancers de la prostate, de 63 % pour le cancer colorectal et de 97 % pour le cancer du sein.1 De ce fait, le cancer ne doit plus être considéré comme une maladie ayant une évolution binaire entre une issue fatale et la guérison, mais comme une maladie chronique avec une importance croissante de paramètres comme la qualité de vie, les capacités fonctionnelles et la tolérance des traitements.
L’efficacité et la tolérance des trai- tements anticancéreux vont être influencées par le statut nutritionnel qui dépend à son tour du cancer ainsi que des traitements entrepris. Il est donc logique de mettre en place une stratégie pour prévenir et diminuer la dénutrition, voire pour améliorer le statut nutritionnel.
Différentes thématiques nutritionnelles ont bénéficié de réels progrès : compréhension plus approfondie des mécanismes, prise de conscience que la dénutrition ou la cachexie cancéreuse est un continuum de différents stades, intérêt de l’analyse de la masse musculaire (skeletal muscle mass), importance d’une prise en charge multimodale avec une place particulière pour l’activité physique adaptée, meilleure définition des indications et des modalités de la nutrition artificielle.
Classiquement, la cachexie cancéreuse est décrite comme la résultante de deux mécanismes associés à des degrés variables : diminution des apports et anomalies des métabolismes glucidique, protéique, voire lipidique.2 Si depuis de nombreuses années le rôle du type et du stade évolutif de la tumeur a été bien décrit comme associé à la cachexie, de nouvelles études mettent en avant le rôle du sexe (la perte protéique n’est pas la même en fonction du sexe), de facteurs génétiques, du statut nutritionnel initial et des traitements antitumoraux.3
Cachexie cancéreuse : un continuum de différents stades
Il y a quelques années, la définition de la cachexie cancéreuse n’était pas précise, avec des paramètres qui étaient qualitatifs, voire sans utilisation des critères nutritionnels usuels (anémie, qualité de vie, œdème…). En 2011, une réunion d’experts internationaux a posé les bases de la définition de la cachexie cancéreuse en utilisant des paramètres cliniques (perte de poids et indice de masse corporelle [IMC]) et en incluant l’évaluation de la masse musculaire.4 Cette définition présente l’avantage de bien déterminer les valeurs seuils et de définir la cachexie cancéreuse comme un continuum de situations pathologiques nutritionnelles allant du stade de pré-cachexie à la cachexie et à celui de cachexie réfractaire. Le stade de cachexie réfractaire correspond à la situation où la dénutrition n’est plus réversible, même partiellement, en raison de l’évolutivité tumorale. Dans cette situation, le décès survient souvent rapidement, et la prise en charge nutritionnelle est inefficace. La question qui se pose, mais avec beaucoup de réserves et quelques rares arguments dans la littérature, est celle de l’intérêt d’une prise en charge nutritionnelle proposée au stade de pré-cachexie, avant que les anomalies métaboliques ne soient importantes et avant la perte de poids
La cachexie cancéreuse est un continuum de différents stades avec les notions de pré-cachexie et de cachexie réfractaire (v. figure 1).
Il y a quelques années, la définition de la cachexie cancéreuse n’était pas précise, avec des paramètres qui étaient qualitatifs, voire sans utilisation des critères nutritionnels usuels (anémie, qualité de vie, œdème…). En 2011, une réunion d’experts internationaux a posé les bases de la définition de la cachexie cancéreuse en utilisant des paramètres cliniques (perte de poids et indice de masse corporelle [IMC]) et en incluant l’évaluation de la masse musculaire.4 Cette définition présente l’avantage de bien déterminer les valeurs seuils et de définir la cachexie cancéreuse comme un continuum de situations pathologiques nutritionnelles allant du stade de pré-cachexie à la cachexie et à celui de cachexie réfractaire. Le stade de cachexie réfractaire correspond à la situation où la dénutrition n’est plus réversible, même partiellement, en raison de l’évolutivité tumorale. Dans cette situation, le décès survient souvent rapidement, et la prise en charge nutritionnelle est inefficace. La question qui se pose, mais avec beaucoup de réserves et quelques rares arguments dans la littérature, est celle de l’intérêt d’une prise en charge nutritionnelle proposée au stade de pré-cachexie, avant que les anomalies métaboliques ne soient importantes et avant la perte de poids
Détection et évaluation de la dénutrition
Favoriser l’anabolisme
Augmenter les apports énergétiques et protéiques
Jeûne
La théorie que les nutriments et en particulier que le sucre « nourrissent la tumeur » n’a aucun support clinique et ne doit pas être un argument pour refuser, diminuer ou arrêter le support nutritionnel. Une courte période de jeûne avant les chimiothérapies a été proposée pour en diminuer les toxicités et en augmenter l’efficacité. Quelques études cliniques sont en cours, mais aucune à ce jour n’a étayé cette théorie. Devant le risque d’aggraver les problèmes liés à la dénutrition, il n’est pas actuellement recommandé de proposer cette conduite à tenir. Dans le même ordre d’idée, aucun régime « à la mode » n’a montré son efficacité. Le risque dans ces régimes souvent restrictifs est d’augmenter la dénutrition.Apports supplémentaires en vitamines et oligo-éléments
À l’exclusion des apports nécessaires lors d’une nutrition parentérale, il n’est pas recommandé, voire il est déconseillé, d’avoir des apports supplémentaires d’une association de vitamines ou d’une vitamine parti- culière au cours du traitement du cancer. En effet, différentes études et méta-analyses ont montré une absence d’efficacité voire une augmentation de mortalité en cas d’apports vitaminiques élevés en dehors d’un déficit spécifique bien individualisé.Prise en charge nutritionnelle
Les différentes sociétés savantes recommandent une prise en charge nutritionnelle pour augmenter les ingesta chez les patients qui sont à risque de dénutrition ou dénutris avérés et ayant conservé la possibilité de s’alimenter.7, 8 Cette prise en charge doit être faite par un personnel qualifié (diététicien et/ou médecin nutritionniste) et comporter des conseils pour adapter les apports alimentaires associés plus ou moins à la prescription de compléments nutritionnels oraux. Néanmoins, les preuves scientifiques de l’intérêt d’une prise en charge nutritionnelle manquent. Une revue récente n’a pas montré de différence en termes de survie mais a montré une amélioration de la qualité de vie plus spécialement chez les patients traités par radiothérapie. Les résultats étaient moins probants chez les patients ayant une anorexie et traités par chimiothérapie.Nutrition artificielle
Qu’elle soit entérale ou parentérale, la nutrition artificielle est recommandée si le patient ne peut pas s’alimenter pendant plus d’une semaine ou si les apports sont inférieurs à 60 % des besoins estimés pendant plus de deux semaines. La règle est de privilégier la nutrition entérale quand le tube digestif est fonctionnel. Cette règle est d’autant plus justifiée que la tumeur ou les traitements diminuent la prise des aliments au niveau de la partie haute du tube digestif (cancers de la tête et du cou et cancers œsogastriques). La nutrition parentérale quant à elle est à privilégier en cas d’occlusion digestive, de carcinose péritonéale, de syndrome du grêle court… Au stade de prise en charge palliative exclusive (survie inférieure à 2 mois), le support nutritionnel n’est pas recommandé mais il est important de tenir compte de la valeur symbolique de la nutrition dans certaines cultures. La prise en charge nutritionnelle est à adapter en fonction de certaines situations bien particulières (tableau 2).Modulation des anomalies du métabolisme
Trop longtemps, la prise en charge s’est focalisée sur la compensation de la diminution des ingesta. Il est admis aujourd’hui que pour espérer diminuer le catabolisme ou augmenter l’anabolisme musculaire, il faut agir non seulement sur les apports mais aussi moduler les anomalies du métabolisme. Pour améliorer la qualité de vie des années gagnées sur la maladie, il faut avoir une vision plus globale, avec une prise en charge multimodale de tous les symptômes.Différentes pistes ont été explorées et/ou sont en cours d’études pour moduler les anomalies du métabolisme :
– il paraît logique de vouloir traiter les conséquences métaboliques de l’inflammation en instaurant un traitement anti-inflammatoire. Néanmoins, peu de données clini- ques sont disponibles pour pouvoir recommander la prescription d’anti- inflammatoires non stéroïdiens en routine ;
– la corticothérapie augmente l’appétit des patients à un stade avancé de la maladie pour une courte période de 1 à 3 semaines, mais il est important de mettre en balance ce bénéfice tout relatif avec les effets indésirables que sont l’augmentation de la protéolyse musculaire, l’incidence plus élevée des infections ainsi que le développement d’une insulinorésistance ;
– beaucoup d’espoirs ont été mis sur les acides gras oméga 3, avec des résultats très intéressants essentiellement dans les études expérimentales, mais les études cliniques n’ont pas été très concluantes ;
– malgré un nombre important d’études sur les dérivés du cannabis pour évaluer l’impact de ces produits sur l’anorexie et les troubles du goût associés au cancer, les résultats sont insuffisants pour permettre de recommander leur utilisation ;
– beaucoup de molécules issues de la recherche pharmacologique ont été évaluées : progestatifs, androgènes, thalidomide, ghréline, mélatonine… Deux sont arrivées au stade de la recherche clinique et malgré d’intéressants résultats au cours des phases III leur développement a été arrêté : analogues de la ghréline, molécules ayant une action sur les récepteurs musculaires spécifiques aux androgènes.
Activité physique adaptée
L’anabolisme des protéines mus- culaires utilise des voies de signalisation intracellulaires qui peuvent être inhibées par le processus tumoral ou par certaines thérapies anticancéreuses. L’intérêt de l’activité physique est qu’elle peut favoriser l’anabolisme des protéines mus- culaires en utilisant des voies de signalisation alternes non impactées par la tumeur ou les traitements. Différentes études ont déjà montré qu’une activité physique adaptée est non seulement non délétère mais également possible au cours du cancer. La recherche clinique actuelle porte sur la nature et la durée de cette activité physique. Il n’est pas clai- rement établi s’il faut privilégier la pratique d’exercices en haute intensité contre résistance ou favoriser l’activité aérobie. Dans tous les cas, il faut insister pour privilégier un mode de vie le moins sédentaire possible et pour diminuer les périodes d’inactivité. Pour certains patients, l’activité physique adaptée peut prendre la forme d’une marche quotidienne avec pour objectif de diminuer l’atrophie musculaire
INTERVENIR PRÉCOCEMENT
La définition plus précise des différents stades de cachexie devrait permettre de déterminer le moment le plus approprié pour initier le support nutritionnel. Il est peut-être intéressant de le mettre en place très tôt au stade de pré-cachexie avant que les mécanismes responsables de la cachexie ne s’accélèrent et ne deviennent irréversibles (stade de cachexie réfractaire).
L’augmentation des apports est l’objectif de la prise en charge nutritionnelle avec les conseils diététiques, la prescription de compléments nutritionnels oraux, et la nutrition artificielle. La nutrition entérale doit être la règle quand le tube digestif fonctionne. L’évaluation de l’efficacité de la nutrition entérale et de sa tolérance dans les cancers où l’anorexie est le facteur physiopathologique pré- dominant est encore à faire.
La prise en charge nutritionnelle doit être intégrée dans une approche multimodale qui met l’accent sur la pratique d’une activité physique adaptée.
La mesure de la perte de poids reste le paramètre le plus pertinent et le plus facile à mesurer, mais le concept de la dénutrition au cours du cancer est en train d’évoluer avec une place prépondérante pour l’évaluation de la déplétion musculaire (sarcopénie). Les défis du futur sont de déterminer et d’intervenir sur les paramètres qui participent à la résistance à l’anabolisme musculaire et de prouver non seulement que l’augmen- tation de la masse musculaire est possible mais aussi qu’elle permet d’améliorer le pronostic et la qualité de vie.
La définition plus précise des différents stades de cachexie devrait permettre de déterminer le moment le plus approprié pour initier le support nutritionnel. Il est peut-être intéressant de le mettre en place très tôt au stade de pré-cachexie avant que les mécanismes responsables de la cachexie ne s’accélèrent et ne deviennent irréversibles (stade de cachexie réfractaire).
L’augmentation des apports est l’objectif de la prise en charge nutritionnelle avec les conseils diététiques, la prescription de compléments nutritionnels oraux, et la nutrition artificielle. La nutrition entérale doit être la règle quand le tube digestif fonctionne. L’évaluation de l’efficacité de la nutrition entérale et de sa tolérance dans les cancers où l’anorexie est le facteur physiopathologique pré- dominant est encore à faire.
La prise en charge nutritionnelle doit être intégrée dans une approche multimodale qui met l’accent sur la pratique d’une activité physique adaptée.
Tableau 1. FAACT-A/CS : functional assesment of anorexia cachexia therapy-anorexia/cachexia subscale : échelle de détection de l’anorexie, le seuil est validé dans une seule étude. IMC : indice de masse corporelle.
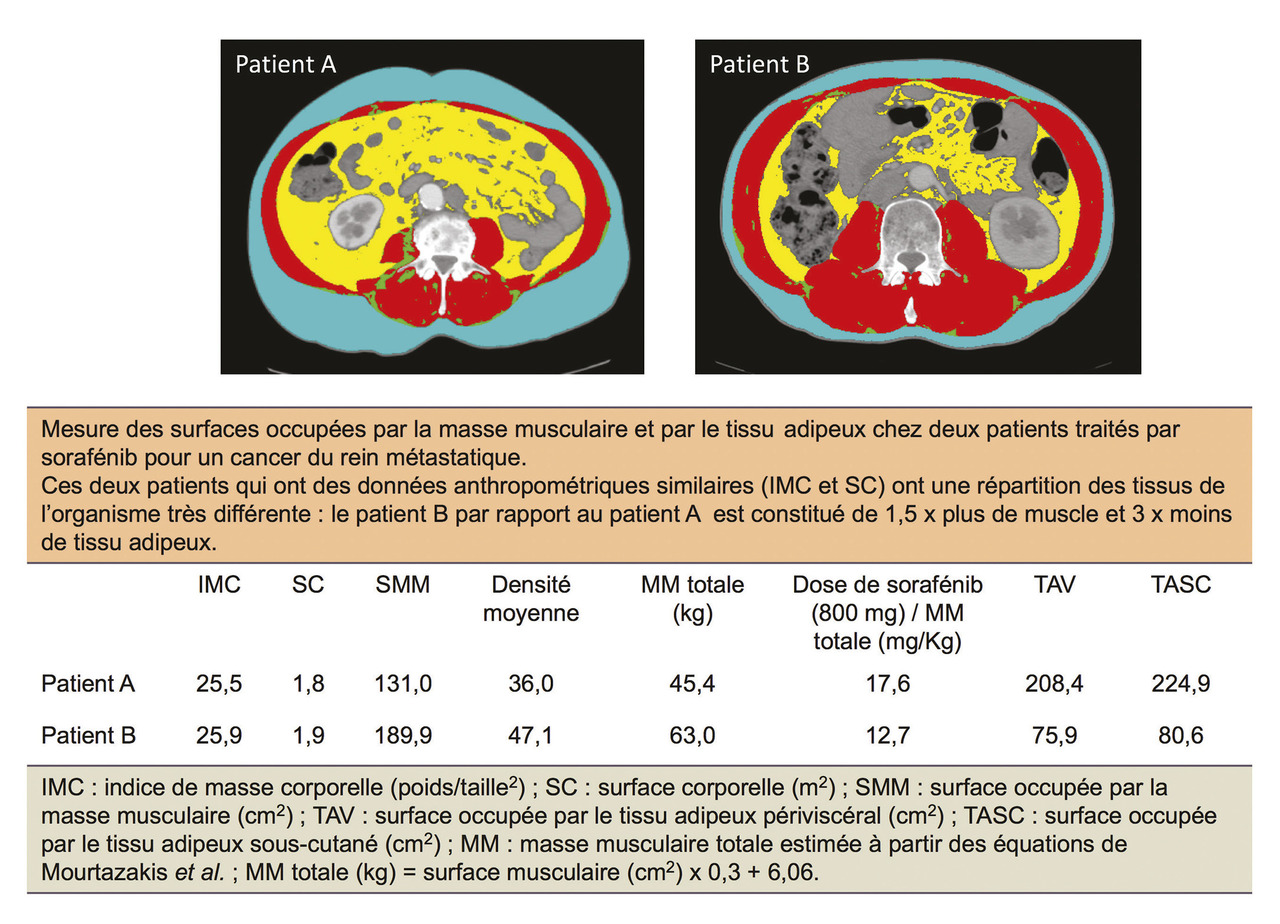
Le poids et la perte de poids ne constituent plus les pierres angulaires de la réflexion sur la nutrition en oncologie depuis que les travaux de l’équipe d’Edmonton ont montré un lien entre la déplétion de masse musculaire ou sarcopénie et le pronostic, et entre la sarcopénie et la toxicité des chimiothérapies.1 Désormais, ce qui compte ce n’est plus le gain ou la perte de poids mais les changements qui vont concerner la masse musculaire. L’utilisation de logiciels informatiques a permis l’analyse de la composition corporelle à partir d’images de tomodensitométrie. Ces techniques ont permis de montrer que deux patients ayant des paramètres anthropométriques (poids, indice de masse corporelle [IMC]) similaires peuvent avoir une grande variabilité dans la répartition des deux principaux tissus de l’organisme que sont la masse musculaire et le tissu adipeux (v. figure 2). Ayant des masses musculaires différentes (réservoirs d’acides aminés qui entrent dans la synthèse des défenses de l’organisme), ces patients ont des pronostics différents. Par ailleurs, ils vont recevoir des posologies de chimiothérapie différentes quand celles-ci sont rapportées à la masse musculaire et peuvent donc présenter une fréquence de toxicité plus importante.
Obèse sarcopénique
Sarcopénie et pronostic
Densité musculaire et pronostic
Force musculaire et pronostic
Sarcopénie et toxicité des chimiothérapies
Sarcopénie et complications postopératoires
La question qui se pose alors concerne la généralisation de la mesure de la masse musculaire dans l’évaluation nutritionnelle en cancérologie. Il est difficile à l’heure actuelle d’en faire un élément du bilan standard. En effet, avec les données disponibles, il est difficile de définir le paramètre musculaire le plus pertinent à utiliser : masse, densité, fonction, « frailty ». Par ailleurs, les valeurs seuils définissant la sarcopénie sont à valider ; ces valeurs dépendent de nombreux paramètres dont bien évidemment le sexe mais aussi l’origine ethnique du patient. Des études sont encore nécessaires, surtout pour montrer le lien entre la toxicité de la chimiothérapie et la sarcopénie et surtout pour montrer que l’adaptation de la posologie à la masse musculaire est susceptible de diminuer la toxicité.
Tableau 2. ERAS : enhanced recovery after surgery.
Le poids et la perte de poids ne constituent plus les pierres angulaires de la réflexion sur la nutrition en oncologie depuis que les travaux de l’équipe d’Edmonton ont montré un lien entre la déplétion de masse musculaire ou sarcopénie et le pronostic, et entre la sarcopénie et la toxicité des chimiothérapies.1 Désormais, ce qui compte ce n’est plus le gain ou la perte de poids mais les changements qui vont concerner la masse musculaire. L’utilisation de logiciels informatiques a permis l’analyse de la composition corporelle à partir d’images de tomodensitométrie. Ces techniques ont permis de montrer que deux patients ayant des paramètres anthropométriques (poids, indice de masse corporelle [IMC]) similaires peuvent avoir une grande variabilité dans la répartition des deux principaux tissus de l’organisme que sont la masse musculaire et le tissu adipeux (v. figure 2). Ayant des masses musculaires différentes (réservoirs d’acides aminés qui entrent dans la synthèse des défenses de l’organisme), ces patients ont des pronostics différents. Par ailleurs, ils vont recevoir des posologies de chimiothérapie différentes quand celles-ci sont rapportées à la masse musculaire et peuvent donc présenter une fréquence de toxicité plus importante.
Obèse sarcopénique
L’analyse de la composition corporelle a permis de prendre en compte la sarcopénie chez des patients à poids normal voire en surcharge pondérale ou obèses. En cancérologie, la fréquence de la sarcopénie chez les patients qui ont un IMC ≥ 25 kg/m2 est non négligeable. Elle varie de 29 % pour les cancers du rein à 59 % dans certaines études sur le cancer du pancréas. Ces patients semblent, d’après les données pondérales, non dénutris, mais le sont en réalité si l’on considère la perte de masse musculaire. Ils cumulent les risques associés à l’obésité et ceux associés à la sarcopénie.
Sarcopénie et pronostic
Une équipe a montré pour la première fois en 2008 un lien étroit entre la sarcopénie et un pronostic défavorable ;2 il s’agissait de cancers pulmonaires (27 %), de cancers du côlon et du rectum (54 %) et de divers autres cancers (19 %). De nombreuses autres études ont confirmé ultérieurement cette relation.
Densité musculaire et pronostic
La notion de densité musculaire est une notion qui s’est développée avec l’analyse des images de tomodensitométrie ; elle donne une idée de la qualité du muscle, plus la densité est faible, plus le muscle est riche en lipides et moins bonne est la qualité du muscle (diminution de la survie). La diminution de la densité musculaire est très probablement liée au dépôt intramusculaire d’acides gras secondaires à la lipolyse induite par la tumeur (probable rôle de l’inflammation) et à l’absence d’utilisation de ces acides gras pour la production énergétique. En cancérologie, une diminution de la densité musculaire a été associée à une diminution de la survie.
Force musculaire et pronostic
Plusieurs études, essentiellement dans le cancer non à petites cellules du poumon, ont montré que la fonction musculaire (testée par la force [dynamomètre], par un exercice aérobie, ou par des tests de mobilité [comme ceux utilisés en gériatrie]) est un facteur prédictif de survie.
Sarcopénie et toxicité des chimiothérapies
De nombreuses études ont montré que la sarcopénie augmente la toxicité des chimiothérapies. Les mécanismes sous-jacents restent toutefois débattus. L’hypothèse pharmacocinétique suggère que la perte de masse musculaire peut être associée à une diminution du volume de distribution de la molécule, et donc à un surdosage et probablement à une toxicité accrue. Cette relation entre sarcopénie et toxicité des traitements anticancéreux mérite néanmoins d’être confirmée avant de pouvoir proposer l’adaptation des posologies à la mesure de la masse musculaire.
Sarcopénie et complications postopératoires
Il est difficile de faire une synthèse des résultats des différentes études. L’évaluation de la masse musculaire ne semble pas pertinente étudiée isolément ; en revanche, la prise en compte de la masse dans le concept de « frailty » qui englobe des notions de fonction musculaire et parfois de notions cognitives semble être associée à un nombre élevé de complications postopératoires. La question qui se pose alors concerne la généralisation de la mesure de la masse musculaire dans l’évaluation nutritionnelle en cancérologie. Il est difficile à l’heure actuelle d’en faire un élément du bilan standard. En effet, avec les données disponibles, il est difficile de définir le paramètre musculaire le plus pertinent à utiliser : masse, densité, fonction, « frailty ». Par ailleurs, les valeurs seuils définissant la sarcopénie sont à valider ; ces valeurs dépendent de nombreux paramètres dont bien évidemment le sexe mais aussi l’origine ethnique du patient. Des études sont encore nécessaires, surtout pour montrer le lien entre la toxicité de la chimiothérapie et la sarcopénie et surtout pour montrer que l’adaptation de la posologie à la masse musculaire est susceptible de diminuer la toxicité.
2. Prado CM, Lieffers JR, McCargar LJ, et al. Prevalence and clinical implications of sarcopenic obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study. Lancet Oncol 2008;9:629-35.
2. Raynard B, Chaubet M. Conséquences nutritionnelles et métaboliques au cours des cancers. Oncologie 2009;11:200-3.
3. Fearon KC. The 2011 ESPEN Arvid Wretlind lecture: cancer cachexia: the potential impact of translational research on patient-focused outcomes. Clin Nutr 2012;31:577-82.
4. Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011;12:489-95.
5. Khan S, Alibay TA, Merad M, DiPalma M, Raynard B, Antoun S. Détection et évaluation de la dénutrition en oncologie : quels sont les outils, pour quel type de cancer et dans quels buts ? Bull Cancer 2016;103:776-85.
6. Senesse P, Hébuterne X, le groupe de travail. SFNEP oncology nutrition guidelines: Nutritional, energetic and protein needs throughout the cancer treatment process. Nutr Clin Metab 2012;26:189-96.
7. Arends J, Bachmann P, Baracos V, et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr 2017;36:11-48.
Dans cet article
- Cachexie cancéreuse : un continuum de différents stades
- Détection et évaluation de la dénutrition
- Favoriser l’anabolisme
- INTERVENIR PRÉCOCEMENT
- Obèse sarcopénique
- Sarcopénie et pronostic
- Densité musculaire et pronostic
- Force musculaire et pronostic
- Sarcopénie et toxicité des chimiothérapies
- Sarcopénie et complications postopératoires

 Encadrés
Encadrés