La maladie de Parkinson est une des plus fréquentes affections neurodégénératives et représente la deuxième cause de handicap moteur du sujet âgé. Le traitement est rendu complexe par la grande variété des signes de la maladie à la fois moteurs et non moteurs. Le traitement, qui reste symptomatique, doit prendre en compte ces manifestations hétérogènes mais aussi les risques d’effets secondaires et enfin doit s’adapter à l’évolution de la maladie.
Traitements disponibles
Traitements médicamenteux
Lévodopa
La Lévodopa (L-Dopa) reste, depuis les années 1970, le plus prescrit et le plus efficace des traitements antiparkinsoniens.1 Les études randomisées montrent une amélioration des signes moteurs et de la qualité de vie de l’ordre de 40 à 50 % sous L-dopa contre 30 % sous agonistes dopaminergiques.1, 2 La durée d’action de chaque prise de L-dopa dépend du stade de la maladie et a tendance à diminuer avec la durée d’évolution de la maladie, imposant de fractionner les prises (plus de 4 heures en début de maladie puis 3 heures ou moins au stade des fluctuations motrices).3 Une grande étude multicentrique a évalué trois différentes doses de L-dopa et a confirmé le bénéfice majeur observé sous L-dopa et son caractère dépendant de la dose.1 Cette étude a aussi montré que l’effet maximal de la L-dopa était noté après 24 semaines et que la survenue de dyskinésies était dépendante de la dose. Cela souligne le fait qu’il faut se donner du recul avant d’apprécier le bénéfice du traitement et de conclure à une éventuelle dopa-résistance et qu’il faut éviter les trop fortes doses (mieux vaut fractionner de plus faibles doses que de donner des fortes doses espacées). Les effets indésirables de la L-dopa sont principalement des nausées et une hypotension orthostatique, mais le médicament est en général bien toléré.4 Malgré une controverse ancienne, la L-dopa n’est pas toxique.5 Les dyskinésies, si elles sont induites par la L-dopa, sont liées intrinsèquement à l’évolution de la dégénérescence des neurones dopaminergiques et à d’autres mécanismes.6À côté de la L-dopa orale, une autre forme d’administration est maintenant proposée, la L-dopa en gel, administrée via une jéjunostomie.7 Cette administration permet, par rapport aux prises orales classiques, d’améliorer significativement l’état moteur des patients fluctuants.7 Il existe toutefois des effets indésirables liés directement à la voie d’administration (douleur, problème de matériels, infection locale) ou en rapport avec un risque de polyneuropathie périphérique.Agonistes dopaminergiques
Les agonistes dopaminergiques agissent directement sur les récepteurs dopaminergiques et sont classés en deux catégories : dérivés de l’ergot de seigle (bromocriptine, pergolide, lisuride et cabergoline) et non dérivés de l’ergot de seigle (pramipexole, ropinirole, piribédil et rotigotine). Leur demi-vie est plus longue que celle de la L-dopa et la plupart existent sous forme de médicaments à libération prolongée permettant une prise unique par jour. Leur administration se fait par voie orale ou percutanée. L’efficacité des agonistes dopaminergiques est bien établie et similaire quelle que soit la molécule utilisée et qu’il s’agisse de formes à libération prolongée ou à libération immédiate.8 Comparés à la L-dopa, les agonistes dopaminergiques sont moins efficaces mais génèrent moins de dyskinésies, ce qui contribue à privilégier leur usage en début de maladie chez les patients jeunes.9 Toutefois, des études montrent que le risque de dyskinésies sous L-dopa à long terme a peut-être été surestimé.10Les agonistes dopaminergiques sont également efficaces sur certains troubles neuropsychiques tels que l’apathie ou la dépression.11Il est bien établi que les agonistes dopaminergiques ont plus d’effets indésirables que la L-dopa. Il s’agit notamment d’un risque d’œdème des membres inférieurs, de somnolence, voire d’une attaque de sommeil, d’hallucinations et de nausées.12 Les agonistes dopaminergiques ergotés entraînent un risque de fibrose pulmonaire ou rétropéritonéale et un risque de valvulopathies, ce qui a conduit à leur retrait du marché, sauf pour la bromocriptine.12 Mais l’effet indésirable le plus problématique est l’apparition, chez jusqu’à 25 % des patients, de comportements addictifs ou de troubles du contrôle des impulsions à type de jeu pathologique, achats compulsifs, hypersexualité, boulimie, punding (activités répétitives sans but) ou une consommation compulsive de L-dopa.13À côté des formes orales d’agonistes dopaminergiques, l’apomorphine est un agoniste d’action rapide, administré soit par injections sous-cutanées discontinues, permettant de réduire les phénomènes « off » (v. infra) très rapidement, soit par pompe sous-cutanée injectant en continu, permettant de réduire nettement les fluctuations motrices et les dyskinésies, les périodes « off » et le traitement dopaminergique.14 Les principaux problèmes de l’apomorphine sont le risque de nausées, d’hypotension, de troubles neuropsychiques et, pour les pompes, la présence de nodules cutanés. Quels que soient les traitements dopaminergiques utilisés, les nausées sont un effet indésirable fréquent. Pour les réduire, la règle est de proposer une titration lente et, si nécessaire au début, de prescrire de la dompéridone, en notant qu’en raison du risque accru de troubles du rythme cardiaque lié à ce médicament il faut respecter strictement ses indications et prendre en compte ce risque (dont l’allongement de l’espace QT), en particulier chez les patients qui ont des facteurs de risque cardiovasculaires, et limiter la prescription à la durée de traitement la plus courte (habituellement 7 jours maximum) et à la dose la plus faible possible (maximum 30 mg/j).Inhibiteur de la monoamine oxydase B
La sélégiline n’est pratiquement plus prescrite, et seule la rasagiline garde une place significative. Ce traitement peut être utilisé en monothérapie en début de maladie ou en association avec d’autres traitements. L’efficacité même modeste de la rasagiline a été démontrée, en monothérapie et en association.15 L’étude ADAGIO avait suggéré que la rasagiline à 1 mg/j ralentirait l’évolution de la maladie, ce qui n’a pas été confirmé par le suivi à long terme.15, 16 La tolérance est en règle générale excellente. Initialement, les inhibiteurs de la recapture de la sérotonine étaient contre-indiqués en raison d’un risque de syndrome sérotoninergique, mais de larges études récentes ont démontré qu’en dehors de la fluoxétine il n’y a pas de risque à cette association.17Inhibiteurs de la cathécol-O-méthyltransférase
La cathécol-O-méthyltransférase est une des enzymes de dégradation de la dopamine. Ses inhibiteurs permettent de réduire sa dégradation principalement au niveau digestif et donc de potentialiser l’action de la L-dopa. Il existe deux molécules commercialisées, l’entacapone et la tolcapone. L’entacapone doit être prise avec chaque prise de L-dopa soit de manière séparée, soit dans la même forme galénique (association fixe), tandis que la tolcapone est prise indépendamment. Toutefois, pour prescrire un inhibiteur de la cathécol-O-méthyltransférase, il faut systématiquement que les patients reçoivent de la L-dopa. À ce jour, il n’y a pas de bénéfice, notamment en termes de réduction des dyskinésies, à utiliser la L-dopa seule comparée à l’association L-dopa et inhibiteurs de la cathécol-O-méthyltransférase en début de maladie.18 Actuellement, la tolcapone est peu utilisée en raison de son hépatotoxicité. En termes d’efficacité, les inhibiteurs de la cathécol-O-méthyltransférase permettent un bénéfice moteur de l’ordre de 10 à 30 % et une réduction significative de la dose journalière de L-dopa.19 Les effets indésirables sont les nausées, la diarrhée, l’hypotension orthostatique et la coloration en orange des urines.Anticholinergiques
En dehors des formes tremblantes sévères du sujet jeune, ces traitements ont peu de place dans la maladie de Parkinson. Une méta-analyse de 2003 a montré l’efficacité des anticholinergiques sur les signes moteurs de la maladie sans toutefois conclure formellement sur leur efficacité antitrémorique.20 Les effets indésirables notamment cognitifs, psychiques (confusion, hallucinations, délire), les troubles de l’accommodation, la sécheresse de bouche ou la rétention urinaires,20 sont le problème majeur de ces médicaments, ce qui limite considérablement leur usage, en particulier chez le sujet âgé.Amantadine
L’amantadine, prescrit initialement comme antiviral, agit principalement sur les dyskinésies via un mécanisme glutamatergique.21 C’est le seul antiparkinsonien antidyskinétique.21 Ses effets indésirables sont le livedo reticularis, la confusion, l’insomnie (qui fait que l’on déconseille son usage le soir), la sécheresse de bouche et des troubles visuels.Traitements chirurgicaux
La stimulation cérébrale profonde du noyau sous- thalamique a été développée depuis les années 1990 et est aujourd’hui le traitement de référence pour les patients parkinsoniens fluctuants difficiles à équilibrer sous traitements antiparkinsoniens administrés par voie orale ou par pompe. Les bénéfices moteurs sont majeurs, avec en moyenne une amélioration de 60 % des signes parkinsoniens (comparable au bénéfice obtenu avec la L-dopa), une quasi-disparition des dyskinésies et une réduction de 60 % des traitements dopaminergiques.22 Les principaux critères d’opérabilité sont : un âge inférieur à 70 ans, un bon état cognitif (absence de troubles cognitifs), une imagerie par résonance magnétique (IRM) cérébrale normale et une bonne réponse à la dopamine. Cette technique est maintenant proposée à un stade plus précoce de la maladie.23 Elle ne permet pas, en revanche, de différer l’apparition des signes axiaux dopa-résistants et donc la progression de la maladie.22 Enfin, au plan neuropsychique, malgré les controverses, la stimulation du noyau sous-thalamique permet en général d’améliorer les troubles du contrôle des impulsions mais augmente le risque d’apathie postopératoire si le traitement médicamenteux n’est pas correctement géré après la chirurgie.24 Chez les sujets plus fragiles au plan cognitif, très gênés par les dyskinésies et ayant quelques troubles axiaux, la cible pallidale interne peut être discutée. De même, chez les patients sortant des critères d’opérabilité du noyau sous-thalamique et ayant une forme tremblante de maladie de Parkinson, la cible thalamique peut être envisagée.25 Le risque de ces procédures stéréotaxiques est d’environ 5 % d’infection du matériel, et moins de 1 % de risque d’hémorragie cérébrale.
Stratégies thérapeutiques
Stratégie en début de maladie
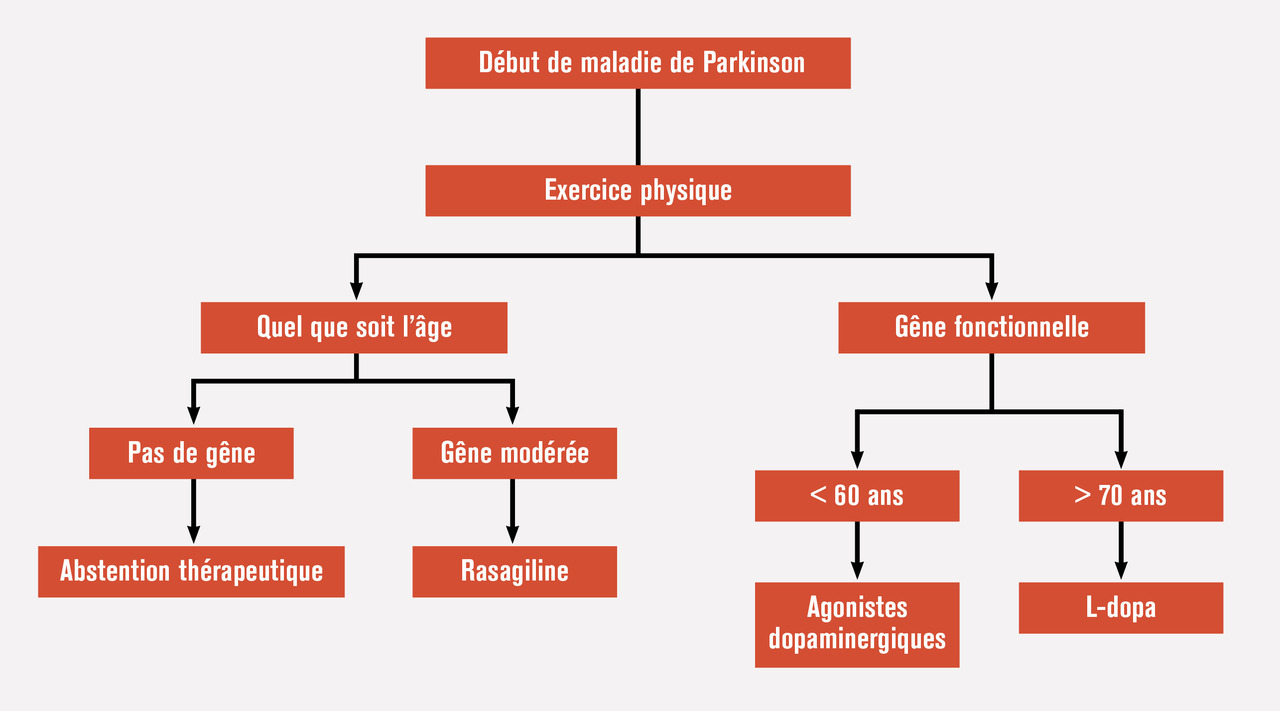
La mise en place d’un traitement antiparkinsonien se décide dès lors que le patient est gêné. Le choix du traitement initial repose sur plusieurs critères et doit être expliqué et discuté avec lui notamment en raison de la possibilité de certains effets indésirables (troubles du contrôle des impulsions notamment). Lorsque la gêne est modérée, la rasagiline en monothérapie peut être proposée, car elle est bien tolérée, facile d’usage, mais il faut garder à l’esprit un bénéfice modeste. Ainsi, lorsque le handicap du patient augmente, il est nécessaire de recourir à un traitement dopaminergique plus puissant : L-dopa ou agonistes dopaminergiques.Chez les patients jeunes (définis comme ayant moins de 60 ans, ce qui est arbitraire surtout si l’on prend en compte la sévérité du tableau moteur), il est conseillé de retarder la mise sous L-dopa et de privilégier les agonistes dopaminergiques afin de retarder l’apparition des dyskinésies. Cette stratégie nécessite néanmoins de bien surveiller l’éventuelle apparition de troubles du contrôle des impulsions à chaque visite, au vu des conséquences parfois désastreuses de ces manifestations. Ce risque est plus grand chez les hommes jeunes, célibataires et aux antécédents dépressifs et addictifs.13 La L-dopa sera ajoutée lorsque le handicap fonctionnel ne sera plus suffisamment contrôlé par l’agoniste.Chez les patients plus âgés (plus de 70 ans), la L-dopa est considérée comme le traitement de choix en raison d’un meilleur rapport efficacité-risque que sous agonistes dopaminergiques, en particulier chez les sujets plus fragiles sur le plan plan cognitif avec un risque de confusion ou d’hallucination plus élevé. Sous L-dopa, la posologie doit être maintenue au niveau minimum efficace pour limiter la survenue des dyskinésies.Chez les jeunes parkinsoniens ayant un tremblement important, les anticholinergiques peuvent être proposés. L’amantadine ou les inhibiteurs de la cathécol-O-méthyltransférase n’ont pas leur place à ce stade de la prise en charge. La figure 1 résume les choix thérapeutiques possibles en début de maladie.
Stratégie au stade des fluctuations et des complications motrices
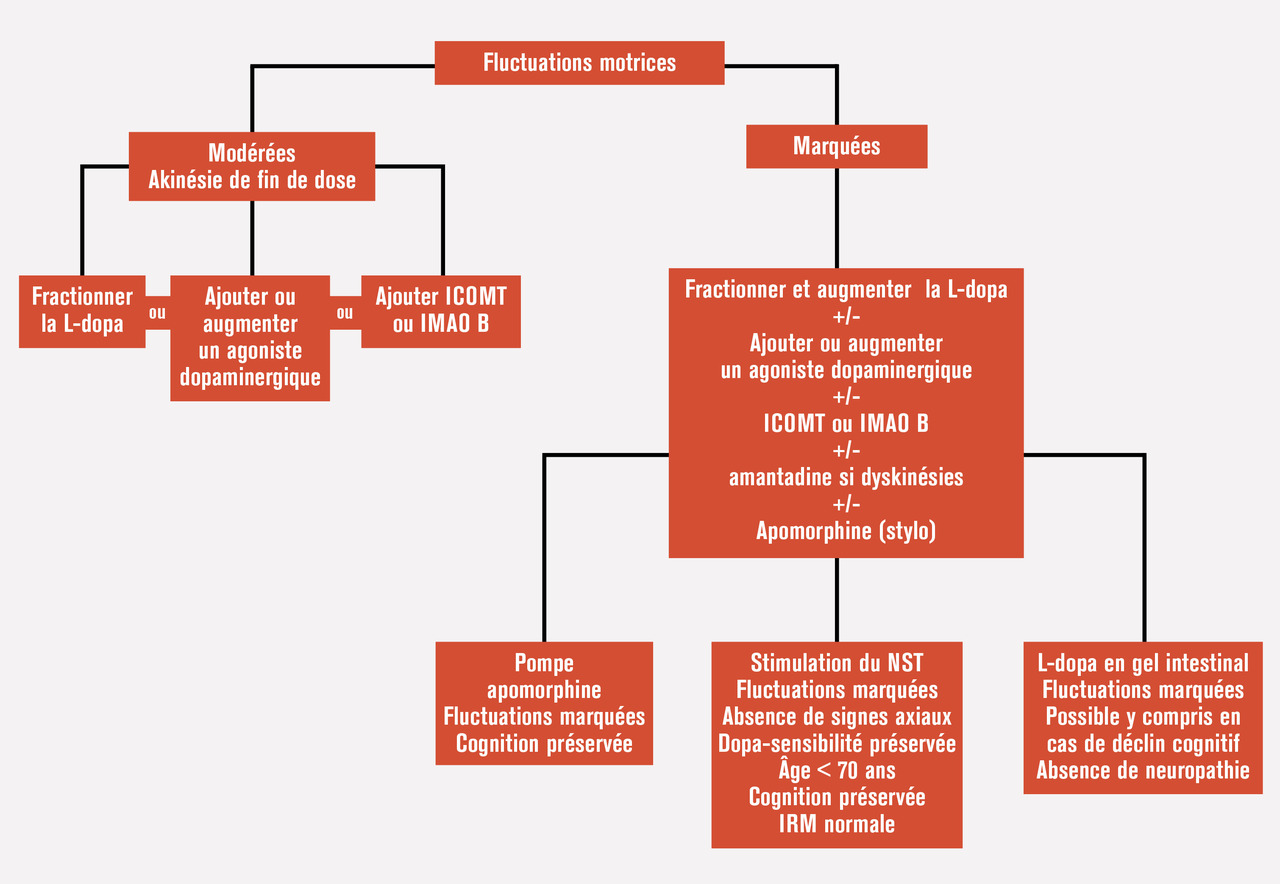
Ce stade apparaît après la lune de miel, le plus souvent après 3 à 5 ans d’évolution. Le but est de limiter les phases « off » ou simplement les akinésies de fin de dose, mais aussi de réduire les dyskinésies lorsqu’elles existent. Ce stade de la maladie se caractérise par l’alternance de périodes « on », durant lesquelles le patient est sous l’effet du traitement dopaminergique et a un bon état moteur moyennant parfois des mouvements anormaux involontaires (dyskinésies), et de périodes « off », durant lesquelles le traitement cesse d’agir et les signes de la maladie réapparaissent. L’idée générale est de lisser les prises de traitements dopaminergiques.La stratégie initiale est d’augmenter les agonistes dopaminergiques ou de fractionner les prises de L-dopa sur la journée et, souvent, d’ajouter une prise de L-dopa à libération prolongée au coucher pour limiter l’akinésie nocturne. À noter que la L-dopa à libération prolongée ne permet pas de mieux contrôler les fluctuations motrices que la L-dopa standard. L’utilisation d’un inhibiteur de la cathécol-O-méthyltransférase ou d’un inhibiteur de la monoamine oxydase B permet aussi à ce stade d’optimiser et de prolonger l’action de la L-dopa et donc de réduire les fluctuations motrices. En cas de dyskinésies invalidantes, et après avoir optimisé les prises et doses unitaires de L-dopa, l’amantadine est une option intéressante et souvent efficace. Les périodes « off » de survenue brutale et imprévue ou les dystonies de phase « off », souvent douloureuses, peuvent bénéficier d’injections sous-cutanées discontinues d’apomorphine (stylo).Lorsque les fluctuations motrices sont plus marquées et deviennent difficiles à gérer par les traitements médicamenteux classiques, les thérapies dites de recours peuvent être proposées. Il s’agit des pompes sous-cutanées à apomorphine à passer sur 14 ou 24 heures ou de la dopamine en gel administrée au moyen d’une pompe jéjunale (gel intestinal de L-dopa). Chez les sujets les plus fragiles sur le plan cognitif, la L-dopa en gel intestinal a l’avantage d’entraîner beaucoup moins de risques de syndrome confusionnel ou d’hallucinations ; en revanche, elle entraîne plus de complications directement liées au matériel de jéjunostomie, surtout dans les premières semaines qui suivent sa mise en place.Enfin, chez les sujets remplissant des critères bien définis (v. supra), la stimulation cérébrale profonde, principalement du noyau sous-thalamique, est le traitement le plus efficace pour corriger les fluctuations motrices et les dyskinésies. La figure 2 résume les principaux choix thérapeutiques au stade des fluctuations motrices.
Stratégie à la phase de déclin
Lorsque les signes axiaux (chutes, dysarthrie sévère, dysphagie) et l’altération cognitive apparaissent, il faut souligner d’emblée la limite des traitements et la nécessité, très souvent, de simplifier l’ordonnance pour limiter l’iatrogénie.Il faut aussi insister sur la kinésithérapie et l’orthophonie qui, seules, apportent un certain bénéfice sur les troubles de la marche et de l’équilibre ainsi que sur la dysarthrie et la dysphagie. Le « freezing » ou enrayage cinétique (difficulté à initier la marche, avec impression de pieds « collés » au sol) relève particulièrement de la kinésithérapie et de règles permettant de prévenir son apparition et de limiter les chutes lorsqu’il apparaît. Il faut notamment être très vigilant dans les espaces confinés, au passage des portes ou lors des demi-tours, et éviter les doubles tâches (porter un objet et marcher…).Lorsque les troubles cognitifs apparaissent, les traitements anticholinestérasiques tels que la rivastigmine apportent un bénéfice modeste.26En cas d’hallucinations, de confusion ou de psychose dopaminergique (délire de jalousie, délire de persécution), il faut tout d’abord éliminer un facteur intercurrent (fièvre, changement de traitement, défaut d’observance, traumatisme crânien avec hématome sous-dural, déshydratation…). Ensuite, il faut simplifier le traitement en ne gardant souvent que la L-dopa. Il ne faut en revanche jamais totalement arrêter le traitement dopaminergique car on court alors le risque de syndrome malin des neuroleptiques, potentiellement gravissime. Lorsque cette stratégie ne suffit pas, la clozapine ou la quétiapine peuvent être proposées à visée anti-hallucinatoire ou pour traiter un syndrome interprétatif. La clozapine est plus efficace mais nécessite une surveillance très régulière de l’hémogramme et une prescription par un neurologue, gériatre ou psychiatre. La quétiapine peut parfois aggraver les signes moteurs mais est plus simple à prescrire.
CONCLUSION ET PERSPECTIVES
Le traitement de la maladie de Parkinson est complexe en raison de la nature très hétérogène des manifestations rencontrées. Il est primordial de prendre en compte le patient dans sa globalité, à la fois en termes de manifestations motrices et non motrices. Le but est de préserver la meilleure qualité de vie possible tout en évitant les effets indésirables parfois sévères. Actuellement, le traitement reste symptomatique mais, à l’avenir, il permettra sans doute d’influencer l’évolution de la maladie en agissant notamment sur l’accumulation d’alpha-synucléine.
Références
1. Fahn S, Oakes D, Shoulson I et al. Levodopa and the progression of Parkinson’s disease. N Engl J Med 2004;351:2498-508.
2. Lees AJ, Katzenschlager R, Head J, Ben-Shlomo Y. Ten-year follow-up of three different initial treatments in de-novo PD: a randomized trial. Neurology 2001;57:1687-94.
3. LeWitt P. Levodopa therapy for Parkinson’s disease: pharmacokinetics and pharmacodynamics. Mov Disord 2015;30:64-72.
4. Koller WC. Levodopa in the treatment of Parkinson’s disease. Neurology 2000;55:S2-7; discussion S8-12.
5. Parkkinen L, O’Sullivan SS, Kuoppamäki M, et al. Does levodopa accelerate the pathologic process in Parkinson disease brain? Neurology 2011;77:1420-6.
6. Bastide MF, Meissner WG, Picconi B, et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson’s disease. Prog Neurobiol 2015;132:96-168.
7. Ray Chaudhuri K, Qamar MA, Rajah T et al. Non-oral dopaminergic therapies for Parkinson's disease: current treatments and the future. NPJ Parkinsons Dis 2016;2:16023.
8. Zhou CQ, Lou JH, Zhang YP, et al. Long-acting versus standard non-ergot dopamine agonists in Parkinson’s disease: a meta-analysis of randomized controlled trials. CNS Neurosci Ther 2014;20(4):368-76.
9. Chondrogiorgi M, Tatsioni A, Reichmann H, Konitsiotis S. Dopamine agonist monotherapy in Parkinson’s disease and potential risk factors for dyskinesia: a meta-analysis of levodopa-controlled trials. Eur J Neurol 2014;21:433-40.
10. Katzenschlager R, Head J, Schrag A, et al. Fourteen-year final report of the randomized PDRG-UK trial comparing three initial treatments in PD. Neurology 2008;71:474-80.
11. Thobois S, Prange S, Sgambato-Faure V, Tremblay L, Broussolle E. Imaging the etiology of apathy, anxiety, and depression in Parkinson’s disease: implication for treatment. Curr Neurol Neurosci Rep 2017;17:76.
12. Ceravolo R, Rossi C, Del Prete E, Bonuccelli U. A review of adverse events linked to dopamine agonists in the treatment of Parkinson’s disease. Expert Opin Drug Saf 2016;15:181-98.
13. Weintraub D, David AS, Evans AH, Grant JE, Stacy M. Clinical spectrum of impulse control disorders in Parkinson’s disease. Mov Disord 2015;30:121-7.
14. Trenkwalder C, Chaudhuri KR, García Ruiz PJ, et al. Expert Consensus Group report on the use of apomorphine in the treatment of Parkinson's disease--Clinical practice recommendations. Parkinsonism Relat Disord 2015;21:1023-30.
15. Olanow CW, Rascol O, Hauser R, et al. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease. N Engl J Med 2009;361:1268-78.
16. Rascol O, Hauser RA, Stocchi F, et al. Long-term effects of rasagiline and the natural history of treated Parkinson’s disease. Mov Disord 2016;31:1489-96.
17. Panisset M, Chen JJ, Rhyee SH, Conner J, Mathena J, STACCATO study investigators. Serotonin toxicity association with concomitant antidepressants and rasagiline treatment: retrospective study (STACCATO). Pharmacotherapy 2014;34:1250-8.
18. Stocchi F, Rascol O, Kieburtz K, et al. Initiating levodopa/carbidopa therapy with and without entacapone in early Parkinson disease: the STRIDE-PD study. Ann Neurol 2010;68:18-27.
19. Hauser RA, Panisset M, Abbruzzese G, et al. Double-blind trial of levodopa/carbidopa/entacapone versus levodopa/carbidopa in early Parkinson’s disease. Mov Disord 2009;24:541-50.
20. Katzenschlager R, Sampaio C, Costa J, Lees A. Anticholinergics for symptomatic management of Parkinson’s disease. Cochrane Database Syst Rev 2003;2:CD003735.
21. Chase TN, Oh JD, Konitsiotis S. Antiparkinsonian and antidyskinetic activity of drugs targeting central glutamatergic mechanisms. J Neurol 2000;247:II36-42.
22. Krack P, Batir A, Van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med 2003;349:1925-34.
23. Schuepbach WM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson's disease with early motor complications. N Engl J Med 2013;368:610-22.
24. Lhommée E, Boyer F, Wack M, et al. Personality, dopamine, and Parkinson's disease: Insights from subthalamic stimulation. Mov Disord 2017;32:1191-200.
25. Cury RG, Fraix V, Castrioto A, et al. Thalamic deep brain stimulation for tremor in Parkinson disease, essential tremor, and dystonia. Neurology 2017;89:1416-23.
26. Emre M, Aarsland D, Albanese A, et al. Rivastigmine for dementia associated with Parkinson’s disease. N Engl J Med 2004;351:2509-18
2. Lees AJ, Katzenschlager R, Head J, Ben-Shlomo Y. Ten-year follow-up of three different initial treatments in de-novo PD: a randomized trial. Neurology 2001;57:1687-94.
3. LeWitt P. Levodopa therapy for Parkinson’s disease: pharmacokinetics and pharmacodynamics. Mov Disord 2015;30:64-72.
4. Koller WC. Levodopa in the treatment of Parkinson’s disease. Neurology 2000;55:S2-7; discussion S8-12.
5. Parkkinen L, O’Sullivan SS, Kuoppamäki M, et al. Does levodopa accelerate the pathologic process in Parkinson disease brain? Neurology 2011;77:1420-6.
6. Bastide MF, Meissner WG, Picconi B, et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson’s disease. Prog Neurobiol 2015;132:96-168.
7. Ray Chaudhuri K, Qamar MA, Rajah T et al. Non-oral dopaminergic therapies for Parkinson's disease: current treatments and the future. NPJ Parkinsons Dis 2016;2:16023.
8. Zhou CQ, Lou JH, Zhang YP, et al. Long-acting versus standard non-ergot dopamine agonists in Parkinson’s disease: a meta-analysis of randomized controlled trials. CNS Neurosci Ther 2014;20(4):368-76.
9. Chondrogiorgi M, Tatsioni A, Reichmann H, Konitsiotis S. Dopamine agonist monotherapy in Parkinson’s disease and potential risk factors for dyskinesia: a meta-analysis of levodopa-controlled trials. Eur J Neurol 2014;21:433-40.
10. Katzenschlager R, Head J, Schrag A, et al. Fourteen-year final report of the randomized PDRG-UK trial comparing three initial treatments in PD. Neurology 2008;71:474-80.
11. Thobois S, Prange S, Sgambato-Faure V, Tremblay L, Broussolle E. Imaging the etiology of apathy, anxiety, and depression in Parkinson’s disease: implication for treatment. Curr Neurol Neurosci Rep 2017;17:76.
12. Ceravolo R, Rossi C, Del Prete E, Bonuccelli U. A review of adverse events linked to dopamine agonists in the treatment of Parkinson’s disease. Expert Opin Drug Saf 2016;15:181-98.
13. Weintraub D, David AS, Evans AH, Grant JE, Stacy M. Clinical spectrum of impulse control disorders in Parkinson’s disease. Mov Disord 2015;30:121-7.
14. Trenkwalder C, Chaudhuri KR, García Ruiz PJ, et al. Expert Consensus Group report on the use of apomorphine in the treatment of Parkinson's disease--Clinical practice recommendations. Parkinsonism Relat Disord 2015;21:1023-30.
15. Olanow CW, Rascol O, Hauser R, et al. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease. N Engl J Med 2009;361:1268-78.
16. Rascol O, Hauser RA, Stocchi F, et al. Long-term effects of rasagiline and the natural history of treated Parkinson’s disease. Mov Disord 2016;31:1489-96.
17. Panisset M, Chen JJ, Rhyee SH, Conner J, Mathena J, STACCATO study investigators. Serotonin toxicity association with concomitant antidepressants and rasagiline treatment: retrospective study (STACCATO). Pharmacotherapy 2014;34:1250-8.
18. Stocchi F, Rascol O, Kieburtz K, et al. Initiating levodopa/carbidopa therapy with and without entacapone in early Parkinson disease: the STRIDE-PD study. Ann Neurol 2010;68:18-27.
19. Hauser RA, Panisset M, Abbruzzese G, et al. Double-blind trial of levodopa/carbidopa/entacapone versus levodopa/carbidopa in early Parkinson’s disease. Mov Disord 2009;24:541-50.
20. Katzenschlager R, Sampaio C, Costa J, Lees A. Anticholinergics for symptomatic management of Parkinson’s disease. Cochrane Database Syst Rev 2003;2:CD003735.
21. Chase TN, Oh JD, Konitsiotis S. Antiparkinsonian and antidyskinetic activity of drugs targeting central glutamatergic mechanisms. J Neurol 2000;247:II36-42.
22. Krack P, Batir A, Van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med 2003;349:1925-34.
23. Schuepbach WM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson's disease with early motor complications. N Engl J Med 2013;368:610-22.
24. Lhommée E, Boyer F, Wack M, et al. Personality, dopamine, and Parkinson's disease: Insights from subthalamic stimulation. Mov Disord 2017;32:1191-200.
25. Cury RG, Fraix V, Castrioto A, et al. Thalamic deep brain stimulation for tremor in Parkinson disease, essential tremor, and dystonia. Neurology 2017;89:1416-23.
26. Emre M, Aarsland D, Albanese A, et al. Rivastigmine for dementia associated with Parkinson’s disease. N Engl J Med 2004;351:2509-18