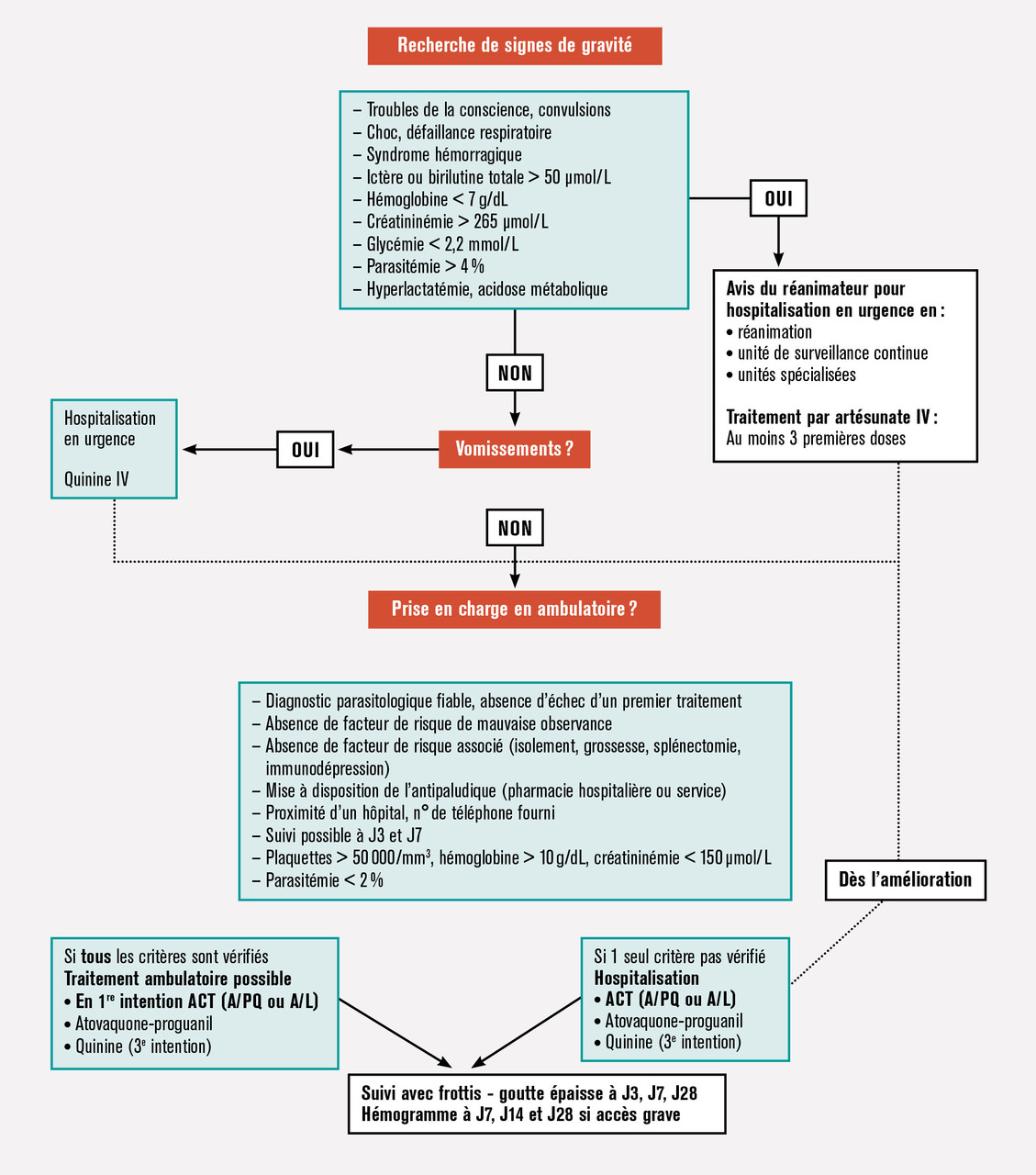
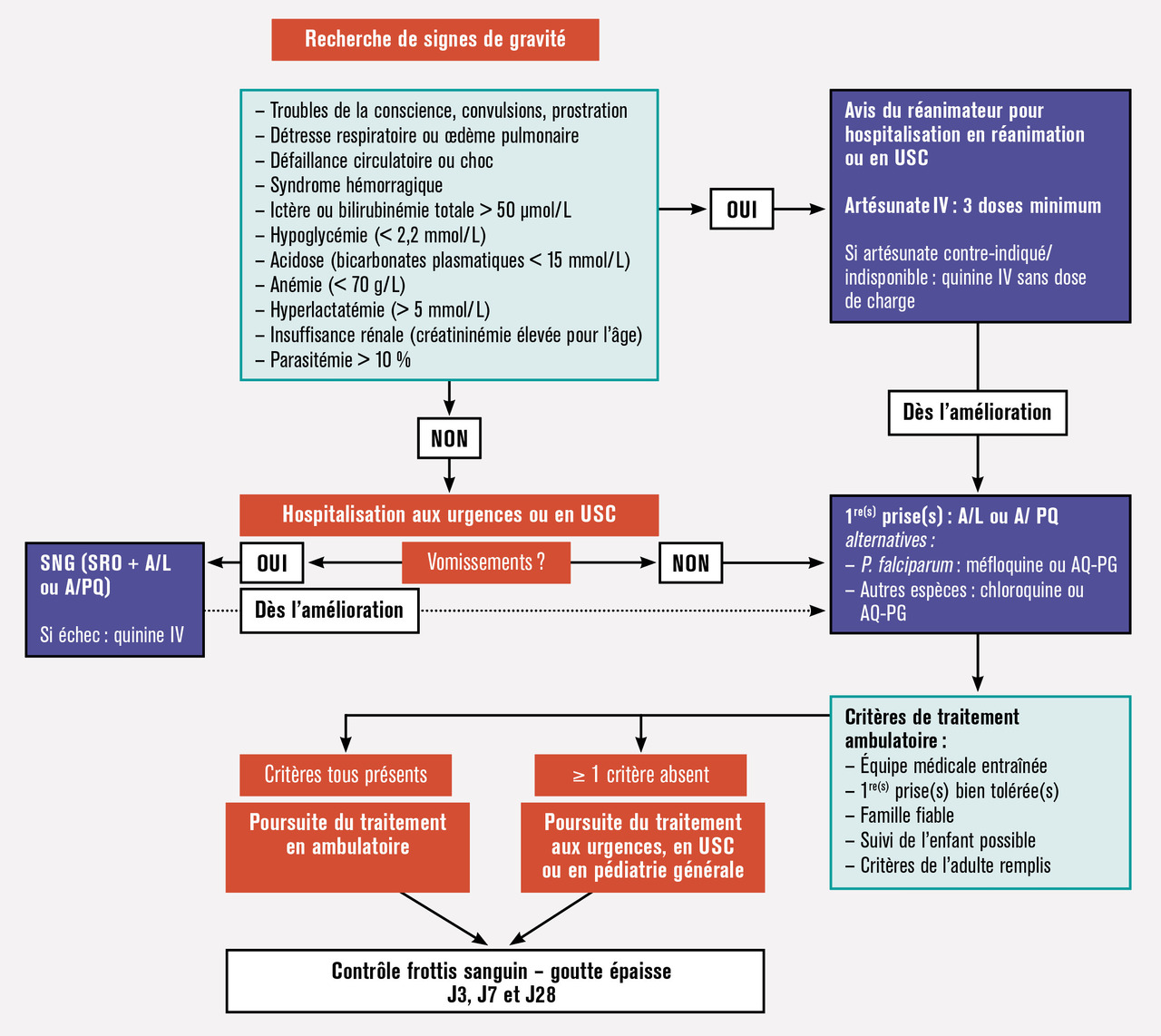
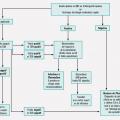
Bien que le paludisme d’importation reste une pathologie rare en France, elle peut, si elle n’est pas prise en charge rapidement, évoluer défavorablement. Tous les médecins devraient donc avoir le réflexe de penser au paludisme devant toute fièvre au retour d’une zone d’endémie.1 La prise en charge thérapeutique a récemment évolué, avec l’actualisation des recommandations de prise en charge du paludisme de la Société de pathologie infectieuse de langue française réalisées en partenariat avec plusieurs sociétés savantes.2 La grande majorité des paludismes observés en France étant dus à l’espèce Plasmodium falciparum au retour d’Afrique subsaharienne (v. encadré p. 150), nous nous concentrerons ici sur la prise en charge des cas liés à cette espèce, les autres étant abordées dans l’encadré (p. 159) sur les formes particulières du paludisme. Les figures 1 et 2 résument la prise en charge chez un adulte ou un enfant.
Physiopathologie
Plasmodium est transmis par la piqûre d’un anophèle femelle qui inocule des sporozoïtes par voie sanguine.3 Ces derniers rejoignent le foie par la circulation en moins d’une heure où ils infectent les hépatocytes et vont former des schizontes et des hypnozoïtes (uniquement pour P. ovale et P. vivax à l’origine des reviviscences à distance). La rupture des premiers entraîne un relargage de mérozoïtes dans la circulation sanguine qui pénètrent au sein des hématies et sont à l’origine du cycle intra-érythrocytaire. Ils deviennent alors des trophozoïtes puis des schizontes qui finissent par se rompre et relarguent à leur tour (cycle d’amplification) des mérozoïtes, à l’origine des symptômes. Certains parasites se différencient en formes sexuées, les gamétocytes, à l’origine de la chaîne de la transmission à l’occasion d’une nouvelle piqûre.
La fièvre : symptôme cardinal
Toute fièvre ou histoire de fièvre au retour d’une zone d’endémie est un paludisme jusqu’à preuve du contraire, quels que soient les symptômes ou diagnostics qui peuvent y être associés.1 Une vigilance particulière est de mise pour les voyageurs (principalement migrants) au retour d’Afrique subsaharienne, continent de très loin le plus souvent à l’origine des cas d’importation. La fièvre (notion de « corps chaud »), volontiers irrégulière (évolution par pics), est isolée ou associée à des symptômes généraux (frissons, sueurs, myalgies, asthénie, anorexie), digestifs (nausées, diarrhée, etc.), et/ou à des céphalées.3, 4 Le diag- nostic de paludisme est possible même en cas de prise de chimioprophylaxie (souvent mal prise) ou de notion de traitement antiparasitaire sur place. Les accès palustres à Plasmodium falciparum surviennent au moins 7 jours après la piqûre infectante (période d’incubation) et jusqu’à 2 à 3 mois après (quelques rares émergences plus tardives sont possibles). Les accès palustres à P. falciparum observés en France surviennent ainsi le plus souvent dans les 2 à 3 semaines après le retour d’une zone d’endémie. Le voyage en zone tropicale n’est pas toujours évoqué par le patient, ce qui justifie de systématiquement poser la question des antécédents de voyage quand on prend en charge une fièvre.
Devant une fièvre au retour d’une zone tropicale, il est également important de rechercher les diagnostics différentiels. Un examen clinique complet est indispensable pour rechercher des signes de gravité et évoquer des diagnostics différentiels ou associés. Les pièges classiques qui peuvent retarder le diagnostic de paludisme sont un tableau de gastroentérite fébrile (surtout chez l’enfant), un tableau évocateur de syndrome grippal en hiver, l’absence de fièvre lors de l’examen (notamment chez les patients sous antipyrétiques ou ayant reçu un traitement antiparasitaire inadapté avant de quitter la zone à risque) et le diagnostic d’une autre maladie infectieuse associée comme une infection urinaire ou une dengue qui peuvent faussement rassurer.
Devant une fièvre au retour d’une zone tropicale, il est également important de rechercher les diagnostics différentiels. Un examen clinique complet est indispensable pour rechercher des signes de gravité et évoquer des diagnostics différentiels ou associés. Les pièges classiques qui peuvent retarder le diagnostic de paludisme sont un tableau de gastroentérite fébrile (surtout chez l’enfant), un tableau évocateur de syndrome grippal en hiver, l’absence de fièvre lors de l’examen (notamment chez les patients sous antipyrétiques ou ayant reçu un traitement antiparasitaire inadapté avant de quitter la zone à risque) et le diagnostic d’une autre maladie infectieuse associée comme une infection urinaire ou une dengue qui peuvent faussement rassurer.
Frottis sanguin, goutte épaisse ou test de diagnostic rapide
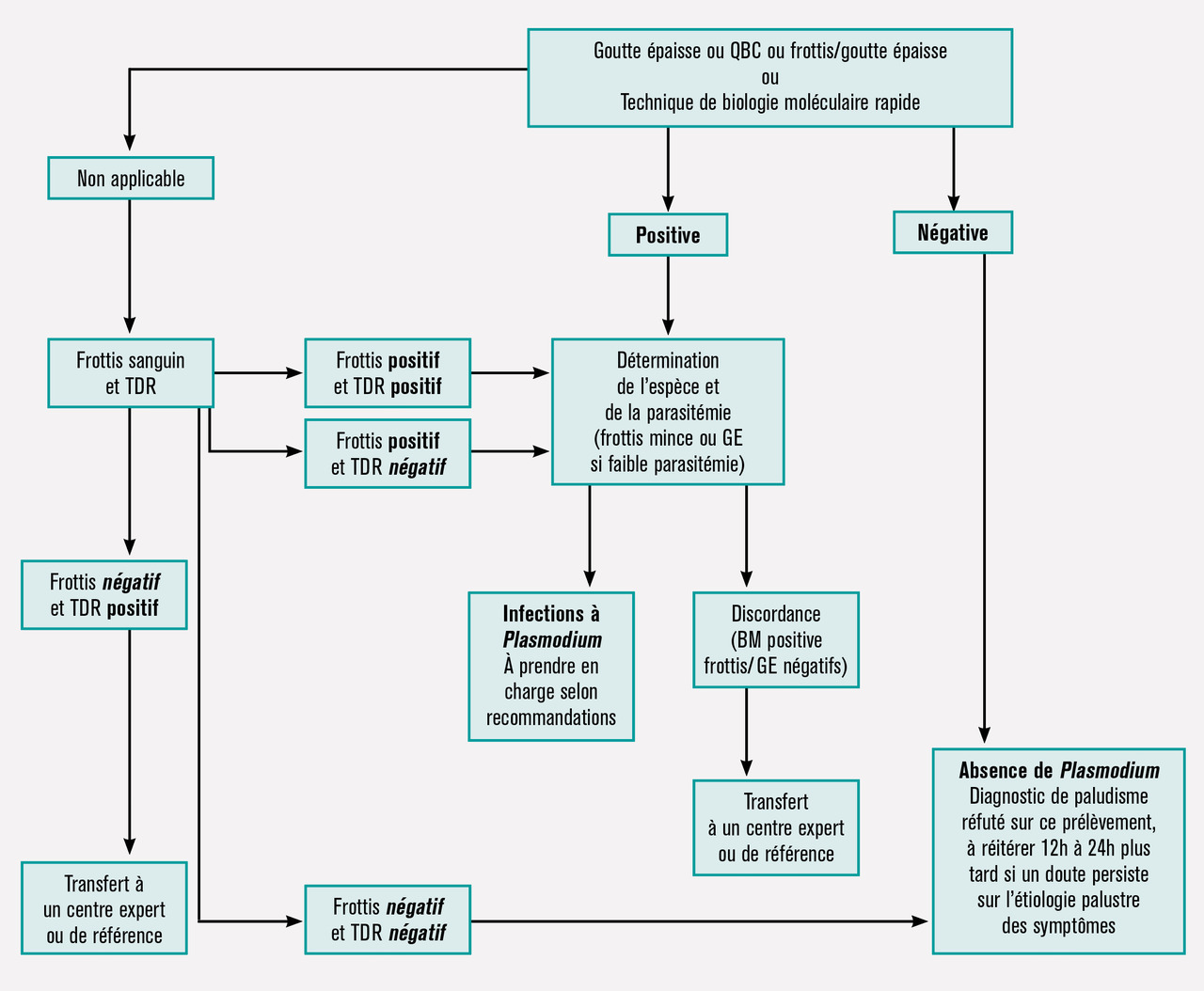
Le diagnostic du paludisme repose sur un prélèvement veineux envoyé en urgence au laboratoire pour réalisation d’un frottis sanguin associé à une goutte épaisse ou, à défaut, un test de diagnostic rapide (TDR) immunochromatographique détectant au minimum l’antigène HRP2 spécifique de P. falciparum (fig. 3). Plusieurs de ces tests de diagnostic rapide sont sur le marché, certains permettant de détecter uniquement P. falciparum et certains de différencier P. falciparum et les autres espèces plasmodiales.5
Outre le diagnostic, le frottis permet d’identifier l’espèce et de quantifier la parasitémie (hospitalisation indispensable si > 2 %, classement en paludisme grave si > 4 %). Le résultat doit être rendu au clinicien dans les 2 heures après réception au laboratoire, le clinicien devant s’assurer de l’acheminement immédiat du prélèvement. L’association d’un frottis mince et d’un test de diagnostic rapide est une alternative quand la goutte épaisse ne peut être rendue dans les 2 heures, notamment dans les laboratoires non spécialisés. En cas de premier résultat négatif ou douteux, il est nécessaire de réitérer le diagnostic dans les heures qui suivent.
Il est important de rappeler qu’un frottis sanguin- goutte épaisse négatif n’élimine pas le diagnostic en cas de forte suspicion clinique (faux négatif par erreur de lecture ou parasitémie faible). Dans les structures de référence, la polymerase chain reaction (PCR) prend de plus en plus de place pour contrôler un résultat (pauci- infection, identification d’espèce ou recherche d’association d’espèces), voire en routine.
Le diagnostic parasitologique est complété d’un bilan standard pour évaluer des signes de gravité et rechercher un diagnostic différentiel, avec en particulier : hémogramme, protéine C-réactive (CRP), ionogramme, urée, créatinine, aspartate aminotransférase, alanine amino- transférase, gamma glutamyltransférase, phosphatases alcalines, bilirubine, hémocultures, et en fonction de l’examen clinique : gaz du sang, examen cytobactério- logique des urines, cliché thoracique, etc. Cette prise de sang peut être mise à profit pour réaliser un dépistage des virus de l’immunodéficience humaine et des hépatites B et C selon les recommandations actuelles. On trouve classiquement une thrombopénie, assez évocatrice dans ce contexte, une hémoglobine limite, voire une anémie hémolytique, l’absence d’hyperleucocytose, voire une leucopénie (à la différence des infections bactériennes invasives), une discrète cytolyse, une hyperbilirubinémie libre témoignant de l’hémolyse et une CRP élevée (à la différence des arboviroses comme la dengue et le chikungunya). Les autres signes biologiques évoquant la gravité sont décrits plus bas.
Outre le diagnostic, le frottis permet d’identifier l’espèce et de quantifier la parasitémie (hospitalisation indispensable si > 2 %, classement en paludisme grave si > 4 %). Le résultat doit être rendu au clinicien dans les 2 heures après réception au laboratoire, le clinicien devant s’assurer de l’acheminement immédiat du prélèvement. L’association d’un frottis mince et d’un test de diagnostic rapide est une alternative quand la goutte épaisse ne peut être rendue dans les 2 heures, notamment dans les laboratoires non spécialisés. En cas de premier résultat négatif ou douteux, il est nécessaire de réitérer le diagnostic dans les heures qui suivent.
Il est important de rappeler qu’un frottis sanguin- goutte épaisse négatif n’élimine pas le diagnostic en cas de forte suspicion clinique (faux négatif par erreur de lecture ou parasitémie faible). Dans les structures de référence, la polymerase chain reaction (PCR) prend de plus en plus de place pour contrôler un résultat (pauci- infection, identification d’espèce ou recherche d’association d’espèces), voire en routine.
Le diagnostic parasitologique est complété d’un bilan standard pour évaluer des signes de gravité et rechercher un diagnostic différentiel, avec en particulier : hémogramme, protéine C-réactive (CRP), ionogramme, urée, créatinine, aspartate aminotransférase, alanine amino- transférase, gamma glutamyltransférase, phosphatases alcalines, bilirubine, hémocultures, et en fonction de l’examen clinique : gaz du sang, examen cytobactério- logique des urines, cliché thoracique, etc. Cette prise de sang peut être mise à profit pour réaliser un dépistage des virus de l’immunodéficience humaine et des hépatites B et C selon les recommandations actuelles. On trouve classiquement une thrombopénie, assez évocatrice dans ce contexte, une hémoglobine limite, voire une anémie hémolytique, l’absence d’hyperleucocytose, voire une leucopénie (à la différence des infections bactériennes invasives), une discrète cytolyse, une hyperbilirubinémie libre témoignant de l’hémolyse et une CRP élevée (à la différence des arboviroses comme la dengue et le chikungunya). Les autres signes biologiques évoquant la gravité sont décrits plus bas.
Écarter la gravité
En France, en l’absence de prise en charge rapide, 15 % des accès palustres évoluent vers une forme grave qui implique majoritairement P. falciparum. Les signes de gravité sont systématiquement recherchés à l’arrivée et à intervalles réguliers au cours des premières heures qui suivent le début de la prise en charge à l’aide de l’examen clinique et des examens complémentaires indiqués (v. p 162).
Une urgence thérapeutique
La prise en charge du paludisme, même dans sa forme simple, est une urgence thérapeutique (risque d’aggra- vation brutale, avec décès possible en quelques heures). Elle est habituellement hospitalière (urgences et hospitalisation courte), mais les dernières recommandations2 laissent une place pour une prise en charge ambulatoire de certains paludismes à P. falciparum sous réserve de critères cliniques et biologiques précis qui imposent souvent un prélèvement veineux aux urgences. Ces critères sont de disposer des résultats des examens parasitologique et biologiques (frottis positif, parasitémie < 2 %, plaquettes > 50 G/L, hémoglobine > 10 g/dL, créatinémie < 145 µmol/L), l’absence de prise d’un traitement antérieur, l’absence de signes de gravité, l’absence de troubles digestifs qui pourraient entraîner les vomissements des comprimés, l’absence de comorbidités, de grossesse ou d’isolement social, une bonne compréhension et une bonne observance attendue, une délivrance immédiate et supervisée du traitement avec une période d’obser- vation minimale de 2 heures et en fournissant aux patients le reste du traitement. Dans tous les autres cas et en particulier chez l’enfant et chez les patients à risque de complication (grossesse, personnes âgées, comorbidités, difficultés sociales laissant craindre une insuffisance de la prise en charge, etc.), une courte hospitalisation est recommandée.
On observe depuis plusieurs années l’émergence de parasites résistant aux antipaludiques, ce qui explique que les recommandations aient évolué vers des combinaisons contenant des dérivés de l’artémisinine (artemisinin-based combinaison therapy [ACT]). Ces combinaisons ont le double avantage de contenir deux molécules synergiques et de prévenir l’émergence de résistance. Leur positionnement en première intention repose aussi sur leur rapidité d’action qui permettrait de prévenir l’évolution vers les formes graves. Les ACT disponibles en France sont les associations arténimol (aussi appelé dihydroartémisinine)-pipéraquine (Eurartesim) ou artéméther-luméfantrine (Riamet) et sont recommandées en première ligne.6, 7 L’arténimol-pipéraquine est prescrite en une prise par jour pendant 3 jours (tableau 1). La prise orale se fait préférentiellement avec de l’eau, à jeun. Les comprimés peuvent être écrasés si besoin. S’il y a des facteurs de risque d’arythmie, un électrocardiogramme (ECG) avec mesure du QT corrigé est réalisé avant le début du traitement et, si le patient est encore hospitalisé, avant la 3e dose. La prise du traitement avec des aliments augmente le risque d’allongement du QT, d’où l’indication d’une prise en dehors des repas. En cas de vomissements dans les 30 minutes, la dose entière est réadministrée ; en cas de vomissements dans les 30 à 60 minutes, une demi-dose est réadministrée. L’association artéméther- luméfantrine a aussi une efficacité rapide mais nécessite deux prises par jour, 8 heures après la première prise, puis toutes les 12 heures à partir du 2e jour (tableau 1). Elle doit, à l’inverse de l’autre ACT, être prise avec un repas ou une collation lactée (risque de rechutes si prise à jeun). Ces deux associations sont, en règle générale, bien tolérées, mais une vigilance est de mise en cas de facteurs de risque d’allongement du QT. La réalisation d’un ECG préthérapeutique est alors recommandée, et le QT corrigé doit être inférieur à 500 ms.
L’association atovaquone-proguanil, qui est doré- navant disponible en générique, reste une alternative acceptable en cas d’indisponibilité, d’intolérance ou de contre-indication aux ACT, mais son mode d’action est moins rapide (tableau 1). Son utilisation doit être évitée si elle a été utilisée en chimiprophylaxie. Elle s’administre en une prise par jour, à prendre impérativement avec une collation.
En cas d’intolérance digestive aux traitements per os, un traitement par quinine par voie intraveineuse est envisagé sans dose de charge (8 mg/kg toutes les 8 h) [tableau 1]. Dans ce cas, un relais per os est envisagé le plus tôt possible dès l’amendement des signes digestifs par une cure complète d’un traitement per os (ACT).
La méfloquine (Lariam) n’est plus utilisée chez l’adulte en raison de son mauvais profil de tolérance neuropsychiatrique. La chloroquine n’est pas indiquée pour P. falciparum. Il est important de souligner que des résistances aux associations à base d’artémisinine sont décrites, en particulier en Asie du Sud-Est (zones frontalières Thaïlande-Birmanie et Cambodge). Une vigilance accrue est donc de mise en cas d’évolution défavorable d’un paludisme à P. falciparum au retour de ces zones. Plusieurs candidats antiparasitaires sont à l’étude et pourraient apporter des réponses à l’avenir.8
Dans certaines régions comme l’Île-de-France, une astreinte régionale d’infectiologie est joignable en dehors des heures ouvrables et permet d’avoir un avis circonstancié sur la prise en charge d’un patient atteint de paludisme quand les correspondants habituels ne sont plus joignables.
On observe depuis plusieurs années l’émergence de parasites résistant aux antipaludiques, ce qui explique que les recommandations aient évolué vers des combinaisons contenant des dérivés de l’artémisinine (artemisinin-based combinaison therapy [ACT]). Ces combinaisons ont le double avantage de contenir deux molécules synergiques et de prévenir l’émergence de résistance. Leur positionnement en première intention repose aussi sur leur rapidité d’action qui permettrait de prévenir l’évolution vers les formes graves. Les ACT disponibles en France sont les associations arténimol (aussi appelé dihydroartémisinine)-pipéraquine (Eurartesim) ou artéméther-luméfantrine (Riamet) et sont recommandées en première ligne.6, 7 L’arténimol-pipéraquine est prescrite en une prise par jour pendant 3 jours (tableau 1). La prise orale se fait préférentiellement avec de l’eau, à jeun. Les comprimés peuvent être écrasés si besoin. S’il y a des facteurs de risque d’arythmie, un électrocardiogramme (ECG) avec mesure du QT corrigé est réalisé avant le début du traitement et, si le patient est encore hospitalisé, avant la 3e dose. La prise du traitement avec des aliments augmente le risque d’allongement du QT, d’où l’indication d’une prise en dehors des repas. En cas de vomissements dans les 30 minutes, la dose entière est réadministrée ; en cas de vomissements dans les 30 à 60 minutes, une demi-dose est réadministrée. L’association artéméther- luméfantrine a aussi une efficacité rapide mais nécessite deux prises par jour, 8 heures après la première prise, puis toutes les 12 heures à partir du 2e jour (tableau 1). Elle doit, à l’inverse de l’autre ACT, être prise avec un repas ou une collation lactée (risque de rechutes si prise à jeun). Ces deux associations sont, en règle générale, bien tolérées, mais une vigilance est de mise en cas de facteurs de risque d’allongement du QT. La réalisation d’un ECG préthérapeutique est alors recommandée, et le QT corrigé doit être inférieur à 500 ms.
L’association atovaquone-proguanil, qui est doré- navant disponible en générique, reste une alternative acceptable en cas d’indisponibilité, d’intolérance ou de contre-indication aux ACT, mais son mode d’action est moins rapide (tableau 1). Son utilisation doit être évitée si elle a été utilisée en chimiprophylaxie. Elle s’administre en une prise par jour, à prendre impérativement avec une collation.
En cas d’intolérance digestive aux traitements per os, un traitement par quinine par voie intraveineuse est envisagé sans dose de charge (8 mg/kg toutes les 8 h) [tableau 1]. Dans ce cas, un relais per os est envisagé le plus tôt possible dès l’amendement des signes digestifs par une cure complète d’un traitement per os (ACT).
La méfloquine (Lariam) n’est plus utilisée chez l’adulte en raison de son mauvais profil de tolérance neuropsychiatrique. La chloroquine n’est pas indiquée pour P. falciparum. Il est important de souligner que des résistances aux associations à base d’artémisinine sont décrites, en particulier en Asie du Sud-Est (zones frontalières Thaïlande-Birmanie et Cambodge). Une vigilance accrue est donc de mise en cas d’évolution défavorable d’un paludisme à P. falciparum au retour de ces zones. Plusieurs candidats antiparasitaires sont à l’étude et pourraient apporter des réponses à l’avenir.8
Dans certaines régions comme l’Île-de-France, une astreinte régionale d’infectiologie est joignable en dehors des heures ouvrables et permet d’avoir un avis circonstancié sur la prise en charge d’un patient atteint de paludisme quand les correspondants habituels ne sont plus joignables.
Surveillance clinique et biologique
Un suivi clinique et biologique est systématiquement recommandé (fig. 1). L’efficacité clinique et parasitologique est évaluée à J3, J7 et J28. Le bilan prescrit associe un frottis sanguin, une goutte épaisse et un hémogramme, associés à tout autre examen jugé pertinent en fonction du tableau clinique initial. La parasitémie à J3 doit être inférieure à 25 % de la valeur initiale. Elle doit être négative à J7 et J28. La présence de gamétocytes sur les frottis de contrôle (forme sexuée du parasite non pathogène) est possible et n’est pas un signe d’échec du traitement. Il n’y a pas lieu de poursuivre la chimioprophylaxie après le traitement curatif. V
Références
1. Wilson ME, Weld LH, Boggild A, et al. Fever in returned travelers: results from the GeoSentinel Surveillance Network. Clin Infect Dis 2007;44:1560-8.
2. Société de pathologie infectieuse de langue française ; groupe recommandations de la SPILF. Prise en charge et prévention du paludisme d’importation. Mise à jour 2017 des RPC 2007. Paris : SPILF, 2017. www.infectiologie.com ou https://bit.ly/2ASDr9J
3. White NJ, Pukrittayakamee S, Hien TT, Faiz MA, Mokuolu OA, Dondorp AM. Malaria. Lancet 2014;383:723-35.
4. Svenson JE, Gyorkos TW, MacLean JD. Diagnosis of malaria in the febrile traveler. Am J Trop Med Hyg 1995;53:518-21.
5. Mukkala AN, Kwan J, Lau R, Harris D, Kain D, Boggild AK. An update on malaria rapid diagnostic tests. Curr Infect Dis Rep 2018;20:49.
6. Bassat Q, Mulenga M, Tinto H, et al. Dihydroartemisinin-piperaquine and artemether-lumefantrine for treating uncomplicated malaria in African children: a randomised, non-inferiority trial. PLoS One 2009;4:e7871.
7. Valecha N, Phyo AP, Mayxay M, et al. An open-label, randomised study of dihydroartemisinin-piperaquine versus artesunate-mefloquine for falciparum malaria in Asia. PLoS One 2010;5:e11880.
8. Hooft van Huijsduijnen R, Wells TN. The antimalarial pipeline. Curr Opin Pharmacol 2018;42:1-6.
2. Société de pathologie infectieuse de langue française ; groupe recommandations de la SPILF. Prise en charge et prévention du paludisme d’importation. Mise à jour 2017 des RPC 2007. Paris : SPILF, 2017. www.infectiologie.com ou https://bit.ly/2ASDr9J
3. White NJ, Pukrittayakamee S, Hien TT, Faiz MA, Mokuolu OA, Dondorp AM. Malaria. Lancet 2014;383:723-35.
4. Svenson JE, Gyorkos TW, MacLean JD. Diagnosis of malaria in the febrile traveler. Am J Trop Med Hyg 1995;53:518-21.
5. Mukkala AN, Kwan J, Lau R, Harris D, Kain D, Boggild AK. An update on malaria rapid diagnostic tests. Curr Infect Dis Rep 2018;20:49.
6. Bassat Q, Mulenga M, Tinto H, et al. Dihydroartemisinin-piperaquine and artemether-lumefantrine for treating uncomplicated malaria in African children: a randomised, non-inferiority trial. PLoS One 2009;4:e7871.
7. Valecha N, Phyo AP, Mayxay M, et al. An open-label, randomised study of dihydroartemisinin-piperaquine versus artesunate-mefloquine for falciparum malaria in Asia. PLoS One 2010;5:e11880.
8. Hooft van Huijsduijnen R, Wells TN. The antimalarial pipeline. Curr Opin Pharmacol 2018;42:1-6.