L’hidradénite suppurée (HS), aussi appelée hidrosadénite suppurée ou maladie de Verneuil, est une maladie cutanée inflammatoire chronique du follicule pileux.1 Son diagnostic repose sur un faisceau d’arguments cliniques incluant l’association de :
- lésions typiques telles que des nodules et abcès douloureux évoluant vers la suppuration, la fistulisation et la formation de cicatrices ;
- une localisation typique de ces lésions au niveau des aisselles, seins, plis sous-mammaires, pubis, plis inguinaux, région périanale et pli interfessier ;
- une évolution récidivante avec au moins deux poussées en six mois.
La prévalence de l’HS est estimée à environ 0,7 % de la population en Europe.2 Elle apparaît généralement après la puberté et concerne principalement les femmes (sex-ratio à 3/1). Le délai diagnostique est particulièrement long (environ 8 ans), les patients étant souvent confrontés à une connaissance insuffisante de cette affection par les professionnels de santé.3 Or cette maladie a un impact majeur sur la qualité de vie.4 Chez ces patients, l’image de soi, de même que les relations interpersonnelles et sexuelles, sont altérées, ce qui peut les conduire à une dépression.5
Les causes de cette maladie semblent multiples. D’une part, la composante génétique est de plus en plus certaine, avec l’identification de mutations de plusieurs gènes de la voie de la gamma-sécrétase.6,7 Ces mutations entraîneraient des défauts de la voie Notch qui joueraient un rôle principal dans l’activation des lymphocytes T et B et dans l’activation de l’immunité innée.8,9 Des antécédents familiaux d’HS sont ainsi rapportés dans un tiers des cas.1,10 D’autre part, une participation des hormones sexuelles (principalement les androgènes) mais aussi de bactéries,11 du tabac et de l’obésité12 est aussi très largement suspectée.
Conception de nouvelles recommandations nationales
Des recommandations ont été rédigées en 2019 en raison de l’absence de consensus français sur la prise en charge d’une maladie ayant des phénotypes et des grades de sévérité très différents et dont la prise en charge repose sur de nombreuses spécialités. L’amélioration des connaissances cliniques, épidémiologiques, physiopathologiques et thérapeutiques devrait permettre de mieux hiérarchiser la place de l’antibiothérapie, de la chirurgie et des biothérapies.
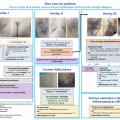
Le centre de preuves de la Société française de dermatologie (SFD) a réuni un groupe de travail composé de treize membres, comprenant des praticiens désignés par la société savante de leur spécialité : dermatologue, chirurgien plasticien, urgentiste, infectiologue, microbiologiste, médecin généraliste, psychologue et un représentant des patients. Les membres n’avaient aucun conflit d’intérêts, et une méthodologie stricte a été suivie et accompagnée par la Haute Autorité de santé.13 Elles sont accessibles sur un site dédié, du centre de preuves de la SFD (https ://reco.sfdermato.org/fr/recommandations-hidradénite-suppurée) (fig. 1) en langues française et anglaise, mais aussi sur le site Chronoreco de la SFD (https ://chronoreco.sfdermato.org). Ces recommandations ont été par la suite publiées dans le British Journal of Dermatology14 et dans les Annales de dermatologie – FMC.15
Principales conclusions des recommandations françaises
Toute lésion nodulaire ou kystique, tout abcès situé dans les régions axillaire, inguinale, périnéale ou mammaire doit faire évoquer le diagnostic d’HS. Cependant il convient de savoir distinguer l’HS :
- d’autres atteintes des glandes cutanées telles que l’acné conglobata, un sinus pilonidal, un kyste des glandes de Bartholin ;
- de dermatoses infectieuses telles que les furoncles, des abcès isolés, une actinomycose, une donovanose, une syphilis, une bartonellose…
- de maladies inflammatoires telles que des maladies inflammatoires chroniques de l’intestin (MICI) qui auraient un retentissement cutané au niveau périnéal exclusivement.
Trois types d’hidradénite suppurée
On distingue désormais trois types d’HS :16
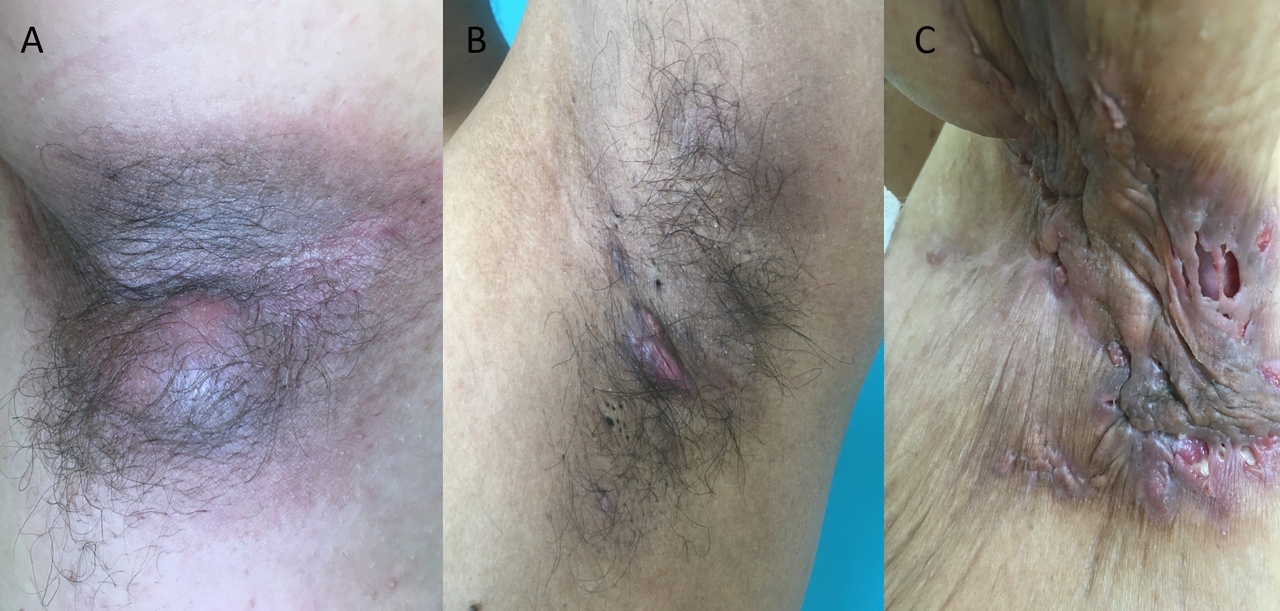
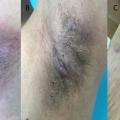
- la forme axillomammaire dite « typique », qui concerne environ 50 % des patients. Ce phénotype est plutôt celui de femmes avec un indice de masse corporelle élevé (fig. 2 A, B et C) ;
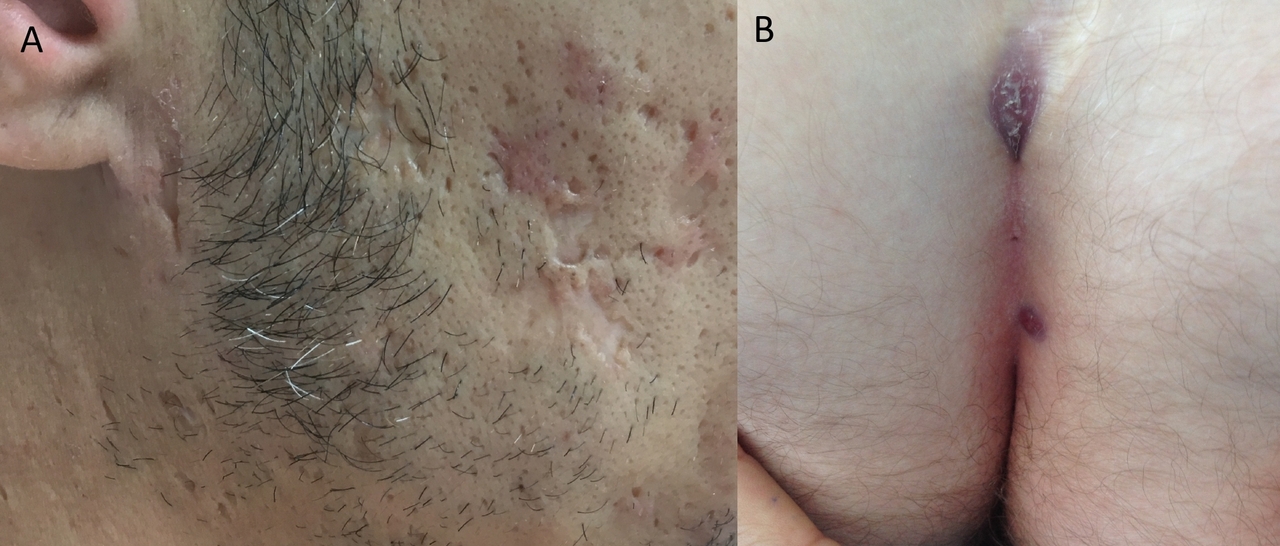
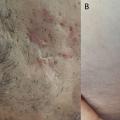
- la forme folliculaire, qui concerne environ 25 % des patients. Ce phénotype semble plus fréquent chez les hommes et chez les patients avec un tabagisme actif. Le début de l’HS est précoce et l’évolution sévère, avec des cicatrices à l’emporte-pièce, des pics à glace, des lésions folliculaires à type de kystes épidermiques, des comédons et un sinus pilonidal (fig. 3 A et B) ;
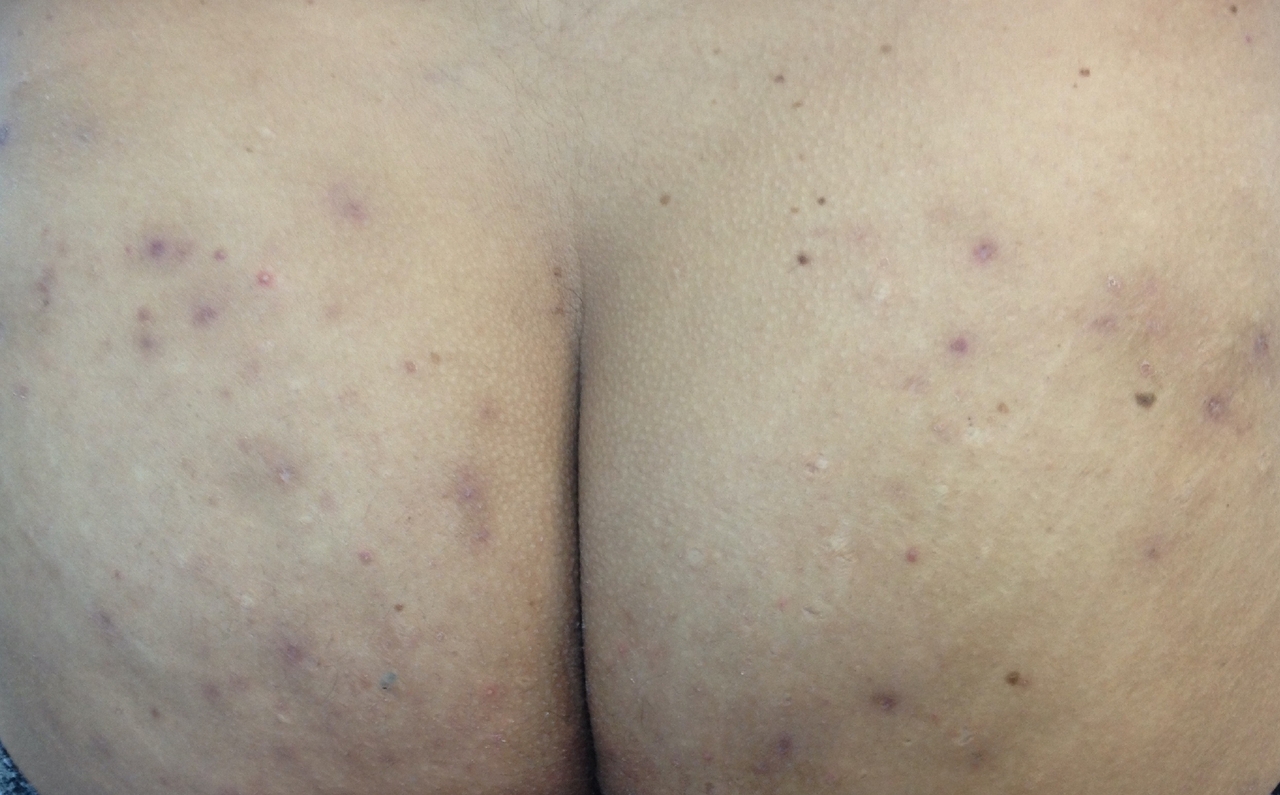
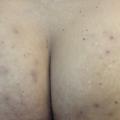
- la forme fessière, qui représente le dernier quart des patients. Ce phénotype est caractérisé par des lésions abcédées, sinueuses, profondes de la région glutéale mais également par la présence de lésions papuleuses ou de folliculites (fig. 4). Il concerne préférentiellement des patients tabagiques et des patients ayant un indice de masse corporelle moins élevé.
Aucun examen complémentaire n’est nécessaire au diagnostic d’HS. Il convient cependant d’être attentif à la présence d’un syndrome métabolique et à des symptômes évocateurs de pathologies inflammatoires digestives ou rhumatismales (maladie de Crohn, rectocolite hémorragique, spondylarthropathie ankylosante...). En effet – rarement –, certaines de ces maladies peuvent être associées à l’HS et nécessitent une escalade thérapeutique plus rapide.
Prise en charge médicale et chirurgicale
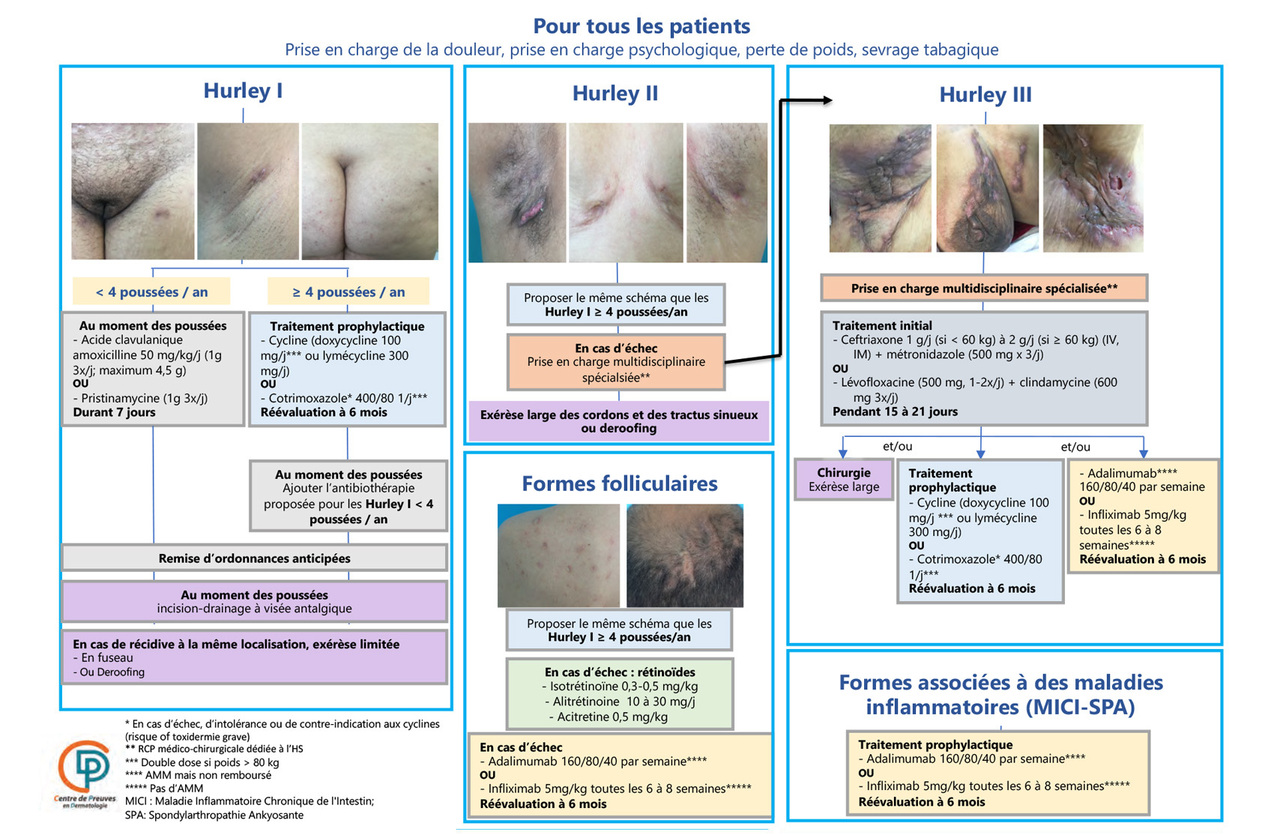
Il n’existe pas de traitement curatif de cette maladie, mais, grâce à une prise en charge médicale et chirurgicale, il est clairement possible désormais :
- d’atténuer les signes et les symptômes (douleur, abcès, suppuration), voire parfois de les faire disparaître ;
- de réduire la fréquence et la sévérité des poussées ;
- d’améliorer la qualité de vie.
La prise en charge des patients et notamment de ceux ayant une forme sévère, est pluridisciplinaire, idéalement lors d’une réunion de concertation pluridisciplinaire (RCP) dédiée, médico-chirurgicale et paramédicale, ou dans le cadre d’un réseau spécialisé. Le groupe HS-France de la SFD propose une RCP nationale régulière pour les dossiers complexes (rcp-hs@sfdermato.org).
L’ensemble de la prise en charge préconisée pour l’HS a été synthétisée dans un algorithme (fig. 1).14,15
Traitements adjuvants
Aucun « régime alimentaire » ne peut être actuellement recommandé aux patients atteints d’HS. Cependant, une alimentation équilibrée est à encourager.
Le sevrage tabagique et la réduction pondérale sont recommandés.17,18
Lorsque les lésions suppurent de manière importante, des pansements adhésifs en périphérie de type hydrofibres ou hydrocellulaires permettent d’apporter une amélioration de la qualité de vie. Ils sont non irritants, absorbants et réduisent les odeurs.
Il semble primordial d’évaluer le retentissement psychologique de l’HS. Un avis spécialisé, psychologique ou psychiatrique, peut s’avérer nécessaire.19
La prise en compte de la douleur est également importante, en suivant les pratiques guidées par l’Organisation mondiale de la santé (OMS) [paliers 1 à 3].
En revanche, compte tenu du risque de complications infectieuses, il n’est pas recommandé d’utiliser des anti-inflammatoires (AINS, corticoïdes) à visée antalgique.
Traitement médical
Localement
En raison du risque d’émergence de résistances, il n’est pas recommandé d’employer d’antibiotiques topiques. Par ailleurs, les antiseptiques locaux n’ont pas montré davantage d’efficacité qu’une toilette à l’eau et au savon en cas de poussées d’HS.
Traitements antibiotiques systémiques
La prescription d’antibiotiques est recommandée en cas de poussée aiguë, de prophylaxie secondaire et afin de réduire les lésions en période préopératoire (tableau 1).20,21
La microbiologie des lésions d’HS varie selon le stade lésionnel, c’est pourquoi le traitement antibiotique est probabiliste et ne nécessite pas la réalisation de prélèvements bactériologiques locaux ou d’hémocultures.
Dans les formes sévères, l’administration des antibiotiques peut être préconisée jusqu’à vingt et un jours (tableau 2), mais leur utilisation doit rester ponctuelle au cours de l’année, et les effets indésirables, notamment ceux des fluoroquinolones, doivent être pris en compte tout comme les risques d’émergence de résistances bactériennes.
Lors d’une prophylaxie secondaire, une évaluation clinique est indiquée à 24 semaines. Dans le cas d’une aggravation ou d’une stagnation de la maladie, elle peut être effectuée dès 12 semaines.
L’association de clindamycine et de rifampicine n’a pas été retenue dans ces recommandations en raison de :
- l’induction enzymatique sur le cytochrome P450 3A4 de la rifampicine qui entraîne alors un effondrement majeur des concentrations plasmatiques de clindamycine (baisse de 82 % des taux sanguins) ;22
- un risque d’émergence de résistances induites par ces molécules employées jusqu’alors à des tiers ou demi-doses de leur emploi en infectiologie ;23
- une méconnaissance des prescripteurs sur les modalités de prise à jeun de la rifampicine ;
- un faible niveau de preuve de cette combinaison qui, comme de nombreuses autres thérapies utilisées dans l’HS, ne sont fondées que sur des études d’observation.
Biothérapies
Lors de la rédaction de ces recommandations françaises, le seul traitement biologique accessible était l’infliximab (anti-TNF alpha) en perfusion intraveineuse à l’hôpital. L’autorisation de mise sur le marché (AMM) avait été obtenue en France pour l’adalimumab en sous-cutané dans le traitement de l’HS, mais son remboursement n’a été finalement accordé qu’en 2021.24
Depuis 2023, le sécukinumab, un anti-IL- 17, a reçu l’AMM pour son utilisation chez les patients atteints d’HS. Cette AMM repose sur une réponse clinique des patients à 16 semaines de 42 % et 45 % contre 31 % et 34 % sous placebo (p = 0,015 et p = 0,0022) dans les études SUNSHINE et SUNRISE respectivement.25 Ce traitement est remboursé depuis février 2024. Une réévaluation de l’indication de ces traitements après huit à douze mois est nécessaire en raison d’une perte d’efficacité relevée au long cours.
Dans l’état actuel des connaissances, l’étanercept et l’ustékinumab ne possèdent pas d’indication dans l’HS, mais des études restent en cours sur les anti-IL- 36, anti-IL- 23, anti-IL- 1 et anti-JAK.
Rétinoïdes
Les rétinoïdes paraissent plus spécifiquement indiqués dans les HS folliculaires (fig. 3 ou 3A).26,27 Certains experts recommandent plus précisément l’usage de l’acitrétine chez les hommes et de l’alitrétinoïne ou l’isotrétinoïne chez les femmes.
Traitement hormonal
Il n’est pas recommandé de prescrire une contraception pour le traitement de l’HS en l’absence de besoin contraceptif. Si des rechutes d’HS suivent les cycles menstruels et/ou s’il existe une suspicion de syndrome des ovaires polykystiques (SOPK) associé à l’HS, une consultation gynécologique ou endocrinologique doit être proposée pour envisager un traitement adapté par un spécialiste.28
Autres thérapeutiques
De nombreuses autres thérapeutiques ont fait l’objet de publications (corticostéroïdes intralésionnels, corticostéroïdes systémiques, dapsone, colchicine, tacrolimus, ciclosporine A, metformine, gluconate de zinc, gammaglobuline, fumarates, toxine botulique, résorcine et cryothérapie), mais le niveau de preuve reste insuffisant pour recommander leur usage.
Traitement par laser/luminothérapie
En tant que mesure préventive, l’épilation au laser pulsé long Nd :YAG pourrait être proposée.29
Chirurgie
Le groupe de travail recommande que le traitement chirurgical s’envisage systématiquement dans le cadre d’une coopération médico-chirurgicale.30 - 32
La chirurgie doit être présentée aux patients lors de la première consultation, car les traitements antibiotiques et biologiques n’ont qu’un effet suspensif.
Le choix du traitement chirurgical dépend de la présentation clinique :
- un abcès chaud inflammatoire récent nécessite une incision-drainage ou une ablation du toit de la lésion (deroofing) au punch pour permettre un soulagement immédiat des douleurs. En revanche, cela ne constitue pas un traitement définitif ;
- un nodule froid persistant ou des tractus sinueux peuvent faire l’objet soit d’une exérèse complète limitée avec suture directe, soit d’un deroofing large à type de marsupialisation suivie d’une cicatrisation dirigée ;
- enfin, devant un plastron cicatriciel, une exérèse large est proposée sous anesthésie générale avec une marge de sécurité de peau saine latérale (de 1 à 3 cm) et profonde. Une imagerie cutanée telle qu’une échographie peut ici être utile pour mieux visualiser les limites de la lésion.
Maladie chronique à prendre en charge au long cours
L’HS est une maladie chronique. Elle nécessite une prise en charge multidisciplinaire sur le long terme, prenant en compte à la fois la douleur, les différents traitements médicaux et chirurgicaux, la préservation de l’écologie microbienne et l’impact psychologique.
Le groupe ayant rédigé les recommandations : Prs Émilie Sbidian, Olivier Join-Lambert, Isabelle Bourgault-Villada, Éric Caumes, Pierre Perrot ; Drs Jean-François Sei, Micheline Moyal-Barracco, Nicole Jouan, Youri Yordanov et Sophie Sidorkiewicz, Karine Chazelas, Marie-France Bru-Daprés.
Les membres du centre de preuves en dermatologie : Prs Olivier Chosidow, Marie Beylot-Barry, Sébastien Barbarot, Guillaume Chaby, Pascal Joly, Nicolas Dupin, Bernard Guillot, Denis Jullien, Annabel Maruani, Manuelle Viguier ; Drs Florence Corgibet, Eve Pépin, Patricia Senet.
Les membres de la Haute Autorité de santé (HAS) : Gaëlle Fanelli, bibliothécaire de santé, pour son aide à nos recherches dans la littérature ; Drs Michel Laurence et Christine Revel-Delhom, pour leur soutien.
Les experts interrogés : Prs Hervé Bachelez, Marie-Aleth Richard ; Drs Olivier Cogrel, Philippe Guillem, Claire Hotz, Aude Nassif.
Le groupe de relecture : Drs Marc Bertocchi, Sophie Berville, Florence Corgibet, Germaine Gabison, Emmanuel Mahe, Pascale Perrin, Josefina Marco-Bonnet, Claire Sibon, Éric Tisserand (dermatologues) ; Clélia Coutzac (gastroentérologue) ; Aurélien Dinh, Adrien Lenaignen, Gentiane Monsel (infectiologues) ; Virginie Grouthier, Isabelle Heron, Marie Lambert (gynécologues) ; Radwan Kassir, Antoine Lafon, Marc Serra (chirurgiens) ; Pr David Saadoun (interniste).
2. Ingram JR, Jenkins-Jones S, Knipe DW, Morgan CLI, Cannings-John R, Piguet V. Population-based Clinical Practice Research Datalink study using algorithm modelling to identify the true burden of hidradenitis suppurativa. Br J Dermatol 2018;178:917–24.
3. Loget J, Saint-Martin C, Guillem P, Kanagaratnam L, Becherel P-A, Nassif A, et al. Misdiagnosis of hidradenitis suppurativa continues to be a major issue. The R-ENS Verneuil study. Ann Dermatol Venereol 2018;145:331–8.
4. McLellan C, Sisic M, Oon HH, Tan J. Preliminary validation of the HS-QoL: A quality-of-life measure for hidradenitis suppurativa. J Cutan Med Surg 2018;22:142–6.
5. Onderdijk AJ, van der Zee HH, Esmann S, Lophaven S, Dufour DN, Jemec GBE, et al. Depression in patients with hidradenitis suppurativa. J Eur Acad Dermatol Venereol JEADV 2013;27:473–8
6.Wang B, Yang W, Wen W, Sun J, Su B, Liu B, et al. Gamma-secretase gene mutations in familial acne inversa. Science 2010;330:1065.
7. Pink AE, Simpson MA, Desai N, Trembath RC, Barker JNW. γ-Secretase mutations in hidradenitis suppurativa: New insights into disease pathogenesis. J Invest Dermatol 2013;133:601–7.
8. Pan Y, Lin M-H, Tian X, Cheng H-T, Gridley T, Shen J, et al. Gamma-secretase functions through Notch signaling to maintain skin appendages but is not required for their patterning or initial morphogenesis. Dev Cell 2004;7:731–43.
9. Aubin-Houzelstein G. Notch signaling and the developing hair follicle. Adv Exp Med Biol 2012;727:142-60.
10. Zouboulis CC, Desai N, Emtestam L, Hunger RE, Ioannides D, Juhász I, et al. European S1 guideline for the treatment of hidradenitis suppurativa/acne inversa. J Eur Acad Dermatol Venereol 2015;29:619-44.
11. Guet-Revillet H, Jais J-P, Ungeheuer M-N, Coignard-Biehler H, Duchatelet S, Delage M, et al. The microbiological landscape of anaerobic infections in hidradenitis suppurativa: A prospective metagenomic study. Clin Infect Dis Off Publ Infect Dis Soc Am 2017;65:282-91.
12. Dauden E, Lazaro P, Aguilar MD, Blasco AJ, Suarez C, Marin I, et al. Recommendations for the management of comorbidity in hidradenitis suppurativa. J Eur Acad Dermatol Venereol 2018;32:129-44.
13. Haute Autorité de santé. Practice Guidelines. Clinical practice guidelines. Methodology for guideline development. 2015 http://www.has-sante.fr/portail/jcms/c_2040454/en/methodology-for-guideline-
14. Bertolotti A, Sbidian E, Join-Lambert O, Bourgault-Villada I, Moyal-Barracco M, Perrot P, et al. Guidelines for the management of hidradenitis suppurativa: Recommendations supported by the Centre of Evidence of the French Society of Dermatology. Br J Dermatol 2021;184(5):963-5.
15. Bertolotti A, Sbidian E, Join-Lambert O, Bourgault-Villada I, Moyal-Barracco M, Perrot P, et al. Recommandations françaises sur la prise en charge de l’hidradénite suppurée. Ann Derm Venereol – FMC 2022;2(3):170-82.
16. Canoui-Poitrine F, Le Thuaut A, Revuz JE, Viallette C, Gabison G, Poli F. Identification of three hidradenitis suppurativa phenotypes: Latent class analysis of a cross-sectional study. J Invest Dermatol 2013;133(6):1506-11.
17. Tzellos T, Zouboulis CC, Gulliver W, Cohen AD, Wolkenstein P, Jemec GBE. Cardiovascular disease risk factors in patients with hidradenitis suppurativa: A systematic review and meta-analysis of observational studies. Br J Dermatol 2015;173:1142-55.
18. Denny G, Anadkat MJ. The effect of smoking and age on the response to first-line therapy of hidradenitis suppurativa: An institutional retrospective cohort study. J Am Acad Dermatol 2017;76:54-9.
19. Crowley JJ, Mekkes JR, Zouboulis CC, Scheinfeld N, Kimball A, Sundaram M, et al. Association of hidradenitis suppurativa disease severity with increased risk for systemic comorbidities. Br J Dermatol 2014;171(6):1561-5.
20. Gener G, Canoui-Poitrine F, Revuz JE, Faye O, Poli F, Gabison G, et al. Combination therapy with clindamycin and rifampicin for hidradenitis suppurativa: A series of 116 consecutive patients. Dermatol Basel Switz 2009;219:148-54.
21. van der Zee HH, Boer J, Prens EP, Jemec GBE. The effect of combined treatment with oral clindamycin and oral rifampicin in patients with hidradenitis suppurativa. Dermatol Basel Switz 2009;219:143-7.
22. Join-Lambert O, Ribadeau-Dumas F, Jullien V, Kitzis M-D, Jais J-P, Coignard-Biehler H, et al. Dramatic reduction of clindamycin plasma concentration in hidradenitis suppurativa patients treated with the rifampin-clindamycin combination. Eur J Dermatol 2014;24:94-5.
23. Albrecht J, Mehta S, Bigby M. Development of resistance to Mycobacterium tuberculosis is manageable in hidradenitis suppurativa. Response to “Treatment of hidradenitis suppurativa with rifampicin: Have we forgotten tuberculosis?” Br J Dermatol 2018;178:300.
24. Kimball AB, Okun MM, Williams DA, Gottlieb AB, Papp KA, Zouboulis CC, et al. Two phase 3 trials of adalimumab for hidradenitis suppurativa. N Engl J Med 2016;375:422-34.
25. Kimball AB, Jemec GBE, Alavi A, Reguiai Z, Gottlieb AB, Bechara FG, et al. Secukinumab in moderate-to-severe hidradenitis suppurativa (SUNSHINE and SUNRISE): Week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet 2023;401(10378):747-61.
26. Soria A, Canoui-Poitrine F, Wolkenstein P, Poli F, Gabison G, Pouget F, et al. Absence of efficacy of oral isotretinoin in hidradenitis suppurativa: A retrospective study based on patients’ outcome assessment. Dermatol Basel Switz 2009;218:134-5.
27. Boer J, Nazary M. Long-term results of acitretin therapy for hidradenitis suppurativa. Is acne inversa also a misnomer? Br J Dermatol 2011;164:170-5.
28. Kraft JN, Searles GE. Hidradenitis suppurativa in 64 female patients: Retrospective study comparing oral antibiotics and antiandrogen therapy. J Cutan Med Surg 2007;11:125-31.
29. Xu LY, Wright DR, Mahmoud BH, Ozog DM, Mehregan DA, Hamzavi IH. Histopathologic study of hidradenitis suppurativa following long-pulsed 1064-nm Nd: YAG laser treatment. Arch Dermatol 2011;147:21-8.
30. Alharbi Z, Kauczok J, Pallua N. A review of wide surgical excision of hidradenitis suppurativa. BMC Dermatol 2012;12:9.
31. van der Zee HH, Prens EP, Boer J. Deroofing: A tissue-saving surgical technique for the treatment of mild to moderate hidradenitis suppurativa lesions. J Am Acad Dermatol 2010;63:475-80.
32. van Rappard DC, Mooij JE, Mekkes JR. Mild to moderate hidradenitis suppurativa treated with local excision and primary closure. J Eur Acad Dermatol Venereol 2012;26:898-902.