Le dépistage des dysthyroïdies est en hausse, mais elles sont probablement surdiagnostiquées. Les algorithmes de prise en charge sont maintenant bien codifiés, ce qui permet d’éviter les examens et traitements inutiles. Les indices cliniques et les antécédents du patient tendent à révéler les causes et orientent le diagnostic.
Les dysthyroïdies sont fréquentes chez l’adulte. En Europe, une méta-analyse a estimé la prévalence de l’hyperthyroïdie à 0,75 % de la population (femmes et hommes confondus), avec une incidence de 0,51 cas pour 1 000 personnes par an. La prévalence européenne de l’hypothyroïdie, quant à elle, se situe entre 0,2 et 5,3 % (selon la définition utilisée) avec une incidence de 0,6 cas pour 1 000 hommes et 5 cas pour 1 000 femmes par an.1
Depuis une dizaine d’années, les études épidémiologiques montrent une augmentation de la prévalence des dysthyroïdies. Elle est probablement liée, en particulier dans les pays développés, à l’accroissement des prescriptions du dosage de la thyroid-stimulating hormone (TSH, ou thyréostimuline), entraînant un nombre important de surdiagnostics, donc de traitements par excès.
En effet, un taux de TSH anormal (selon les seuils du laboratoire) n’est pas forcément synonyme de dysthyroïdie : les valeurs de référence peuvent différer selon les populations, l’état de santé et l’âge du patient, par exemple ; par ailleurs, les variations de cette hormone sont fréquentes au cours de la phase aiguë d’une pathologie non thyroïdienne, sans pour autant être pathologiques.
Hormis les cas exceptionnels du coma hypothyroïdien ou de la cardiothyréose sévère dont les diagnostics sont le plus souvent posés en service de réanimation, les anomalies de la fonction thyroïdienne ne nécessitent que très rarement une prise en charge urgente. Il est donc préférable de différer le dosage de la TSH dans des situations aiguës où la suspicion de dysthyroïdie est faible. Enfin, si un premier dosage de TSH est anormal, il doit toujours être contrôlé par un deuxième dosage après quelques jours ou semaines.
Quand évoquer une dysthyroïdie ?
Le dépistage systématique de la dysthyroïdie dans la population générale n’est pas recommandé en l’absence de signes cliniques évocateurs.2
Hypothyroïdie : la clinique peu fiable ?
La symptomatologie de l’hypothyroïdie varie en fonction des personnes, de sa cause, de sa durée et de sa sévérité. Généralement, un ralentissement global de l’activité physique et mentale est observé, conduisant aux symptômes les plus fréquents que sont la fatigue, la frilosité, la constipation, la peau sèche et la modification de la voix (
La spécificité individuelle des symptômes est faible ; c’est plutôt une association de plusieurs signes qui fait suspecter une hypothyroïdie – sans toutefois une meilleure performance diagnostique. En effet, il a été rapporté que 15 % des patients avec une hypothyroïdie avérée n’exprimaient qu’un seul symptôme, voire aucun, alors que plus de 70 % des sujets contrôles exprimaient au moins un symptôme pouvant faire évoquer une hypothyroïdie.3
Thyrotoxicose : pas toujours synonyme d’hyperthyroïdie
En premier lieu, il est nécessaire de différencier la thyrotoxicose, qui correspond aux manifestations cliniques d’un excès d’hormones thyroïdiennes quelle qu’en soit sa cause, et l’hyperthyroïdie, qui suggère que la thyrotoxicose observée est liée à un hyperfonctionnement thyroïdien (
La symptomatologie de la thyrotoxicose, comme celle de l’hypothyroïdie, est aspécifique. Certains signes sont néanmoins évocateurs : perte de poids, agitation psychomotrice, tachycardie, voire troubles du rythme, et troubles de l’humeur. Un examen cardiovasculaire clinique avec une évaluation du rythme cardiaque est alors recommandé, et des explorations complémentaires peuvent être nécessaires selon les antécédents du patient. Des signes oculaires (inflammation des paupières, exophtalmie...) doivent être recherchés. Leur présence est clairement évocatrice de maladie de Basedow et peut suffire au diagnostic étiologique.
Situations pouvant faire craindre une dysthyroïdie
Plusieurs situations spécifiques doivent faire rechercher une dysthyroïdie sous-jacente. Ainsi, une arythmie cardiaque par fibrillation atriale (ACFA) de novo ou des troubles du rythme cardiaque doivent faire rechercher une hyperthyroïdie en cause.
De même, l’instauration de certains traitements (amiodarone, lithium) nécessite la recherche préalable d’une dysthyroïdie qui pourrait être précipitée par leur prise.
Enfin, la mise en évidence d’un nodule ou d’un goitre thyroïdien doit également faire rechercher une dysthyroïdie sous-jacente.
Hyper- et hypothyroïdie : place de la biologie dans la démarche diagnostique
Lorsque la clinique ou la situation est évocatrice d’hypothyroïdie ou d’hyperthyroïdie, poser le diagnostic et en chercher la cause passe par une démarche simple et bien codifiée.
En cas de suspicion d’hypothyroïdie
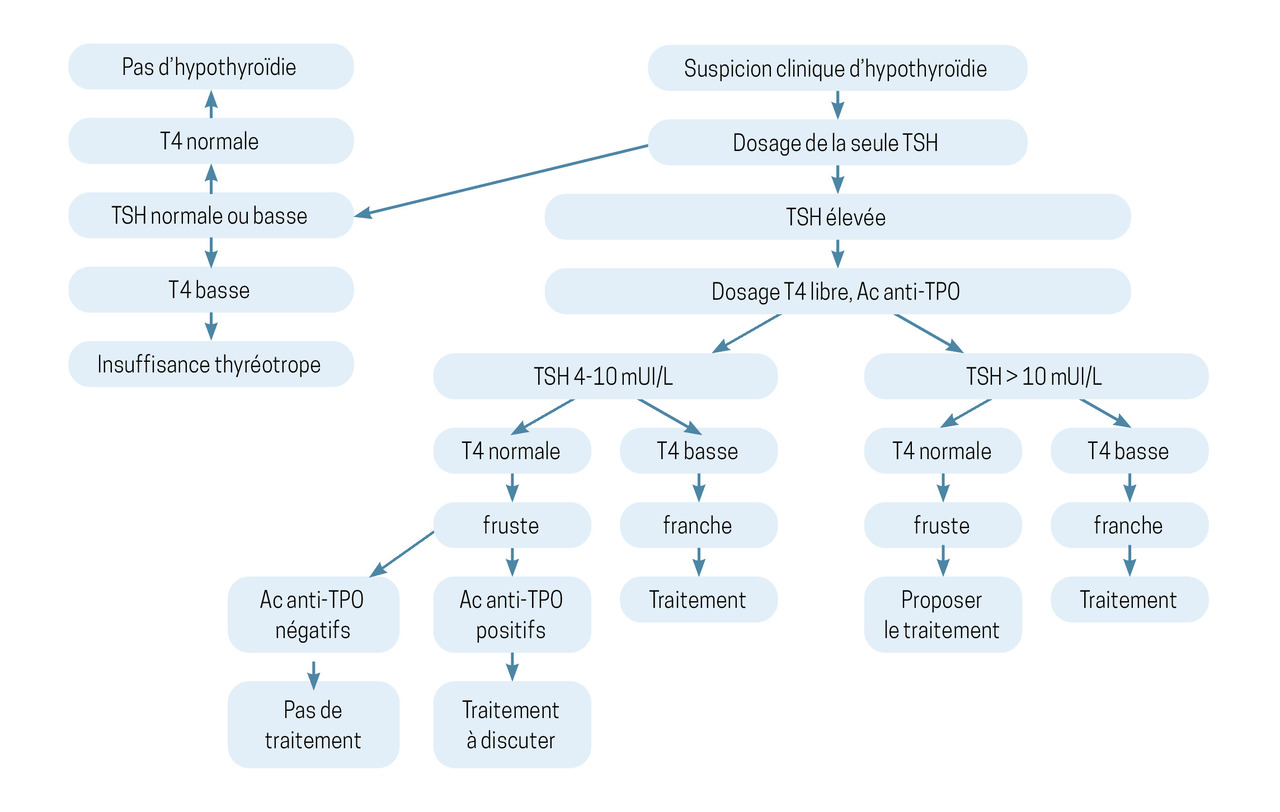
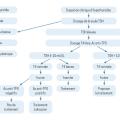
Si l’interrogatoire et l’examen clinique font suspecter une hypothyroïdie, il est recommandé de prescrire en première intention uniquement le dosage sanguin de la TSH. Plusieurs situations sont alors possibles (
Si le dosage de la TSH est normal
Dans ce cas, aucun examen complémentaire n’est nécessaire (en dehors des rares situations d’insuffisance thyréotrope qui nécessiteraient un dosage de la thyroxine libre [T4L]), et un dosage de contrôle n’est justifié qu’en cas de modification clinique.
Si le taux de TSH est élevé
Dans ce cas, un dosage de la T4L doit être demandé, permettant de distinguer deux situations :
– 4 mUI/L < TSH < 10 mUI/L et T4L normale, correspondant à une hypothyroïdie fruste, aussi appelée infraclinique ;
– TSH élevée (> 10 mUI/L) et T4L basse correspondant à une hypothyroïdie avérée ou franche.
Les seuils de TSH indiqués sont usuels et donnés à titre indicatif. Ils ne doivent pas être perçus comme une valeur absolue conduisant au basculement d’un état « euthyroïdien » à un état « hypothyroïdien ». Ce sont l’examen clinique et la singularité du patient qui doivent orienter la prise en charge.
En cas de TSH élevée, le dosage des anticorps antithyropéroxydase (TPO) peut être également réalisé. S’il est positif, il oriente vers un diagnostic de thyroïdite auto-immune, cause la plus fréquente des hypothyroïdies. Il n’est jamais nécessaire de contrôler le titre des anticorps, car il n’est pas corrélé à l’évolution clinico-biologique.4
Aucun autre dosage n’est nécessaire
Le plus souvent, aucun autre examen n’est utile au diagnostic des patients hypothyroïdiens :
– le dosage de la thyroglobuline et des anticorps anti-thyroglobuline n’est pas utile en cas d’hypothyroïdie primaire ; il est réservé au suivi des néoplasies thyroïdiennes opérées ;
– le dosage de la tri-iodothyronine (T3) ne doit pas être demandé dans les situations cliniques banales ; son interprétation peut être difficile et conduire à un surtraitement ;
– en l’absence d’anomalie à la palpation thyroïdienne (nodule thyroïdien, adénopathie cervicale) et en présence d’un tableau clinique et biologique d’hypothyroïdie, il n’est pas recommandé de réaliser d’échographie thyroïdienne : aucun critère échographique ne permet d’affirmer le diagnostic ni sa cause. Si, en cas de thyroïdite, il est possible d’observer une hypertrophie glandulaire avec une hétérogénéité parenchymateuse (stigmates de l’atteinte inflammatoire), ces éléments n’ont pas de caractère pronostique.
Hyperthyroïdie : sévérité et causes à déterminer
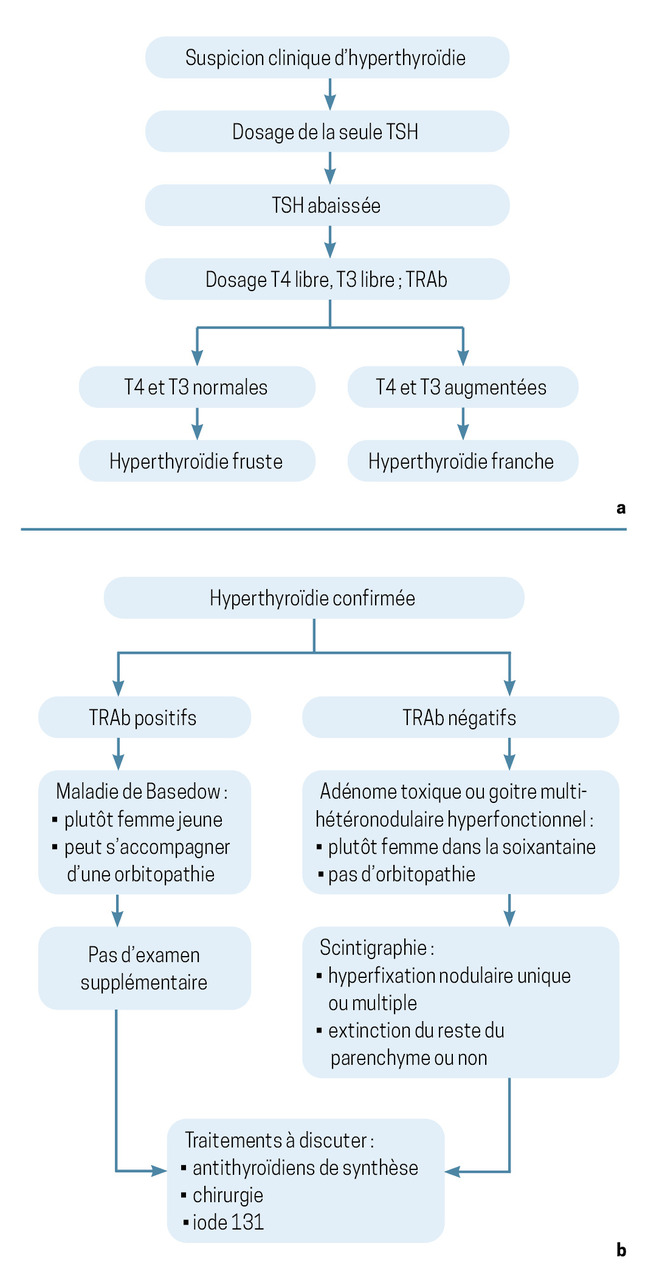
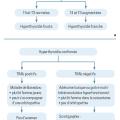
Le dosage de la TSH est nécessaire en première intention dans le cas d’une suspicion d’hyperthyroïdie. Sa diminution confirme le diagnostic et doit amener à la réalisation d’un bilan complémentaire.
Fruste ou avérée ?
Le dosage de la thyroxine, ou T4 (et éventuellement T3 si la T4 est normale, à la recherche d’une hyperthyroïdie à T3), permet de juger de la sévérité de l’hyperthyroïdie.
Elle est qualifiée de fruste ou d’infraclinique si les hormones thyroïdiennes sont normales. Elle est franche ou avérée si elles sont augmentées (
Anticorps antirécepteurs de la TSH, élément essentiel du diagnostic étiologique
Les causes les plus fréquentes d’hyperthyroïdie sont la maladie de Basedow, le goitre multi-hétéronodulaire hyperfonctionnel et l’adénome toxique ou nodule hyperfonctionnel (
Le résultat du dosage des anticorps antirécepteurs de la TSH (TRAb pour TSH receptor antibodies) permet d’orienter le diagnostic étiologique.
Leur positivité est pathognomonique de la maladie de Basedow et suffit à son diagnostic. Il s’agit d’auto-anticorps reconnaissant la partie extracellulaire du récepteur de la TSH des cellules thyroïdiennes, et capables de l’activer comme le ferait la TSH. Il en résulte un état d’activation permanente et dérégulée des cellules thyroïdiennes. Il n’est pas nécessaire de réaliser une échographie ni une scintigraphie thyroïdienne.
En revanche, la scintigraphie doit être réalisée en cas de négativité des anticorps. Elle permet de rechercher une ou plusieurs hyperfixations focales et nodulaires, qui posent le diagnostic d’adénome toxique (nodule hyperfonctionnel isolé) ou de goitre multi-hétéronodulaire toxique (GMNT).
La négativité des anticorps antirécepteurs de la TSH et une scintigraphie blanche doivent faire rechercher à l’interrogatoire une surcharge iodée (injection de produit de contraste iodé dans les 6 derniers mois ou prise d’amiodarone essentiellement) ou, plus rarement, une thyroïdite de De Quervain (thyroïdite survenant dans un contexte de virose avec goitre douloureux, syndrome grippal et augmentation de la protéine C-réactive [CRP]).
Faut-il traiter toutes les dysthyroïdies ?
La lévothyroxine est indiquée dans l’hypothyroïdie, mais la mise en place et les modalités du traitement doivent être ajustées en fonction des contrôles de la TSH. Dans le cadre d’une hyperthyroïdie, plusieurs traitements sont possibles, selon sa cause : antithyroïdiens de synthèse, iode 131 et chirurgie.
Hypothyroïdie : maintenir l’équilibre
L’objectif du traitement substitutif est ici de maintenir la TSH dans l’intervalle de référence et de permettre la disparition des symptômes.
Traitement substitutif à réévaluer régulièrement
La substitution hormonale par lévothyroxine per os à une dose de 1,5 à 1,8 µg/kg est le traitement indiqué en cas d’hypothyroïdie. Les formes galéniques combinant lévothyroxine (T4) et tri-iodothyronine (T3) n’ont pas fait la preuve de leur intérêt.
Un contrôle de la TSH doit être réalisé huit à douze semaines après l’instauration du traitement ou en cas de modification de posologie, puis à six mois et de manière annuelle en même temps qu’un examen clinique. Il n’y a pas lieu de doser à nouveau les hormones thyroïdiennes ou les anticorps antithyropéroxydase une fois le diagnostic posé et le traitement instauré.
La prise de lévothyroxine doit se faire de préférence le matin à jeun, avec un verre d’eau et au moins trente minutes avant de s’alimenter ou de prendre tout autre médicament. En effet, son absorption peut en être significativement altérée, et l’équilibre hormonal difficile à atteindre. En cas de déséquilibre inexpliqué, ces règles doivent être rappelées au patient.
Quand l’instaurer ?
Lorsque l’hypothyroïdie est franche (tableau clinique évocateur, TSH élevée, T4 basse), l’introduction d’un traitement est indiscutable. L’hypothyroïdie infraclinique reste à ce jour une anomalie biologique de signification clinique indéterminée. Il est nécessaire, dans ce cas, de réévaluer le taux de TSH six à douze semaines après le premier dosage et à distance de tout événement clinique, la TSH se corrigeant le plus souvent naturellement. Il devient alors inutile de répéter le dosage en l’absence de modification clinique. La littérature ne fait état, à ce jour, d’aucune donnée montrant un bénéfice à la substitution systématique des hypothyroïdies infracliniques. Ainsi, une étude prospective norvégienne n’a pas montré de différence clinique (performances cognitives et symptômes d’hypothyroïdie) entre une population euthyroïdienne et des personnes en hypothyroïdie infraclinique (TSH < 10 mUI/L), même après normalisation de la TSH sous traitement par lévothyroxine.5 Une méta-analyse de 2018 n’a pas montré de bénéfice clinique (qualité de vie et symptômes liés à l’hypothyroïdie) après traitement d’une hypothyroïdie infraclinique, malgré une diminution de la TSH.6
Il est généralement admis, quoique sans données étayées justifiant cette attitude, de débuter un traitement par lévothyroxine en cas de TSH persistante supérieure à 10 mUI/L, hormis chez le sujet âgé (
En cas de TSH augmentée mais inférieure à 10 mUI/L, un traitement n’est en général pas nécessaire d’emblée mais peut être discuté selon la situation de chaque patient. La positivité des anticorps anti-TPO peut être, ici, considérée comme un marqueur de risque de développer une hypothyroïdie franche et peut participer à la décision d’introduire un traitement.
Hyperthyroïdie : prise en charge individualisée
Les objectifs du traitement de l’hyperthyroïdie sont multiples : contrôler des symptômes, prévenir les complications, tenter de restaurer une euthyroïdie tout en évitant l’hypothyroïdie iatrogène. L’équilibre entre ces objectifs dépend de l’origine de l’hyperthyroïdie, de l’âge et des comorbidités du patient. De manière générale, une prise en charge en fonction de la cause de l’hyperthyroïdie est nécessaire, et un avis spécialisé peut faciliter la prise de décision.
Traiter en fonction de la cause
Pour une hyperthyroïdie avérée, trois types de traitement sont indiqués :
Les antithyroïdiens de synthèse, ou ATS (méthimazole, carbimazole, propylthiouracile), inhibent la fonction thyroïdienne, avec un effet qui dépend de la dose. La diminution des hormones thyroïdiennes s’observe en quelques semaines (selon l’augmentation initiale) et nécessite un suivi régulier. Un hémogramme hebdomadaire est nécessaire les six premières semaines afin de ne pas négliger une agranulocytose toxique. Rare, avec une incidence de 0,4 % en moyenne (proportionnelle à la posologie), le patient doit être informé de sa survenue possible, avec des consignes simples : nécessité de réaliser un hémogramme en urgence et de consulter en cas de fièvre ou d’infection ORL. Sa survenue est plus fréquente en cas de dose importante et en début de traitement, mais elle peut survenir à tout moment lors du traitement. La surveillance du bilan hépatique n’est pas obligatoire mais il peut être réalisé toutes les deux semaines durant les deux premiers mois de traitement. Chez les femmes en âge de procréer, une contraception efficace est nécessairement proposée, vu le risque tératogène des ATS.
Le traitement par iode 131 équivaut à une radiothérapie interne vectorisée : une gélule ou une solution d’iode 131 administrée per os est métabolisée par les cellules thyroïdiennes, qui sont ensuite détruites par le rayonnement bêta émis par cet isotope. Ce traitement est réalisé en ambulatoire car il ne nécessite qu’une faible dose. Son efficacité est progressive sur plusieurs semaines et permet un retour à l’euthyroïdie. Toutefois, plusieurs effets indésirables sont possibles, dont l’hypothyroïdie définitive est le plus fréquent. Un traitement insuffisant peut évoluer vers une récidive.
La chirurgie est également envisageable : elle permet une guérison définitive tout en traitant une éventuelle problématique nodulaire. Il est toutefois nécessaire de prendre en considération les risques liés à l’anesthésie et à la chirurgie (notamment en cas de lésion parathyroïdienne ou récurrentielle) ainsi que l’éventualité d’un traitement substitutif définitif par lévothyroxine selon le type de chirurgie réalisé (exérèse totale ou partielle par lobo-isthmectomie, par exemple).
Cas particuliers : goitre multihétéronodulaire et nodule hyperfonctionnel
Dans le cas du goitre multihétéronodulaire (GMHN) ou du nodule hyperfonctionnel, le traitement par antithyroïdiens de synthèse n’est pas curatif. Il est utilisé en première ligne pour réduire les symptômes, éviter les complications et préparer le traitement curatif. Selon l’âge du patient, l’intensité de la fixation à la scintigraphie et la présence ou non d’autres nodules thyroïdiens, le traitement du nodule hyperfonctionnel unique peut être chirurgical ou par iode 131.
Le traitement du goitre multinodulaire hyperfonctionnel est le plus souvent chirurgical et permet à la fois de traiter la pathologie fonctionnelle et nodulaire.
Et pour la maladie de Basedow ?
Dans le cas de la maladie de Basedow, les trois traitements peuvent être discutés en première intention. Les pratiques françaises7 sont de proposer les antithyroïdiens de synthèse en première ligne (durant 12 à 18 mois) et un traitement chirurgical ou par iode 131 en cas d’échec ou de récidive. La Société française d’endocrinologie a rendu un consensus sur le diagnostic et la prise en charge de la maladie de Basedow en 2016.8
Cas de l’hyperthyroïdie fruste
Dans ce cas (TSH abaissée, hormones thyroïdiennes normales), les causes et les traitements sont inchangés. En revanche, leur temporalité et leurs indications sont discutées en fonction de la situation du patient en parallèle d’une surveillance clinico-biologique.
Quand le traitement est-il inutile ?
Le traitement par lévothyroxine est réservé aux situations d’hypothyroïdie (clinique et biologique). Ainsi, il n’est pas nécessaire de traiter un patient avec une symptomatologie, même très évocatrice, mais dont le bilan hormonal est normal. Il n’est pas non plus utile dans le cas de nodules thyroïdiens puisqu’il n’en modifie pas l’histoire naturelle. Concernant les goitres non nodulaires, certaines études ont montré un bénéfice modéré et transitoire du traitement (qui disparaît en quelques mois après son arrêt) sur le volume du goitre. Ce bénéfice a un intérêt clinique apparemment limité.
1. Dysthyroïdies et grossesse
Le dépistage d’une hypothyroïdie doit s’effectuer dans la mesure du possible en préconceptionnel en cas de facteur de risque (âge > 30 ans, anticorps anti-TPO positifs connus, thyroïdite auto-immune dans la famille).9 En effet, l’hypothyroïdie maternelle est un facteur de risque de fausse couche, d’hypertension artérielle gravidique, de troubles du développement embryonnaire, notamment neurologique, de mort fœtale in utero mais également de retard de croissance intra-utérin.
Le traitement est le même qu’en population générale. Une prise en charge spécialisée est cependant recommandée, d’autant plus si l’hypothyroïdie est infraclinique ou s’inscrit dans un contexte d’infertilité.
Il est important de rappeler que la TSH diminue physiologiquement lors du premier trimestre de grossesse en raison de la présence de bêta-HCG qui possède une activité TSH-like.
La majorité des cas d’hyperthyroïdies pathologiques pendant la grossesse sont la conséquence d’une maladie de Basedow, le plus souvent déjà traitée avant la grossesse mais pouvant également débuter ou récidiver pendant celle-ci. Le traitement repose sur les antithyroïdiens de synthèse à la posologie la plus faible possible ; le propylthiouracile est privilégié au premier trimestre de grossesse et le méthimazole ou carbimazole aux deux derniers trimestres.10 Les patientes ayant un antécédent de maladie de Basedow doivent bénéficier d’un dosage des anticorps antirécepteurs de la TSH avant la grossesse afin d’apprécier le niveau de sévérité initial ou le risque de récidive. Une information concernant le risque tératogène des antithyroïdiens de synthèse et de la nécessité, autant que faire se peut, de programmer la grossesse sont également indispensables. Un traitement chirurgical d’emblée peut être proposé selon les situations.
2. Dysthyroïdies et grand âge
Les dysthyroïdies de la personne âgée sont plus difficiles à déceler, du fait notamment d’un appauvrissement de la clinique et de l’absence de spécificité de la symptomatologie. De plus, de nombreuses pathologies aiguës ou chroniques peuvent être à l’origine de variations transitoires du niveau de TSH dans cette population. Cela rend inutile la recherche systématique d’une altération de la fonction thyroïdienne.
La Société française d’endocrinologie a recommandé en 2019 le dosage de la TSH chez les personnes âgées ayant une fibrillation atriale de novo, des troubles cognitifs, un syndrome dépressif d’apparition récente ou un tableau clinique évocateur.11 Aucun dosage de contrôle n’est néanmoins indiqué en l’absence de modification clinique.
Les valeurs de référence de la TSH varient avec l’âge. Si une limite basse unique à 0,4 mUI/L est admise pour tous, la limite supérieure de la normale (LSN) a tendance à augmenter avec l’âge : les seuils pragmatiques proposés sont la normale du laboratoire jusqu’à 69 ans inclus (5 mUI/L), 7 mUI/L à partir de 70 ans, 8 mUI/L à partir de 80 ans et au-delà.11
Des seuils de TSH différents de ceux de la population générale pour l’hypothyroïdie
Le vieillissement physiologique s’accompagne fréquemment d’une modification des niveaux de TSH (tendance à être plus élevés que dans une population plus jeune) sans que cela ne soit à considérer comme forcément pathologique.
En cas de suspicion d’hypothyroïdie, il est recommandé de doser uniquement la TSH et, en cas d’élévation de celle-ci (à interpréter selon l’âge du patient), de contrôler le résultat sur un deuxième prélèvement un à trois mois plus tard. Dans cette situation, aucun autre examen complémentaire n’est nécessaire.
• Si la TSH est > 20 mUI/L, un traitement substitutif est nécessaire.
• Si la TSH reste entre 10 et 20 mUI/L, le traitement substitutif est à discuter selon la situation clinique.
• Si la TSH est < 10 mUI/L, aucun traitement n’est préconisé.
L’introduction de la lévothyroxine doit se faire de manière prudente et progressive en cherchant à atteindre une cible d’environ 1,2 µg/kg, en particulier chez les patients avec des antécédents ou un risque cardiovasculaire élevé.
Privilégier l’iode 131 en cas d’hyperthyroïdie.
Les causes de la thyrotoxicose de la personne âgée sont très largement dominées par les goitres multinodulaires ou les nodules hyperfonctionnels.
L’exploration d’une hyperthyroïdie se fait, comme en population générale, par le dosage des anticorps antirécepteurs de la TSH et la réalisation d’une scintigraphie. L’échographie thyroïdienne n’est demandée qu’en cas d’anomalie à la palpation cervicale ou de bilan pré-thérapeutique (iode 131 notamment).
Concernant la prise en charge thérapeutique de l’hyperthyroïdie, les traitements à l’iode 131 doivent être privilégiés lorsqu’un traitement radical est nécessaire.
La prise prolongée d’antithyroïdiens de synthèse ne devrait être proposée que chez des patients âgés (ou ayant de nombreuses comorbidités) avec une espérance de vie limitée ou pour qui la chirurgie ou le traitement par iode 131 sont contre-indiqués.
Un risque de fibrillation atriale de novo a été associé à l’hyperthyroïdie fruste, d’autant plus lorsque le patient est âgé ;12 il n’a cependant pas encore été montré que le traitement réduit le risque de passage en fibrillation atriale. Les recommandations internationales pour la prise en charge de l’hyperthyroïdie fruste ne sont pas univoques. La Société française d’endocrinologie propose qu’elle soit personnalisée selon les comorbidités, le diagnostic étiologique, le niveau d’hyperthyroïdie et le choix du patient. Un avis endocrinologique spécialisé peut être demandé.
L’objectif thérapeutique est le maintien d’une TSH inférieure à la limite supérieure de la normale du laboratoire pour les patients de moins de 69 ans ; de 7 mUI/L pour les moins de 79 ans ; et de 8 mUI/L pour les patients les plus âgés.
Que dire à vos patients ?
• Les dysthyroïdies sont fréquentes, de faible gravité et ne nécessitent pas toujours un traitement immédiat.
• La symptomatologie étant aspécifique, les symptômes rapportés ne sont pas forcément en lien avec une anomalie du dosage de la TSH qui est bien souvent ponctuelle et dont le contrôle à distance peut montrer une normalisation spontanée.
• Le traitement d’une dysthyroïdie avérée ne permet pas toujours la correction de tous les symptômes ; la recherche d’autres pathologies peut être nécessaire.
1.Taylor PN, Albrecht D, Scholz A, et al. Global epidemiology of hyperthyroidism and hypothyroidism. Nat Rev Endocrinol 2018;14(5):301-16.
2. Haute Autorité de santé. Pertinence des soins hypothyroïdie. Outil d’amélioration des pratiques professionnelles. Mars 2019.
3. Carlé A, Pedersen IB, Knudsen N, et al. Hypothyroid symptoms and the likelihood of overt thyroid failure: a population-based case–control study. Eur J Endocrinol 2014;171(5):593-602.
4. Jonklaas J, Bianco AC, Bauer AJ, et al. Guidelines for the Treatment of Hypothyroidism: Prepared by the American Thyroid Association Task Force on Thyroid Hormone Replacement. Thyroid 2014;24(12):1670-751.
5. Engum A, Bjøro T, Mykletun A, et al. An association between depression, anxiety and thyroïd function. A clinical fact or an artefact ? Act Psychiatr Scand 2002;106(1):27-34.
6. Feller M, Snel M, Moutzouri E, et al. Association of Thyroid Hormone Therapy With Quality of Life and Thyroid-Related Symptoms in Patients With Subclinical Hypothyroidism: A Systematic Review and Meta-analysis. JAMA 2018;320(13):1349.
7. Goichot B, Bouee S, Castello-Bridoux C, et al. Survey of Clinical Practice Patterns in the Management of 992 Hyperthyroid Patients in France. Eur Thyroid J 2017;6(3):152-9.
8. Goichot B, Leenhardt L, Massart C, et al. Diagnostic procedure in suspected Graves’ disease. Ann Endocrinol (Paris) 2018;79(6):608-17.
9. Stagnaro-Green A, Abalovich M, Alexander E, et al.Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011;21(10):1081-1125.
10. Illouz F, Luton D, Polak M, et al. Graves’ disease and pregnancy. Ann Endocrinol (Paris) 2018;79(6):636-46.
11. Goichot B, Raverot V, Klein M, et al. Management of thyroid dysfunctions in the elderly. French Endocrine Society consensus 2019 guidelines. Short version. Ann Endocrinol (Paris) 2020;81(5):511-5.
12. Cooper DS, Biondi B. Subclinical thyroid disease. Lancet 2012; 379(9821):1142-54.

 Encadrés
Encadrés