Dans les infarctus étendus du territoire de l’artère cérébrale moyenne, la lésion cérébrale peut se comporter comme un processus expansif refoulant les structures de voisinage en raison du volume important de l’infarctus et de l’œdème qu’il engendre. La compression secondaire des artères cérébrales antérieures et postérieures sur des structures intracrâniennes fixes (faux du cerveau, tente du cervelet) contribue à l’extension de l’ischémie dans d’autres territoires, tandis que la compression des veines corticales auto-entretient l’œdème. Le décès survient entre le 2e et le 5e jour dans plus de 70 % des cas, par compression du tronc cérébral sur la tente du cervelet.1
Diagnostic
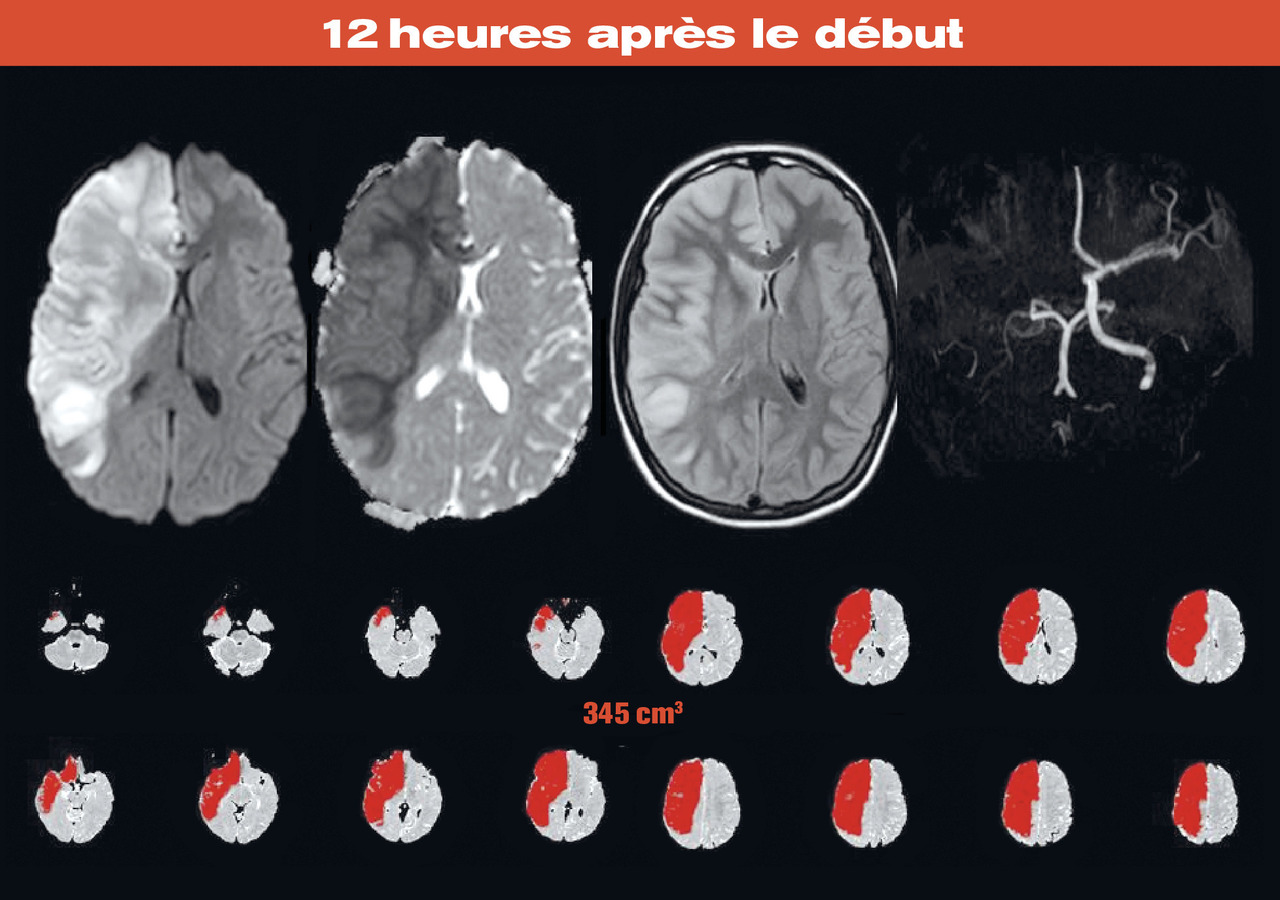
Les infarctus étendus du territoire de l’artère cérébrale moyenne sont responsables d’un déficit neurologique sévère dès l’admission, avec un score à la National Institute of Health Stroke Scale supérieur à 15. Des phénomènes d’autorégulation permettent pendant longtemps le maintien d’une pression intracrânienne normale, mais la décompensation est ensuite rapide, voire brutale. Cela explique que la prise de pression intracrânienne comme outil de dépistage de l’infarctus malin soit inutile,2 car son élévation est tardive et brutale. La destruction secondaire de structures cérébrales initialement épargnées par l’infarctus définit l’infarctus malin. C’est l’imagerie cérébrale qui est le meilleur prédicteur d’évolution maligne. Un volume d’anomalie de diffusion supérieur à 145 cm³ dans les 24 à 48 premières heures est associé à un risque très élevé d’évolution maligne.3 En présence d’une contre-indication à l’imagerie par résonance magnétique (IRM), la tomodensitométrie cérébrale permet aussi de prédire l’évolution maligne en présence de signes d’infarctus touchant plus des deux tiers du territoire de l’artère cérébrale moyenne.
La présentation classique est donc celle d’un patient de moins de 60 ans, dont le tableau clinique initial est sévère mais avec une vigilance longtemps préservée, et dont l’infarctus cérébral est étendu (plus de 145 cm3 d’anomalie de diffusion en IRM), en rapport avec une occlusion de la terminaison de la carotide interne ou plus rarement territoire proximal de M1 (fig. 1 ). Certains de ces patients ont reçu tout l’arsenal thérapeutique disponible en phase aiguë (thrombolyse, thrombectomie), sans succès, alors que d’autres ont été admis hors délai pour les mesures de recanalisation.
La présentation classique est donc celle d’un patient de moins de 60 ans, dont le tableau clinique initial est sévère mais avec une vigilance longtemps préservée, et dont l’infarctus cérébral est étendu (plus de 145 cm3 d’anomalie de diffusion en IRM), en rapport avec une occlusion de la terminaison de la carotide interne ou plus rarement territoire proximal de M1 (
Traitement : chirurgie préventive de décompression
Les traitements médicaux conservateurs n’ont pas d’intérêt, d’une part parce qu’ils n’ont jamais été démontrés efficaces ou n’ont pas été évalués, et d’autre part parce que, de nos jours la stratégie de première intention est l’hémicraniectomie dès que les critères de prédiction d’évolution vers la malignité sont présents.
Technique chirurgicale
L’objectif de l’hémicraniectomie est de permettre au tissu cérébral œdématié de s’étendre en dehors du crâne, sans refouler la ligne médiane et le ventricule latéral.4 La normalisation de la pression intracrânienne permet alors d’améliorer le débit sanguin cérébral et la pression de perfusion, aboutissant à une meilleure oxygénation du tissu cérébral.
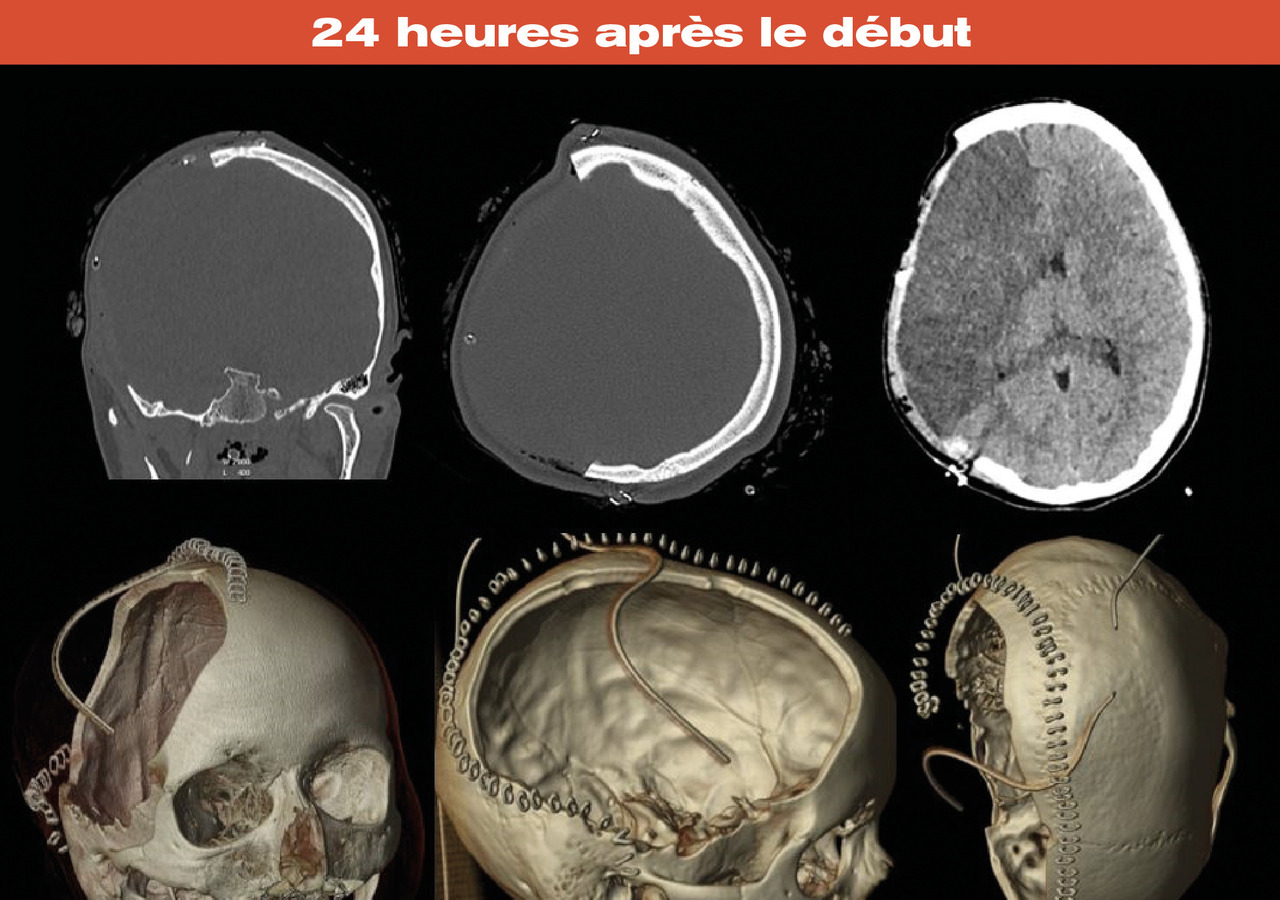
La chirurgie décompressive consiste en une hémicraniectomie large (fig. 2 ) associée à une ouverture de la dure-mère et une plastie durale. Un volet de taille insuffisante peut favoriser des thromboses veineuses sur la marge du volet, aggravant l’œdème.5 Il ne faut pas pratiquer de résection de tissu cérébral.4 La remise en place du volet, ou éventuellement une cranioplastie, sera effectuée dans un délai de 3 à 6 mois après l’intervention.
La chirurgie décompressive consiste en une hémicraniectomie large (
Essais cliniques randomisés
À la suite des résultats prometteurs d’études animales, et de petites séries observationnelles non randomisées, trois essais européens ont été menés. Leurs résultats ont été publiés d’emblée sous forme de méta-analyse.1 Ils ont montré une réduction importante de la mortalité chez les patients opérés, sans augmentation de la dépendance complète (classe 5 de Rankin), mais au prix d’une augmentation significative de la dépendance sévère (classe 4 de Rankin). Il suffit d’opérer 2 patients pour avoir un survivant avec un Rankin < 4 supplémentaire, et 4 patients pour avoir un survivant supplémentaire avec un Rankin < 3 (c’est-à-dire capable de marcher avec aide).1
Si ces résultats ont été une avancée majeure dans la prise en charge des infarctus étendus du territoire de l’artère cérébrale moyenne, il convient toutefois d’avoir une analyse plus nuancée concernant le bénéfice fonctionnel. En effet, un Rankin modifié à 4, considéré comme un résultat favorable dans les essais, est néanmoins un handicap sévère, avec une incapacité à marcher sans aide et à gérer seul certains besoins essentiels comme faire sa toilette, aller aux toilettes, et s’alimenter. Les familles doivent être prévenues avant la chirurgie* que l’amélioration majeure du pronostic vital a pour prix un risque de handicap. Elles doivent aussi être prévenues que les récupérations de bonne qualité (Rankin modifié 0 à 2) sont rares, mais 3 fois plus fréquentes que sans chirurgie.
Si les caractéristiques initiales de l’infarctus, en particulier le volume, prédisent la mortalité à 1 mois après hémicraniectomie, le pronostic vital et fonctionnel à 1 an dépend principalement de l’état préalable du patient, un âge plus élevé et une consommation excessive de boissons alcoolisées étant les deux principaux facteurs de mauvais pronostic.6
Si ces résultats ont été une avancée majeure dans la prise en charge des infarctus étendus du territoire de l’artère cérébrale moyenne, il convient toutefois d’avoir une analyse plus nuancée concernant le bénéfice fonctionnel. En effet, un Rankin modifié à 4, considéré comme un résultat favorable dans les essais, est néanmoins un handicap sévère, avec une incapacité à marcher sans aide et à gérer seul certains besoins essentiels comme faire sa toilette, aller aux toilettes, et s’alimenter. Les familles doivent être prévenues avant la chirurgie* que l’amélioration majeure du pronostic vital a pour prix un risque de handicap. Elles doivent aussi être prévenues que les récupérations de bonne qualité (Rankin modifié 0 à 2) sont rares, mais 3 fois plus fréquentes que sans chirurgie.
Si les caractéristiques initiales de l’infarctus, en particulier le volume, prédisent la mortalité à 1 mois après hémicraniectomie, le pronostic vital et fonctionnel à 1 an dépend principalement de l’état préalable du patient, un âge plus élevé et une consommation excessive de boissons alcoolisées étant les deux principaux facteurs de mauvais pronostic.6
En pratique
Il est recommandé7 d’utiliser la survenue de signes précoces d’ischémie sur l’imagerie comme critère de prédiction d’infarctus malin, et de pratiquer une hémicraniectomie préventive dès que ces critères sont réunis. Il y a un certain consensus pour fixer le seuil déclenchant l’hémicraniectomie à plus de 145 cm3 avant la 24e heure chez les patients de moins de 60 ans. Ce seuil est à interpréter en fonction du délai. Après 60 ans, il ne faut pas exclure de principe sur le seul âge l’indication d’une hémicraniectomie, mais il faut prendre en compte le fait que l’hémicraniectomie gardera son efficacité sur la réduction de mortalité mais pas sur le handicap, qui restera sévère,8 et tenir compte du terrain sous-jacent.
Quelques questions en suspens
Quel timing optimal pour la chirurgie ?
Sur la base de ces essais, la comparaison chirurgie précoce versus chirurgie différée montre que le bénéfice est plus important avec la chirurgie précoce, dans les 24 premières heures. Il n’est donc pas recommandé d’attendre dès lors que le patient a les critères prédictifs d’évolution maligne, même si les essais ont montré un bénéfice jusqu’à 48 heures, car le bénéfice se réduit au fil du temps.
Faut-il tenir compte du côté dans la décision ?
Cette controverse reposait sur le fait que garder une aphasie altérerait plus la qualité de vie que de garder un syndrome de l’hémisphère non dominant. Ce critère de sélection n’est pas approprié et n’apparaît pas dans les recommandations.
Y a-t-il une place pour une stratégie « wait and see » ?
Une stratégie qui consisterait à attendre une aggravation clinique pour poser l’indication d’une hémicraniectomie n’est pas appropriée, car lorsque l’aggravation survient, l’hémicraniectomie n’est plus efficace, et son indication devient très discutable.
Traitement préventif
Le dépistage précoce des patients à risque d’infarctus malin sur des critères radiologiques liés au volume d’infarctus permet la réalisation précoce d’une hémicraniectomie décompressive préventive des complications de l’infarctus malin. Les deux messages importants sont que l’hémicraniectomie décompressive n’est pas un traitement de l’infarctus malin, mais un traitement préventif de ses complications chez des patients qui n’ont pas encore d’infarctus malin mais sont à haut risque ; et que l’hémicraniectomie décompressive n’est efficace que si elle est large.
* La question des directives anticipées ne se pose pas pour les patients de moins de 60 ans (immense majorité des cas) : d’une part il est rare que des personnes de moins de 60 ans en bonne santé préalable rédigent des directives anticipées, d'autre part le niveau de preuve est très élevé. Elle peut se poser entre 60 et 70 ans car les séquelles sont en général très lourdes.
Références
1. Vahedi K, Hofmeijer J, Jüttler E, et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomised controlled trials. Lancet Neurol 2007;6:215-22.
2. Hacke W, Schwab S, Horn M, et al. ‘Malignant’ middle cerebral artery territory infarction: clinical course and prognostic signs. Arch Neurol 1996;53:309-15.
3. Oppenheim C, Samson Y, Manai R, et al. Prediction of malignant middle cerebral artery infarction by diffusion-weighted imaging. Stroke 2000;31:2175-81.
4. Diedler J, Sykora M, Blatow M, et al. Decompressive surgery for severe brain edema. J Intensive Care Med 2009;24:168-78.
5. Wagner S, Schnippering H, Aschoff A, et al. Suboptimum hemicraniectomy as a cause of additional cerebral lesions in patients with malignant infarction of the middle cerebral artery. J Neurosurg 2001;94:693-6.
6. Casolla B, Kyheng M, Kuchcinski G, et al. Predictors of outcome in 1-month survivors of large middle cerebral artery infarcts treated by decompressive hemicraniectomy. J Neurol Neurosurg Psychiatry 2020;91:469-74.
7. Bösel J, Schönenberger S, Dohmen C, et al. Intensivtherapie des raumfordernden ischämischen Hemisphäreninfarkts. Nervenarzt 2015;86:1018-30.
8. Juttler E, Bosel J, Amiri H, et al. DESTINY II: DEcompressive Surgery for the Treatment of malignant INfarction of the middle cerebral arterY II. Int J Stroke 2011;6:79-86.
2. Hacke W, Schwab S, Horn M, et al. ‘Malignant’ middle cerebral artery territory infarction: clinical course and prognostic signs. Arch Neurol 1996;53:309-15.
3. Oppenheim C, Samson Y, Manai R, et al. Prediction of malignant middle cerebral artery infarction by diffusion-weighted imaging. Stroke 2000;31:2175-81.
4. Diedler J, Sykora M, Blatow M, et al. Decompressive surgery for severe brain edema. J Intensive Care Med 2009;24:168-78.
5. Wagner S, Schnippering H, Aschoff A, et al. Suboptimum hemicraniectomy as a cause of additional cerebral lesions in patients with malignant infarction of the middle cerebral artery. J Neurosurg 2001;94:693-6.
6. Casolla B, Kyheng M, Kuchcinski G, et al. Predictors of outcome in 1-month survivors of large middle cerebral artery infarcts treated by decompressive hemicraniectomy. J Neurol Neurosurg Psychiatry 2020;91:469-74.
7. Bösel J, Schönenberger S, Dohmen C, et al. Intensivtherapie des raumfordernden ischämischen Hemisphäreninfarkts. Nervenarzt 2015;86:1018-30.
8. Juttler E, Bosel J, Amiri H, et al. DESTINY II: DEcompressive Surgery for the Treatment of malignant INfarction of the middle cerebral arterY II. Int J Stroke 2011;6:79-86.