Connaître et prévenir les complications de la prééclampsie.
Épidémiologie
Physiopathologie
- un défaut d’invasion trophoblastique extravilleux et de remodelage vasculaire sous-placentaire et notamment des artères spiralées, entraînant des phénomènes d’ischémie-reperfusion et d’hypoxie placentaire ;
- l’hypoxie placentaire relative associée au stress oxydant est responsable d’un dysfonctionnement du trophoblaste villeux qui libère différentes molécules (sFLT1, radicaux libres, cytokines) et débris syncytiaux dans la circulation maternelle ;
- les substances libérées induisent un dysfonctionnement de l’endothélium maternel entraînant les signes cliniques et biologiques de la maladie chez la mère.
Connaître la physiopathologie de la prééclampsie permet de mieux comprendre certains signes cliniques : prise de poids excessive et apparition d’œdèmes (baisse de la pression oncotique plasmatique secondaire à la protéinurie et augmentation de la perméabilité vasculaire), dysfonction endothéliale pouvant évoluer vers une microangiopathie thrombotique (MAT), le plus souvent dans le territoire vasculaire hépatique (mise en tension de la capsule de Glisson expliquant la douleur en barre épigastrique). MAT expliquant la thrombopénie et l’hémolyse du HELLP syndrome (hemolysis, elevated liver enzymes and low platelets).
Facteurs de risque
- l’antécédent personnel de prééclampsie ou de retard de croissance intra-utérin vasculaire ;
- l’hypertension artérielle chronique ;
- le syndrome des antiphospholipides [SAPL] ;
- le lupus ;
- les pathologies rénales chroniques ;
- le diabète prééxistant à la grossesse ;
- l’âge maternel supérieur à 40 ans ;
- l’obésité ;
- les grossesses obtenues par fécondation in vitro avec don d’ovocyte ;
- les grossesses multiples ;
- la nulliparité.
Définitions
Prééclampsie
- une hypertension artérielle (HTA) systolique ≥ 140 mmHg et/ou diastolique ≥ 90 mmHg ;
- une protéinurie ≥ 0,3 g/24 h ou à un ratio protéinurie/créatininurie ≥ 30 mg/mmol sur échantillon d’urines ;
- survenant après 20 SA.
Le diagnostic de prééclampsie peut s’effectuer selon la même définition jusqu’à quinze jours en post-partum.
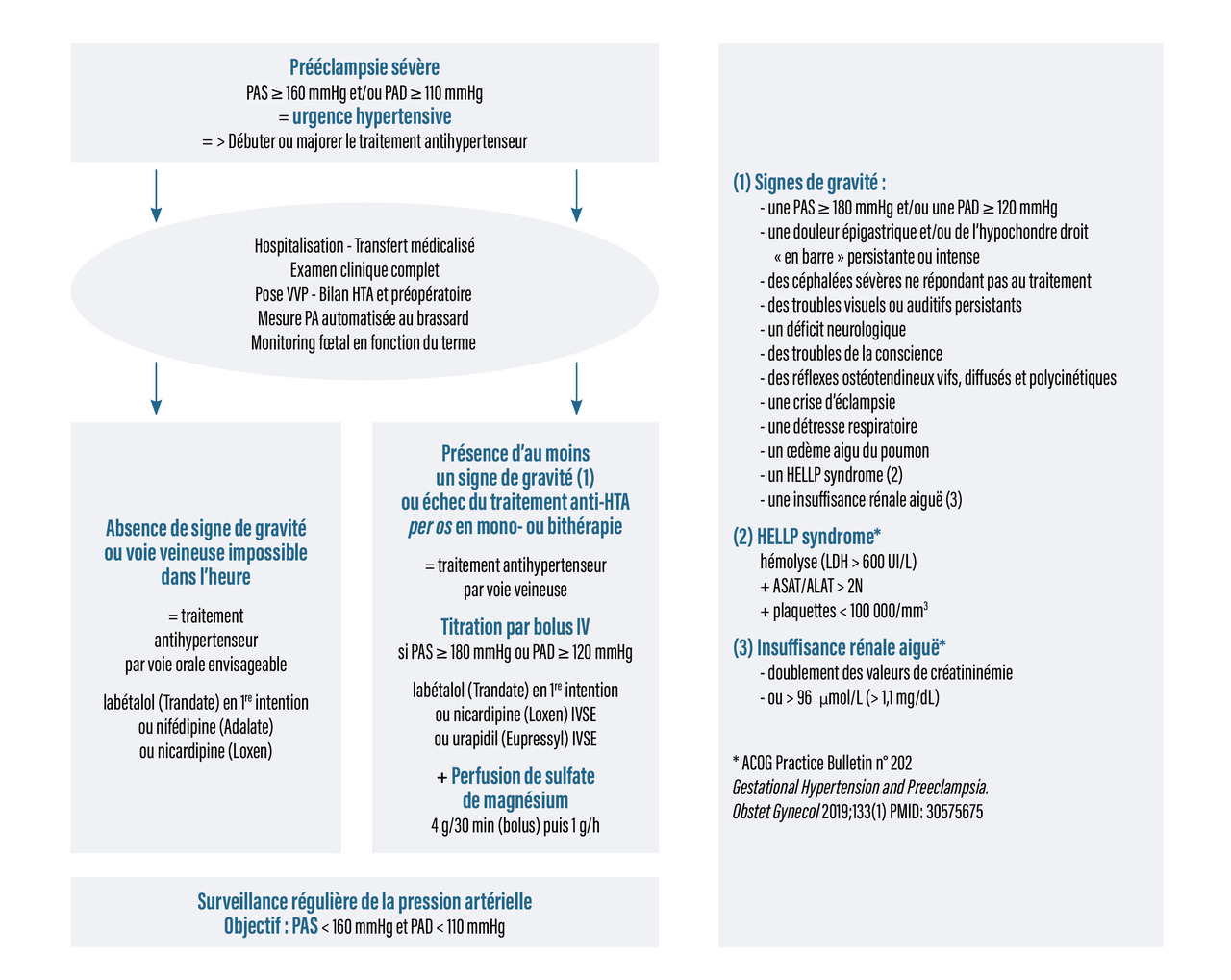
Prééclampsie sévère
Les critères cliniques sont les suivants :
- une HTA sévère (PAS ≥ 160 mmHg et/ou PAD ≥ 110 mmHg) ou non contrôlée ;
- une oligurie < 500 mL/24 h ou < 25 mL/h ;
- une douleur abdominale épigastrique et/ou une douleur de l’hypochondre droit « en barre » persistante ou intense ;
- une douleur thoracique, une dyspnée, un œdème aigu pulmonaire (OAP) ;
- des signes neurologiques : céphalées sévères ne répondant pas au traitement, troubles visuels ou auditifs persistants (myodésopsies, phosphènes, acouphènes), réflexes ostéotendineux vifs, diffusés et polycinétiques.
- une protéinurie > 3 g/24 h ;
- une créatinémie ≥ 90 μmol/L ;
- une thrombopénie < 100 000/mm3 ;
- une cytolyse hépatique (ASAT et/ou ALAT > 2 fois la normale).
Critères de gravité
– une PAS ≥ 180 mmHg et/ou une PAD ≥ 120 mmHg ;
- une douleur épigastrique et/ou de l’hypochondre droit « en barre » persistante ;
- des céphalées sévères ne répondant pas au traitement, des troubles visuels ou auditifs persistants, un déficit neurologique, des troubles de la conscience ;
- une crise d’éclampsie ;
- une détresse respiratoire, un œdème aigu du poumon ;
- un HELLP syndrome ;
- une insuffisance rénale aiguë.
Avant 34 SA, en situation de viabilité fœtale, la pression artérielle ≥ 180/120 mmHg, si elle est rapidement contrôlée et isolée, n’est pas systématiquement un critère de naissance, et l’expectative sous surveillance hospitalière peut se discuter pour diminuer la prématurité. En revanche, les autres critères de gravité peuvent être considérés comme des défaillances d’organe et constituent une indication de naissance en urgence, en plus de leur prise en charge spécifique.
Autres critères
Complications maternelles de la prééclampsie
Complications neurologiques
HELLP syndrome
Le HELLP syndrome doit être évoqué devant toute douleur épigastrique en barre ou en hypochondre droit, et recherché de manière systématique en cas de poussée d’HTA. L’hématome sous-capsulaire du foie est une complication rare et le plus souvent mortelle pour la mère. Ce diagnostic doit être évoqué en cas de persistance d’une douleur en hypochondre droit associée à une déglobulisation aiguë. Les signes biologiques de coagulation intravasculaire disséminée (CIVD), de HELLP syndrome et d’insuffisance hépatocellulaire sont souvent associés.
Hématome rétroplacentaire
Complications rénales
Complications cardiopulmonaires
Un bilan étiologique complet doit être systématique (électrocardiogramme, dosage de la troponine, du brain natriuretic peptide [BNP] ou du NT-pro-BNP [N-terminal pro brain natriuretic peptide]) et doit comprendre une échocardiographie transthoracique maternelle en urgence à la recherche d’une cardiopathie (préexistante méconnue ou cardiomyopathie du péripartum). En cas de doute diagnostique dans ce contexte, un angioscanner thoracique avec injection de produit de contraste à la recherche d’une embolie pulmonaire doit être effectué.
Évaluations clinique et paraclinique d’une prééclampsie
- neurologiques (céphalées, phosphènes, acouphènes, réflexes ostéotendineux vifs, diffus ou polycinétiques) ;
- pulmonaires (dyspnée, désaturation, auscultation pulmonaire) ;
- œdème des membres inférieurs, oligurie, prise de poids rapide ;
- douleurs abdominales inhabituelles, contracture utérine, douleur en hypochondre droit, vomissements ;
- métrorragies ;
- sur le plan fœtal (mouvements actifs fœtaux, recherche d’un retard de croissance par la mesure de la hauteur utérine, enregistrement du rythme cardiaque fœtal par monitoring).
- protéinurie ;8
- hémogramme, LDH, haptoglobine, taux de prothrombine (TP), temps de céphaline activée (TCA), fibrinogène ;
- ASAT, ALAT, créatinine, uricémie, ionogramme sanguin ;
- bilan préopératoire (groupe ABO Rhésus RAI).
- une estimation du poids et de la vitalité fœtale ;
- une évaluation de la présentation fœtale, localisation placentaire, quantité de liquide amniotique, Doppler ombilical et cérébral fœtal.
Prise en charge d’une patiente ayant une prééclampsie
En dehors de ces situations, compte tenu du caractère imprévisible de cette pathologie, le transfert in utero (TIU) vers une maternité de type adapté à l’âge gestationnel et au poids fœtal estimé est recommandé.4
Pour les grossesses de moins de 32 SA ou si l’estimation pondérale fœtale est inférieure à 1 500 g, le TIU doit s’effectuer vers une maternité de type 3. La nécessité du recours à un service de réanimation pour la mère doit également être prise en compte dans les formes sévères. En cas de prééclampsie sévère, il est usuel de surveiller la patiente en hospitalisation jusqu’à l’accouchement.
Enfin, une prééclampsie avec signes de gravité avant 24-25 SA et une estimation de poids fœtal inférieure aux seuils retenus pour une prise en charge néonatale active par l’équipe obstétrico-pédiatrique peut justifier une interruption médicale de grossesse pour sauvetage maternel.
Corticothérapie anténatale
Traitement antihypertenseur
Dans cette population, l’objectif tensionnel est donc strictement inférieur à 140/90 mmHg.12
En situation de prééclampsie sévère, il est recommandé d’administrer systématiquement un traitement antihypertenseur aux patientes avec une PAS ≥ 160 mmHg et/ou une PAD ≥ 110 mmHg au repos et persistant durant plus de quinze minutes, et de maintenir la pression artérielle en dessous de ces seuils pour réduire la survenue de complications maternelles, fœtales et néonatales sévères.
En cas de prééclampsie sévère avec au moins un signe de gravité clinique ou biologique, il est recommandé d’administrer le traitement antihypertenseur par voie intraveineuse.
Les antihypertenseurs recommandés en cas de prééclampsie et utilisables par voie veineuse sont le labétalol (alpha/bêtabloquant), la nicardipine (inhibiteur calcique de type dihydropyridine), l’urapidil (alphabloquant). Lorsqu’un antihypertenseur intraveineux est indiqué, il est recommandé d’utiliser le labétalol en première intention.
Les antihypertenseurs recommandés par voie orale sont le labétalol, la nicardipine, l’urapidil et l’alpha-méthyldopa (antihypertenseur central).
Les inhibiteurs de l’enzyme de conversion ainsi que les antagonistes des récepteurs AT1 de l’angiotensine sont contre-indiqués pendant la grossesse.
Sulfate de magnésium
Ces indications maternelles du sulfate de magnésium en prévention primaire ou secondaire de l’éclampsie s’imposent quel que soit le terme de la grossesse et ne doivent pas être confondues avec les indications à visée de neuroprotection fœtale en cas de naissance envisagée avant 32 SA.
Terme de naissance et voie d’accouchement
Gestion du post-partum
Post-partum immédiat
L’inhibition de la lactation par dérivés de l’ergot de seigle (comme le lisuride et la cabergoline) n’est pas contre-indiquée en cas de prééclampsie. La prééclampsie n’est pas une contre-indication à la contraception par pilule microprogestative en post-partum.
Consultation de suivi
En cas de perturbations persistantes du bilan biologique, une consultation avec un médecin spécialiste d’organe est à prévoir. En raison du risque élevé de développer une hypertension artérielle chronique à moyen terme et du risque accru de complications cardiovasculaires à long terme, il est recommandé d’informer les femmes ayant présenté une prééclampsie de la nécessité d’un suivi médical pour surveiller la pression artérielle et prendre en charge de possibles autres facteurs de risque cardiovasculaire. Chez les femmes avec un antécédent de prééclampsie isolée, il n’est pas recommandé de réaliser une recherche de thrombophilie héréditaire. En cas de prééclampsie sévère avant 34 SA, la patiente peut bénéficier d’un bilan biologique, à la recherche d’un SAPL.12
Risque de récidive et nouvelle grossesse
En dehors de l’antécédent de pathologie vasculaire placentaire, les facteurs de risque maternels, même cumulés, ne sont pas considérés à ce jour, en France, comme des indications à une prophylaxie par aspirine.
POINTS FORTS À RETENIR
La prééclampsie est une pathologie obstétricale pouvant mettre en jeu le pronostic vital maternel quel que soit le terme de survenue.
Toute suspicion de prééclampsie doit conduire à adresser la patiente en urgence à la maternité.
La prééclampsie est définie par une hypertension artérielle (HTA) systolique ≥ 140 mmHg et/ou diastolique ≥ 90 mmHg associée à une protéinurie ≥ 0,3 g/24 h ou un ratio protéinurie/créatininurie ≥ 30 mg/mmol et survenant après 20 semaines d’aménorrhée.
Toute patiente avec une prééclampsie confirmée doit être initialement hospitalisée en maternité de type adapté au terme et au poids fœtal estimé.
La corticothérapie à visée maturative fœtale est systématique avant 34 SA.
Un antécédent de prééclampsie quel que soit le terme de diagnostic ou de naissance est une indication à une prévention secondaire par aspirine (100 à 160 mg/j) pour les grossesses ultérieures.
Feux rouges
La connaissance des signes de sévérité de la prééclampsie est indispensable à la prise en charge obstétricale et notamment à la détermination du terme de naissance.
La présence de signes de gravité impose une prise en charge multidisciplinaire en urgence, en secteur de soins avec surveillance maternelle et fœtale continue, la perfusion de sulfate de magnésium et une naissance sans expectative en cas de défaillance d’organe.
2. Inserm-Santé publique France. Les morts maternelles en France : mieux comprendre pour mieux prévenir. 6e rapport de l’Enquête nationale confidentielle sur les morts maternelles (ENCMM) 2013-2015. Mis à jour le 25 janvier 2021.
3. Lecarpentier E, Fournier T, Guibourdenche J, Tsatsaris V. Pathophysiology of preeclampsia. Presse Med 2016 ;45(7-8 Pt 1):631-7.
4. Bonnet MP, Garnier M, Keita H, Compere V, Arthuis C, Raia-Barjat T, et al. Republication des recommandations formalisées d’experts. Prise en charge de la patiente avec une prééclampsie sévère–RFE communes à la Société française d’anesthésie-réanimation (SFAR) et au Collège national des gynécologues et obstétriciens français (CGNOF). Gynécologie Obstétrique Fertilité & Sénologie 2022;50(1):2-25.
5. Lisonkova S, Bone JN, Muraca GM, Razaz N, Qing Wang L, Sabr Y, et al. Incidence and risk factors for severe preeclampsia, hemolysis, elevated liver enzymes, and low platelet count syndrome, and eclampsia at preterm and term gestation: A population-based study. Am J Obstet Gynecol 2021;225(5):538.e1-538.e19.
6. Ananth CV, Lavery JA, Vintzileos AM, Skupski DW, Varner M, Saade G, et al. Severe placental abruption: Clinical definition and associations with maternal complications. Am J Obstet Gynecol 2016:214 (2):272.e1-272.e9.
7. Fakhouri F, Scully M, Provôt F, Blasco M, Coppo P, Noris M, et al. Management of thrombotic microangiopathy in pregnancy and postpartum: Report from an International Working Group. Blood 2020;136(19):2103-17.
8. Fishel Bartal M, Lindheimer MD, Sibai BM. Proteinuria during pregnancy: Definition, pathophysiology, methodology, and clinical significance. Am J Obstet Gynecol 2022;226 (2S), S819-S834.
9. Sotiriadis A, Hernandez-Andrade E, da Silva Costa, Ghi T, Glanc P, Khalil A, et al. ISUOG CSC Pre-eclampsia Task Force. ISUOG Practice Guidelines: Role of ultrasound in screening for and follow-up of pre-eclampsia. Ultrasound Obstet Gynecol 2019;53(1):7-22.
10. Haute Autorité de santé. Critères et indications de transfert maternel. https://www.has-sante.fr
11. Amorim MM, Santos LC, Faúndes A. Corticosteroid therapy for prevention of respiratory distress syndrome in severe preeclampsia. Am J Obstet Gynecol 1999;180(5):1283-8.
12. Recommandations pour la pratique clinique 2023. CNGOF : prise en charge d’une prééclampsie non sévère. http://cngof.fr

 Encadrés
Encadrés