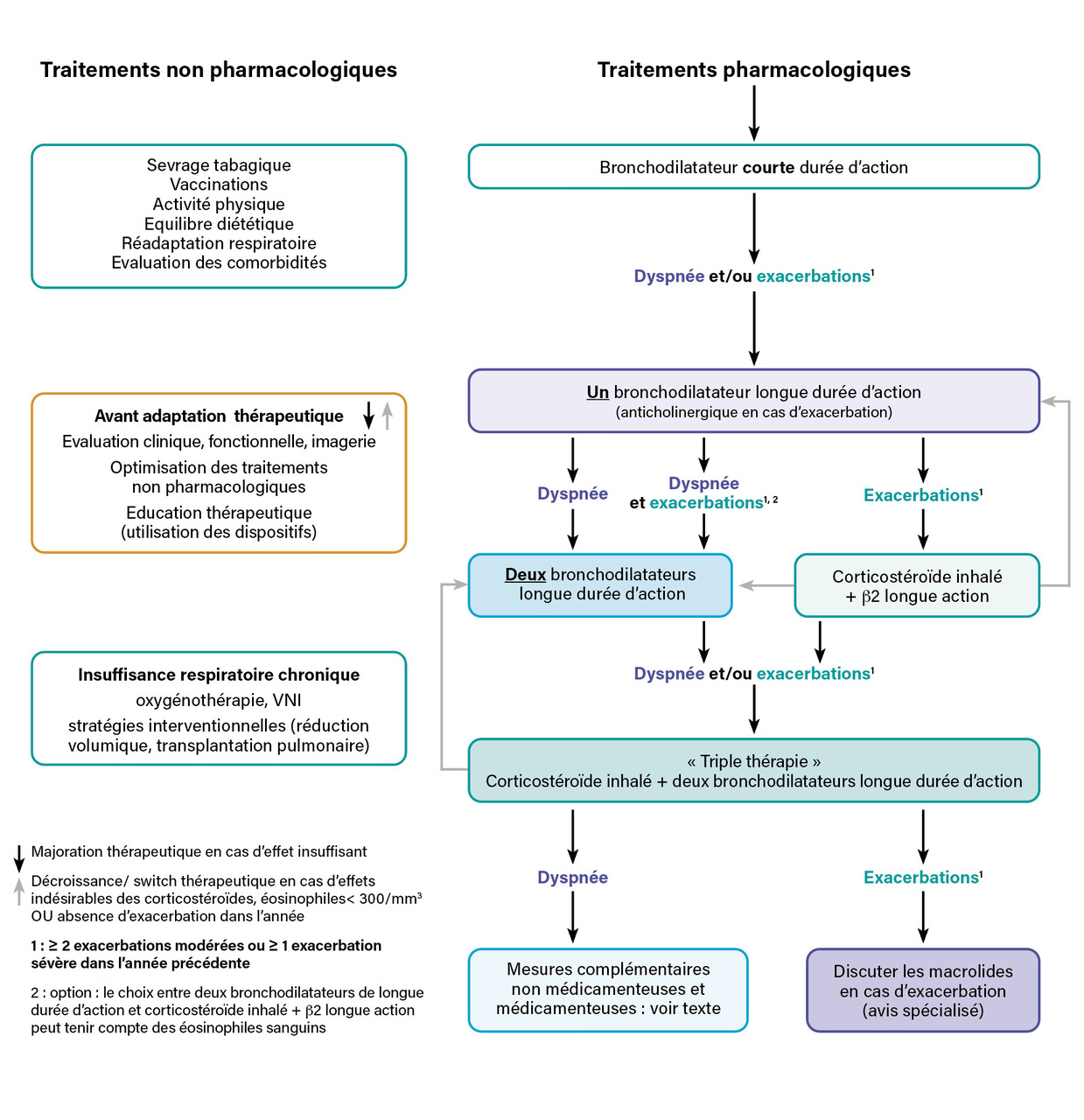
La prise en charge médicamenteuse de la bronchopneumopathie chronique obstructive (BPCO) [hormis l’oxygénothérapie] repose sur des traitements inhalés, et notamment l’utilisation de bronchodilatateurs de courte durée d’action en cas de symptômes respiratoires. Si ceux-ci sont quotidiens, le traitement de fond débute par un bronchodilatateur de longue durée d’action puis, en l’absence d’amélioration, il évolue vers une bithérapie, voire une trithérapie. Des biothérapies pourraient venir élargir l’arsenal thérapeutique pour certains patients, rendant nécessaire le dosage des éosinophiles et d’autres biomarqueurs sanguins.
La prise en charge de la bronchopneumopathie chronique obstructive (BPCO) repose principalement sur des mesures non médicamenteuses, d’une part, et médicamenteuses, d’autre part, essentiellement fondées sur des traitements inhalés.1 La place des vaccinations (lire « Quels vaccins pour les patients ayant une BPCO ? » par Pierre-Régis Burgel, page 13 ), les modalités de l’oxygénothérapie (sujet abordé dans un prochain numéro) et de la réhabilitation respiratoire (lire « Réadaptation des patients atteints de BPCO » par Jean-Maris Grosbois, dans La Revue du Praticien n° 10 de décembre 2023), mesures essentielles, ainsi que celle de la prise en charge des exacerbations (sujet abordé dans un prochain numéro) ne seront pas ici détaillées.
Une fois le diagnostic de BPCO confirmé par spirométrie, avec l’existence d’un trouble ventilatoire obstructif défini par un rapport VEMS/CVF (volume expiratoire maximal par seconde/capacité vitale forcée) inférieur à 0,7 après prise d’un bronchodilatateur, les mesures générales dont l’efficacité a été démontrée avec un haut niveau de preuve doivent être mises en place pour tous les patients. Ainsi il est nécessaire de proposer systématiquement (figure ) :
- une aide au sevrage tabagique ;
- les vaccinations grippale et pneumococcique ;
- un bon équilibre diététique ;
- des conseils d’activité physique ;
- une réadaptation si la dyspnée ou le handicap persiste dans la vie quotidienne.
En cas d’insuffisance respiratoire sévère, une oxygénothérapie de longue durée, voire une ventilation non invasive, est proposée. En cas d’emphysème sévère, une réduction de volume, par voie endoscopique et/ou chirurgicale doit se discuter. Ces sujets ne sont pas abordés dans cet article.
Dans tous les cas, le choix du dispositif d’inhalation, la technique de son utilisation et l’observance doivent être évalués régulièrement. L’absence de diagnostic différentiel ou associé en cas de dyspnée persistante doit être vérifiée.
En cas d’asthme associé, défini selon les documents GOLD et GINA (www.goldcopd.org et www.ginasthma.org) par un historique de diagnostic d’asthme, surtout avant l’âge de 40 ans, une importante variabilité des symptômes et de l’obstruction bronchique (écarts supérieurs à 400 mL) et un historique personnel ou familial d’allergies, un traitement par corticostéroïdes inhalés (CSI) associés à un bronchodilatateur est privilégié.
Une fois le diagnostic de BPCO confirmé par spirométrie, avec l’existence d’un trouble ventilatoire obstructif défini par un rapport VEMS/CVF (volume expiratoire maximal par seconde/capacité vitale forcée) inférieur à 0,7 après prise d’un bronchodilatateur, les mesures générales dont l’efficacité a été démontrée avec un haut niveau de preuve doivent être mises en place pour tous les patients. Ainsi il est nécessaire de proposer systématiquement (
- une aide au sevrage tabagique ;
- les vaccinations grippale et pneumococcique ;
- un bon équilibre diététique ;
- des conseils d’activité physique ;
- une réadaptation si la dyspnée ou le handicap persiste dans la vie quotidienne.
En cas d’insuffisance respiratoire sévère, une oxygénothérapie de longue durée, voire une ventilation non invasive, est proposée. En cas d’emphysème sévère, une réduction de volume, par voie endoscopique et/ou chirurgicale doit se discuter. Ces sujets ne sont pas abordés dans cet article.
Dans tous les cas, le choix du dispositif d’inhalation, la technique de son utilisation et l’observance doivent être évalués régulièrement. L’absence de diagnostic différentiel ou associé en cas de dyspnée persistante doit être vérifiée.
En cas d’asthme associé, défini selon les documents GOLD et GINA (www.goldcopd.org et www.ginasthma.org) par un historique de diagnostic d’asthme, surtout avant l’âge de 40 ans, une importante variabilité des symptômes et de l’obstruction bronchique (écarts supérieurs à 400 mL) et un historique personnel ou familial d’allergies, un traitement par corticostéroïdes inhalés (CSI) associés à un bronchodilatateur est privilégié.
Monothérapie avec un bronchodilatateur de courte ou longue durée d’action
Le principe des traitements médicamenteux dans la BPCO repose sur un traitement par bronchodilatateur de courte durée d’action en cas de symptômes respiratoires. En cas de symptômes quotidiens à type de dyspnée invalidante définie par un score modified Medical Research Council (mMRC) supérieur ou égal à 1 ou des exacerbations fréquentes définies par au moins deux épisodes modérés ou un sévère par an, un traitement de fond quotidien par bronchodilatateur de longue durée d’action est proposé : antimuscarinique (anticholinergique de longue durée d’action ou Long-acting muscarinic antagonists [LAMA]) ou β2-agoniste (β-2 agonistes de longue durée d’action ou Long-acting beta2-agonists [LABA]). Puis, en cas de persistance des symptômes (dyspnée et/ou exacerbation), une bithérapie puis une trithérapie est prescrite (figure ).
En comparaison au placebo, une méta-analyse confirme le bénéfice de l’indacatérol (150 μg et 300 μg) de façon significative et cliniquement pertinente sur le VEMS (147 à 167 mL), la dyspnée et le nombre d’exacerbations à douze et vingt-quatre semaines de traitement.2 De même, une autre étude confirme que l’indacatérol comparé aux autres bêta-2-mimétiques de longue durée d’action en deux prises par jour permet une amélioration supplémentaire du VEMS, sans atteindre le seuil de pertinence clinique (+62 mL). La qualité de vie, mesurée par le score SGRQ (St George’s Respiratory Questionnaire), n’est pas améliorée significativement.3
Concernant le tiotropium, une étude montre son intérêt chez des patients atteints de BPCO légère à modérée, GOLD 1 et 2.4 Le tiotropium améliore de manière statistique et cliniquement pertinente le VEMS (de 127 à 169 mL en pré-bronchodilatation) et est associé à une diminution significative du déclin annuel du VEMS post-bronchodilatation (29 mL par an pour le groupe tiotropium contre 51 mL par an pour le groupe placebo). De plus, le taux d’exacerbations est significativement diminué en comparaison au placebo. Cependant, le bénéfice décrit sur le déclin semble lié à l’amélioration initiale du VEMS lors de l’introduction du tiotropium au début de l’étude.
En comparaison au tiotropium, il existe une non-infériorité de l’indacatérol sur le VEMS avec un plus grand pourcentage de patients sous indacatérol dépassant le seuil de pertinence clinique pour les scores de dyspnée (transition dyspnea index [TDI], indice de dyspnée de transition) et de qualité de vie (SGRQ). En revanche, l’indacatérol est inférieur sur la prévention des exacerbations modérées à sévères, avec un taux annuel de 0,79 versus 0,61 pour le tiotropium.5 Ainsi, un LAMA est privilégié dans le cas où il existe des exacerbations fréquentes. Enfin, il existe peu de données récentes sur les autres LABA.
Dans tous les cas et à chaque étape, une réévaluation clinique et fonctionnelle est proposée à trois mois avec recherche de comorbidités, d’un diagnostic différentiel, d’un mésusage des traitements inhalés et évaluation de l’observance.
En comparaison au placebo, une méta-analyse confirme le bénéfice de l’indacatérol (150 μg et 300 μg) de façon significative et cliniquement pertinente sur le VEMS (147 à 167 mL), la dyspnée et le nombre d’exacerbations à douze et vingt-quatre semaines de traitement.2 De même, une autre étude confirme que l’indacatérol comparé aux autres bêta-2-mimétiques de longue durée d’action en deux prises par jour permet une amélioration supplémentaire du VEMS, sans atteindre le seuil de pertinence clinique (+62 mL). La qualité de vie, mesurée par le score SGRQ (St George’s Respiratory Questionnaire), n’est pas améliorée significativement.3
Concernant le tiotropium, une étude montre son intérêt chez des patients atteints de BPCO légère à modérée, GOLD 1 et 2.4 Le tiotropium améliore de manière statistique et cliniquement pertinente le VEMS (de 127 à 169 mL en pré-bronchodilatation) et est associé à une diminution significative du déclin annuel du VEMS post-bronchodilatation (29 mL par an pour le groupe tiotropium contre 51 mL par an pour le groupe placebo). De plus, le taux d’exacerbations est significativement diminué en comparaison au placebo. Cependant, le bénéfice décrit sur le déclin semble lié à l’amélioration initiale du VEMS lors de l’introduction du tiotropium au début de l’étude.
En comparaison au tiotropium, il existe une non-infériorité de l’indacatérol sur le VEMS avec un plus grand pourcentage de patients sous indacatérol dépassant le seuil de pertinence clinique pour les scores de dyspnée (transition dyspnea index [TDI], indice de dyspnée de transition) et de qualité de vie (SGRQ). En revanche, l’indacatérol est inférieur sur la prévention des exacerbations modérées à sévères, avec un taux annuel de 0,79 versus 0,61 pour le tiotropium.5 Ainsi, un LAMA est privilégié dans le cas où il existe des exacerbations fréquentes. Enfin, il existe peu de données récentes sur les autres LABA.
Dans tous les cas et à chaque étape, une réévaluation clinique et fonctionnelle est proposée à trois mois avec recherche de comorbidités, d’un diagnostic différentiel, d’un mésusage des traitements inhalés et évaluation de l’observance.
Bithérapie si la dyspnée persiste
Le bénéfice d’une association de bronchodilatateurs LABA-LAMA par rapport au placebo est bien établi.
Si la dyspnée persiste malgré une monothérapie, une double bronchodilatation (LABA + LAMA) est proposée. En cas d’exacerbations fréquentes malgré une monothérapie, on peut proposer une association LABA et LAMA ou une association LABA et corticostéroïdes inhalés (CSI). La bithérapie améliore inconstamment la dyspnée. Son bénéfice clinique vis-à-vis de la prévention des exacerbations ou de l’amélioration des capacités à l’exercice versus un LAMA est modeste.6
Les études suggèrent un rapport bénéfice/risque plus favorable pour l’association LABA-LAMA par rapport à l’association LABA-CSI en l’absence d’antécédent d’asthme ou d’éosinophilie supérieure à 600/µL (étude FLAME).7,8
En revanche, en l’absence de sélection des patients sur ces critères, la bithérapie LABA-CSI est supérieure à la bithérapie LABA-LAMA (étude IMPACT).9 Dans les études IMPACT et KRONOS, plus des deux tiers des patients étaient sous CSI à l’inclusion, et le « sevrage brutal » en CSI dans le bras LABA-LAMA a pu contribuer à défavoriser ce bras de traitement comparativement au bras LABA-CSI comme décrit précédemment,10 et comme pourrait le suggérer le nombre des exacerbations pendant les premières semaines de l’étude IMPACT.9 Néanmoins, ceci n’est pas confirmé dans une étude post-hoc ni dans l’étude ETHOS.11
Chez les patients insuffisamment contrôlés par cette dernière association se pose la question d’une rotation de bithérapie ou de l’escalade vers une trithérapie. En faveur d’un remplacement de l’association LABA-CSI par LABA-LAMA figurent les effets indésirables des corticostéroïdes inhalés, en premier lieu le sur-risque de pneumonie, et des données de la littérature en faveur d’une efficacité de la double bronchodilatation sur la réduction des exacerbations.7
Ainsi, l’essai CRYSTAL12 a spécifiquement étudié le switch de la bithérapie LABA-CSI pour l’association indacatérol-glycopyrronium, chez des patients atteints de BPCO modérée mais dyspnéiques (selon l’échelle mMRC ≥ 1). À douze semaines, on constatait une amélioration significative du VEMS (+ 71 mL) et de la dyspnée (score de dyspnée TDI + 1,1 point).
La plupart des études ont été réalisées chez des patients déjà antérieurement traités, notamment par corticoïdes inhalés, ce qui limite la possibilité de généraliser ces résultats aux patients naïfs. En corollaire, aucune des études citées n’est en mesure de déterminer si une mono- ou une bithérapie est préférable chez des patients nouvellement diagnostiqués, sans traitement antérieur.
Si la dyspnée persiste malgré une monothérapie, une double bronchodilatation (LABA + LAMA) est proposée. En cas d’exacerbations fréquentes malgré une monothérapie, on peut proposer une association LABA et LAMA ou une association LABA et corticostéroïdes inhalés (CSI). La bithérapie améliore inconstamment la dyspnée. Son bénéfice clinique vis-à-vis de la prévention des exacerbations ou de l’amélioration des capacités à l’exercice versus un LAMA est modeste.6
Les études suggèrent un rapport bénéfice/risque plus favorable pour l’association LABA-LAMA par rapport à l’association LABA-CSI en l’absence d’antécédent d’asthme ou d’éosinophilie supérieure à 600/µL (étude FLAME).7,8
En revanche, en l’absence de sélection des patients sur ces critères, la bithérapie LABA-CSI est supérieure à la bithérapie LABA-LAMA (étude IMPACT).9 Dans les études IMPACT et KRONOS, plus des deux tiers des patients étaient sous CSI à l’inclusion, et le « sevrage brutal » en CSI dans le bras LABA-LAMA a pu contribuer à défavoriser ce bras de traitement comparativement au bras LABA-CSI comme décrit précédemment,10 et comme pourrait le suggérer le nombre des exacerbations pendant les premières semaines de l’étude IMPACT.9 Néanmoins, ceci n’est pas confirmé dans une étude post-hoc ni dans l’étude ETHOS.11
Chez les patients insuffisamment contrôlés par cette dernière association se pose la question d’une rotation de bithérapie ou de l’escalade vers une trithérapie. En faveur d’un remplacement de l’association LABA-CSI par LABA-LAMA figurent les effets indésirables des corticostéroïdes inhalés, en premier lieu le sur-risque de pneumonie, et des données de la littérature en faveur d’une efficacité de la double bronchodilatation sur la réduction des exacerbations.7
Ainsi, l’essai CRYSTAL12 a spécifiquement étudié le switch de la bithérapie LABA-CSI pour l’association indacatérol-glycopyrronium, chez des patients atteints de BPCO modérée mais dyspnéiques (selon l’échelle mMRC ≥ 1). À douze semaines, on constatait une amélioration significative du VEMS (+ 71 mL) et de la dyspnée (score de dyspnée TDI + 1,1 point).
La plupart des études ont été réalisées chez des patients déjà antérieurement traités, notamment par corticoïdes inhalés, ce qui limite la possibilité de généraliser ces résultats aux patients naïfs. En corollaire, aucune des études citées n’est en mesure de déterminer si une mono- ou une bithérapie est préférable chez des patients nouvellement diagnostiqués, sans traitement antérieur.
Trithérapie pour réduire les exacerbations
La triple thérapie LABA-LAMA-CSI a fait la preuve de sa supériorité par rapport à la double bronchodilatation en matière de réduction du taux annuel d’exacerbations dans des essais contrôlés randomisés de grande envergure, chez les patients ayant une BPCO sévère à très sévère (majorité de patients inclus de grade GOLD 3 et aux exacerbations fréquentes). Dans l’étude IMPACT, le taux annuel d’exacerbations modérées à sévères dans le bras triple thérapie était de 0,91 versus 1,21 dans le bras double bronchodilatation (p < 0,001).9 Les résultats étaient similaires mais plus modestes dans l’étude TRIBUTE (0,5 versus 0,59 ; p = 0,043).13 La fonction pulmonaire, critère secondaire des études IMPACT9 et TRIBUTE13, était également améliorée de manière statistiquement significative mais peu pertinente cliniquement avec une différence de VEMS pré-bronchodilatation de respectivement 54 mL et 22 mL. De manière plus modeste, l’étude IMPACT a aussi démontré une amélioration de la qualité de vie, avec une diminution de -5,5 versus -3,7 du score SGRQ.9
D’autres études ont comparé la triple thérapie LABA-LAMA-CSI à l’association LABA-CSI et ont démontré un bénéfice en matière de VEMS pré-bronchodilatation avec une différence de 63 mL (p < 0,01)14 à 171 mL (p < 0,001).15 Le taux d’exacerbations sur un an était l’un des critères secondaires et apparaissait diminué dans les deux études (TRILOGY14 : fréquence de 0,41 versus 0,57 exacerbation modérée à sévère [p = 0,05]14 ; FULFIL : fréquence de 0,25 versus 0,39 toutes exacerbations confondues [p < 0,001]15). De plus, ces études ont pris en compte la qualité de vie, mais seule l’étude FULFIL a souligné une différence significative (p < 0,001), avec une diminution de -6,6 versus -4,3 du score SGRQ.15
Enfin, les études de trithérapiesIMPACT16 et ETHOS11 démontrent également un gain significatif statistiquement en matière de mortalité toute cause en faveur des trithérapies, bien que le nombre d’événements soit trop faible pour tirer des conclusions définitives.
En conclusion, les trithérapies devraient être réservées aux patients présentant des exacerbations modérées à sévères malgré une bithérapie (CSI-LABA ou LABA-LAMA) bien conduite et en l’absence d’effets indésirables antérieurs des CSI, et aux patients ayant une dyspnée persistante sous bithérapie CSI-LABA.
D’autres études ont comparé la triple thérapie LABA-LAMA-CSI à l’association LABA-CSI et ont démontré un bénéfice en matière de VEMS pré-bronchodilatation avec une différence de 63 mL (p < 0,01)14 à 171 mL (p < 0,001).15 Le taux d’exacerbations sur un an était l’un des critères secondaires et apparaissait diminué dans les deux études (TRILOGY14 : fréquence de 0,41 versus 0,57 exacerbation modérée à sévère [p = 0,05]14 ; FULFIL : fréquence de 0,25 versus 0,39 toutes exacerbations confondues [p < 0,001]15). De plus, ces études ont pris en compte la qualité de vie, mais seule l’étude FULFIL a souligné une différence significative (p < 0,001), avec une diminution de -6,6 versus -4,3 du score SGRQ.15
Enfin, les études de trithérapiesIMPACT16 et ETHOS11 démontrent également un gain significatif statistiquement en matière de mortalité toute cause en faveur des trithérapies, bien que le nombre d’événements soit trop faible pour tirer des conclusions définitives.
En conclusion, les trithérapies devraient être réservées aux patients présentant des exacerbations modérées à sévères malgré une bithérapie (CSI-LABA ou LABA-LAMA) bien conduite et en l’absence d’effets indésirables antérieurs des CSI, et aux patients ayant une dyspnée persistante sous bithérapie CSI-LABA.
Désescalade en cas d’inefficacité ou d’effets indésirables
Du fait des effets indésirables dus à la prise de CSI dans la BPCO1 et de l’importance du nombre de patients atteints de BPCO déjà sous CSI, un enjeu majeur reste la désescalade thérapeutique en cas d’inefficacité ou d’effets indésirables. Ainsi la décision d’un sevrage en CSI nécessite-t-elle d’évaluer la balance bénéfice/risque (antécédents d’asthme, d’exacerbations fréquentes de BPCO, de pneumonies, d’éosinophilie) et de programmer et optimiser la décroissance en instaurant une double bronchodilatation si nécessaire, en l’absence d’exacerbations modérées à sévères pendant un an.17
En effet, plusieurs méta-analyses confirment que l’arrêt des CSI n’augmente pas le risque de survenue d’exacerbations de BPCO modérée à sévère et entraîne un déclin statistiquement significatif mais non pertinent cliniquement du VEMS de 30 mL en moyenne. En revanche, l’arrêt des CSI ne semble pas prudent chez les patients exacerbateurs fréquents ou avec un taux d’éosinophiles élevés (≥ 300/µL).18-20 Ainsi l’identification de facteurs prédictifs d’une réponse aux différentes classes thérapeutiques disponibles reste un défi important.
En effet, plusieurs méta-analyses confirment que l’arrêt des CSI n’augmente pas le risque de survenue d’exacerbations de BPCO modérée à sévère et entraîne un déclin statistiquement significatif mais non pertinent cliniquement du VEMS de 30 mL en moyenne. En revanche, l’arrêt des CSI ne semble pas prudent chez les patients exacerbateurs fréquents ou avec un taux d’éosinophiles élevés (≥ 300/µL).18-20 Ainsi l’identification de facteurs prédictifs d’une réponse aux différentes classes thérapeutiques disponibles reste un défi important.
Éosinophilie : utile pour décider ?
Le dosage des éosinophiles sanguins comme biomarqueur a été proposé dans de récents essais cliniques afin de guider l’utilisation du traitement par CSI pour prévenir les exacerbations avec un seuil proposé à 300/µL.21 Chez les patients insuffisamment contrôlés sous LABA-CSI dont le taux d’éosinophiles est inférieur à 300/µL, on opte pour un switch avec une double bronchodilatation plutôt que pour la triple thérapie. De même, une désescalade de la triple thérapie vers la bithérapie LABA-LAMA est privilégiée chez les patients ayant un effet indésirable de la corticothérapie inhalée ou un taux d’éosinophile inférieur au seuil de 300/µL. Néanmoins, la mesure de l’éosinophilie n’a un intérêt que chez les patients exacerbateurs.
Oui, mais avec prudence !
L’utilisation de l’éosinophilie comme biomarqueur doit être prudente compte tenu de sa variabilité au cours du temps, et son dosage doit être réalisé à l’état stable et en valeur absolue. En effet, aucune étude prospective n’a utilisé l’éosinophilie sanguine dans une stratégie thérapeutique à l’échelle individuelle. L’éosinophilie doit donc rester un critère de décision secondaire dans la prise en charge des patients BPCO. Le rapport bénéfice/risque de la corticothérapie inhalée doit être évalué essentiellement en fonction du profil clinique de chaque patient (exacerbations, antécédent de pneumonie) et de la présence de comorbidités (diabète, ostéoporose…).
Les CSI ont probablement un intérêt particulier chez les patients présentant une BPCO avec obstruction bronchique modérée à très sévère ayant au moins une exacerbation par an et un taux d’éosinophiles supérieur ou égal à 300/µL, et ce, en association avec un LABA, un LAMA ou les deux. Les CSI doivent être maintenus chez les patients avec une éosinophilie sanguine supérieure ou égale à 300/µL et des antécédents d’exacerbations fréquentes, en l’absence de pneumonie.
Les CSI ont probablement un intérêt particulier chez les patients présentant une BPCO avec obstruction bronchique modérée à très sévère ayant au moins une exacerbation par an et un taux d’éosinophiles supérieur ou égal à 300/µL, et ce, en association avec un LABA, un LAMA ou les deux. Les CSI doivent être maintenus chez les patients avec une éosinophilie sanguine supérieure ou égale à 300/µL et des antécédents d’exacerbations fréquentes, en l’absence de pneumonie.
Macrolides au long cours hors AMM en cas d’exacerbations
Concernant les macrolides au long cours dans la prise en charge de la BPCO, l’azithromycine est une thérapeutique utilisée actuellement hors autorisation de mise sur le marché (AMM) ; elle a néanmoins démontré son efficacité dans la diminution de la fréquence des exacerbations, chez les patients BPCO exacerbateurs fréquents au prix de peu d’effets indésirables et avec une efficacité maintenue à long terme. La posologie minimale (250 mg/j, trois jours par semaine) semble aussi efficace que des posologies supérieures, et moins à risque d’effets indésirables à long terme. La stratégie de traitement par azithromycine à visée de réduction de la fréquence des exacerbations de BPCO doit cependant rester une stratégie d’exception réservée à des patients ayant des exacerbations fréquentes malgré une prise en charge optimale incluant une évaluation précise des facteurs de non-contrôle de la BPCO, une aide au sevrage tabagique, une optimisation du traitement inhalé et une réadaptation respiratoire.
Autres traitements médicamenteux
Concernant le traitement de la dys-pnée persistante, seuls les opioïdes à faibles doses ont démontré leur efficacité et sont dénués d’effet indésirable majeur.22
La théophylline n’a pas d’intérêt dans la prévention des exacerbations de BPCO. Devant un rapport bénéfice/risque et un indice thérapeutique faibles, elle n’est pas recommandée en présence d’alternative thérapeutique disponible par voie inhalée.
Les bêtabloquants n’ont pas d’intérêt dans la prévention des exacerbations de BPCO.23 Cependant, un patient présentant une indication cardiovasculaire de traitement par bêtabloquants doit bénéficier de ce traitement.
Les statines n’ont pas d’intérêt dans la prévention des exacerbations de BPCO.
La théophylline n’a pas d’intérêt dans la prévention des exacerbations de BPCO. Devant un rapport bénéfice/risque et un indice thérapeutique faibles, elle n’est pas recommandée en présence d’alternative thérapeutique disponible par voie inhalée.
Les bêtabloquants n’ont pas d’intérêt dans la prévention des exacerbations de BPCO.23 Cependant, un patient présentant une indication cardiovasculaire de traitement par bêtabloquants doit bénéficier de ce traitement.
Les statines n’ont pas d’intérêt dans la prévention des exacerbations de BPCO.
Les biothérapies pourraient trouver une place
Les biothérapies n’avaient jus-qu’alors aucune place dans la prise en charge des patients atteints de BPCO. Les résultats prometteurs de l’étude BOREAS changent les perspectives.24 Elle a évalué l’efficacité et la tolérance du dupilumab (anti- IL-4/IL-13) chez 939 patients atteints de BPCO et âgés de 40 à 80 ans présentant un tabagisme à plus de 10 paquets-années, un profil exacerbateur (au moins deux exacerbations modérées ou une sévère l’année passée) malgré un traitement par trithérapie inhalée et une inflammation de type 2 (définie par une éosinophilie sanguine supérieure à 300/mm3). Le dupilumab, administré toutes les deux semaines par voie sous-cutanée, a permis une réduction de 30 % du taux annuel d’exacerbations modérées ou sévères dans le groupe traité (0,78 versus 1,10, RR : 0,70 ; IC à 95 % : 0,58-0,86 ; p < 0,001). Par ailleurs, une amélioration significative du VEMS pré-bronchodilatateur à douze semaines a été constatée (160 mL versus 77 mL, différence moyenne 83 mL ; IC à 95 % : 42-125 ; p < 0,001). Cette différence était observée dès la deuxième semaine et était stable dans le temps, jusqu’à 52 semaines. De même, la qualité de vie (différence moyenne SGRQ -3,4 ; IC à 95 % : -5,5 - -1,3 ; p = 0,002) ainsi que les symptômes respiratoires étaient significativement améliorés à 52 semaines (différence moyenne, -1,1 ; IC à 95 % : -1,8 - -0,4 ; p = 0,001). Par ailleurs, le nombre de patients présentant des effets indésirables ayant conduit à l’arrêt du traitement, des effets indésirables graves ou ayant entraîné le décès étaient équilibrés dans les deux groupes.
Des études avec d’autres biothérapies ciblant l’inflammation de type 2 telles que le benralizumab (anti-IL-5 récepteur) ou le mépolizumab (anti- IL-5) sont actuellement en cours.
Par ailleurs, les cellules composant l’épithélium respiratoire peuvent également jouer un rôle dans la réponse aux agressions environnementales en sécrétant des alarmines, dont l’IL-33, qui ont un rôle de signal d’alarme pour le déclenchement d’une réaction inflammatoire de types 1 et 2. Des études sont actuellement en cours afin de développer des biothérapies ciblant l’IL-33 ou son récepteur, ST2.
Des études avec d’autres biothérapies ciblant l’inflammation de type 2 telles que le benralizumab (anti-IL-5 récepteur) ou le mépolizumab (anti- IL-5) sont actuellement en cours.
Par ailleurs, les cellules composant l’épithélium respiratoire peuvent également jouer un rôle dans la réponse aux agressions environnementales en sécrétant des alarmines, dont l’IL-33, qui ont un rôle de signal d’alarme pour le déclenchement d’une réaction inflammatoire de types 1 et 2. Des études sont actuellement en cours afin de développer des biothérapies ciblant l’IL-33 ou son récepteur, ST2.
Références
1. Zysman M, Chabot F, Devillier P, Housset B, Morelot-Panzini C, Roche N. Pharmacological treatment optimization for stable chronic obstructive pulmonary disease. Proposals from the Société de pneumologie de langue française. Revue des maladies respiratoires 2016;33(10):911‑36.
2. Donohue JF, Betts KA, Du EX, Altman P, Goyal P, Keininger DL, et al. Comparative efficacy of long-acting β2-agonists as monotherapy for chronic obstructive pulmonary disease: A network meta-analysis. Int J Chron Obstruct Pulmon Dis 2017;12:367‑81.
3. Geake JB, Dabscheck EJ, Wood‐Baker R, Cates CJ. Indacaterol, a once‐daily beta2‐agonist, versus twice‐daily beta2‐agonists or placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2015;2015(1):CD010139.
4. Zhou Y, Zhong N, Li X, Chen S, Zheng J, Zhao D, et al. Tiotropium in early-stage chronic obstructive pulmonary disease. N Engl J Med 2017;377(10):923‑35.
5. Decramer ML, Chapman KR, Dahl R, Frith P, Devouassoux G, Fritscher C, et al. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): A randomised, blinded, parallel-group study. The Lancet Respiratory Medicine 2013;1(7):524‑33.
6. Calzetta L, Ora J, Cavalli F, Rogliani P, O’Donnell DE, Cazzola M. Impact of LABA/LAMA combination on exercise endurance and lung hyperinflation in COPD: A pair-wise and network meta-analysis. Respiratory Medicine 2017;129:189‑98.
7. Wedzicha JA, Banerji D, Chapman KR, Vestbo J, Roche N, Ayers RT, et al. Indacaterol–glycopyrronium versus salmeterol–fluticasone for COPD. N Engl J Med 2016;374(23):2222‑34.
8. Roche N, Chapman KR, Vogelmeier CF, Herth FJF, Thach C, Fogel R, et al. Blood eosinophils and response to maintenance chronic obstructive pulmonary disease treatment. Data from the FLAME Trial. Am J Respir Crit Care Med 2017;195(9):1189‑97.
9. Lipson DA, Barnhart F, Brealey N, Brooks J, Criner GJ, Day NC, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med 2018;378(18):1671‑80.
10. Singh S, Maltais F, Tombs L, Fahy WA, Vahdati-Bolouri M, Locantore N, et al. Relationship between exercise endurance and static hyperinflation in a post hoc analysis of two clinical trials in patients with COPD. Int J Chron Obstruct Pulmon Dis 2018;13:203‑15.
11. Martinez FJ, Rabe KF, Ferguson GT, Wedzicha JA, Singh D, Wang C, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med 2021;203(5):553‑64.
12. Vogelmeier CF, Gaga M, Aalamian-Mattheis M, Greulich T, Marin JM, Castellani W, et al. Efficacy and safety of direct switch to indacaterol/glycopyrronium in patients with moderate COPD: The CRYSTAL open-label randomised trial. Respir Res 2017;18:140.
13. Papi A, Vestbo J, Fabbri L, Corradi M, Prunier H, Cohuet G, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): A double-blind, parallel group, randomised controlled trial. The Lancet 2018;391(10125):1076‑84.
14. Singh D, Papi A, Corradi M, Pavlišová I, Montagna I, Francisco C, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting β2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): A double-blind, parallel group, randomised controlled trial. The Lancet 2016;388(10048):963‑73.
15. Lipson DA, Barnacle H, Birk R, Brealey N, Locantore N, Lomas DA, et al. FULFIL Trial: Once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2017;196(4):438‑46.
16. Lipson DA, Crim C, Criner GJ, Day NC, Dransfield MT, Halpin DMG, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2020;201(12):1508‑16.
17. Nici L, Mammen MJ, Charbek E, Alexander PE, Au DH, Boyd CM, et al. Pharmacologic management of chronic obstructive pulmonary disease. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med 2020;201(9):e56‑69.
18. Chapman KR, Hurst JR, Frent S-M, Larbig M, Fogel R, Guerin T, et al. Long-term triple therapy de-escalation to indacaterol/glycopyrronium in patients with chronic obstructive pulmonary disease (SUNSET): A randomized, double-blind, triple-dummy clinical trial. Am J Respir Crit Care Med 2018;198(3):329‑39.
19. Magnussen H, Disse B, Rodriguez-Roisin R, Kirsten A, Watz H, Tetzlaff K, et al. Withdrawal of inhaled glucocorticoids and exacerbations of COPD. N Engl J Med 2014;371(14):1285‑94.
20. Watz H, Tetzlaff K, Wouters EFM, Kirsten A, Magnussen H, Rodriguez-Roisin R, et al. Blood eosinophil count and exacerbations in severe chronic obstructive pulmonary disease after withdrawal of inhaled corticosteroids: A post-hoc analysis of the WISDOM trial. The Lancet Respiratory Medicine 2016;4(5):390‑8.
21. Papi A, Kostikas K, Wedzicha JA, Vogelmeier CF, Roche N, Shen S, et al. Dual bronchodilation response by exacerbation history and eosinophilia in the FLAME Study. Am J Respir Crit Care Med 2018;197(9):1223‑6.
22. Currow DC, Abernethy AP, Ko DN. The active identification and management of chronic refractory breathlessness is a human right. Thorax 2014;69(4):393‑4.
23. Dransfield MT, Voelker H, Bhatt SP, Brenner K, Casaburi R, Come CE, et al. Metoprolol for the prevention of acute exacerbations of COPD. N Engl J Med 2019;381(24):2304-14.
24. Bhatt SP, Rabe KF, Hanania NA, Vogelmeier CF, Cole J, Bafadhel M, et al. Dupilumab for COPD with type 2 inflammation indicated by eosinophil counts. N Engl J Med 2023;389(3):205-14.
2. Donohue JF, Betts KA, Du EX, Altman P, Goyal P, Keininger DL, et al. Comparative efficacy of long-acting β2-agonists as monotherapy for chronic obstructive pulmonary disease: A network meta-analysis. Int J Chron Obstruct Pulmon Dis 2017;12:367‑81.
3. Geake JB, Dabscheck EJ, Wood‐Baker R, Cates CJ. Indacaterol, a once‐daily beta2‐agonist, versus twice‐daily beta2‐agonists or placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2015;2015(1):CD010139.
4. Zhou Y, Zhong N, Li X, Chen S, Zheng J, Zhao D, et al. Tiotropium in early-stage chronic obstructive pulmonary disease. N Engl J Med 2017;377(10):923‑35.
5. Decramer ML, Chapman KR, Dahl R, Frith P, Devouassoux G, Fritscher C, et al. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): A randomised, blinded, parallel-group study. The Lancet Respiratory Medicine 2013;1(7):524‑33.
6. Calzetta L, Ora J, Cavalli F, Rogliani P, O’Donnell DE, Cazzola M. Impact of LABA/LAMA combination on exercise endurance and lung hyperinflation in COPD: A pair-wise and network meta-analysis. Respiratory Medicine 2017;129:189‑98.
7. Wedzicha JA, Banerji D, Chapman KR, Vestbo J, Roche N, Ayers RT, et al. Indacaterol–glycopyrronium versus salmeterol–fluticasone for COPD. N Engl J Med 2016;374(23):2222‑34.
8. Roche N, Chapman KR, Vogelmeier CF, Herth FJF, Thach C, Fogel R, et al. Blood eosinophils and response to maintenance chronic obstructive pulmonary disease treatment. Data from the FLAME Trial. Am J Respir Crit Care Med 2017;195(9):1189‑97.
9. Lipson DA, Barnhart F, Brealey N, Brooks J, Criner GJ, Day NC, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med 2018;378(18):1671‑80.
10. Singh S, Maltais F, Tombs L, Fahy WA, Vahdati-Bolouri M, Locantore N, et al. Relationship between exercise endurance and static hyperinflation in a post hoc analysis of two clinical trials in patients with COPD. Int J Chron Obstruct Pulmon Dis 2018;13:203‑15.
11. Martinez FJ, Rabe KF, Ferguson GT, Wedzicha JA, Singh D, Wang C, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med 2021;203(5):553‑64.
12. Vogelmeier CF, Gaga M, Aalamian-Mattheis M, Greulich T, Marin JM, Castellani W, et al. Efficacy and safety of direct switch to indacaterol/glycopyrronium in patients with moderate COPD: The CRYSTAL open-label randomised trial. Respir Res 2017;18:140.
13. Papi A, Vestbo J, Fabbri L, Corradi M, Prunier H, Cohuet G, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): A double-blind, parallel group, randomised controlled trial. The Lancet 2018;391(10125):1076‑84.
14. Singh D, Papi A, Corradi M, Pavlišová I, Montagna I, Francisco C, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting β2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): A double-blind, parallel group, randomised controlled trial. The Lancet 2016;388(10048):963‑73.
15. Lipson DA, Barnacle H, Birk R, Brealey N, Locantore N, Lomas DA, et al. FULFIL Trial: Once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2017;196(4):438‑46.
16. Lipson DA, Crim C, Criner GJ, Day NC, Dransfield MT, Halpin DMG, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2020;201(12):1508‑16.
17. Nici L, Mammen MJ, Charbek E, Alexander PE, Au DH, Boyd CM, et al. Pharmacologic management of chronic obstructive pulmonary disease. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med 2020;201(9):e56‑69.
18. Chapman KR, Hurst JR, Frent S-M, Larbig M, Fogel R, Guerin T, et al. Long-term triple therapy de-escalation to indacaterol/glycopyrronium in patients with chronic obstructive pulmonary disease (SUNSET): A randomized, double-blind, triple-dummy clinical trial. Am J Respir Crit Care Med 2018;198(3):329‑39.
19. Magnussen H, Disse B, Rodriguez-Roisin R, Kirsten A, Watz H, Tetzlaff K, et al. Withdrawal of inhaled glucocorticoids and exacerbations of COPD. N Engl J Med 2014;371(14):1285‑94.
20. Watz H, Tetzlaff K, Wouters EFM, Kirsten A, Magnussen H, Rodriguez-Roisin R, et al. Blood eosinophil count and exacerbations in severe chronic obstructive pulmonary disease after withdrawal of inhaled corticosteroids: A post-hoc analysis of the WISDOM trial. The Lancet Respiratory Medicine 2016;4(5):390‑8.
21. Papi A, Kostikas K, Wedzicha JA, Vogelmeier CF, Roche N, Shen S, et al. Dual bronchodilation response by exacerbation history and eosinophilia in the FLAME Study. Am J Respir Crit Care Med 2018;197(9):1223‑6.
22. Currow DC, Abernethy AP, Ko DN. The active identification and management of chronic refractory breathlessness is a human right. Thorax 2014;69(4):393‑4.
23. Dransfield MT, Voelker H, Bhatt SP, Brenner K, Casaburi R, Come CE, et al. Metoprolol for the prevention of acute exacerbations of COPD. N Engl J Med 2019;381(24):2304-14.
24. Bhatt SP, Rabe KF, Hanania NA, Vogelmeier CF, Cole J, Bafadhel M, et al. Dupilumab for COPD with type 2 inflammation indicated by eosinophil counts. N Engl J Med 2023;389(3):205-14.
Dans cet article
- Monothérapie avec un bronchodilatateur de courte ou longue durée d’action
- Bithérapie si la dyspnée persiste
- Trithérapie pour réduire les exacerbations
- Désescalade en cas d’inefficacité ou d’effets indésirables
- Macrolides au long cours hors AMM en cas d’exacerbations
- Autres traitements médicamenteux
- Les biothérapies pourraient trouver une place