Spondyloarthrites. Le retard diagnostique entraîne une perte de chance concernant l’évolution de la maladie. Un délai diagnostique supérieur à 5 ans serait associé significativement à une atteinte structurale plus sévère, une mobilité rachidienne diminuée et une altération fonctionnelle.
Les spondylarthropathies ont longtemps été définies comme des affections différentes partageant certaines atteintes : l’atteinte axiale, des arthrites périphériques, des enthésites, des dactylites, des manifestations extra-articulaires et un terrain immunogénétique commun. Ce concept a évolué vers celui unifié de spondyloarthrites, où l’on ne considère plus différentes maladies proches, mais une seule affection avec différents phénotypes. Les deux phénotypes principaux sont l’atteinte axiale prédominante et l’atteinte périphérique prédominante, articulaire ou enthésitique. Le pronostic et le retentissement fonctionnel diffèrent en fonction du phénotype.
Évolution des spondyloarthrites
L’évolution de la maladie est variable et imprévisible à l’échelon individuel d’un patient à l’autre, le plus souvent par poussées, avec une symptomatologie elle aussi d’intensité variable.
Les spondyloarthrites ont majoritairement un bon pronostic.1 Cependant, il y a peu de données sur le pronostic global. La majorité des études se sont focalisées soit sur les facteurs prédictifs de sévérité à partir de cohortes de spondylarthrites ankylosantes ou de rhumatismes psoriasiques suivis en milieu hospitalier, potentiellement plus graves, soit sur les facteurs prédictifs de passage de la forme axiale non radiographique vers la forme radiographique.
Concernant ce dernier point, la prévalence des formes non radio- graphiques sur un panel de spondyloarthrites axiales récentes varie entre 23 et 80 %. L’évolution vers une forme radiographique, c’est-à-dire vers une sacro-iliite radiographique, concerne de 4,9 à 12 % des patients à 2 ans, 19,4 à 27,3 % à 15 ans et pourrait concerner jusqu’à 68,5 % des cas à long terme.2, 3
Ces données récentes suggèrent que la progression structurale existe dans les spondyloarthrites axiales non radiographiques, mais seulement chez une faible proportion de patients, et que cette progression est influencée par les facteurs génétiques (HLA-B27), environnementaux (tabagisme) et inflammatoires (sacro-iliite en imagerie par résonance magnétique [IRM], protéine C réactive élevée).4, 5 La proportion de spondyloarthrites radiographiques évoluant vers une ankylose rachidienne (colonne bambou) est moins bien connue.
Les spondyloarthrites axiales non radiographiques sont moins souvent masculines, ont moins d’inflammation biologique, moins de lésions inflammatoires en imagerie par résonance magnétique (IRM) et moins de limitation de la mobilité rachidienne, mais elles ont le même profil clinique, le même profil génétique et le même retentissement clinique que les spondyloarthrites axiales radiographiques.6
Les spondyloarthrites ont majoritairement un bon pronostic.1 Cependant, il y a peu de données sur le pronostic global. La majorité des études se sont focalisées soit sur les facteurs prédictifs de sévérité à partir de cohortes de spondylarthrites ankylosantes ou de rhumatismes psoriasiques suivis en milieu hospitalier, potentiellement plus graves, soit sur les facteurs prédictifs de passage de la forme axiale non radiographique vers la forme radiographique.
Concernant ce dernier point, la prévalence des formes non radio- graphiques sur un panel de spondyloarthrites axiales récentes varie entre 23 et 80 %. L’évolution vers une forme radiographique, c’est-à-dire vers une sacro-iliite radiographique, concerne de 4,9 à 12 % des patients à 2 ans, 19,4 à 27,3 % à 15 ans et pourrait concerner jusqu’à 68,5 % des cas à long terme.2, 3
Ces données récentes suggèrent que la progression structurale existe dans les spondyloarthrites axiales non radiographiques, mais seulement chez une faible proportion de patients, et que cette progression est influencée par les facteurs génétiques (HLA-B27), environnementaux (tabagisme) et inflammatoires (sacro-iliite en imagerie par résonance magnétique [IRM], protéine C réactive élevée).4, 5 La proportion de spondyloarthrites radiographiques évoluant vers une ankylose rachidienne (colonne bambou) est moins bien connue.
Les spondyloarthrites axiales non radiographiques sont moins souvent masculines, ont moins d’inflammation biologique, moins de lésions inflammatoires en imagerie par résonance magnétique (IRM) et moins de limitation de la mobilité rachidienne, mais elles ont le même profil clinique, le même profil génétique et le même retentissement clinique que les spondyloarthrites axiales radiographiques.6
Retentissement des spondyloarthrites
Ainsi, la spondyloarthrite a souvent été considérée comme une affection de bon pronostic et d’évolution fluctuante. Cependant, certains travaux rapportaient une réduction de l’espérance de vie, résultats non confirmés dans des publications plus récentes.7 L’excès de mortalité serait lié aux manifestations extra-arti- culaires, à un sur-risque cardio- vasculaire et étonnamment aussi à un taux d’alcoolisme et de suicide supérieur à celui observé dans la population générale.7
Quel que soit le phénotype, les patients atteints de spondyloarthrite axiale ont un retentissement fonctionnel. Le handicap fonctionnel augmente avec l’ancienneté de la maladie. En revanche, il n’y a pas de corrélation nette entre la sévérité des lésions structurales et la fonction. L’ankylose peut, dans les formes les plus sévères, entraîner une diminution de l’ampliation thoracique et de la mobilité du rachis et une insuffisance respiratoire restrictive.
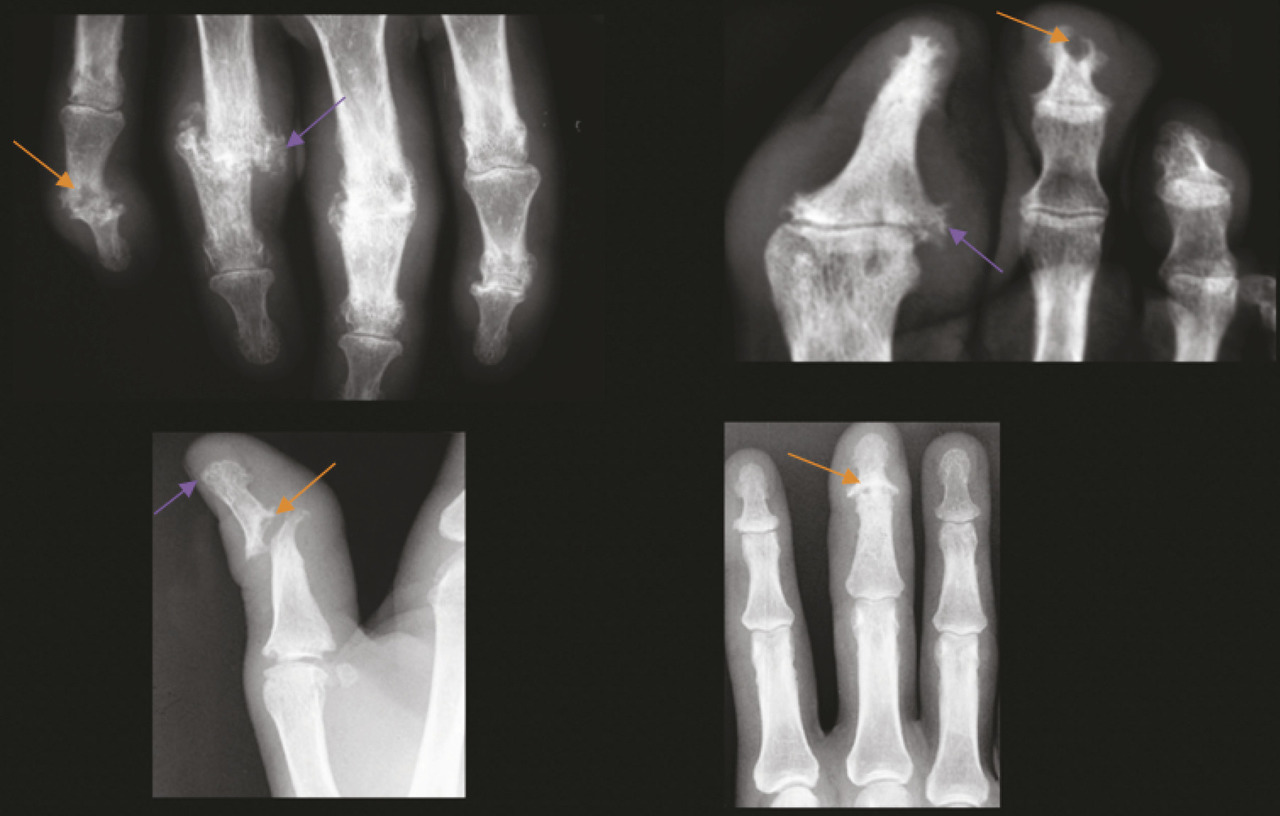
L’atteinte périphérique est également polymorphe, avec des arthralgies simples, des oligoarthrites asymétriques, des dactylites mais aussi parfois de véritables tableaux de polyarthrites érosives et mutilantes. Dans ces dernières, on observe l’association de lésions constructrices (ankylose, périostose, syndesmophytes) et de lésions destructrices (érosions, acro-ostéolyse) sur une même arti- culation ou une même région ana- tomique (main, pied) [v. figure]. Le pronostic fonctionnel dépend de l’activité de la maladie et des destructions structurales responsables du handicap.
Au total, la spondyloarthrite peut être responsable de douleurs chroniques, d’une asthénie, de raideur rachidienne, de destruction articulaire avec en particulier la coxite destructrice, d’ankylose rachidienne, et d’atteintes extra-articulaires comme l’ostéoporose ou l’uvéite antérieure, et ainsi causer un handicap fonctionnel sévère et une altération de la qualité de vie.8
Elle peut aussi avoir des conséquences professionnelles. Environ 15 % des patients atteints de spondylarthrite évoluent vers un état de santé néces- sitant une mise en invalidité ou en longue maladie. Cependant, même si plus de 80 % des patients poursuivent leurs activités professionnelles, il existe encore peu de données sur le présentéisme des patients atteints de spondyloarthrites. Enfin, encore peu d’études prennent en compte l’impact des biomédicaments sur le travail. Une meilleure connaissance des facteurs pronostiques permettra d’améliorer le maintien au travail.
Quel que soit le phénotype, les patients atteints de spondyloarthrite axiale ont un retentissement fonctionnel. Le handicap fonctionnel augmente avec l’ancienneté de la maladie. En revanche, il n’y a pas de corrélation nette entre la sévérité des lésions structurales et la fonction. L’ankylose peut, dans les formes les plus sévères, entraîner une diminution de l’ampliation thoracique et de la mobilité du rachis et une insuffisance respiratoire restrictive.
L’atteinte périphérique est également polymorphe, avec des arthralgies simples, des oligoarthrites asymétriques, des dactylites mais aussi parfois de véritables tableaux de polyarthrites érosives et mutilantes. Dans ces dernières, on observe l’association de lésions constructrices (ankylose, périostose, syndesmophytes) et de lésions destructrices (érosions, acro-ostéolyse) sur une même arti- culation ou une même région ana- tomique (main, pied) [v. figure]. Le pronostic fonctionnel dépend de l’activité de la maladie et des destructions structurales responsables du handicap.
Au total, la spondyloarthrite peut être responsable de douleurs chroniques, d’une asthénie, de raideur rachidienne, de destruction articulaire avec en particulier la coxite destructrice, d’ankylose rachidienne, et d’atteintes extra-articulaires comme l’ostéoporose ou l’uvéite antérieure, et ainsi causer un handicap fonctionnel sévère et une altération de la qualité de vie.8
Elle peut aussi avoir des conséquences professionnelles. Environ 15 % des patients atteints de spondylarthrite évoluent vers un état de santé néces- sitant une mise en invalidité ou en longue maladie. Cependant, même si plus de 80 % des patients poursuivent leurs activités professionnelles, il existe encore peu de données sur le présentéisme des patients atteints de spondyloarthrites. Enfin, encore peu d’études prennent en compte l’impact des biomédicaments sur le travail. Une meilleure connaissance des facteurs pronostiques permettra d’améliorer le maintien au travail.
Maladies extra-articulaires associées
À côté des manifestations rhumatologiques, il existe d’autres manifestations dites extra-articulaires ou systémiques (v. tableau) pouvant apparaître au décours de l’évolution de la maladie ou plus rarement être inaugurales, qui peuvent également avoir un retentissement fonctionnel surajouté.
L’atteinte ophtalmologique est l’atteinte la plus fréquente, surtout sous la forme d’une uvéite antérieure pouvant toucher près de 25 % des patients. Le retard de son diagnostic et de sa prise en charge peut engager le pronostic visuel.
L’atteinte digestive est une atteinte également fréquente. L’association à des maladies inflammatoires du tube digestif, maladie de Crohn et rectocolite hémorragique, s’observe dans environ 5 à 10 % des cas de spondyloarthrite. L’association à la maladie de Whipple est peu fréquente.
L’atteinte cardiovasculaire est classique, mais rare au cours de la maladie, que ce soit une insuffisance aortique, des atteintes vasculaires ou des troubles du rythme et de la conduction. Le psoriasis est l’atteinte cutanée la plus fréquemment associée aux spondyloarthrites (10 à 25 %). D’autres atteintes cutanées telles que la maladie de Verneuil ou le pyoderma gangrenosum peuvent être responsables d’un véritable handicap.
Enfin, on observe parfois des atteintes telles que l’amylose AA, la fibrose pulmonaire ou les néphropathies à immunoglobulines de type A, rares car plus l’apanage de spondyloarthrites anciennes négligées et insuffisamment traitées.
L’atteinte ophtalmologique est l’atteinte la plus fréquente, surtout sous la forme d’une uvéite antérieure pouvant toucher près de 25 % des patients. Le retard de son diagnostic et de sa prise en charge peut engager le pronostic visuel.
L’atteinte digestive est une atteinte également fréquente. L’association à des maladies inflammatoires du tube digestif, maladie de Crohn et rectocolite hémorragique, s’observe dans environ 5 à 10 % des cas de spondyloarthrite. L’association à la maladie de Whipple est peu fréquente.
L’atteinte cardiovasculaire est classique, mais rare au cours de la maladie, que ce soit une insuffisance aortique, des atteintes vasculaires ou des troubles du rythme et de la conduction. Le psoriasis est l’atteinte cutanée la plus fréquemment associée aux spondyloarthrites (10 à 25 %). D’autres atteintes cutanées telles que la maladie de Verneuil ou le pyoderma gangrenosum peuvent être responsables d’un véritable handicap.
Enfin, on observe parfois des atteintes telles que l’amylose AA, la fibrose pulmonaire ou les néphropathies à immunoglobulines de type A, rares car plus l’apanage de spondyloarthrites anciennes négligées et insuffisamment traitées.
Comorbidités
Pour les formes axiales, les comorbidités les plus fréquentes sont l’ostéoporose (13 % vs 5 % dans la population générale du même âge) ainsi que les ulcères gastroduodénaux (11 %) probablement secondaires à la prise d’anti-inflammatoires non stéroïdiens (AINS) au long cours. On note également des comorbidités cardiovasculaires, avec une hypertension artérielle, un tabagisme actif et une hypercholestérolémie respectivement chez 34 %, 29 % et 27 % des patients.9
Pour les formes périphériques et notamment pour le rhumatisme psoriasique, les comorbidités cardiovasculaires sont le plus représentées avec en particulier l’obésité et le syndrome métabolique (hypertension artérielle, diabète, hypercholestérolémie).
Citons également pour les formes axiales et périphériques l’association à des états dépressifs majeurs ainsi qu’à la fibromyalgie avec des fréquences comprises entre 5 et 20 %.
Pour les formes périphériques et notamment pour le rhumatisme psoriasique, les comorbidités cardiovasculaires sont le plus représentées avec en particulier l’obésité et le syndrome métabolique (hypertension artérielle, diabète, hypercholestérolémie).
Citons également pour les formes axiales et périphériques l’association à des états dépressifs majeurs ainsi qu’à la fibromyalgie avec des fréquences comprises entre 5 et 20 %.
Facteurs pronostiques de sévérité
La plupart des travaux sont des études rétrospectives, hétérogènes en termes de populations étudiées, de définition de la sévérité de la maladie, de durée de suivi et de qualité méthodologique. Cette hétérogénéité rend difficiles la comparaison et la synthèse des résultats. Cependant, on peut conclure que les facteurs prédictifs de sévérité de la maladie à moyen et long terme sont les suivants :
– un début précoce de la maladie ;
– l’atteinte coxo-fémorale et les autres atteintes articulaires périphériques ;
– la faible efficacité des anti-inflammatoires non stéroïdiens (AINS) ;
– le tabagisme ;
– la présence d’un syndrome inflammatoire biologique.
D’autres facteurs, tels que l’association à des maladies extra-articulaires, les comorbidités et la non-réponse aux traitements de fond, sont aussi des facteurs de mauvais pronostic à l’échelle individuelle.
Le retard diagnostique entraîne une perte de chance concernant l’évolution de la maladie. Un délai diagnostique supérieur à 5 ans serait associé significativement à une atteinte structurale plus sévère, une mobilité rachidienne diminuée et une altération fonctionnelle. Cependant, la notion de fenêtre d’opportunité, clairement démontrée dans la polyarthrite rhumatoïde, n’a pas encore été confirmée dans la spondyloarthrite.
Selon les dernières recommandations, l’objectif de la prise en charge est d’améliorer la qualité de vie, de contrôler les symptômes et l’inflammation, de prévenir les dommages structuraux, de préserver ou restaurer les capacités fonctionnelles, l’autonomie et la participation sociale des patients.10 Même si la fenêtre d’opportunité n’est pas formellement établie, il existe des arguments scientifiques pour justifier une prise en charge précoce, et tout particulièrement les formes périphériques associées au psoriasis. Ainsi, le diagnostic et la prise en charge doivent être les plus précoces possible. Reconnaître la maladie per- met au patient d’éviter une errance diagnostique prolongée, source d’angoisse supplémentaire, d’examens complémentaires inutiles, voire de procédures thérapeutiques inadaptées, inefficaces et/ou dangereuses, et d’être traités précocement, avec une incidence favorable sur le pronostic. Le rôle du médecin traitant est primordial dans l’orientation rapide du patient à un rhumatologue au début de la maladie, puis par son rôle central dans la coordination de la prise en charge multidisciplinaire.
– un début précoce de la maladie ;
– l’atteinte coxo-fémorale et les autres atteintes articulaires périphériques ;
– la faible efficacité des anti-inflammatoires non stéroïdiens (AINS) ;
– le tabagisme ;
– la présence d’un syndrome inflammatoire biologique.
D’autres facteurs, tels que l’association à des maladies extra-articulaires, les comorbidités et la non-réponse aux traitements de fond, sont aussi des facteurs de mauvais pronostic à l’échelle individuelle.
Le retard diagnostique entraîne une perte de chance concernant l’évolution de la maladie. Un délai diagnostique supérieur à 5 ans serait associé significativement à une atteinte structurale plus sévère, une mobilité rachidienne diminuée et une altération fonctionnelle. Cependant, la notion de fenêtre d’opportunité, clairement démontrée dans la polyarthrite rhumatoïde, n’a pas encore été confirmée dans la spondyloarthrite.
Selon les dernières recommandations, l’objectif de la prise en charge est d’améliorer la qualité de vie, de contrôler les symptômes et l’inflammation, de prévenir les dommages structuraux, de préserver ou restaurer les capacités fonctionnelles, l’autonomie et la participation sociale des patients.10 Même si la fenêtre d’opportunité n’est pas formellement établie, il existe des arguments scientifiques pour justifier une prise en charge précoce, et tout particulièrement les formes périphériques associées au psoriasis. Ainsi, le diagnostic et la prise en charge doivent être les plus précoces possible. Reconnaître la maladie per- met au patient d’éviter une errance diagnostique prolongée, source d’angoisse supplémentaire, d’examens complémentaires inutiles, voire de procédures thérapeutiques inadaptées, inefficaces et/ou dangereuses, et d’être traités précocement, avec une incidence favorable sur le pronostic. Le rôle du médecin traitant est primordial dans l’orientation rapide du patient à un rhumatologue au début de la maladie, puis par son rôle central dans la coordination de la prise en charge multidisciplinaire.
Impact des traitements sur le pronostic fonctionnel
La prise en charge pharmacologique des spondyloarthrites repose dans un premier temps sur l’utilisation d’AINS. Si plusieurs d’entre eux (à bonne dose maximale et/ou tolérée pendant une durée suffisante) s’avèrent inefficaces ou mal tolérés, peuvent être ensuite utilisés des traitements de fond synthétiques conventionnels (conventional synthetic disease-modifying antirheumatic drug [csDMARD]) tels que le métho- trexate ou la salazopyrine dans les formes périphériques et/ou des traitements biologiques dans les formes ayant une composante axiale. Ces biomédicaments ciblent différentes cytokines : tumor necrosis factor (TNF), interleukine 17, interleukine 23. Ces traitements ont montré une efficacité clinique, avec une amélioration des symptômes à court et long terme. Ils ont aussi démontré leur efficacité sur les paramètres de mobilité mais également sur la qualité de vie des patients.11-18 En revanche, les effets structuraux des biomédicaments sont moins clairs. En effet, il n’est pas éthique de mener des études de plusieurs années avec un bras placebo. Les seules comparaisons possibles pour évaluer l’effet structural des biomédicaments sont indirectes, par rapport à des cohortes historiques de spondyloarthrites par exemple. L’effet structural des anti-TNF n’a pas été démontré après 2 ans de traitement, mais une plus longue période d’exposition pourrait permettre un ralentissement de la progression radiographique. L’inhibition de l’interleukine 17 pourrait aussi avoir un effet structural.19
Les biomédicaments ont changé le pronostic des spondyloarthrites. Cependant, il existe encore des besoins non satisfaits. Par exemple, les facteurs prédictifs de réponse au traitement ne sont pas effectifs à l’échelon individuel. Autre exemple, il existe des douleurs et autres signes fonctionnels persistants malgré l’amélioration de l’inflammation sous traitement.20 Il convient donc de poursuivre les recherches afin d’améliorer la compréhension de la maladie et de son évolution pour mieux adapter la prise en charge thérapeutique.
Les biomédicaments ont changé le pronostic des spondyloarthrites. Cependant, il existe encore des besoins non satisfaits. Par exemple, les facteurs prédictifs de réponse au traitement ne sont pas effectifs à l’échelon individuel. Autre exemple, il existe des douleurs et autres signes fonctionnels persistants malgré l’amélioration de l’inflammation sous traitement.20 Il convient donc de poursuivre les recherches afin d’améliorer la compréhension de la maladie et de son évolution pour mieux adapter la prise en charge thérapeutique.
Références
1. van der Linden S, van der Heijde D, Braun J. Ankylosing spondylitis. In: Harris Jr. ED, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB, editors. Kelley’s Textbook of Rheumatology 2005:1125-41.
2. Wang R, Ward MM. Epidemiology of axial spondyloarthritis: an update. Curr Opin Rheumatol 2018;30:137-43.
3. Costantino F, Zeboulon N, Said-Nahal R, Breban M. Radiographic sacroiliitis develops predictably over time in a cohort of familial spondyloarthritis followed longitudinally. Rheumatology (Oxford) 2017;56:811-7.
4. Wang R, Gabriel SE, Ward MM. Progression of nonradiographic axial spondyloarthritis to ankylosing spondylitis: a population-based cohort study. Arthritis Rheumatol 2016;68:1415-21.
5. Dougados M, Demattei C, van den Berg R, et al. Rate and predisposing factors for sacroiliac joint radiographic progression after a two-year follow-up period in recent-onset spondyloarthritis. Arthritis Rheumatol 2016;68:1904-13.
6. Baraliakos X, Braun J. Non-radiographic axial spondyloarthritis and ankylosing spondylitis: what are the similarities and differences? RMD Open 2015;1:e000053.
7. Prati C, Claudepierre P, Pham T, Wendling D. Mortality in spondylarthritis. Joint Bone Spine 2011;78:466-70.
8. Lopez-Medina C, Garrido-Castro JL, Castro-Jimenez J, et al. Evaluation of quality of life in patients with axial spondyloarthritis and its association with disease activity, functionality, mobility, and structural damage. Clin Rheumatol 2018;37:1581-8.
9. Molto A, Etcheto A, van der Heijde D, et al. Prevalence of comorbidities and evaluation of their screening in spondyloarthritis: results of the international cross-sectional ASAS-COMOSPA study. Ann Rheum Dis 2016;75:1016-23.
10. Wendling D, Lukas C, Prati C, et al. 2018 update of French Society for Rheumatology (SFR) recommendations about the everyday management of patients with spondyloarthritis. Joint Bone Spine 2018;85:275-84.
11. Strand V, Singh JA. Patient burden of axial spondyloarthritis. J Clin Rheumatol 2017;23:383-91.
12. Pham T, van der Heijde DM, Pouchot J, Guillemin F. Development and validation of the French ASQoL questionnaire. Clin Exp Rheumatol 2010;28:379-85.
13. Sieper J, Lenaerts J, Wollenhaupt J, et al. Efficacy and safety of infliximab plus, naproxen versus naproxen alone in patients with early, active axial spondyloarthritis: results from the double-blind, placebo-controlled INFAST study, part 1. Ann Rheum Dis 2014;73:101-7.
14. Wang H, Zuo D, Sun M, et al. Randomized, placebo controlled and double-blind trials of efficacy and safety of adalimumab for treating ankylosing spondylitis: a meta-analysis. Int J Rheum Dis 2014;17:142-8.
15. Van der Heijde D, BrebanM, Halter D, et al. Maintenance of improvement in spinal mobility, physical function and quality of life in patients with ankylosing spondylitis after 5 years in a clinical trial of adalimumab. Rheumatology (Oxford) 2015;54:1210-9.
16. Sieper J, van derHeijde D, DougadosM, et al. A randomized, double-blind, placebo-controlled, sixteen-week study of subcutaneous golimumab in patients with active nonradiographic axial spondyloarthritis. Arthritis Rheumatol 2015;67:2702-12.
17. Van den Bosch F, Drescher E, Rosa J, et al. Long-term effects of etanercept on patient-reported outcomes in early non-radiographic axial spondyloarthritis: 104-week results of a phase III study [abstract]. Arthritis Rheumatol 2015;67(suppl 10):abstract 2285.
18. Sieper J, Kivitz A, van Tubergen A, et al. Impact of certolizumab pegol on patient-reported outcomes in patients with axial spondyloarthritis. Arthritis Care Res (Hoboken) 2015;67:1475-80.
19. Baeten D, Sieper J, Braun J, et al. Secukinumab, an interleukin-17A inhibitor, in ankylosing spondylitis. N Engl J Med 2015;373:2534-48.
20. McArthur MA, Birt L, Goodacre L. “Better but not best”: a qualitative exploration of the experiences of occupational gain for people with inflammatory arthritis receiving anti-TNFα treatment. Disabil Rehabil 2015;37:854-63
2. Wang R, Ward MM. Epidemiology of axial spondyloarthritis: an update. Curr Opin Rheumatol 2018;30:137-43.
3. Costantino F, Zeboulon N, Said-Nahal R, Breban M. Radiographic sacroiliitis develops predictably over time in a cohort of familial spondyloarthritis followed longitudinally. Rheumatology (Oxford) 2017;56:811-7.
4. Wang R, Gabriel SE, Ward MM. Progression of nonradiographic axial spondyloarthritis to ankylosing spondylitis: a population-based cohort study. Arthritis Rheumatol 2016;68:1415-21.
5. Dougados M, Demattei C, van den Berg R, et al. Rate and predisposing factors for sacroiliac joint radiographic progression after a two-year follow-up period in recent-onset spondyloarthritis. Arthritis Rheumatol 2016;68:1904-13.
6. Baraliakos X, Braun J. Non-radiographic axial spondyloarthritis and ankylosing spondylitis: what are the similarities and differences? RMD Open 2015;1:e000053.
7. Prati C, Claudepierre P, Pham T, Wendling D. Mortality in spondylarthritis. Joint Bone Spine 2011;78:466-70.
8. Lopez-Medina C, Garrido-Castro JL, Castro-Jimenez J, et al. Evaluation of quality of life in patients with axial spondyloarthritis and its association with disease activity, functionality, mobility, and structural damage. Clin Rheumatol 2018;37:1581-8.
9. Molto A, Etcheto A, van der Heijde D, et al. Prevalence of comorbidities and evaluation of their screening in spondyloarthritis: results of the international cross-sectional ASAS-COMOSPA study. Ann Rheum Dis 2016;75:1016-23.
10. Wendling D, Lukas C, Prati C, et al. 2018 update of French Society for Rheumatology (SFR) recommendations about the everyday management of patients with spondyloarthritis. Joint Bone Spine 2018;85:275-84.
11. Strand V, Singh JA. Patient burden of axial spondyloarthritis. J Clin Rheumatol 2017;23:383-91.
12. Pham T, van der Heijde DM, Pouchot J, Guillemin F. Development and validation of the French ASQoL questionnaire. Clin Exp Rheumatol 2010;28:379-85.
13. Sieper J, Lenaerts J, Wollenhaupt J, et al. Efficacy and safety of infliximab plus, naproxen versus naproxen alone in patients with early, active axial spondyloarthritis: results from the double-blind, placebo-controlled INFAST study, part 1. Ann Rheum Dis 2014;73:101-7.
14. Wang H, Zuo D, Sun M, et al. Randomized, placebo controlled and double-blind trials of efficacy and safety of adalimumab for treating ankylosing spondylitis: a meta-analysis. Int J Rheum Dis 2014;17:142-8.
15. Van der Heijde D, BrebanM, Halter D, et al. Maintenance of improvement in spinal mobility, physical function and quality of life in patients with ankylosing spondylitis after 5 years in a clinical trial of adalimumab. Rheumatology (Oxford) 2015;54:1210-9.
16. Sieper J, van derHeijde D, DougadosM, et al. A randomized, double-blind, placebo-controlled, sixteen-week study of subcutaneous golimumab in patients with active nonradiographic axial spondyloarthritis. Arthritis Rheumatol 2015;67:2702-12.
17. Van den Bosch F, Drescher E, Rosa J, et al. Long-term effects of etanercept on patient-reported outcomes in early non-radiographic axial spondyloarthritis: 104-week results of a phase III study [abstract]. Arthritis Rheumatol 2015;67(suppl 10):abstract 2285.
18. Sieper J, Kivitz A, van Tubergen A, et al. Impact of certolizumab pegol on patient-reported outcomes in patients with axial spondyloarthritis. Arthritis Care Res (Hoboken) 2015;67:1475-80.
19. Baeten D, Sieper J, Braun J, et al. Secukinumab, an interleukin-17A inhibitor, in ankylosing spondylitis. N Engl J Med 2015;373:2534-48.
20. McArthur MA, Birt L, Goodacre L. “Better but not best”: a qualitative exploration of the experiences of occupational gain for people with inflammatory arthritis receiving anti-TNFα treatment. Disabil Rehabil 2015;37:854-63