En l’absence de mesures de protection adaptées, l’exposition des populations aux iodes radioactifs peut être responsable de l’apparition de cancers de la thyroïde. En effet, une augmentation de l’incidence de cette pathologie a été observée chez des personnes qui étaient enfants et adolescents au moment de l’accident de Tchernobyl, dans les territoires contaminés par les retombées radioactives.
Au Japon, les conséquences réelles de l’accident de Fukushima sur l’incidence du cancer de la thyroïde ne seront, quant à elles, connues que dans plusieurs années.
La stratégie de protection de la population en cas de menace ou de rejet radioactif lors d’un accident nucléaire vise à limiter son exposition à un niveau aussi faible que possible. Cette stratégie est mise en œuvre sous l’autorité du préfet ; elle repose sur trois mesures principales : l’évacuation, la mise à l’abri et la prise unique d’iode stable.
À ce jour, aucune recommandation ne permettait de couvrir une éventuelle exposition des populations à des rejets répétés d’iodes radioactifs, mais en France c’est désormais chose faite – au moins partiellement.
Données pharmacocinétiques de l’iode
Absorptions orale et pulmonaire
Présent sous forme minérale et organique, l’iode est absorbé à l’état d’iodures. Son absorption orale est rapide et complète en deux heures environ. Lors d’un rejet accidentel, les formes gazeuses (organique et particulaire) des iodes radioactifs peuvent pénétrer dans l’organisme par voies orale et pulmonaire. L’iode moléculaire passe dans la circulation générale en quelques minutes au travers de l’arbre respiratoire. L’iode (qu’il soit stable ou radioactif) pénètre donc très facilement dans l’organisme, et il n’y a pas de barrière de perméabilité ou métabolique limitant son absorption.
Distribution des iodures : la thyroïde, premier organe cible
Une fois absorbés, les iodures se distribuent dans le compartiment extracellulaire et sont capturés très rapidement par les tissus exprimant un transporteur membranaire, le symporteur sodium/iodure (NIS), capable de les faire pénétrer dans le compartiment intracellulaire, en particulier dans la glande thyroïde. La capture thyroïdienne des iodures fait l’objet d’une régulation très fine en permettant à cette glande de s’adapter à une élévation transitoire ou constante de la concentration circulante en iode ; c’est l’effet de Wolff-Chaikoff. Il associe deux mécanismes : inhibition de la capacité d’accumulation d’iode dans la thyroïde par inactivation du transport de l’iode et inhibition transitoire de la sécrétion des hormones thyroïdiennes dont l’iode est le substrat.1 Cette inhibition est ainsi responsable de la rétention de l’iode, entraînant une augmentation de la dose de radioactivité si la personne a été exposée et, par conséquent, d’une cancérogenèse thyroïdienne éventuelle.2
Il est à noter que, si la thyroïde est l’organe privilégié d’accumulation des iodures, ceux-ci se distribuent aussi au niveau des glandes mammaires et salivaires, de la muqueuse gastrique et du placenta, localisations exprimant également le NIS.
Clairances externalisée et internalisée
La clairance corporelle totale des iodures est essentiellement rénale. Après ingestion d’iode, l’excrétion rénale du pool non fixé (par la thyroïde ou les autres organes) atteint son plateau entre 24 et 48 heures. L’iode est aussi éliminé dans les fèces, par le catabolisme hépatique des hormones thyroïdiennes. Enfin, il peut se concentrer sous forme inorganique dans le lait maternel jusqu’à 48 heures après son ingestion. Ces trois mécanismes de clairance contribuent à externaliser les iodures et, par conséquent, à réduire l’exposition interne au niveau tissulaire. En revanche, la clairance thyroïdienne, aussi importante quantitativement que la clairance rénale, constitue, elle, une étape d’internalisation des iodures au sein du tissu thyroïdien. La clairance thyroïdienne représente donc la principale origine de la radio-induction des cancers thyroïdiens par une augmentation de la durée d’exposition des tissus à l’iode radioactif.
La stratégie de protection thyroïdienne est donc de limiter, voire de bloquer, si possible, l’étape de captation et d’organification de l’iode au sein de la thyroïde afin de réduire la phase de cancérogenèse radio-induite.
Prophylaxie iodée, mesure de protection de la population
L’administration de comprimés d’iodure de potassium (KI) à la population permet de saturer la glande thyroïde par de l’iode stable et d’éviter ainsi la fixation et la pénétration des iodes radioactifs.3 L’objectif est de limiter l’apparition de pathologies thyroïdiennes, notamment cancéreuses, dans les années et décennies suivant l’exposition.
Quand ?
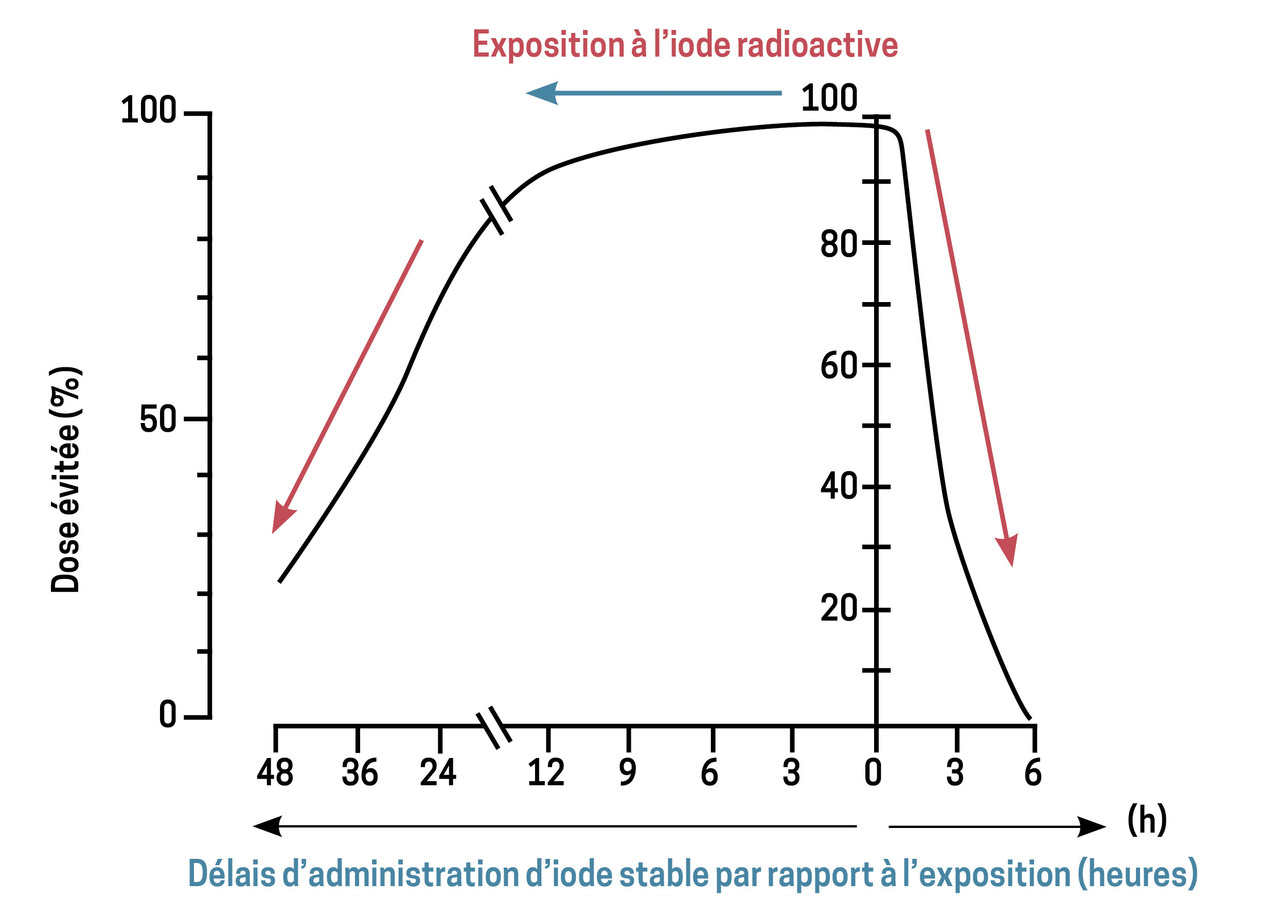
Pour être pleinement efficace, l’ingestion de cet antidote doit intervenir idéalement 1 à 2 heures avant l’exposition (figure). Plus l’administration de KI est tardive, plus la perte d’efficacité est marquée.4 La mise en œuvre rapide de cette mesure est d’autant plus capitale que les iodes rejetés ont une courte période physique (8 jours pour l’iode 131, par exemple), et sont susceptibles d’engendrer une toxicité thyroïdienne importante dès leur fixation.
Comment ?
En France, la doctrine iode,5 publiée par l’Autorité de sûreté nucléaire, prévoit que l’ensemble de la population susceptible d’être exposée aux rejets radioactifs bénéficie de cette mesure de protection, en veillant à donner la priorité aux femmes enceintes et aux jeunes de moins de 18 ans : administration d’une prise unique d’iode stable sous forme de comprimés de KI à 65 mg, selon un schéma posologique conforme aux recommandations de l’Organisation mondiale de la santé (OMS).6 La production de ces comprimés est assurée, en France, par la Pharmacie centrale des armées (PCA). La prise de ce traitement se fait sur instruction des autorités compétentes.
Limites d’une prophylaxie en prise unique
L’émission radioactive peut être ponctuelle ou prolongée dans le temps.
Parmi les questionnements issus du retour d’expérience de l’accident nucléaire de Fukushima au Japon en 2011, se pose notamment celui de l’évolution de la doctrine de prise d’iode pour assurer une protection optimale de la population au travers de possibles prises répétées en situation de rejets prolongés.
Sur un plan strictement règlementaire, l’autorisation de mise sur le marché (AMM) initiale des comprimés de KI ne permettait pas d’envisager des prises réitérées, puisqu’elle avait été délivrée sur la base d’études toxicologiques et d’efficacité prévoyant une prise unique. Dans la dernière version de ses recommandations, l’OMS avait annoncé un besoin de recherches pour objectiver une balance bénéfice-risque favorable à une prophylaxie répétée par le KI.6
Des avancées françaises !
Initié en 2014 et coordonné par l’IRSN, le programme de recherche PRIODAC (« Prophylaxie répétée par l’iode stable en situation accidentelle ») avait plusieurs objectifs : déterminer les modalités d’administrations répétées d’iode stable et en évaluer les éventuels effets indésirables (étude de toxicité) sur des modèles précliniques représentatifs des différentes classes d’âge de la population.7 Les études précliniques ont permis de déterminer une balance bénéfice-risque favorable pour les prises répétées de KI pendant sept jours consécutifs.
Une première modification de l’AMM pour une prophylaxie répétée chez l’adulte (sauf femmes enceintes ou allaitantes) et l’enfant de plus de 12 ans a ainsi pu être obtenue en France en mars 2020.8
Au sein de ce programme, des travaux de recherche sont en cours, afin de valider par des études (selon les bonnes pratiques de laboratoire [BPL]) la prophylaxie répétée de KI chez les femmes enceintes et les enfants de moins de 12 ans. En fonction des résultats obtenus, une nouvelle variation de l’AMM étendant le principe d’une prise sur sept jours à l’ensemble des catégories de la population pourrait être envisagée. Dans les suites de ce changement d’AMM, le Haut Conseil de la santé publique a publié un avis « relatif à l’actualisation des recommandations concernant la protection des populations par l’iode stable en cas d’accident nucléaire », le 6 juillet 2021.9 Les travaux français sont particulièrement suivis par l’OMS.
En pratique
Le KI est donc une contre-mesure pharmacologique permettant de prévenir l’accumulation d’iode radioactif au niveau de la thyroïde. Son administration se fait sur instruction des autorités compétentes et s’inscrit dans un dispositif global de radioprotection défini au niveau ministériel. Des campagnes de distribution de comprimés d’iode ont lieu régulièrement depuis 1997 pour les personnes qui résident ou travaillent à proximité d’une centrale nucléaire (rayon de 20 km).
Posologie et mode de conservation
La dose à administrer varie selon le profil du patient (
Chez la femme enceinte, allaitante et l’enfant de moins de 12 ans, la prise réitérée n’est pas actuellement recommandée. Ils doivent donc faire l’objet d’une évacuation prioritaire de la zone contaminée.
Le KI se conserve 10 ans au maximum8, dans l’emballage extérieur d’origine, à l’abri de l’humidité, à une température inférieure à 25 °C.
Surveillance après prophylaxie
Les populations ayant bénéficié du traitement par KI doivent faire l’objet d’une surveillance par le médecin traitant.
Le Résumé des caractéristiques du produit8 recommande une prise en charge spécifique après la prise de KI :
– pour les femmes enceintes exposées au-delà de la 12e semaine de gestation (début de production thyroïdienne fœtale), une surveillance échographique jusqu’à la fin de la grossesse puis un suivi du nouveau-né avec recherche de goitre et un contrôle de la fonction thyroïdienne (TSH, T4 libre) sont recommandés ;
– pour les nourrissons de moins de 12 mois et pour les femmes allaitantes, un contrôle de la fonction thyroïdienne (TSH et T4 libre) doit être pratiqué deux semaines après administration ;
– pour les sujets ayant un antécédent de goitre ou de pathologie thyroïdienne évolutive ou non, une surveillance clinique est nécessaire.
Contre-indications
En l’état actuel des connaissances, sauf rarissimes pathologies immunologiques préexistantes, il n’existe pas de contre-indication à l’administration du KI.8
1. Wolff J, Chaikoff IL. Plasma inorganic iodide as a homeostatic regulator of thyroid function. J Biol Chem 1948;174(2):555-64.
2. Ron E, Lubin JH, Shore RE, et al. Thyroid cancer after exposure to external radiation: a pooled analysis of seven studies. Radiat Res 1995;141(3):259-77.
3. Verger P, Aurengo A, Geoffroy B, et al. Iodine kinetics and effectiveness of stable iodine prophylaxis after intake of radioactive iodine: a review. Thyroid 2001;11(4):353-60.
4. Geoffroy B, Verger P, Le Guen B. Pharmacocinétique de l’iode : revue des connaissances utiles en radioprotection accidentelle. Radioprotection 2000;35(2):151-74.
5. Autorité de sûreté nucléaire. Éléments de doctrine pour la gestion post-accidentelle d’un accident nucléaire. Octobre 2012. Disponible sur : https://bit.ly/3B8xgLT
6. OMS, IRSN. Blocage de la thyroïde par l’iode : guide de directives pour la planification et la réponse aux situations d’urgence nucléaire ou radiologique. 2020.
7. IRSN. Le projet PRIODAC (prophylaxie répétée par l’iode stable en situation accidentelle) : https://bit.ly/3l9P6Zg
8. ANSM. Résumé des caractéristiques du produit – Iodure de potassium Pharmacie centrale des armées 65 mg comprimé sécable. Consulté le 24 juin 2021, disponible sur : https://bit.ly/3DaHonW
9. HCSP. Avis relatif à l’actualisation des recommandations concernant la protection des populations par l’iode stable en cas d’accident nucléaire. 6 juillet 2021.