Les implants mammaires à visée esthétique ou posés après chirurgie pour cancer du sein peuvent être remplis de sérum physiologique ou, la plupart du temps, de silicone.
Leur forme peut être ronde ou anatomique (en « goutte »).
Le suivi des patientes ayant des prothèses diffère selon les antécédents et la clinique.
Leur forme peut être ronde ou anatomique (en « goutte »).
Le suivi des patientes ayant des prothèses diffère selon les antécédents et la clinique.
Quelle imagerie ?
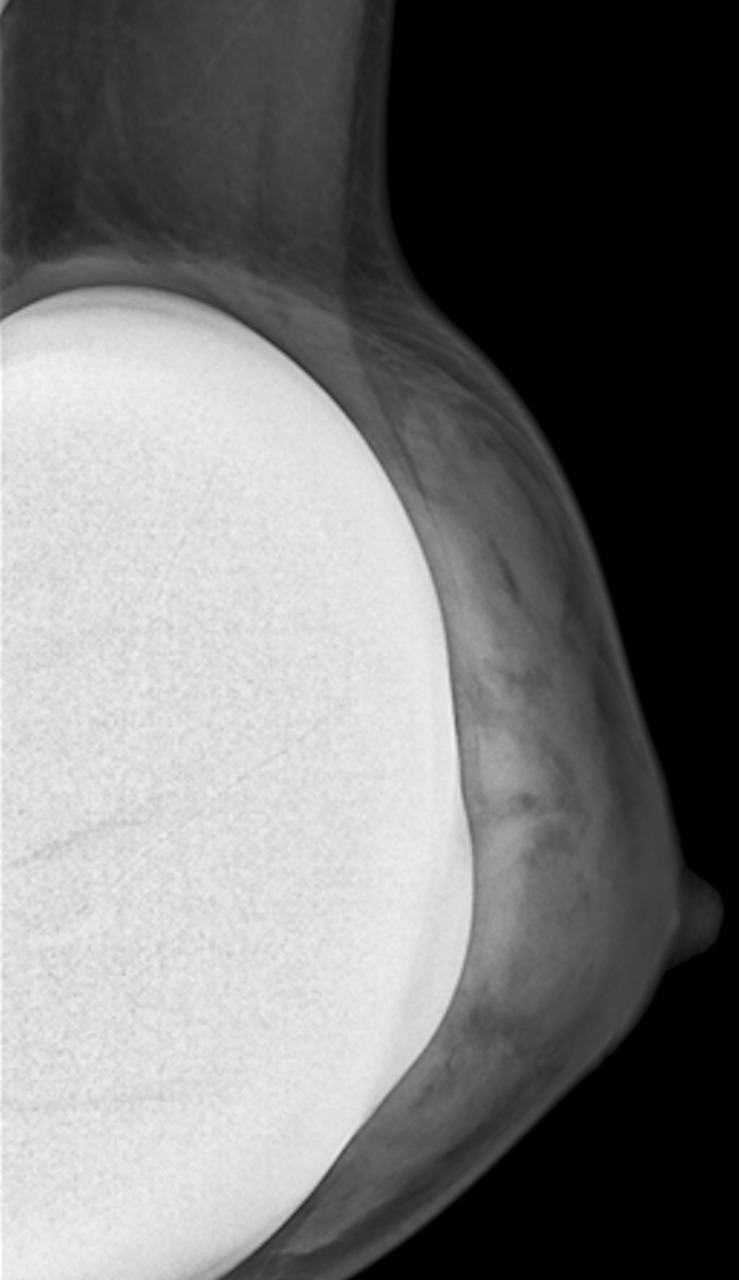
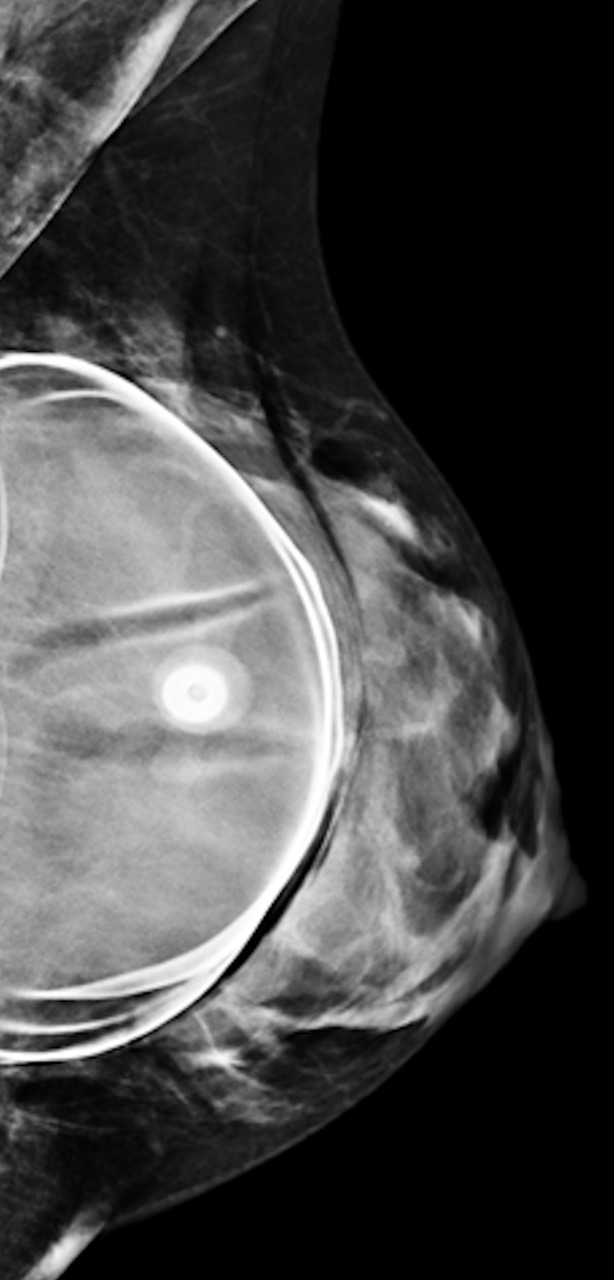
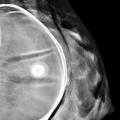
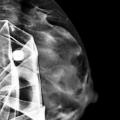
En mammographie : aspect rond, régulier, hyperdense si en silicone (fig. 1), moins dense en cas de sérum physiologique (fig. 2). Confirmé par la tomosynthèse (3D), à utiliser avec parcimonie en raison de l’exposition aux rayons.
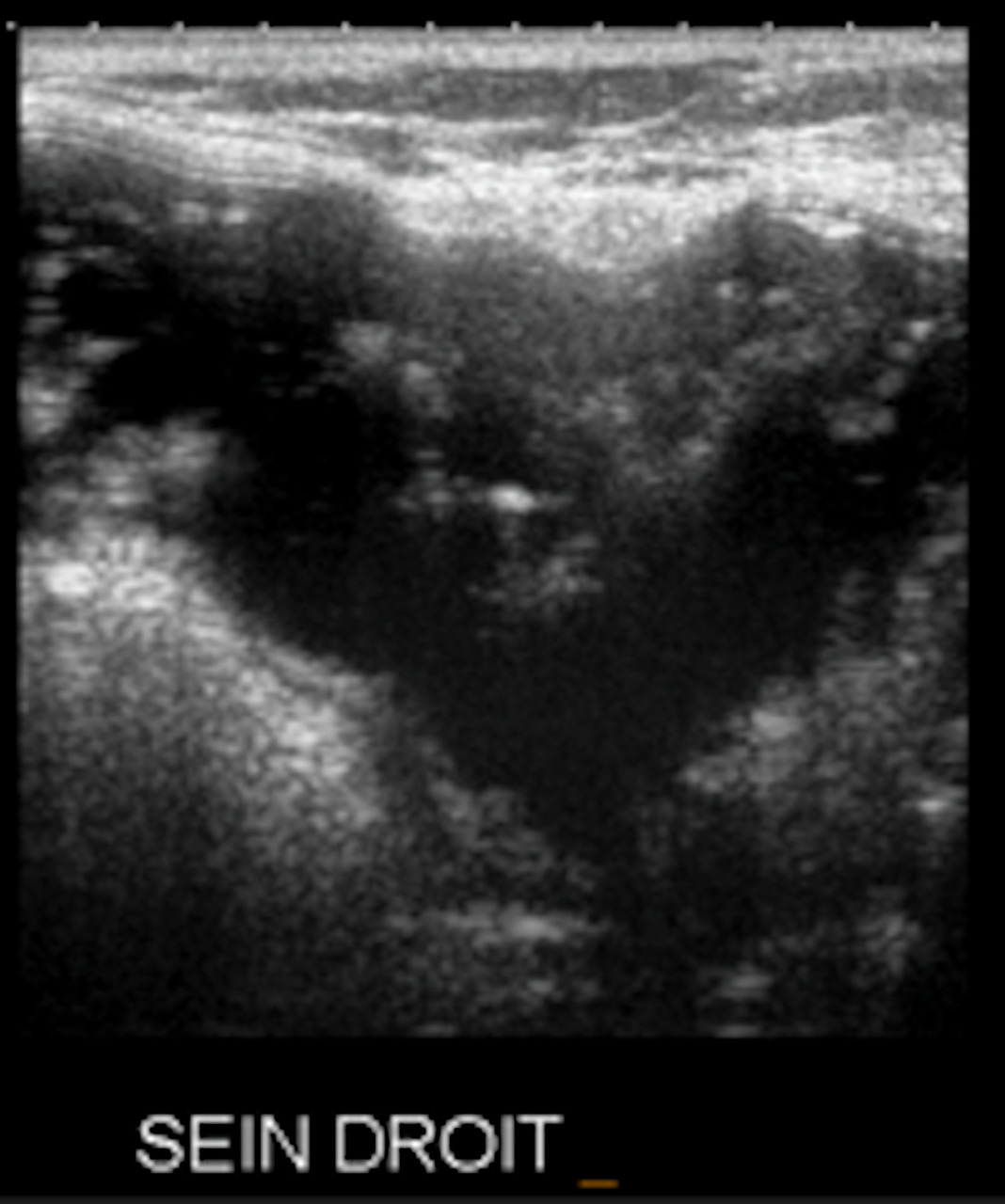
En échographie, impossible de différencier les 2 types : image liquidienne homogène, anéchogène, avec paroi régulière. Parfois des petits plis sont palpables sous la peau.
En IRM mammaire :
– des séquences spécifiques (dédiées silicone) suppriment le signal de l’eau et de la graisse, rendant possible le diagnostic précis de rupture ou de siliconome ;
– pour une analyse concomitante de la glande mammaire : injecter du gadolinium.
En échographie, impossible de différencier les 2 types : image liquidienne homogène, anéchogène, avec paroi régulière. Parfois des petits plis sont palpables sous la peau.
En IRM mammaire :
– des séquences spécifiques (dédiées silicone) suppriment le signal de l’eau et de la graisse, rendant possible le diagnostic précis de rupture ou de siliconome ;
– pour une analyse concomitante de la glande mammaire : injecter du gadolinium.
En l’absence de symptôme
Après chirurgie esthétique : pas de suivi radiologique, en dehors du dépistage classique du cancer.
Après ablation thérapeutique : suivi identique à celui du cancer du sein : mammo- et échographie mammaire annuelles, avec IRM si haut risque familial ou personnel (mutations BRCA).
Après mastectomie prophylactique bilatérale avec reconstruction, une simple surveillance clinique est aujourd’hui recommandée.1
Après ablation thérapeutique : suivi identique à celui du cancer du sein : mammo- et échographie mammaire annuelles, avec IRM si haut risque familial ou personnel (mutations BRCA).
Après mastectomie prophylactique bilatérale avec reconstruction, une simple surveillance clinique est aujourd’hui recommandée.1
En cas de plainte clinique
Augmentation de taille en postopératoire immédiat :
– en dehors de l’hématome survenant dans les 3 à 4 jours, suspecter un sérome (accumulation de liquide lymphatique). Confirmation échographique : collection liquidienne périprothétique. Abstention thérapeutique ou ponction évacuatrice, selon les cas ;
– l’infection est rare (1 à 2 % ; 1 à 6 semaines après chirurgie).
Prothèse durcissant avec le temps : peut évoquer une coque périprothétique => rechercher une rupture d’implant qui nécessite le remplacement chirurgical de la prothèse. Deux types :
• rupture intracapsulaire : aspect irrégulier de la paroi (linguine sign : images linéaires flottant dans le silicone) en mammo-, échographie ou IRM ;2
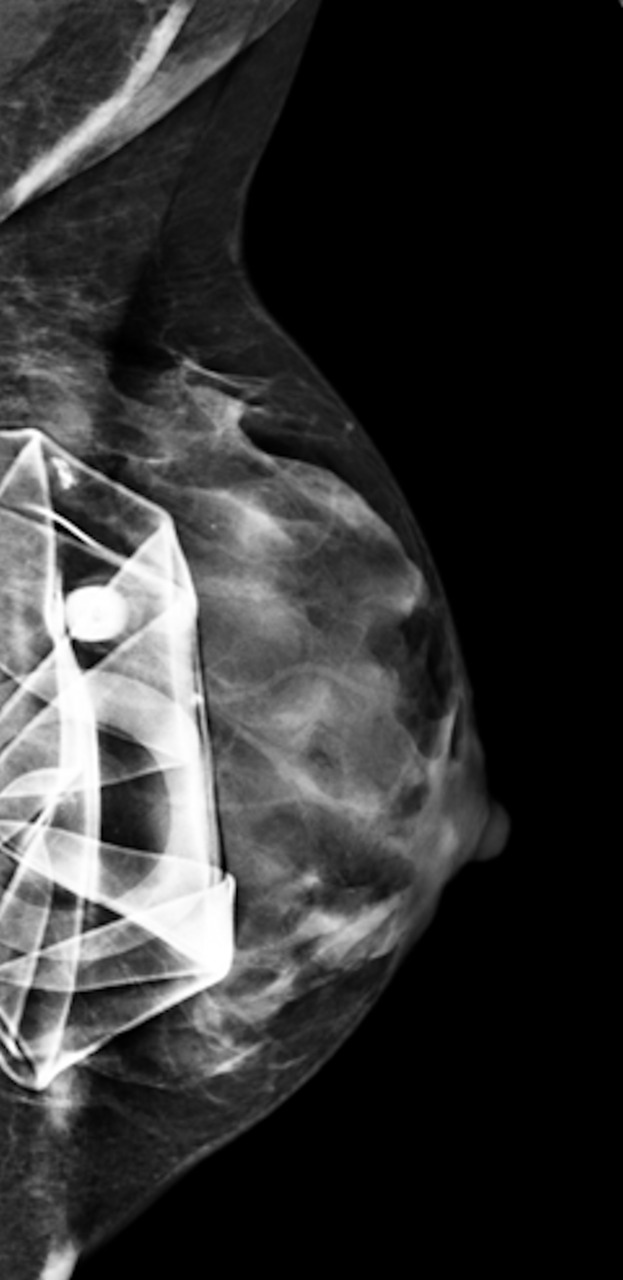
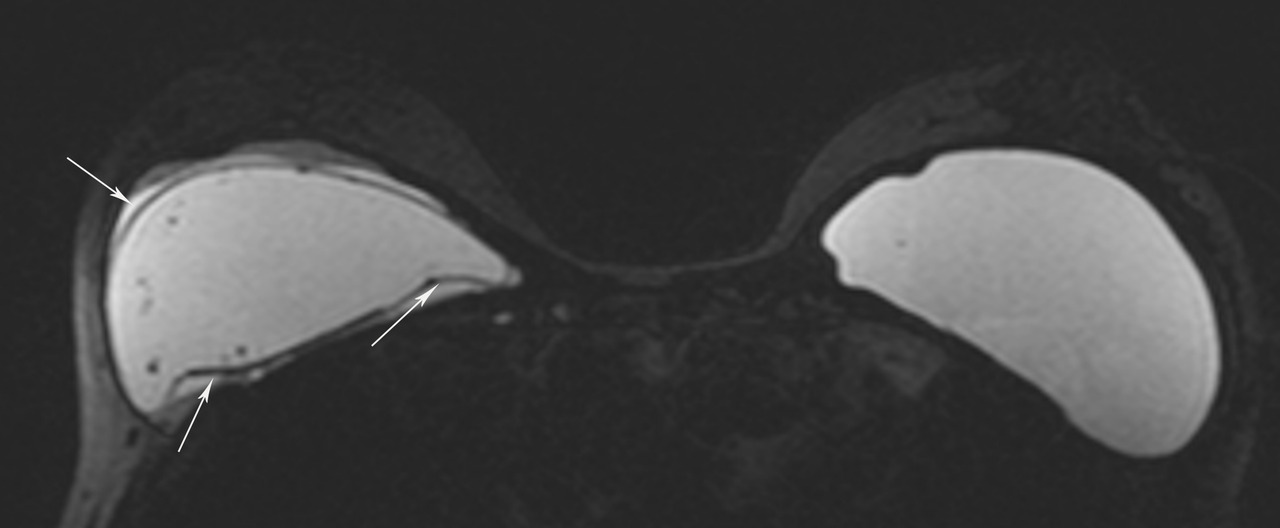
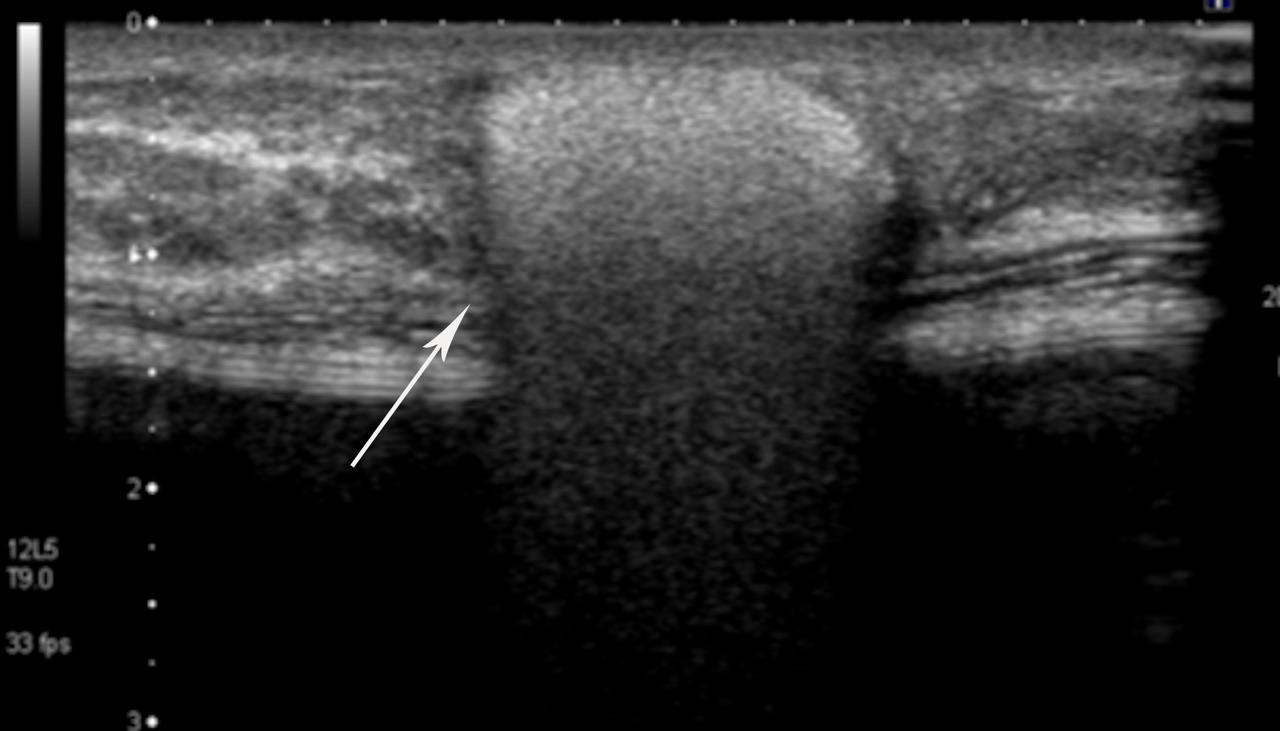
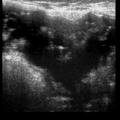
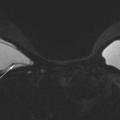
• extracapsulaire (fig. 3 et 4), contenu hétérogène avec échos internes et perte du contour régulier de la paroi à l’échographie. Diagnostic confirmé par l’IRM mammaire avec séquences dédiées silicone, qui montre l’incontinence de la prothèse (paroi irrégulière) et des dépôts de silicone rétro- ou périprothétiques. Des ganglions chargés en silicone peuvent être visibles.
Nodule palpé dans le sein ou dans les aires axillaires : en première intention, mammographie et échographie mammaire pour éliminer un cancer.
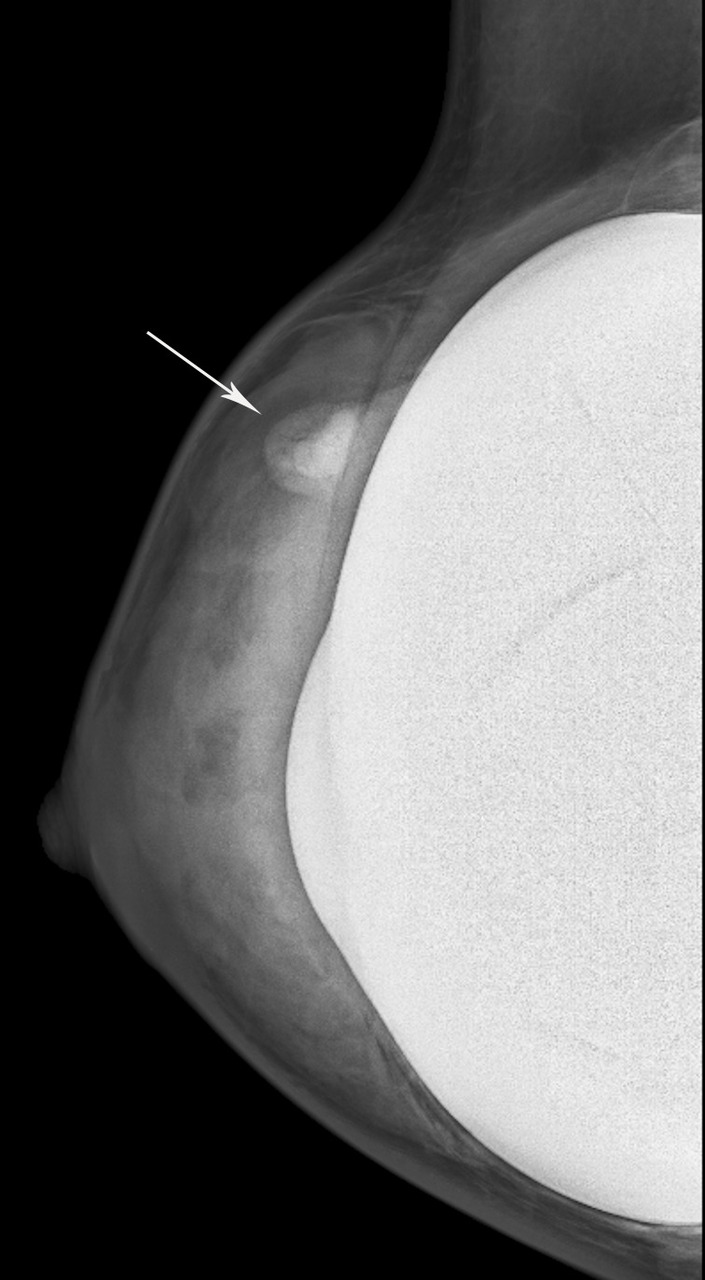
Siliconome : nodule bien régulier, dense en mammographie, hyperéchogène en échographie avec aspect en « tempête de neige » (fig. 5).
Ganglions siliconiques, pas toujours hypertrophiés : centre hyperéchogène et aspect en « tempête de neige ».3
=> Diagnostic fait par cytoponction ou micro- biopsie : silicone retrouvé sur la lame sous forme de grosses particules, associé à une réaction inflammatoire au contact. À l’IRM mammaire (pas indispensable) : nodule sans ou avec rehaussement, avec un signal élevé sur la séquence en T2, restant élevé sur celle dédiée (silicone).
Changement de la forme du sein : évocateur, en cas de prothèses anatomiques, d’une rotation de l’implant pouvant nécessiter un repositionnement. L’imagerie élimine un sérome.
Augmentation de taille du sein, avec plainte fonctionnelle : suspecter une rupture de la prothèse ou un sérome périprothétique (lame liquidienne autour de l’implant).
Épanchement liquidien périprothétique : penser au lymphome anaplasique à grandes cellules, rare mais grave (50 cas déclarés entre 2011 et 2018), affirmé par l’aspiration du liquide avec analyse histologique spécifique.4
– en dehors de l’hématome survenant dans les 3 à 4 jours, suspecter un sérome (accumulation de liquide lymphatique). Confirmation échographique : collection liquidienne périprothétique. Abstention thérapeutique ou ponction évacuatrice, selon les cas ;
– l’infection est rare (1 à 2 % ; 1 à 6 semaines après chirurgie).
Prothèse durcissant avec le temps : peut évoquer une coque périprothétique => rechercher une rupture d’implant qui nécessite le remplacement chirurgical de la prothèse. Deux types :
• rupture intracapsulaire : aspect irrégulier de la paroi (linguine sign : images linéaires flottant dans le silicone) en mammo-, échographie ou IRM ;2
• extracapsulaire (fig. 3 et 4), contenu hétérogène avec échos internes et perte du contour régulier de la paroi à l’échographie. Diagnostic confirmé par l’IRM mammaire avec séquences dédiées silicone, qui montre l’incontinence de la prothèse (paroi irrégulière) et des dépôts de silicone rétro- ou périprothétiques. Des ganglions chargés en silicone peuvent être visibles.
Nodule palpé dans le sein ou dans les aires axillaires : en première intention, mammographie et échographie mammaire pour éliminer un cancer.
Siliconome : nodule bien régulier, dense en mammographie, hyperéchogène en échographie avec aspect en « tempête de neige » (fig. 5).
Ganglions siliconiques, pas toujours hypertrophiés : centre hyperéchogène et aspect en « tempête de neige ».3
=> Diagnostic fait par cytoponction ou micro- biopsie : silicone retrouvé sur la lame sous forme de grosses particules, associé à une réaction inflammatoire au contact. À l’IRM mammaire (pas indispensable) : nodule sans ou avec rehaussement, avec un signal élevé sur la séquence en T2, restant élevé sur celle dédiée (silicone).
Changement de la forme du sein : évocateur, en cas de prothèses anatomiques, d’une rotation de l’implant pouvant nécessiter un repositionnement. L’imagerie élimine un sérome.
Augmentation de taille du sein, avec plainte fonctionnelle : suspecter une rupture de la prothèse ou un sérome périprothétique (lame liquidienne autour de l’implant).
Épanchement liquidien périprothétique : penser au lymphome anaplasique à grandes cellules, rare mais grave (50 cas déclarés entre 2011 et 2018), affirmé par l’aspiration du liquide avec analyse histologique spécifique.4
Encadre
- Le suivi des prothèses mammaires est avant tout clinique.
- Un bilan radiologique peut être demandé dès qu’une plainte fonctionnelle est émise ou qu’une anomalie est palpée.
- On choisit alors la mammo- et l’échographie mammaire en 1re intention, avec un recours facile à l’IRM pour ses excellentes sensibilité et spécificité.
Références
1. INCa. Femmes porteuses d’une mutation BRCA1 ou BRCA2. Détection précoce du cancer du sein et des annexes et stratégies de réduction du risque. Recommandations et référentiels. Mai 2017.
2. Wong T, Lo LW, Fung PY, et al. Magnetic resonance imaging of breast augmentation: a pictorial review. Insights Imaging 2016;7:399-410.
3. Johnson M. Breast implants: history, safety, and imaging. Radiol Technol 2013;84:439M-515M.
4. Expert Panel on Breast Imaging; Lourenco AP, Moy L, Baron P, et al. ACR Appropriateness, Criteria(®) Breast Implant Evaluation. J Am Coll Radiol 2018;15(5S):S13-S25.
2. Wong T, Lo LW, Fung PY, et al. Magnetic resonance imaging of breast augmentation: a pictorial review. Insights Imaging 2016;7:399-410.
3. Johnson M. Breast implants: history, safety, and imaging. Radiol Technol 2013;84:439M-515M.
4. Expert Panel on Breast Imaging; Lourenco AP, Moy L, Baron P, et al. ACR Appropriateness, Criteria(®) Breast Implant Evaluation. J Am Coll Radiol 2018;15(5S):S13-S25.

 Encadrés
Encadrés