Cette dermatose inflammatoire chronique, le plus souvent bénigne, peut avoir un impact psychosocial majeur. Le traitement, suspensif, repose sur des thérapeutiques locales, parfois systémiques et une prise en charge psychologique.
Une maladie fréquente
Le psoriasis touche environ 125 millions d’individus dans le monde.
La prévalence varie selon les pays, allant de 0,9 % aux États-Unis à 8,5 % en Norvège. On estime qu’en moyenne 2 à 4 % de la population est atteinte dans les pays occidentaux. En France, 2,4 millions d’individus seraient touchés.1, 2
Les symptômes peuvent débuter à tout âge, mais deux pics sont classiquement décrits, le premier entre 16 et 22 ans, le deuxième entre 57 et 60 ans.
La prévalence atteint 0,7 % chez les enfants (< 18 ans) en Europe. Elle est très faible avant l’âge de 9 ans, variant de 0 % (Norvège) à 0,55 % (Royaume-Uni).3, 4 Pas de différence significative entre les 2 sexes à l’âge adulte. Le début plus précoce de la pathologie chez les jeunes filles est associé à une prédominance féminine plus élevée du psoriasis chez l’enfant.3, 4
On note une tendance à l’augmentation de sa fréquence dans plusieurs pays ces dernières années. À titre d’exemple, en Espagne elle est passée de 1,4 % en 1998 à 2,3 % en 2013. Aux États-Unis, de 1,6 % à 3,1 % entre 2004 et 2010. Cette hausse est observée chez l’enfant et chez l’adulte, mais les causes ne sont pas connues.5
La prévalence varie selon les pays, allant de 0,9 % aux États-Unis à 8,5 % en Norvège. On estime qu’en moyenne 2 à 4 % de la population est atteinte dans les pays occidentaux. En France, 2,4 millions d’individus seraient touchés.1, 2
Les symptômes peuvent débuter à tout âge, mais deux pics sont classiquement décrits, le premier entre 16 et 22 ans, le deuxième entre 57 et 60 ans.
La prévalence atteint 0,7 % chez les enfants (< 18 ans) en Europe. Elle est très faible avant l’âge de 9 ans, variant de 0 % (Norvège) à 0,55 % (Royaume-Uni).3, 4 Pas de différence significative entre les 2 sexes à l’âge adulte. Le début plus précoce de la pathologie chez les jeunes filles est associé à une prédominance féminine plus élevée du psoriasis chez l’enfant.3, 4
On note une tendance à l’augmentation de sa fréquence dans plusieurs pays ces dernières années. À titre d’exemple, en Espagne elle est passée de 1,4 % en 1998 à 2,3 % en 2013. Aux États-Unis, de 1,6 % à 3,1 % entre 2004 et 2010. Cette hausse est observée chez l’enfant et chez l’adulte, mais les causes ne sont pas connues.5
Populations à risque ?
Bien qu’elle puisse toucher n’importe quel individu, cette maladie a une forte composante génétique. Un antécédent familial de psoriasis au premier degré est retrouvé chez environ un tiers des enfants.6 Cette corrélation diminue avec l’âge.
Un lien épidémiologique avec certaines comorbidités cardiovasculaires et métaboliques a été montré : obésité, HTA, diabète, tabagisme, dyslipidémie.7 L’obésité est plus fréquente chez les patients psoriasiques quel que soit l’âge ;8 elle est associée à des formes plus sévères, à une certaine résistance aux traitements, au rhumatisme psoriasique. En cas d’infection par le VIH, le psoriasis ne semble pas plus fréquent, mais sa sévérité est corrélée à la gravité de l’immunodéficience.
Certains facteurs de risque sont clairement identifiés comme pouvant favoriser les poussées (cf. infra), mais ils ne sont en aucun cas les causes de la maladie.
Un lien épidémiologique avec certaines comorbidités cardiovasculaires et métaboliques a été montré : obésité, HTA, diabète, tabagisme, dyslipidémie.7 L’obésité est plus fréquente chez les patients psoriasiques quel que soit l’âge ;8 elle est associée à des formes plus sévères, à une certaine résistance aux traitements, au rhumatisme psoriasique. En cas d’infection par le VIH, le psoriasis ne semble pas plus fréquent, mais sa sévérité est corrélée à la gravité de l’immunodéficience.
Certains facteurs de risque sont clairement identifiés comme pouvant favoriser les poussées (cf. infra), mais ils ne sont en aucun cas les causes de la maladie.
Physiopathologie
Mécanismes lésionnels
Le renouvellement kératinocytaire physiologique s’effectue en environ 3 semaines. Les cellules basales en mitose passent vers les couches supérieures de l’épiderme en se différenciant progressivement, puis entrent en apoptose. Elles sont ensuite éliminées au niveau de la couche cornée, sous forme de squames.
Dans le psoriasis, ce processus est anormalement accéléré. Après un stimulus initial, les cellules dendritiques activées – Langerhans et plasmacytoïdes, en quantité anormale dans la peau des patients – induisent la différenciation de lymphocytes Th1 et Th17. Il en résulte la libération de cytokines pro- inflammatoires (IFN-γ, TNFα, IL-17, IL-22...), de chimiokines et de facteurs de croissance, qui sont à l’origine de la prolifération accrue et de la différentiation anormale des kératinocytes.
L’activation persistante des cellules dendritiques et des lymphocytes T aboutit à la chronicisation des lésions.
Dans le psoriasis, ce processus est anormalement accéléré. Après un stimulus initial, les cellules dendritiques activées – Langerhans et plasmacytoïdes, en quantité anormale dans la peau des patients – induisent la différenciation de lymphocytes Th1 et Th17. Il en résulte la libération de cytokines pro- inflammatoires (IFN-γ, TNFα, IL-17, IL-22...), de chimiokines et de facteurs de croissance, qui sont à l’origine de la prolifération accrue et de la différentiation anormale des kératinocytes.
L’activation persistante des cellules dendritiques et des lymphocytes T aboutit à la chronicisation des lésions.
Prédisposition génétique
Au moins 9 loci de susceptibilité ont été identifiés (nomenclature PSORS 1-9), notamment le PSORS1, situé sur le chromosome 6p et associé à l’allèle HLA-Cw6.
Les facteurs génétiques semblent également influer sur la gravité. Les patients ayant une maladie de début précoce et d’évolution plus sévère ont une histoire familiale de psoriasis, alors que ceux ayant des formes à début plus tardif ont des manifestations plus modérées et en général pas d’antécédents familiaux.
Les facteurs génétiques semblent également influer sur la gravité. Les patients ayant une maladie de début précoce et d’évolution plus sévère ont une histoire familiale de psoriasis, alors que ceux ayant des formes à début plus tardif ont des manifestations plus modérées et en général pas d’antécédents familiaux.
Facteurs environnementaux
Frottement cutané ou grattage peuvent être à l’origine d’une poussée. On parle de phénomène de Koebner (survenue d’une dermatose sur une zone traumatisée).
Les infections streptococciques (angine, anite, vulvite, impétigo) peuvent déclencher des épisodes de psoriasis en gouttes, surtout chez l’enfant, via la production d’IL-17 et l’activation des cellules épidermiques. Il semble que toute infection, bactérienne ou virale, puisse déstabiliser la maladie.3, 4
Certains médicaments sont des inducteurs ou des facteurs aggravants, en particulier les bêtabloquants, les IEC, le lithium, l’interféron, le G-CSF, l’imiquimod, l’interleukine 2, plus rarement les AINS et les antipaludéens de synthèse. Récemment, différentes biothérapies (anti-TNFα, anti-IL-6…) ou des immunothérapies telles que les anti-PD1 ont été incriminées.9 Devant des formes sévères, l’arrêt des traitements en cause peut se discuter.
Le rôle du stress, des chocs émotionnels et des traumatismes affectifs – naissance d’un frère/sœur, décès familial, stress au travail – est connu (déclenchement de la maladie ou survenue des poussées).
Alcool et tabac sont source de gravité et de résistance thérapeutique.
Ces facteurs déclenchants doivent être recherchés et pris en charge de façon adaptée.
Les infections streptococciques (angine, anite, vulvite, impétigo) peuvent déclencher des épisodes de psoriasis en gouttes, surtout chez l’enfant, via la production d’IL-17 et l’activation des cellules épidermiques. Il semble que toute infection, bactérienne ou virale, puisse déstabiliser la maladie.3, 4
Certains médicaments sont des inducteurs ou des facteurs aggravants, en particulier les bêtabloquants, les IEC, le lithium, l’interféron, le G-CSF, l’imiquimod, l’interleukine 2, plus rarement les AINS et les antipaludéens de synthèse. Récemment, différentes biothérapies (anti-TNFα, anti-IL-6…) ou des immunothérapies telles que les anti-PD1 ont été incriminées.9 Devant des formes sévères, l’arrêt des traitements en cause peut se discuter.
Le rôle du stress, des chocs émotionnels et des traumatismes affectifs – naissance d’un frère/sœur, décès familial, stress au travail – est connu (déclenchement de la maladie ou survenue des poussées).
Alcool et tabac sont source de gravité et de résistance thérapeutique.
Ces facteurs déclenchants doivent être recherchés et pris en charge de façon adaptée.
De multiples formes cliniques
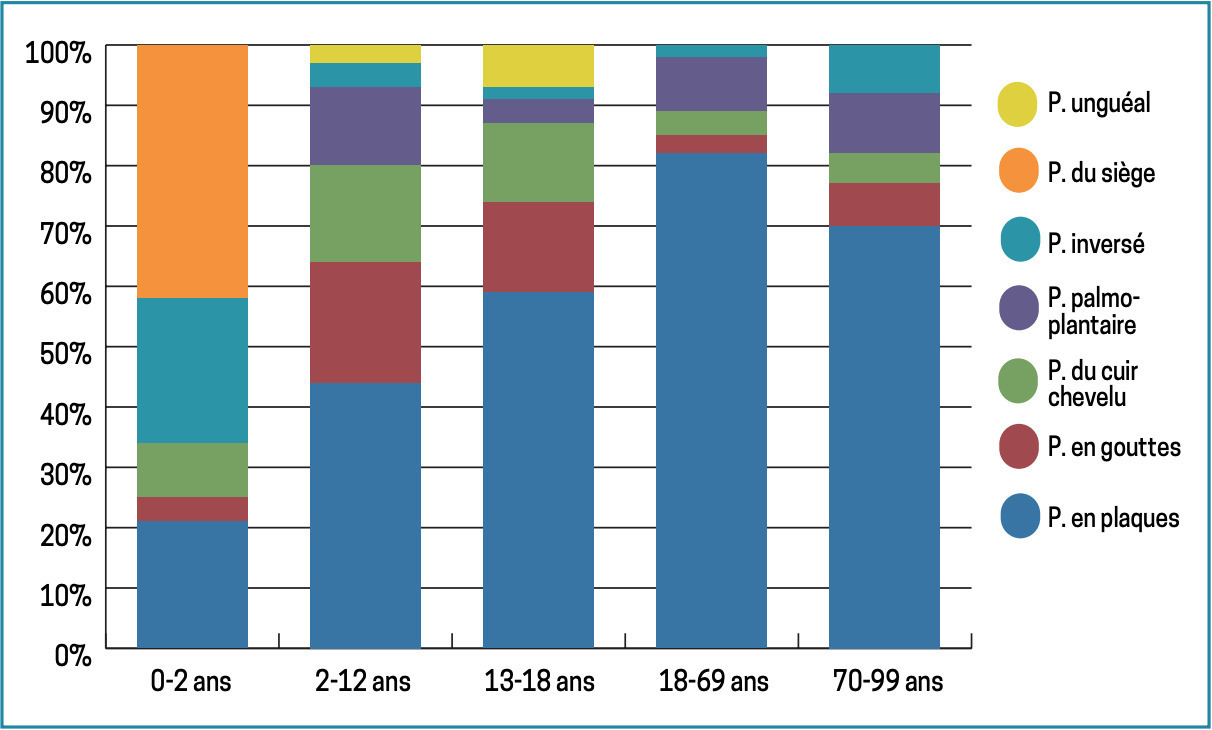
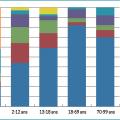
Leur fréquence dépend de l’âge du patient (fig. 1 ). Ainsi, les psoriasis des langes et inversé sont plus fréquents chez le nourrisson, les formes en gouttes et palmo- plantaire semblent plus courantes chez l’enfant, alors que la fréquence du psoriasis en plaques augmente avec l’âge, atteignant 80 % des cas de l’adulte.6, 10, 11
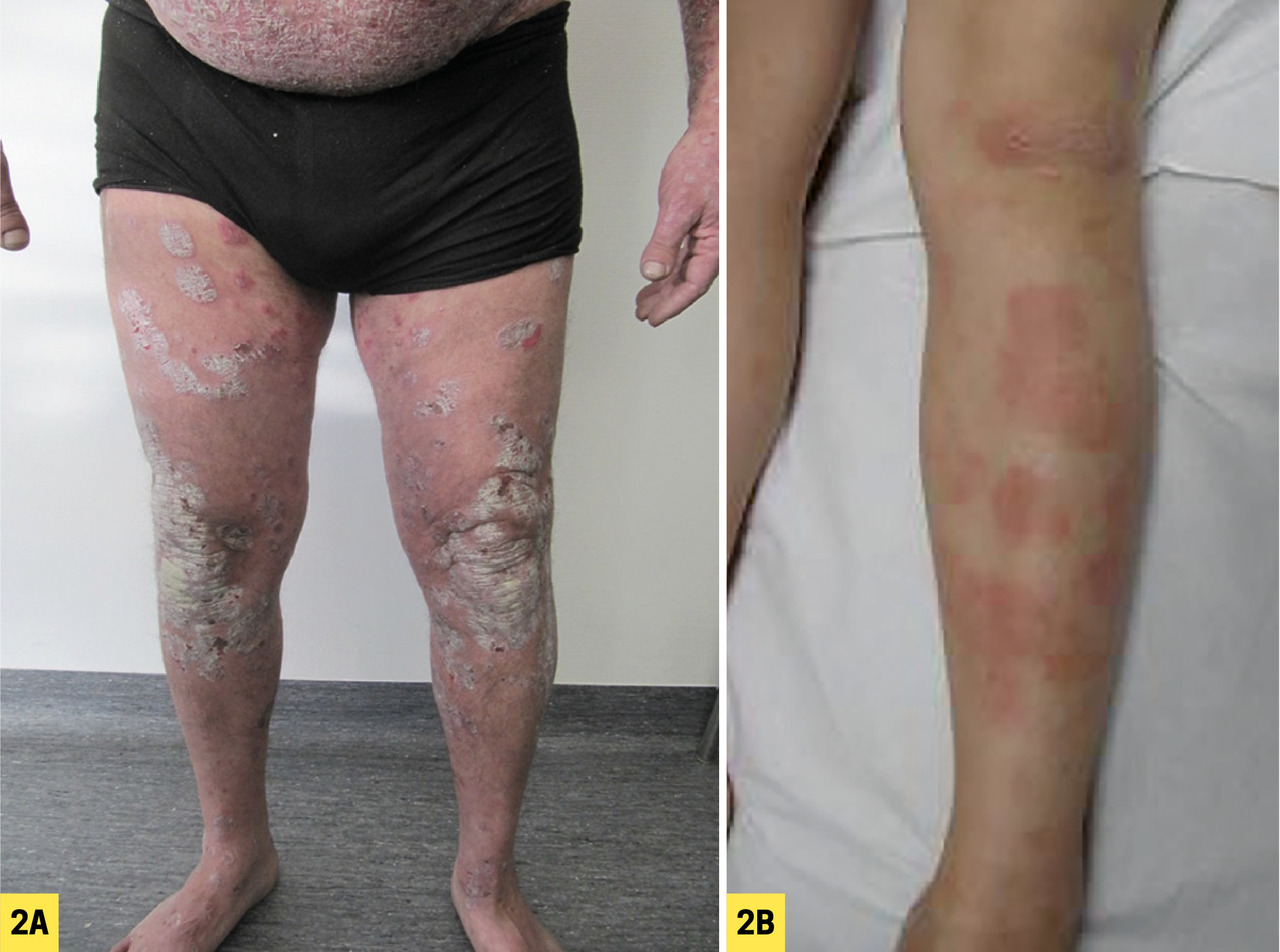
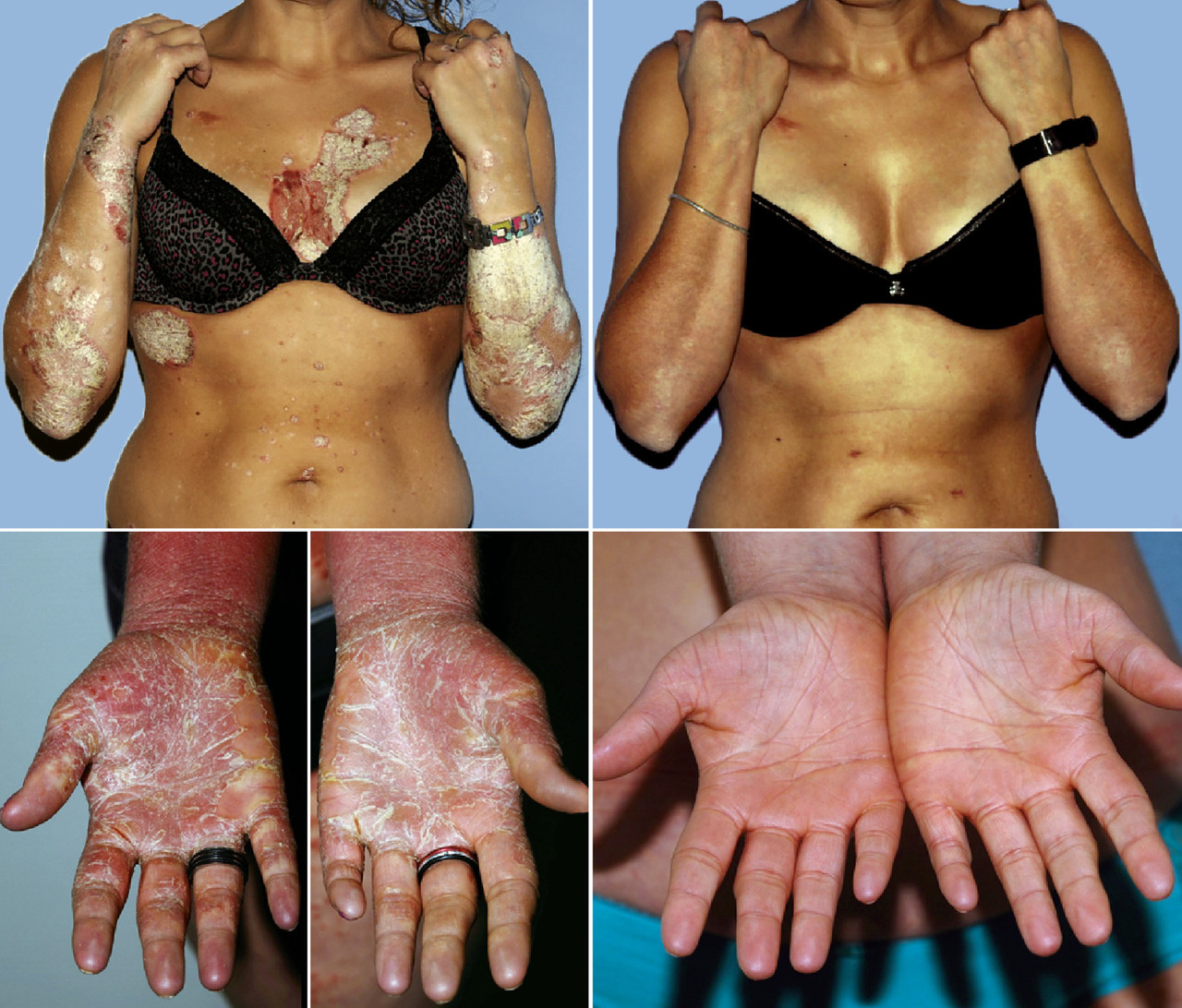
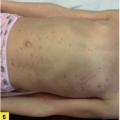
La lésion élémentaire est une plaque érythémateuse, bien limitée, à squames épaisses, généralement non ou peu prurigineuse, ce qui la distingue d’un eczéma (fig. 2A ).
Classiquement, on note un blanchiment des lésions au grattage à la curette (signe de la tache de bougie), et l’apparition de gouttelettes hémorragiques en cas de desquamation (signe de la rosée sanglante). Néanmoins, chez le petit enfant, la lésion peut être eczématiforme, revêtant un aspect trompeur (fig. 2B ).4
La lésion élémentaire est une plaque érythémateuse, bien limitée, à squames épaisses, généralement non ou peu prurigineuse, ce qui la distingue d’un eczéma (
Classiquement, on note un blanchiment des lésions au grattage à la curette (signe de la tache de bougie), et l’apparition de gouttelettes hémorragiques en cas de desquamation (signe de la rosée sanglante). Néanmoins, chez le petit enfant, la lésion peut être eczématiforme, revêtant un aspect trompeur (
Grande variété d’atteintes
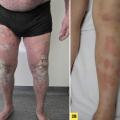
Le psoriasis en plaques, forme la plus fréquente, concerne 80 % des adultes et environ 50 % des enfants.3,4 Les localisations typiques (« zones bastions ») sont les faces d’extension des coudes et genoux, la face antérieure des tibias, les lombes, la zone péri-ombilicale et le cuir chevelu.
Topographies particulières :
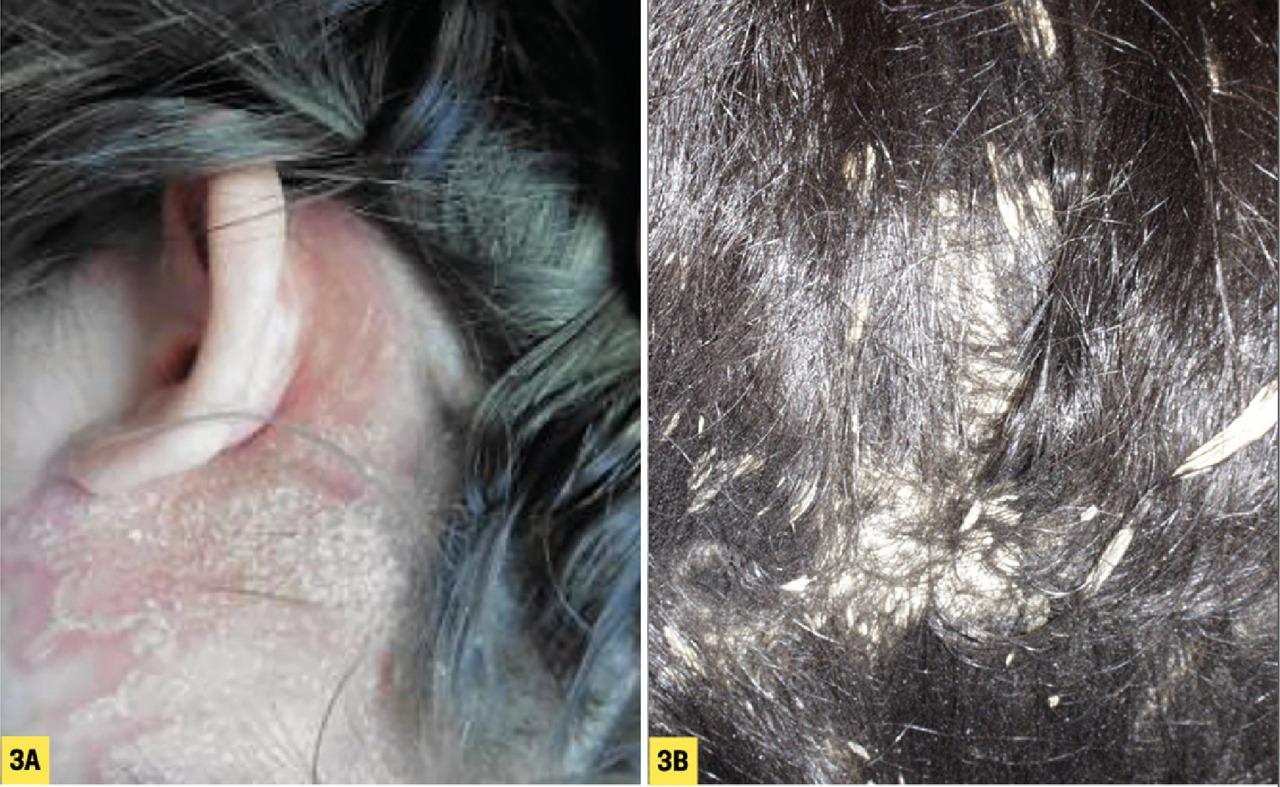
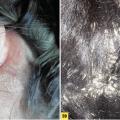
– psoriasis du cuir chevelu : plaques érythémato- squameuses arrondies, bien limitées, classiquement non alopéciantes. À la lisière du cuir chevelu, les lésions sont souvent inflammatoires (fig. 3A ) pouvant prendre l’aspect d’une couronne séborrhéique. Des formes très kératosiques peuvent mimer une pseudo- teigne amiantacée (fig. 3B ) ;
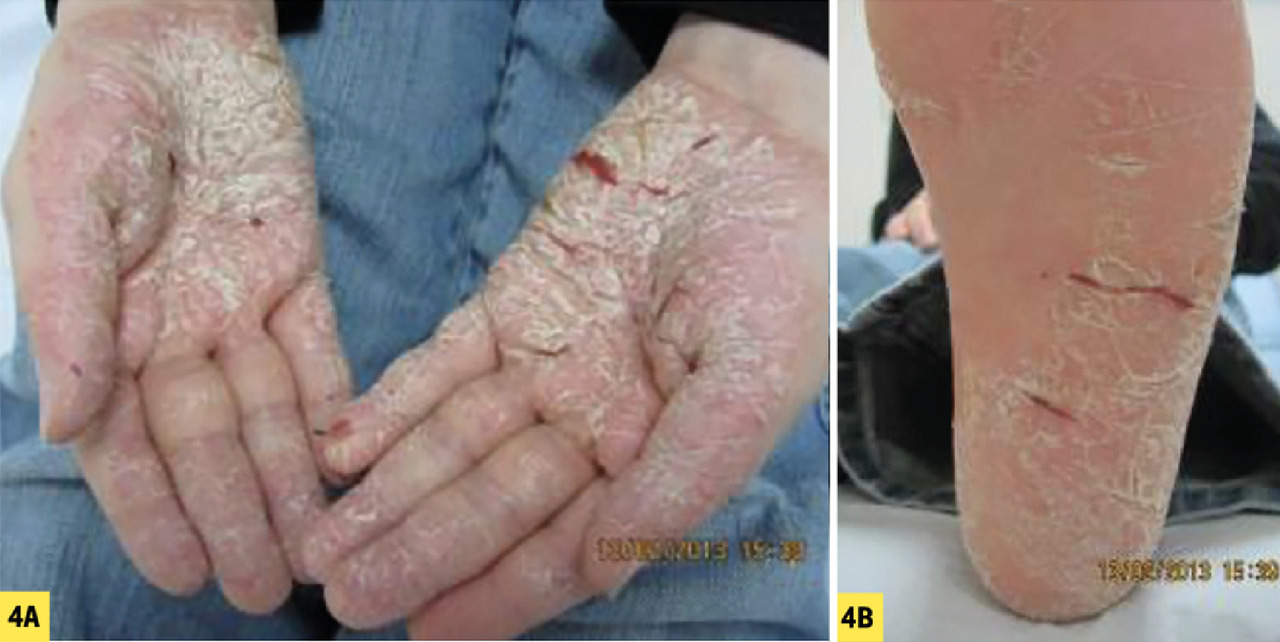
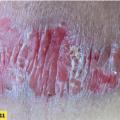
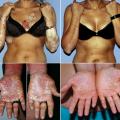
– palmaire (fig. 4A ) et/ou plantaire (fig. 4B ) : lésions hyperkératosiques diffuses ou en îlots, avec une bordure érythémateuse bien limitée. Parfois fissuraires et douloureuses, elles peuvent être localisées (notamment sur les zones d’appui des plantes), ou plus diffuses.
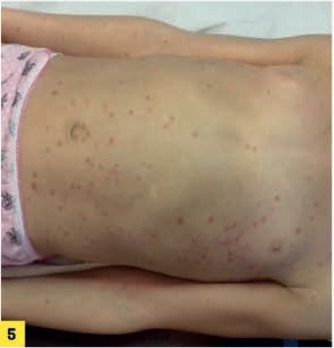
Le psoriasis en gouttes survient essentiellement chez les enfants et les adultes jeunes, généralement à la suite d’une infection streptococcique. Il se manifeste par de petites plaques (< 1 cm), moins épaisses et moins desquamatives que dans la forme classique. Elles siègent essentiellement sur le tronc et la racine des membres ; pas d’atteinte palmo-plantaire, ni unguéale ni du cuir chevelu (fig. 5 ).
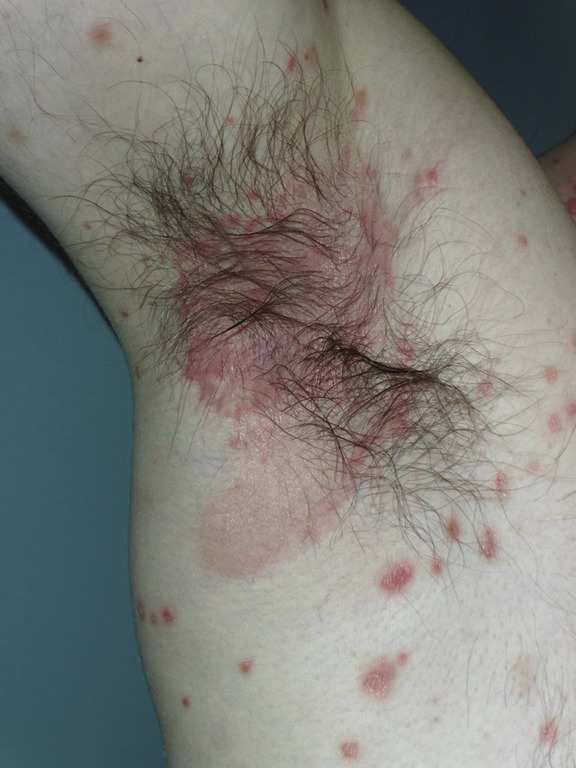
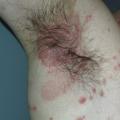
Le type inversé se caractérise par des lésions érythémateuses des plis à limites nettes, souvent dépourvues de squames en raison des frottements et de l’humidité. Localisations les plus évocatrices : plis ombilicaux, interfessier, sous-mammaires, axillaires (fig. 6 ).
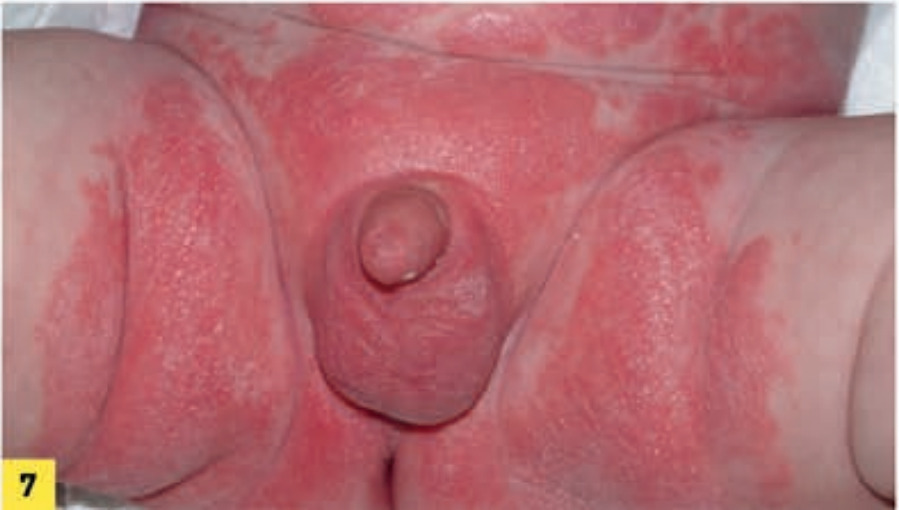
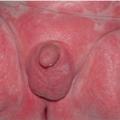
Le psoriasis des langes, forme du nourrisson, est souvent considéré comme un phénomène de Koebner. Il est diagnostiqué devant un érythème fessier traînant. L’aspect sémiologique est celui du psoriasis : sec, bien limité, squameux. Il faut rechercher des lésions à distance étayant le diagnostic. Il touche classiquement les convexités (fig. 7 ) mais peut prédominer au niveau des plis (psoriasis inversé).
Topographies particulières :
– psoriasis du cuir chevelu : plaques érythémato- squameuses arrondies, bien limitées, classiquement non alopéciantes. À la lisière du cuir chevelu, les lésions sont souvent inflammatoires (
– palmaire (
Le psoriasis en gouttes survient essentiellement chez les enfants et les adultes jeunes, généralement à la suite d’une infection streptococcique. Il se manifeste par de petites plaques (< 1 cm), moins épaisses et moins desquamatives que dans la forme classique. Elles siègent essentiellement sur le tronc et la racine des membres ; pas d’atteinte palmo-plantaire, ni unguéale ni du cuir chevelu (
Le type inversé se caractérise par des lésions érythémateuses des plis à limites nettes, souvent dépourvues de squames en raison des frottements et de l’humidité. Localisations les plus évocatrices : plis ombilicaux, interfessier, sous-mammaires, axillaires (
Le psoriasis des langes, forme du nourrisson, est souvent considéré comme un phénomène de Koebner. Il est diagnostiqué devant un érythème fessier traînant. L’aspect sémiologique est celui du psoriasis : sec, bien limité, squameux. Il faut rechercher des lésions à distance étayant le diagnostic. Il touche classiquement les convexités (
Formes extracutanées
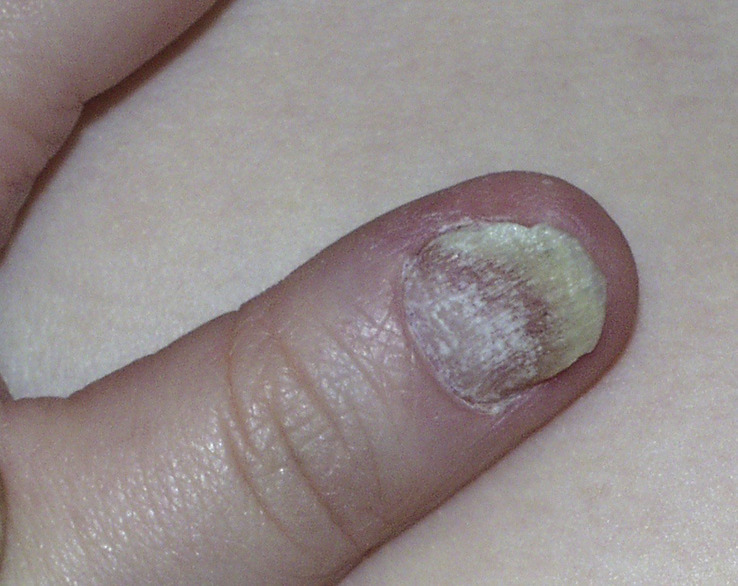
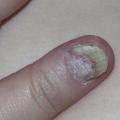
L’atteinte unguéale touche 50 % des patients (et jusqu’à 90 % de ceux ayant une arthrite psoriasique). Elle se caractérise par des dépressions ponctuées en « dé à coudre », des taches saumonées sous la tablette unguéale, une hyperkératose sous-unguéale, une onycholyse distale et, à un stade tardif, par une dystrophie totale (fig. 8 ).
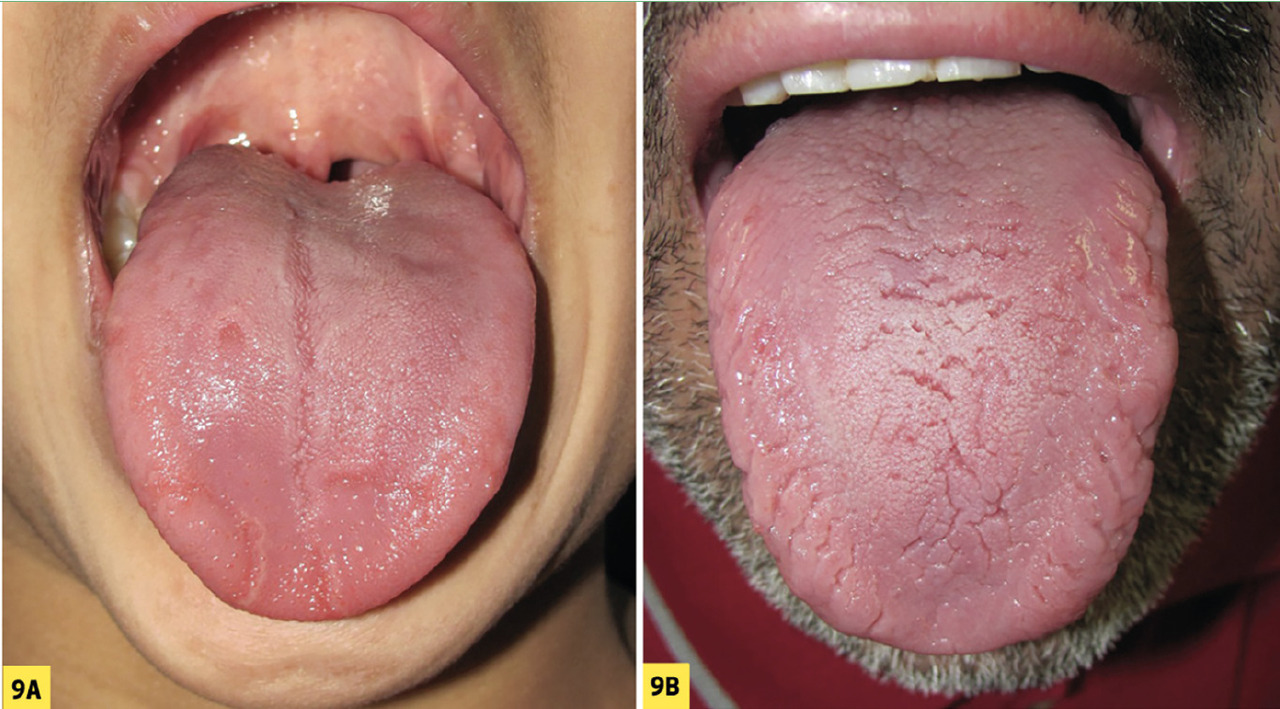
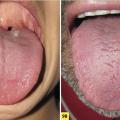
Le psoriasis lingual concerne 30 % des adultes et 10 % des enfants. Il associe un aspect de langue géographique et des fissures (fig. 9A ). Dans les cas les plus sévères, une langue plicaturée (ou fissuraire) est retrouvée (fig. 9B ).
Le psoriasis lingual concerne 30 % des adultes et 10 % des enfants. Il associe un aspect de langue géographique et des fissures (
Formes graves
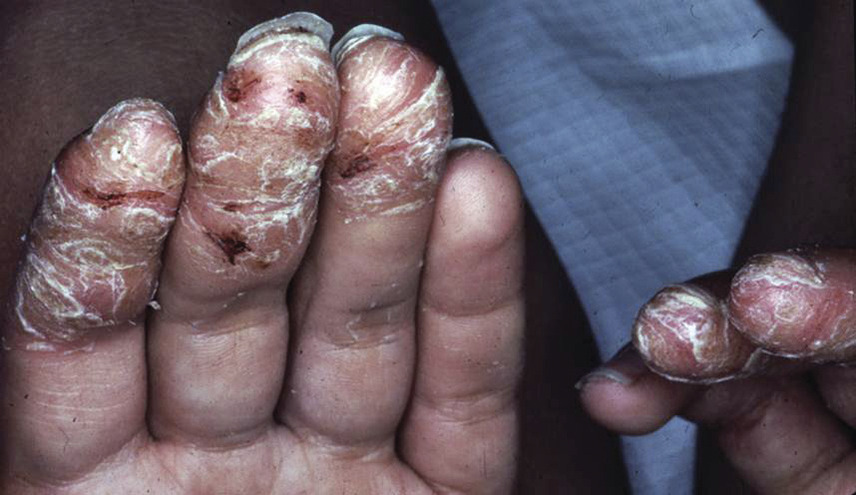
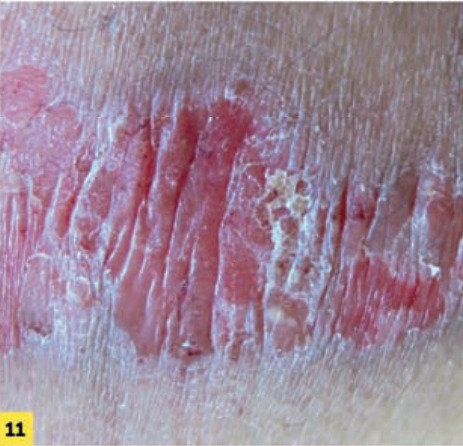
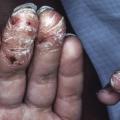
Le psoriasis pustuleux peut être soit localisé (formes palmo-plantaires et acrodermatite continue de Hallopeau, qui affecte les extrémités des doigts et/ou des orteils avec une onychopathie ; fig. 10 ), soit généralisé (de von Zumbusch ; fig. 11 ), caractérisé par l’apparition brutale de patchs érythémateux disséminés avec des pustules stériles qui deviennent coalescentes et une altération de l’état général plus ou moins fébrile.
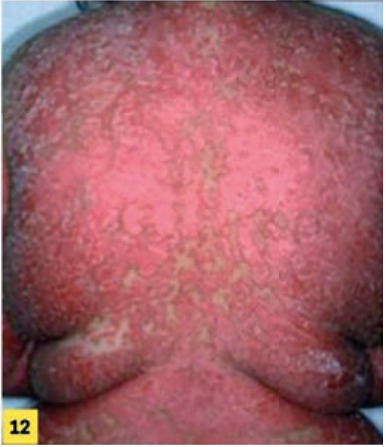
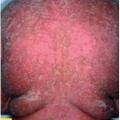
L’érythrodermie psoriasique est une atteinte de plus de 90 % du tégument qui peut être progressive ou brutale (fig. 12 ). Elle peut se compliquer de surinfections et de troubles hydroélectrolytiques, imposant une prise en charge hospitalière. Le diagnostic différentiel avec les autres causes d’érythrodermie est parfois difficile.
L’érythrodermie psoriasique est une atteinte de plus de 90 % du tégument qui peut être progressive ou brutale (
Rhumatisme psoriasique
Touchant 20 à 30 % des patients, il a une prévalence équivalente dans les 2 sexes, augmentant avec l’âge.12
Il survient le plus souvent après les manifestations cutanées (en moyenne 10 ans), parfois avant, et se manifeste par des douleurs articulaires inflammatoires (réveils nocturnes, dérouillage matinal, amélioration au cours de la journée avec les activités).
L’atteinte périphérique, mono- ou oligo-articulaire, est la plus fréquente. Sont touchés soit les grosses articulations (genoux, hanches), soit les orteils ou les doigts surtout au niveau des métacarpo- phalangiennes (MCP), métatarso-phalangiennes (MTP), interphalangiennes proximales (IPP) et/ou distales (IPD). Un aspect de doigt ou orteil boudiné, dit « en saucisse », est très évocateur, résultant de l’association d’une arthrite de l’IPD, de l’IPP et d’une ténosynovite des fléchisseurs. Une polyarthrite est plus rare, et généralement non destructrice, mais des formes sévères très mutilantes sont décrites. Elle se distingue de la polyarthrite rhumatoïde par son caractère asymétrique, l’atteinte prédominante des IPD et l’absence d’anticorps anti-CCP sanguins.
En cas d’atteinte axiale, le tableau est proche de celui de la spondylarthrite ankylosante. La sacro-iliite est peu symptomatique et volontiers asymétrique. Les rachialgies sont inflammatoires, le plus souvent cervico-dorsales. L’antigène HLA-B27 est présent, mais moins souvent que dans les autres spondylarthropathies.
Il survient le plus souvent après les manifestations cutanées (en moyenne 10 ans), parfois avant, et se manifeste par des douleurs articulaires inflammatoires (réveils nocturnes, dérouillage matinal, amélioration au cours de la journée avec les activités).
L’atteinte périphérique, mono- ou oligo-articulaire, est la plus fréquente. Sont touchés soit les grosses articulations (genoux, hanches), soit les orteils ou les doigts surtout au niveau des métacarpo- phalangiennes (MCP), métatarso-phalangiennes (MTP), interphalangiennes proximales (IPP) et/ou distales (IPD). Un aspect de doigt ou orteil boudiné, dit « en saucisse », est très évocateur, résultant de l’association d’une arthrite de l’IPD, de l’IPP et d’une ténosynovite des fléchisseurs. Une polyarthrite est plus rare, et généralement non destructrice, mais des formes sévères très mutilantes sont décrites. Elle se distingue de la polyarthrite rhumatoïde par son caractère asymétrique, l’atteinte prédominante des IPD et l’absence d’anticorps anti-CCP sanguins.
En cas d’atteinte axiale, le tableau est proche de celui de la spondylarthrite ankylosante. La sacro-iliite est peu symptomatique et volontiers asymétrique. Les rachialgies sont inflammatoires, le plus souvent cervico-dorsales. L’antigène HLA-B27 est présent, mais moins souvent que dans les autres spondylarthropathies.
Comorbidités
Les patients atteints de psoriasis modéré à sévère ont un risque accru de pathologies cardiovasculaires, diabète de type 2, syndrome métabolique ;7 ces diverses affections ont en commun des facteurs pro-inflammatoires circulants et une activation endothéliale.
Maladie de Crohn, dépression (prévalence allant jusqu’à 60 %) et anxiété sont fréquemment associées. Certaines études ont montré un risque majoré de lymphomes hodgkiniens, non hodgkiniens et cutanés à cellules T, mais cela est cependant très discuté.
Les comorbidités contribuent à diminuer l’espérance de vie des patients.
Maladie de Crohn, dépression (prévalence allant jusqu’à 60 %) et anxiété sont fréquemment associées. Certaines études ont montré un risque majoré de lymphomes hodgkiniens, non hodgkiniens et cutanés à cellules T, mais cela est cependant très discuté.
Les comorbidités contribuent à diminuer l’espérance de vie des patients.
Traiter selon la gravité
La définition d’un psoriasis modéré à sévère, requérant un traitement systémique, tient compte à la fois d’une évaluation objective par le médecin – surface corporelle atteinte (SCA) ; évaluation globale (Physician’s Global Assessment [PGA]) ; indice de sévérité du psoriasis rapporté aux surfaces atteintes (Psoriasis Area and Severity Index [PASI]) – et d’une mesure de l’impact sur la qualité de vie (Dermatology Life Quality Index [DLQI]), questionnaire rempli par le patient.
Un PASI > 10 et un résultat au DLQI > 10 définissent le psoriasis modéré à sévère. Cependant, certaines atteintes limitées mais très handicapantes (ongles ou régions palmo-plantaires) grèvent la qualité de vie des patients de façon majeure. Par conséquent, un score élevé, même isolé, au DLQI doit inciter à opter pour des thérapeutiques efficaces.
Des guidelines européennes datent de 2015.13 Les recommandations françaises sont en cours de publication.
Le choix d’une thérapie systémique est fait par des praticiens habitués au maniement de ces molécules, au cas par cas.
Un PASI > 10 et un résultat au DLQI > 10 définissent le psoriasis modéré à sévère. Cependant, certaines atteintes limitées mais très handicapantes (ongles ou régions palmo-plantaires) grèvent la qualité de vie des patients de façon majeure. Par conséquent, un score élevé, même isolé, au DLQI doit inciter à opter pour des thérapeutiques efficaces.
Des guidelines européennes datent de 2015.13 Les recommandations françaises sont en cours de publication.
Le choix d’une thérapie systémique est fait par des praticiens habitués au maniement de ces molécules, au cas par cas.
Débuter par des traitements locaux
Bains et émollients soulagent le prurit et décapent les lésions. L’acide salicylique dans un excipient gras (vaseline) est efficace sur les plaques hyperkératosiques. Bien hydrater la peau après la douche.
Les dermocorticoïdes (forts à très forts) sont disponibles dans diverses formes galéniques adaptées à la localisation du psoriasis : pommade pour les lésions sèches, crème, gel, spray-mousse, lotion ou shampoing pour le cuir chevelu. Une application par jour est le plus souvent suffisante. Au niveau des zones palmo-plantaires, un pansement occlusif accroît la pénétration.
Toutefois, les effets secondaires, principalement locaux (atrophie cutanée, dermites rosacéiformes, infections cutanées, troubles de la pigmentation…), limitent leur utilisation au long cours.
Les dérivés de la vitamine D sont administrés seuls (Daivonex, Silkis) ou en association avec un dermocorticoïde (Daivobet, Enstilar, Xamiol). Ils s’appliquent 1 ou 2 fois par jour en fonction de la molécule, sans dépasser 100 g par semaine. Ils peuvent provoquer une irritation cutanée, réversible à l’arrêt du traitement. Des effets systémiques (hypercalcémie, hypercalciurie) ont été rarement rapportés.
Les inhibiteurs de la calcineurine topiques (tacrolimus, Protopic) sont parfois prescrits (hors AMM) pour des zones difficiles à traiter comme les plis ou le visage.
Ces options sont le plus souvent suffisantes dans les psoriasis légers. Dans les formes modérées à sévères (PASI > 10 ou une surface cutanée > 10 % et/ou un DLQI > 10), on leur associe la photothérapie ou une thérapeutique systémique.
Les dermocorticoïdes (forts à très forts) sont disponibles dans diverses formes galéniques adaptées à la localisation du psoriasis : pommade pour les lésions sèches, crème, gel, spray-mousse, lotion ou shampoing pour le cuir chevelu. Une application par jour est le plus souvent suffisante. Au niveau des zones palmo-plantaires, un pansement occlusif accroît la pénétration.
Toutefois, les effets secondaires, principalement locaux (atrophie cutanée, dermites rosacéiformes, infections cutanées, troubles de la pigmentation…), limitent leur utilisation au long cours.
Les dérivés de la vitamine D sont administrés seuls (Daivonex, Silkis) ou en association avec un dermocorticoïde (Daivobet, Enstilar, Xamiol). Ils s’appliquent 1 ou 2 fois par jour en fonction de la molécule, sans dépasser 100 g par semaine. Ils peuvent provoquer une irritation cutanée, réversible à l’arrêt du traitement. Des effets systémiques (hypercalcémie, hypercalciurie) ont été rarement rapportés.
Les inhibiteurs de la calcineurine topiques (tacrolimus, Protopic) sont parfois prescrits (hors AMM) pour des zones difficiles à traiter comme les plis ou le visage.
Ces options sont le plus souvent suffisantes dans les psoriasis légers. Dans les formes modérées à sévères (PASI > 10 ou une surface cutanée > 10 % et/ou un DLQI > 10), on leur associe la photothérapie ou une thérapeutique systémique.
Photothérapie : plusieurs options
Les UVB à spectre étroit sont très efficaces chez 60 à 90 % des patients (en 20 à 30 séances). Les résultats sont cependant nettement meilleurs dans les formes en gouttes que dans le psoriasis en grandes plaques épaisses.
La PUVAthérapie (association d’une irradiation UVA et d’un psoralène photosensibilisant oral pris 2 heures avant) est la référence pour une poussée étendue : on obtient un blanchiment complet ou quasi-complet (PASI 90) dans 80 à 90 % des cas après 15 à 25 séances ; autre option : la balnéo-PUVAthérapie (immersion d’une zone cutanée dans un bain contenant un psoralène topique dilué à faible concentration, suivie de l’irradiation).
Ces traitements sont efficaces mais chronophages, 20 séances en moyenne étant nécessaires pour contrôler la maladie, à raison de 3 fois par semaine.
De plus, ils ne peuvent pas être prolongés à cause d’un risque carcinogène potentiel (carcinome épidermoïde). Une surveillance annuelle du tégument des sujets ayant reçu plus de 150 séances est indispensable. Une protection oculaire (coques opaques) est préconisée pendant les séances et les 12 heures suivant la prise de psoralène pour la PUVAthérapie (lunettes de soleil).
Contre-indications : antécédent personnel de cancer cutané, dermatoses photosensibles, syndrome des nævus atypiques et âge inférieur à 8 ans.
La PUVAthérapie (association d’une irradiation UVA et d’un psoralène photosensibilisant oral pris 2 heures avant) est la référence pour une poussée étendue : on obtient un blanchiment complet ou quasi-complet (PASI 90) dans 80 à 90 % des cas après 15 à 25 séances ; autre option : la balnéo-PUVAthérapie (immersion d’une zone cutanée dans un bain contenant un psoralène topique dilué à faible concentration, suivie de l’irradiation).
Ces traitements sont efficaces mais chronophages, 20 séances en moyenne étant nécessaires pour contrôler la maladie, à raison de 3 fois par semaine.
De plus, ils ne peuvent pas être prolongés à cause d’un risque carcinogène potentiel (carcinome épidermoïde). Une surveillance annuelle du tégument des sujets ayant reçu plus de 150 séances est indispensable. Une protection oculaire (coques opaques) est préconisée pendant les séances et les 12 heures suivant la prise de psoralène pour la PUVAthérapie (lunettes de soleil).
Contre-indications : antécédent personnel de cancer cutané, dermatoses photosensibles, syndrome des nævus atypiques et âge inférieur à 8 ans.
Thérapies systémiques conventionnelles
Indiquées dans le psoriasis en plaques modéré à sévère, pustuleux ou érythrodermique ou en cas d’atteinte rhumatismale, elles sont évaluées à 12 ou 16 semaines.
L’acitrétine (Soriatane) est un rétinoïde (dérivé de la vitamine A) oral. La dose initiale de 0,3 à 0,5 mg/kg/j est progressivement augmentée selon la tolérance jusqu’à 0,5-1 mg/kg/j. Une chéilite témoigne d’une biodisponibilité suffisante. Son efficacité dépend de la dose. Du fait de sa haute tératogénicité, une contraception est obligatoire pour les femmes en âge de procréer jusqu’à 2 ans après l’arrêt du traitement, et un test de grossesse mensuel doit être réalisé.
Effets secondaires : xérose, sécheresse muqueuse source de xérophtalmie, épistaxis, dyspareunies, photosensibilité, douleurs musculaires et osseuses, élévation des enzymes hépatiques, hyperlipidémie.
Le méthotrexate (Novatrex, Imeth, Nordimet, Méthotrexate Belon) est également tératogène. Une contraception est indispensable durant tout le traitement et jusqu’à 3 mois après l’arrêt pour les hommes, 1 cycle menstruel pour les femmes.
La fréquence de prise est hebdomadaire, par voie orale ou sous-cutanée (Metoject, biodisponibilité accrue et intolérance digestive moindre) ; une supplémentation par acide folique est associée pour en diminuer les effets secondaires (à prendre au moins 48 heures après le méthotrexate). La rémission est obtenue en 3 mois pour 30 à 40 % des patients.
Principaux effets indésirables : troubles digestifs (nausées), élévation des enzymes hépatiques, toxicité hématopoïétique, majoration du risque infectieux. Une radiographie thoracique est recommandée avant la mise en route ainsi qu’une évaluation de la fibrose hépatique (dosage du procollagène III ou FibroScan).
La ciclosporine (Néoral) est un immunosuppresseur, administré à la posologie de 2,5 à 5 mg/kg/j (plutôt chez les sujets jeunes sans comorbidité).
Les effets secondaires sont nombreux (néphrotoxicité, hyperplasie gingivale, hypertrichose, troubles digestifs, céphalées, HTA) de même que les interactions médicamenteuses. Ainsi, la durée maximale cumulée d’utilisation est de 1 à 2 ans.
Cette molécule a un intérêt particulièrement dans le psoriasis pustuleux palmo-plantaire et dans toutes les autres formes cliniques pour sa rapidité d’action (blanchiment à 75 % en 3 mois). Prudence si traitement antérieur prolongé par UVA.
L’aprémilast (Otezla), inhibiteur de la phosphodiestérase-4, a l’AMM dans les psoriasis en plaques modérés à sévères après échec d’au moins un des traitements systémiques précédemment cités ou de la photothérapie.
D’efficacité modeste, il se distingue par une bonne tolérance (en dehors d’un risque de dépression), l’absence de toxicité d’organe, de complication infectieuse ou d’anomalie biologique. La dose est progressivement augmentée jusqu’à 30 mg 2 fois par jour per os, selon les effets secondaires (nausées, diarrhée).
À la différence des autres biothérapies, il peut être initié en ville par tout dermatologue et n’est donc pas soumis à une prescription initiale hospitalière. Il est recommandé de l’arrêter en cas d’inefficacité au bout de 24 semaines.
L’acitrétine (Soriatane) est un rétinoïde (dérivé de la vitamine A) oral. La dose initiale de 0,3 à 0,5 mg/kg/j est progressivement augmentée selon la tolérance jusqu’à 0,5-1 mg/kg/j. Une chéilite témoigne d’une biodisponibilité suffisante. Son efficacité dépend de la dose. Du fait de sa haute tératogénicité, une contraception est obligatoire pour les femmes en âge de procréer jusqu’à 2 ans après l’arrêt du traitement, et un test de grossesse mensuel doit être réalisé.
Effets secondaires : xérose, sécheresse muqueuse source de xérophtalmie, épistaxis, dyspareunies, photosensibilité, douleurs musculaires et osseuses, élévation des enzymes hépatiques, hyperlipidémie.
Le méthotrexate (Novatrex, Imeth, Nordimet, Méthotrexate Belon) est également tératogène. Une contraception est indispensable durant tout le traitement et jusqu’à 3 mois après l’arrêt pour les hommes, 1 cycle menstruel pour les femmes.
La fréquence de prise est hebdomadaire, par voie orale ou sous-cutanée (Metoject, biodisponibilité accrue et intolérance digestive moindre) ; une supplémentation par acide folique est associée pour en diminuer les effets secondaires (à prendre au moins 48 heures après le méthotrexate). La rémission est obtenue en 3 mois pour 30 à 40 % des patients.
Principaux effets indésirables : troubles digestifs (nausées), élévation des enzymes hépatiques, toxicité hématopoïétique, majoration du risque infectieux. Une radiographie thoracique est recommandée avant la mise en route ainsi qu’une évaluation de la fibrose hépatique (dosage du procollagène III ou FibroScan).
La ciclosporine (Néoral) est un immunosuppresseur, administré à la posologie de 2,5 à 5 mg/kg/j (plutôt chez les sujets jeunes sans comorbidité).
Les effets secondaires sont nombreux (néphrotoxicité, hyperplasie gingivale, hypertrichose, troubles digestifs, céphalées, HTA) de même que les interactions médicamenteuses. Ainsi, la durée maximale cumulée d’utilisation est de 1 à 2 ans.
Cette molécule a un intérêt particulièrement dans le psoriasis pustuleux palmo-plantaire et dans toutes les autres formes cliniques pour sa rapidité d’action (blanchiment à 75 % en 3 mois). Prudence si traitement antérieur prolongé par UVA.
L’aprémilast (Otezla), inhibiteur de la phosphodiestérase-4, a l’AMM dans les psoriasis en plaques modérés à sévères après échec d’au moins un des traitements systémiques précédemment cités ou de la photothérapie.
D’efficacité modeste, il se distingue par une bonne tolérance (en dehors d’un risque de dépression), l’absence de toxicité d’organe, de complication infectieuse ou d’anomalie biologique. La dose est progressivement augmentée jusqu’à 30 mg 2 fois par jour per os, selon les effets secondaires (nausées, diarrhée).
À la différence des autres biothérapies, il peut être initié en ville par tout dermatologue et n’est donc pas soumis à une prescription initiale hospitalière. Il est recommandé de l’arrêter en cas d’inefficacité au bout de 24 semaines.
Biothérapies : vers un blanchiment total
Elles sont indiquées dans les formes modérées à sévères de psoriasis en cas d’échec, intolérance ou contre-indication à au moins deux traitements parmi les thérapies systémiques conventionnelles (méthotrexate, acitrétine, ciclosporine) et la photothérapie. Elles sont également préconisées dans le rhumatisme psoriasique (fig. 13 ).
Quatre anti-TNFα sont disponibles :
– adalimumab (Humira), anticorps IgG1 monoclonal humain recombinant ; dosage : 80 mg en sous- cutané à J0 puis – 1 semaine après – 40 mg toutes les 2 semaines (biosimilaires : Amgevita, Imraldi, Hulio, Hyrimoz) ;
– étanercept (Enbrel, Benepali, Erelzi), protéine de fusion ; 50 mg en SC 1 ou 2 fois par semaine pendant 12 semaines, puis 50 mg par semaine ;
– infliximab (Remicade, Inflectra, Remsima, Flixabi), anticorps monoclonal chimérique (souris/humain) ; 5 mg/kg en IV à S0, S2, S6, puis toutes les 8 semaines ;
– certolizumab (Cimzia) en débutant par 400 mg en SC aux semaines 0, 2 et 4, puis 200 mg toutes les 2 semaines.
Efficacité : un blanchiment à 75 % est obtenu chez les trois quarts des patients.
Effets secondaires principaux : réaction au site d’injection et infections ; plus rarement : néoplasies, psoriasis paradoxal, lupus induit. L’infliximab est également associé à une fréquence accrue de réactions anaphylactiques. Un risque d’immunisation dû à la formation d’anticorps neutralisants existe sous infliximab ou adalimumab, pouvant induire une perte d’efficacité de ces molécules.
L’ustékinumab (Stelara) est un anticorps IgG1 humain recombinant anti-IL-12 et IL-23. Dose recommandée : 45 ou 90 mg (selon le poids) en SC à S0 et S4, puis 45 ou 90 mg toutes les 12 semaines. L’efficacité est proche de celle des anti-TNFα.
Trois anti-IL-17 sont commercialisés :
– le sécukinumab (Cosentyx), anticorps IgG1 monoclonal humain (300 mg en SC à S0, S1, S2 et S3, puis 300 mg toutes les 4 semaines à partir de S4) ;
– l’ixékizumab (Taltz), molécule récente ayant démontré son efficacité dans le rhumatisme psoriasique (160 mg en dose de charge en 2 injections SC, puis 1 injection de 80 mg toutes les 2 semaines jusqu’à S12, puis toutes les 4 semaines) ;
– le brodalumab (Kyntheum) ; 210 mg en injection SC, aux semaines 0, 1 et 2, puis 210 mg toutes les 2 semaines.
Ces molécules ont un niveau d’efficacité supérieur à celui des précédentes biothérapies et une grande rapidité d’action (dès le 1er mois).
Avant l’instauration de toute biothérapie, en raison d’un risque infectieux accru, il faut faire un bilan rigoureux à la recherche de signes en faveur d’une infection active ou ancienne : radiographie pulmonaire, sérologie pour le VIH et les hépatites B et C, dépistage de la tuberculose, examen dentaire.
Attention, un antécédent personnel ou familial de sclérose en plaques contre-indique les anti-TNFα ; de maladie inflammatoire intestinale interdit les anti- IL-17 ou de cancer dans les 5 ans proscrit toutes les biothérapies.
Ces traitements doivent être poursuivis sur le long terme car la récidive du psoriasis à l’arrêt est quasi constante (au moins 90 % dans les 2 ans après la dernière injection).
D’autres sont en cours d’étude :
– nouvelle molécule dans une classe déjà connue : bimekizumab (anti-IL-17) ;
– nouvelles classes :
. inhibiteur de l’interleukine 23 : guselkumab, Tremfya, disponible en stylo prérempli depuis février 2019 ; tildrakizumab, Ilumetri ; risankizumab, Skyrizi ;
. inhibiteur des JAK kinases : tofacitinib, Xeljanz, AMM dans le rhumatisme psoriasique.
Quatre anti-TNFα sont disponibles :
– adalimumab (Humira), anticorps IgG1 monoclonal humain recombinant ; dosage : 80 mg en sous- cutané à J0 puis – 1 semaine après – 40 mg toutes les 2 semaines (biosimilaires : Amgevita, Imraldi, Hulio, Hyrimoz) ;
– étanercept (Enbrel, Benepali, Erelzi), protéine de fusion ; 50 mg en SC 1 ou 2 fois par semaine pendant 12 semaines, puis 50 mg par semaine ;
– infliximab (Remicade, Inflectra, Remsima, Flixabi), anticorps monoclonal chimérique (souris/humain) ; 5 mg/kg en IV à S0, S2, S6, puis toutes les 8 semaines ;
– certolizumab (Cimzia) en débutant par 400 mg en SC aux semaines 0, 2 et 4, puis 200 mg toutes les 2 semaines.
Efficacité : un blanchiment à 75 % est obtenu chez les trois quarts des patients.
Effets secondaires principaux : réaction au site d’injection et infections ; plus rarement : néoplasies, psoriasis paradoxal, lupus induit. L’infliximab est également associé à une fréquence accrue de réactions anaphylactiques. Un risque d’immunisation dû à la formation d’anticorps neutralisants existe sous infliximab ou adalimumab, pouvant induire une perte d’efficacité de ces molécules.
L’ustékinumab (Stelara) est un anticorps IgG1 humain recombinant anti-IL-12 et IL-23. Dose recommandée : 45 ou 90 mg (selon le poids) en SC à S0 et S4, puis 45 ou 90 mg toutes les 12 semaines. L’efficacité est proche de celle des anti-TNFα.
Trois anti-IL-17 sont commercialisés :
– le sécukinumab (Cosentyx), anticorps IgG1 monoclonal humain (300 mg en SC à S0, S1, S2 et S3, puis 300 mg toutes les 4 semaines à partir de S4) ;
– l’ixékizumab (Taltz), molécule récente ayant démontré son efficacité dans le rhumatisme psoriasique (160 mg en dose de charge en 2 injections SC, puis 1 injection de 80 mg toutes les 2 semaines jusqu’à S12, puis toutes les 4 semaines) ;
– le brodalumab (Kyntheum) ; 210 mg en injection SC, aux semaines 0, 1 et 2, puis 210 mg toutes les 2 semaines.
Ces molécules ont un niveau d’efficacité supérieur à celui des précédentes biothérapies et une grande rapidité d’action (dès le 1er mois).
Avant l’instauration de toute biothérapie, en raison d’un risque infectieux accru, il faut faire un bilan rigoureux à la recherche de signes en faveur d’une infection active ou ancienne : radiographie pulmonaire, sérologie pour le VIH et les hépatites B et C, dépistage de la tuberculose, examen dentaire.
Attention, un antécédent personnel ou familial de sclérose en plaques contre-indique les anti-TNFα ; de maladie inflammatoire intestinale interdit les anti- IL-17 ou de cancer dans les 5 ans proscrit toutes les biothérapies.
Ces traitements doivent être poursuivis sur le long terme car la récidive du psoriasis à l’arrêt est quasi constante (au moins 90 % dans les 2 ans après la dernière injection).
D’autres sont en cours d’étude :
– nouvelle molécule dans une classe déjà connue : bimekizumab (anti-IL-17) ;
– nouvelles classes :
. inhibiteur de l’interleukine 23 : guselkumab, Tremfya, disponible en stylo prérempli depuis février 2019 ; tildrakizumab, Ilumetri ; risankizumab, Skyrizi ;
. inhibiteur des JAK kinases : tofacitinib, Xeljanz, AMM dans le rhumatisme psoriasique.
Autres traitements
La crénothérapie a toute sa place dans le psoriasis, et ce dès le début de la maladie. L’action combinée des douches et des bains est bénéfique contre l’hyper- kératose et le prurit.
Quatre soins spécifiques sont ainsi proposés : bain journalier (avec hydrojets), douches générales pour hydrater les couches superficielles de la peau, filiformes permettant de lutter contre les squames, pulvérisations externes favorisant l’imprégnation de la peau par les minéraux de l’eau thermale.
La crénothérapie peut aussi induire un bien-être psychologique, dans un environnement calme et loin du stress quotidien. Elle favorise l’éducation thérapeutique et une meilleure compréhension de la maladie.
Plusieurs stations thermales existent en France : La Roche-Posay (Vienne), Saint-Gervais-les-Bains (Haute-Savoie), Avène-les-Bains (Hérault), Uriage-les-Bains (Isère)...
Si leur efficacité immédiate est évidente, les bénéfices à long terme sont plus discutables.
Quatre soins spécifiques sont ainsi proposés : bain journalier (avec hydrojets), douches générales pour hydrater les couches superficielles de la peau, filiformes permettant de lutter contre les squames, pulvérisations externes favorisant l’imprégnation de la peau par les minéraux de l’eau thermale.
La crénothérapie peut aussi induire un bien-être psychologique, dans un environnement calme et loin du stress quotidien. Elle favorise l’éducation thérapeutique et une meilleure compréhension de la maladie.
Plusieurs stations thermales existent en France : La Roche-Posay (Vienne), Saint-Gervais-les-Bains (Haute-Savoie), Avène-les-Bains (Hérault), Uriage-les-Bains (Isère)...
Si leur efficacité immédiate est évidente, les bénéfices à long terme sont plus discutables.
Références
1. Richard MA, Corgibet F, Beylot-Barry M, et al. Sex- and age-adjusted prevalence estimates of five chronic inflammatory skin diseases in France: results of the « OBJECTIFS PEAU » study. J Eur Acad Dermatol Venereol 2018;32:1967-71.
2. Parisi R, Symmons DP, Griffiths CE, Ashcroft DM; IMPACT project team. Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J Invest Dermatol 2013;133:377-85.
3. Boehncke WH, Schön MP. Psoriasis. Lancet 2015;386:983-94.
4. Mahé E. Childhood psoriasis. Eur J Dermatol 2016;26:537-48.
5. Tollefson MM, Crowson CS, McEvoy MT, Maradit Kremers H. Incidence of psoriasis in children: a population-based study. J Am Acad Dermatol 2010;62:979-87.
6.. Bonigen J, Phan A, Hadj-Rabia S, et al. Impact de l’âge et du sexe sur les aspects cliniques et épidémiologiques du psoriasis de l’enfant. Données d’une étude transversale, multicentrique française. Ann Dermatol Venereol 2016;143:354-63.
7. Phan C, Sigal ML, Lhafa M, et al. Metabolic comorbidities and hypertension in psoriasis patients in France. Comparisons with French national databases. Ann Dermatol Venereol 2016;143:264-74.
8.. Mahé E, Beauchet A, Bodemer C, et al. Psoriasis and obesity in French children: a case-control, multicentre study. Br J Dermatol 2015; 172:1593-600.
9. Bonigen J, Raynaud-Donzel C, Hureaux J, et al. Anti-PD1-induced psoriasis: a study of 21 patients. J Eur Acad Dermatol Venereol 2017; 31:e254-e257.
10. Phan C, Sigal ML, Estève E, et al. Psoriasis in the elderly: epidemiological and clinical aspects, and evaluation of patients with very late onset psoriasis. J Eur Acad Dermatol Venereol 2016;30:78-82.
11. Amode R, Hadj-Rabia S, Bursztejn AC, et al. Palmoplantar psoriasis in children: a frequent and severe clinical type of psoriasis. J Eur Acad Dermatol Venereol 2016;30:1390-2.
12.Galezowski A, Maccari F, Hadj-Rabia S, et al. Rhumatisme psoriasique en France, du nourrisson à la personne âgée. Données de deux études transversales multicentriques françaises. Ann Dermatol Venereol 2018;145:13-20.
13. Nast A, Gisondi P, Ormerod AD, et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris--Update 2015--Short version-EDF in cooperation with EADV and IPC. J Eur Acad Dermatol Venereol 2015;29:2277-94.
2. Parisi R, Symmons DP, Griffiths CE, Ashcroft DM; IMPACT project team. Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J Invest Dermatol 2013;133:377-85.
3. Boehncke WH, Schön MP. Psoriasis. Lancet 2015;386:983-94.
4. Mahé E. Childhood psoriasis. Eur J Dermatol 2016;26:537-48.
5. Tollefson MM, Crowson CS, McEvoy MT, Maradit Kremers H. Incidence of psoriasis in children: a population-based study. J Am Acad Dermatol 2010;62:979-87.
6.. Bonigen J, Phan A, Hadj-Rabia S, et al. Impact de l’âge et du sexe sur les aspects cliniques et épidémiologiques du psoriasis de l’enfant. Données d’une étude transversale, multicentrique française. Ann Dermatol Venereol 2016;143:354-63.
7. Phan C, Sigal ML, Lhafa M, et al. Metabolic comorbidities and hypertension in psoriasis patients in France. Comparisons with French national databases. Ann Dermatol Venereol 2016;143:264-74.
8.. Mahé E, Beauchet A, Bodemer C, et al. Psoriasis and obesity in French children: a case-control, multicentre study. Br J Dermatol 2015; 172:1593-600.
9. Bonigen J, Raynaud-Donzel C, Hureaux J, et al. Anti-PD1-induced psoriasis: a study of 21 patients. J Eur Acad Dermatol Venereol 2017; 31:e254-e257.
10. Phan C, Sigal ML, Estève E, et al. Psoriasis in the elderly: epidemiological and clinical aspects, and evaluation of patients with very late onset psoriasis. J Eur Acad Dermatol Venereol 2016;30:78-82.
11. Amode R, Hadj-Rabia S, Bursztejn AC, et al. Palmoplantar psoriasis in children: a frequent and severe clinical type of psoriasis. J Eur Acad Dermatol Venereol 2016;30:1390-2.
12.Galezowski A, Maccari F, Hadj-Rabia S, et al. Rhumatisme psoriasique en France, du nourrisson à la personne âgée. Données de deux études transversales multicentriques françaises. Ann Dermatol Venereol 2018;145:13-20.
13. Nast A, Gisondi P, Ormerod AD, et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris--Update 2015--Short version-EDF in cooperation with EADV and IPC. J Eur Acad Dermatol Venereol 2015;29:2277-94.