La puberté est une étape importante de la maturité. Elle est à l’origine de modifications corporelles, physiologiques et psychologiques. Les caractères sexuels secondaires apparaissent, dans 95 % des cas, entre 8 et 13 ans (11,5 ans en moyenne) chez la fille, et entre 9 et 14 ans (12,5 ans en moyenne) chez le garçon. La croissance pubertaire représente 15 à 20 % de la taille adulte.
Les liens entre l’évolution séculaire de la taille adulte et celle de l’âge de la puberté ont été largement documentés ces dernières années ; une diminution particulièrement importante de l’âge des premières règles dans la plupart des pays occidentaux a été observée, stable depuis dix ans. Différents facteurs génétiques et environnementaux ont été explorés ;1,2 en particulier l’épidémie d’obésité influe sur l’âge de la puberté.
L’évaluation clinique de la puberté, le suivi des courbes de taille, de l’indice de corpulence et du périmètre crânien font partie de l’examen de l’enfant. Les définitions de la puberté précoce et du retard pubertaire sont assez claires, mais certaines situations peuvent aboutir à un retard de prise en charge.
Épidémiologie et facteurs d’évolution
Entre le milieu du XIXe siècle et le milieu du XXe siècle, l’âge moyen des premières règles a diminué : il est passé de 17 à 14 ans aux États-Unis et dans plusieurs pays d’Europe de l’Ouest. La cinétique de cette évolution diffère d’un pays à l’autre : des études prospectives font état d’une diminution de 0,3 an par décennie en Norvège et en Finlande ; en France, la diminution est de 0,175 an par décennie. Ces modifications coïncident avec les changements de conditions de vie dans les différents pays. L’évolution séculaire de l’âge des premières règles serait associée à une augmentation généralisée de l’indice de masse corporelle. D’autres marqueurs, tels que le développement mammaire (filles) ou des organes génitaux (garçons), ont été également étudiés : il n’a pas été observé de diminution de l’âge d’apparition du stade S2 en Europe, contrairement aux États-Unis. En revanche, l’âge du stade G2 a augmenté chez les garçons, au cours des dernières décennies aux Pays-Bas.
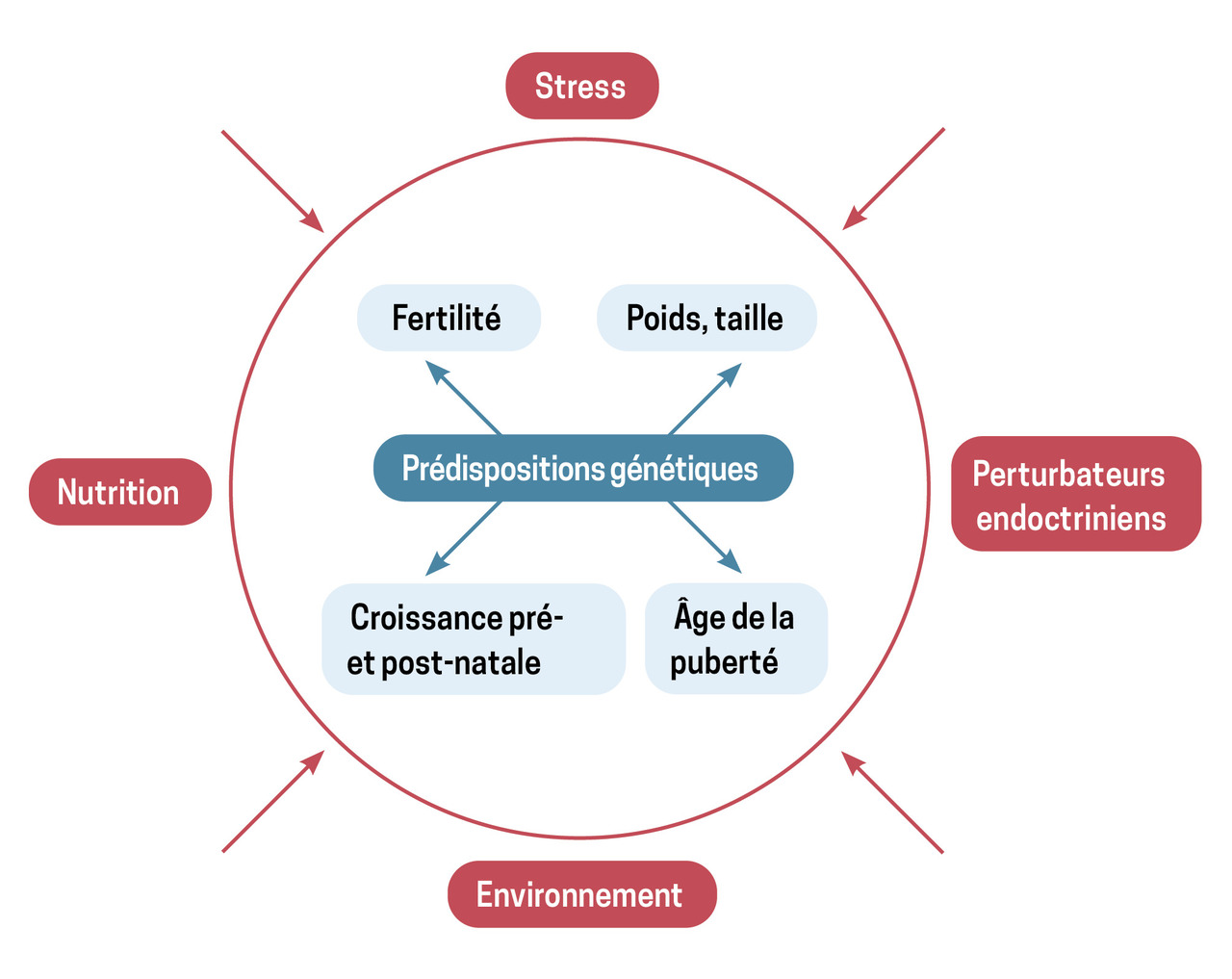
Certaines études épidémiologiques ont permis de corréler les variations de l’âge de la puberté avec plusieurs facteurs, essentiellement chez les filles (
– les conditions socioéconomiques : les filles vivant dans des pays en développement (Asie, Afrique, Amérique du Sud) mais évoluant dans un milieu socialement élevé ont un âge moyen de la ménarche différent de celles issues d’un milieu plus défavorisé, mais comparable à celui des filles des pays occidentaux du pourtour méditerranéen ;
– les facteurs génétiques : les études réalisées avec des jumeaux indiquent que 70 à 80 % des variations de l’âge pubertaire sont expliquées par des facteurs génétiques ;
– la nutrition : une relation entre le poids corporel, notamment l’indice de masse corporelle (IMC), et l’âge de survenue de la puberté a été suggérée depuis longtemps. Un IMC élevé dès l’âge de 36 mois est associé à une puberté précoce chez les filles américaines : celles dont l’IMC était au-dessus de la médiane avaient en moyenne leurs premières règles un an plus tôt que celles dont l’IMC était plus bas ;
– une croissance précoce : le poids de naissance et la croissance précoce sont des facteurs importants. Les enfants nés petits pour l’âge gestationnel et dont le rattrapage statural est rapide ont tendance à avoir une puberté plus précoce que ceux nés avec un poids de naissance élevé ;
– le stress : un entraînement sportif intensif retarde la puberté. D’autres situations de stress peuvent au contraire favoriser une puberté précoce : immigration, adoption, attachement parental insécure... ;
– les perturbateurs endocriniens : l’exposition fœtale et périnatale à des produits chimiques perturbateurs endocriniens (pesticide DDT mesuré dans le sérum sanguin d’enfants immigrés, par exemple) peut engendrer une puberté précoce. Il reste toutefois difficile d’isoler les agents chimiques présents dans l’environnement pour en connaître les effets respectifs sur le système endocrinien.
L’âge de survenue de la puberté a des conséquences biologiques, psychosociales et sanitaires à long terme. Un jeune âge à la ménarche est en effet associé à une augmentation du risque d’obésité, de cancer du sein, de maladies cardiovasculaires, de dépression, de troubles du comportement et de diabète.
Puberté : les repères
La puberté correspond à l’ensemble des phénomènes psychiques, physiques, mentaux et affectifs caractérisant la transition entre l’enfance et l’âge adulte.
Sur le plan physique, elle est essentiellement marquée par l’acquisition des caractères sexuels secondaires, la maturation de la fonction gonadique, l’acquisition des fonctions de la reproduction et une accélération de la vitesse de croissance.
Mécanismes hormonaux
Le déclenchement de la puberté est lié à la réactivation de la sécrétion pulsatile hypothalamique de GnRH (gonadotropin-releasing hormone, anciennement LHRH [luteinizing hormone releasing hormone]) stimulant les sécrétions des gonadotrophines (LH : luteinizing hormone, et FSH : follicle-stimulating hormone).
Chez le garçon, la sécrétion de testostérone par les cellules de Leydig est stimulée par la LH, ce qui est à l’origine du développement de la pilosité et de la croissance de la verge ; la FSH entraîne, quant à elle, l’augmentation du volume testiculaire.
Chez les filles, FSH et LH entraînent l’activation ovarienne et stimulent la sécrétion d’œstrogènes à l’origine du développement mammaire, utérovaginal et de la formation des follicules.
L’augmentation des taux d’hormones sexuelles à la puberté induit également une augmentation de la sécrétion de l’hormone de croissance (GH), à l’origine de l’accélération de la vitesse de croissance (10 à 15 cm/an). L’examen de la courbe de croissance est donc indissociable de l’examen de la puberté.
Caractères sexuels secondaires
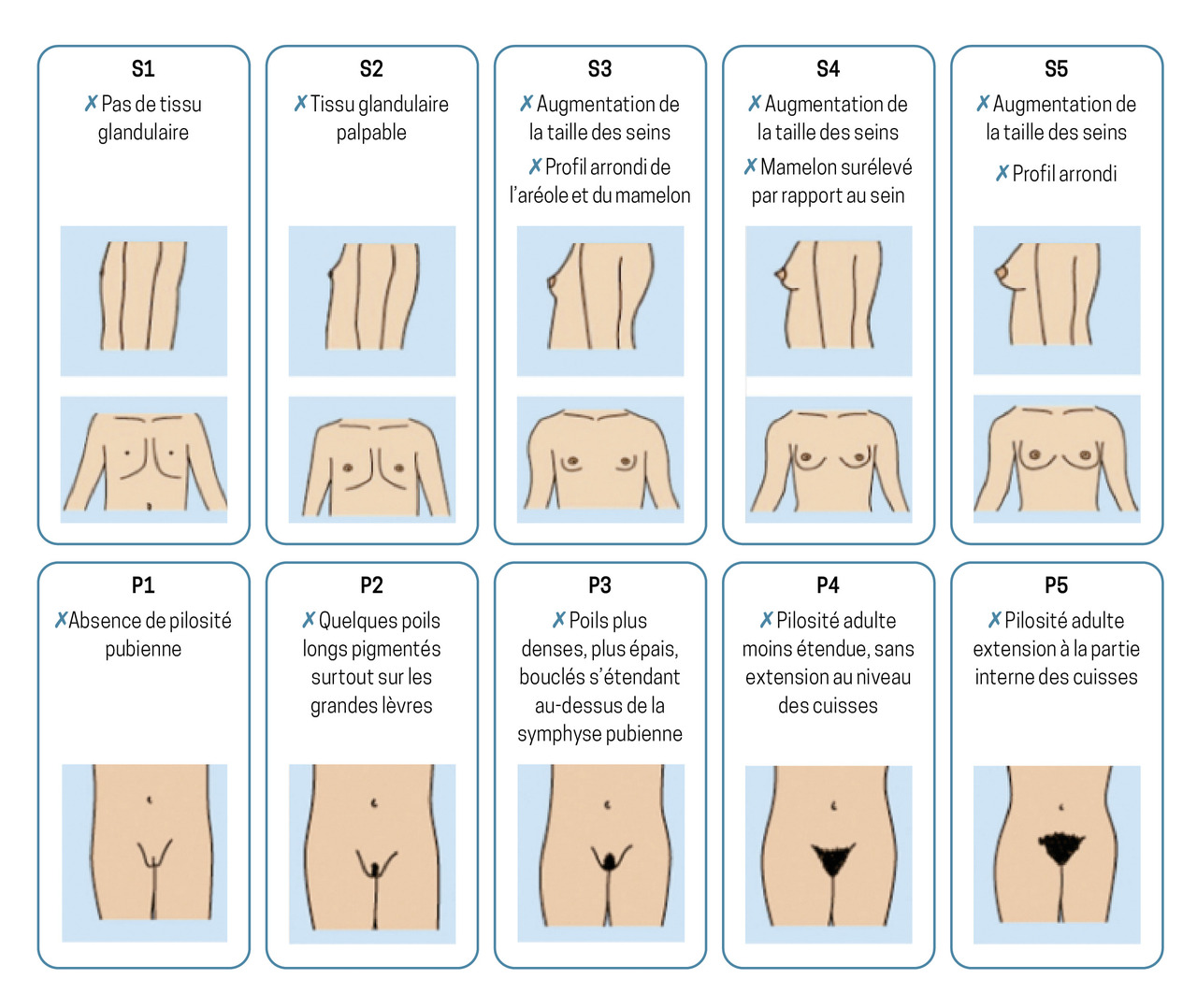
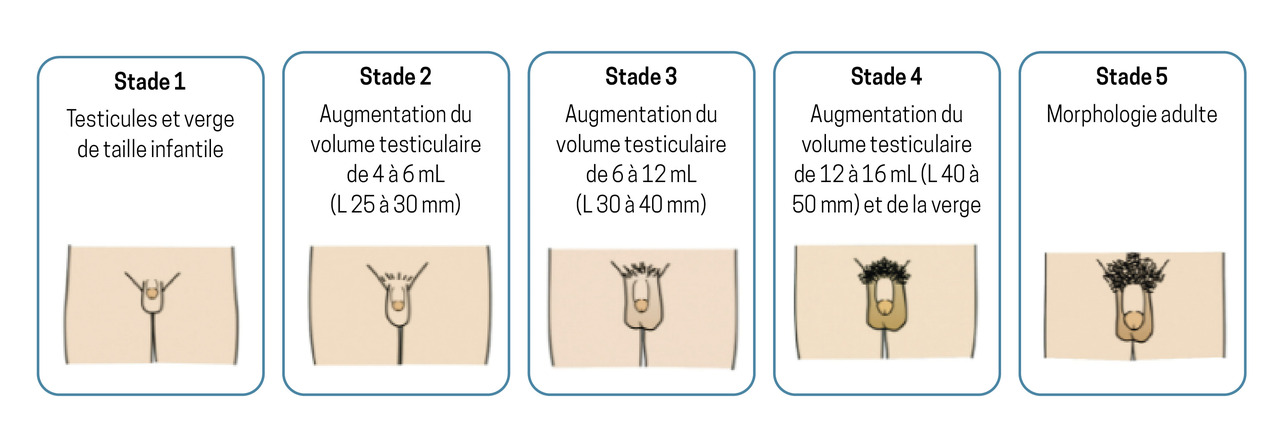
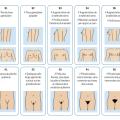
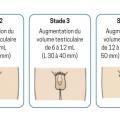
La classification de Tanner permet de définir les différents stades du développement pubertaire : développement mammaire (S), développement testiculaire (G) et pilosité pubienne (P).
Chez la fille (
Chez le garçon (
Croissance staturale et maturation osseuse
Chez les filles, l’accélération de la croissance pubertaire est synchrone des premiers signes pubertaires, tandis que chez les garçons elle est décalée d’environ un an. La croissance pubertaire totale moyenne se situe entre 23 et 25 cm chez les filles et entre 25 et 28 cm chez les garçons. En France, la taille finale est de 165 cm pour les filles et de 178 cm pour les garçons, en moyenne.
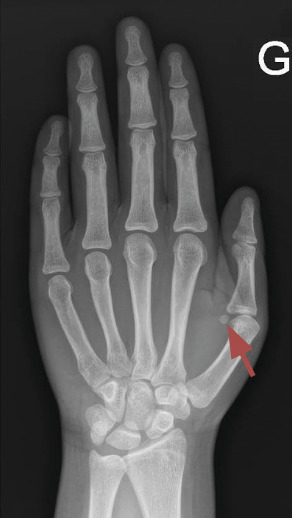
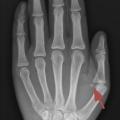
La maturation osseuse est évaluée grâce à une radiographie de la main gauche et du poignet gauche selon la méthode de Greulich et Pyle : c’est l’âge osseux.
Développement pubertaire pathologique : comment le diagnostiquer ?
Une démarche précise et approfondie permet de poser le diagnostic de puberté pathologique. On distingue deux entités : la puberté précoce et le retard pubertaire.
La puberté précoce
Elle se caractérise :
– chez la fille, par un développement mammaire survenant avant l’âge de 8 ans (l’apparition de la ménarche avant 9 ans peut être un critère additionnel) ;
– chez le garçon, par l’augmentation du volume testiculaire avant 9 ans.
La puberté précoce a des répercussions à la fois physiques et psychologiques. Son développement est potentiellement rapide et nécessite une évaluation sans délai.
Démarche diagnostique
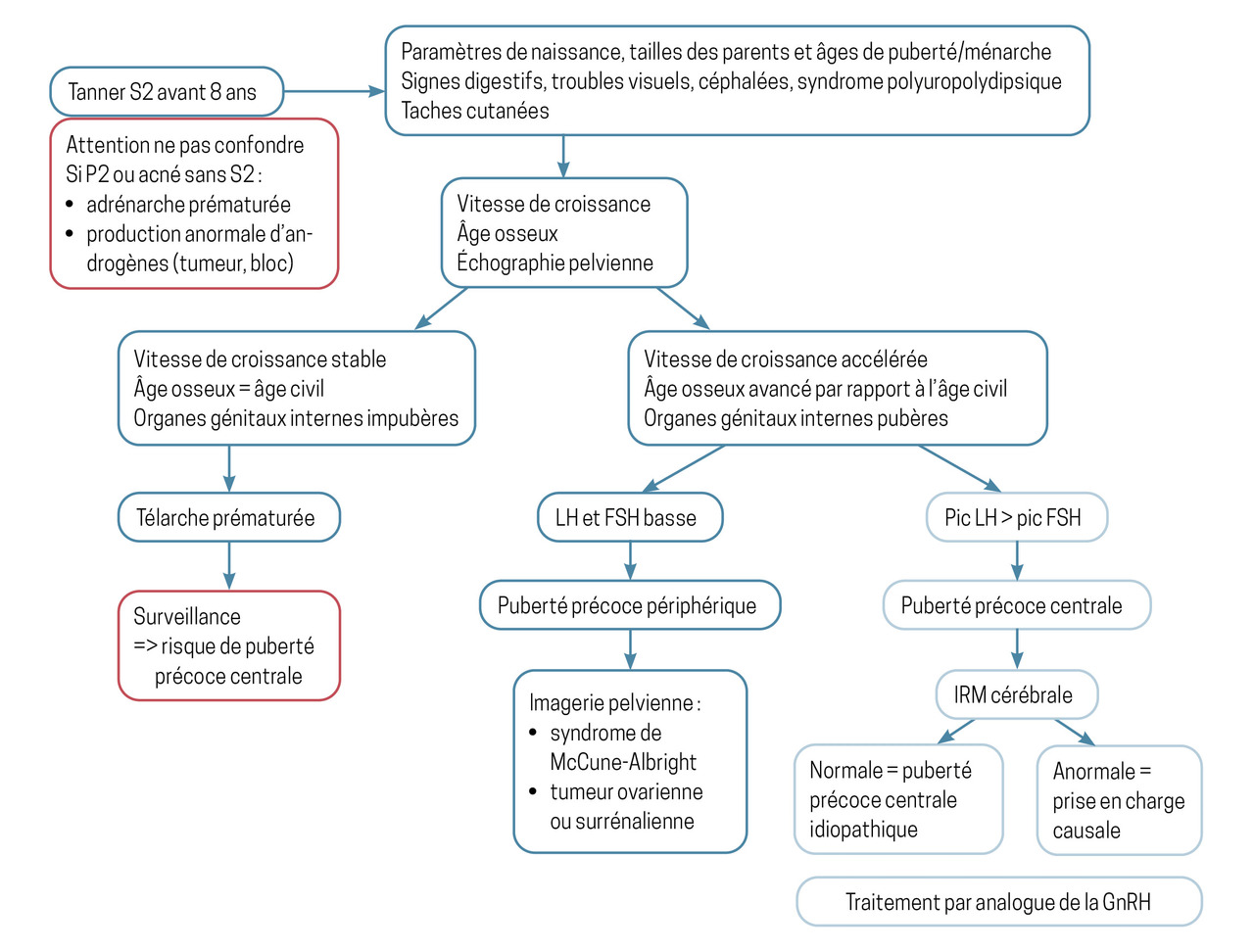
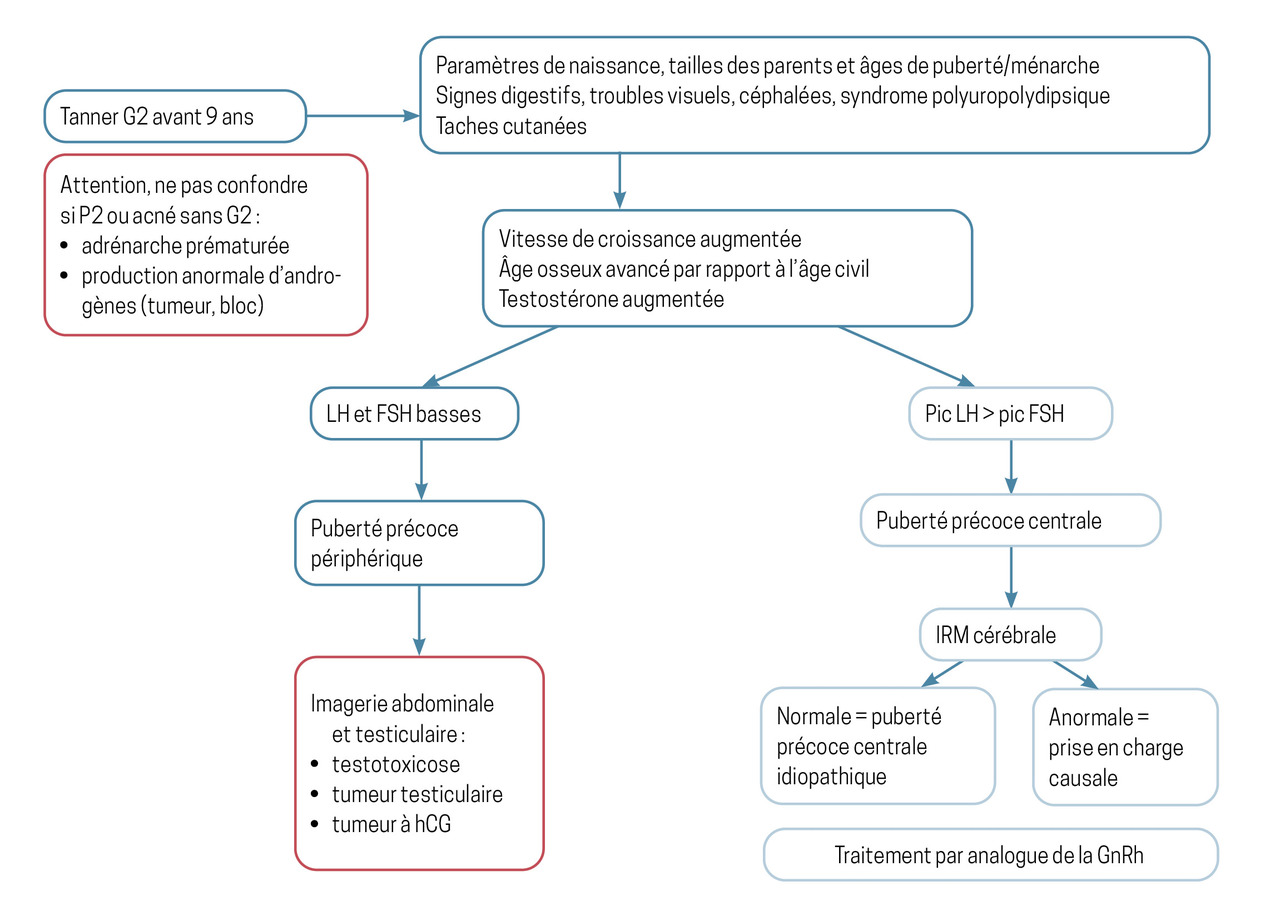
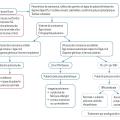
Elle permet d’abord d’affirmer que le patient a bien une puberté précoce, puis de distinguer les formes centrales – qui résultent d’une activation de l’axe hypothalamo-hypophysaire dépendant de la GnRH – des formes périphériques, indépendantes de la sécrétion de GnRH (
Examen clinique d’abord
Plusieurs éléments cliniques doivent être considérés en cas de suspicion de puberté précoce :
– les paramètres de naissance, tailles familiales, âge de la puberté des parents et de la fratrie. À l’interrogatoire, il faut rechercher des signes digestifs, des troubles visuels ou un syndrome polyuropolydipsique. L’existence de crises de rire immotivé (crises gélastiques) fait évoquer la présence d’un hamartome hypothalamique. La présence de taches cutanées doit faire évoquer une neurofibromatose de type 1 ou un syndrome de McCune-Albright. La courbe de croissance peut révéler une accélération de la vitesse de croissance souvent associée à une avance staturale au moment du diagnostic, qui va de pair avec une avance de l’âge osseux ;
– les conséquences psychologiques de l’apparition précoce des signes pubertaires sont à considérer, notamment dans la relation entre l’enfant et son entourage familial et scolaire.
Examens complémentaires
En cas de suspicion clinique de puberté précoce, des dosages hormonaux et des examens radiologiques permettent de confirmer le diagnostic.
Les stéroïdes sexuels sont dosés : la testostérone est augmentée dans les pubertés précoces centrales des garçons. Le dosage de l’estradiol est peu utile chez les filles. Celui des gonadotrophines, de base et souvent après stimulation par de la GnRh, est en revanche recommandé.
Un âge osseux (
Deux origines possibles
Deux types de puberté précoce se distinguent selon l’origine de la sécrétion hormonale anormale : hypothalamo-hypophysaire, centrale ; gonadique, périphérique.
La puberté précoce centrale
La puberté précoce centrale peut être acquise ou, plus rarement, génétique. Lorsque qu’elle est acquise, elle est due au déclenchement prématuré, lésionnel ou non, de l’axe hypothalamo-hypophysaire. Elle est 8 fois plus fréquente chez les filles que chez les garçons. Chez les filles, la puberté précoce centrale est le plus souvent idiopathique, alors que chez les garçons, elle est plus fréquemment lésionnelle (
Un traitement est proposé dans les pubertés précoces centrales confirmées biologiquement dont la progression est rapide, du fait du risque de petite taille finale en cas de début très précoce et/ou pour des raisons psychologiques (immaturité, troubles du comportement…). Un consensus de 2009 préconise l’usage des agonistes de la GnRH.3 Le gain sur la taille finale est très variable, et lié à l’âge auquel le traitement est débuté. Plusieurs études ont montré que freiner une puberté après 8 ans n’a pas d’effet sur la taille finale.
Les agonistes de la GnRH sont prescrits en injection mensuelle ou trimestrielle.
Le rétablissement fonctionnel de l’axe hypothalamo-hypophysaire après arrêt du traitement a été démontré. De plus, le traitement par agonistes de la GnRH n’entraîne pas de risque reconnu sur la fertilité.
La puberté précoce périphérique
La sécrétion précoce de stéroïdes sexuels est ici d’origine gonadique, donc indépendante des gonadotrophines.
Un développement des seins, intermittent ou non, avec parfois des métrorragies, est observé chez les filles. Chez les garçons, l’augmentation du volume testiculaire peut être asymétrique.
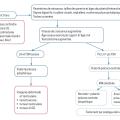
Le dosage des stéroïdes sexuels révèle des taux élevés, contrastant avec des taux plasmatiques de LH et FSH bas ou indétectables et non stimulables par la GnRH (
Le traitement est causal.
Trois entités physiologiques trompeuses
L’adrénarche est un processus physiologique dont l’importance et l’âge de développement sont variables d’un enfant à l’autre. Une acné légère, des cheveux gras, une pilosité pubienne ou axillaire (pubarche) ou des odeurs corporelles peuvent en être les signes cliniques. Ces symptômes peuvent, à tort, être considérés comme ceux d’une puberté précoce, et amènent souvent à consulter. Il n’y a ni développement mammaire ni augmentation du volume testiculaire.
L’adrénarche n’est pas liée à l’activation de l’axe gonadotrope mais à l’augmentation physiologique de la production d’androgènes par la surrénale vers l’âge de 8 ans.
L’adrénarche a tendance à survenir plus tôt chez les enfants obèses ou nés petits pour l’âge gestationnel.
Le diagnostic différentiel de l’adrénarche physiologique est l’hyperandrogénie, liée à la production excessive et anormale d’androgènes par la surrénale. Elle peut être d’origine acquise (tumeur surrénalienne) ou congénitale (forme non classique d’hyperplasie congénitale des surrénales). Les tumeurs surrénaliennes surviennent plutôt chez les enfants jeunes (avant 6 ans) ; les signes de virilisation sont prononcés (hypertrophie du clitoris chez la fille, augmentation de la taille de la verge sans augmentation de la taille des testicules chez le garçon) et évoluent rapidement.
Survenant classiquement entre l’âge de 1 et 3 ans, la thélarche prématurée correspond au développement des seins sans aucun autre signe de puberté : absence d’accélération de la croissance, absence d’avance de maturation osseuse (âge osseux corrélé à l’âge civil), absence d’imprégnation utérine (utérus < 35 mm, ovaires de petite taille < 20 mm). Elle est bénigne ; ses causes précises ne sont pas connues. Un simple suivi permet d’apprécier l’évolution de la thélarche prématurée pour la différencier d’une puberté précoce.
Les métrorragies se définissent comme un saignement d’origine utérine simulant les règles, mais sans aucun autre signe de développement pubertaire. L’examen de la vulve recherche une vulvite, une vulvovaginite, un prolapsus urétral ou un corps étranger. L’absence de développement des seins élimine un kyste ovarien ou un syndrome de McCune-Albright. L’échographie pelvienne retrouve un utérus de taille inférieure à 30 mm et peut mettre en évidence un corps étranger intravaginal, ou plus rarement une tumeur utérovaginale.
Le retard pubertaire
Le retard pubertaire est l’absence de développement mammaire après 13 ans chez les filles, et l’absence d’augmentation du volume testiculaire (> 4 mL) après 14 ans chez les garçons. La vitesse de croissance reste aussi prépubère, de 4 à 5 cm/an. Une aménorrhée primaire après 15 ans ou l’absence d’évolution de la puberté deux ans après son début doivent également être explorées comme un retard pubertaire.
À l’inverse de la puberté précoce centrale, le retard pubertaire simple est peu fréquent chez la fille, et doit faire chercher une pathologie, en particulier le syndrome de Turner.
Chez les garçons, le retard pubertaire simple, diagnostic d’élimination, est le plus fréquent (60 à 80 % des cas).
Le bilan étiologique doit permettre de déterminer l’origine du retard pubertaire.
Il en existe trois grands types :
– l’hypogonadisme hypogonadotrope (de cause centrale) ;
– l’hypogonadisme hypergonadotrope (de cause périphérique) ;
– le retard pubertaire simple.
Démarche diagnostique
Parmi les antécédents, il faut interroger sur la taille des parents et de la fratrie, l’âge de la puberté chez les parents (notamment l’âge des premières règles de la mère) et la fratrie et l’historique de la grossesse et de l’accouchement. Les antécédents pathologiques et les traitements reçus (corticothérapie, chimiothérapie, radiothérapie, etc.) sont soigneusement consignés. À l’interrogatoire sont recherchés des troubles digestifs, une polyuropolydipsie, des céphalées et une anomalie du champ visuel.
L’analyse de la courbe de croissance staturopondérale est indispensable.4
L’examen clinique permet de déceler les signes évoquant une pathologie acquise (syndrome de Cushing) ou une dysmorphie. L’examen des organes génitaux externes, des seins et de la pilosité pubienne conclut soit à une absence totale, soit à un début passé inaperçu, soit à un arrêt de la puberté. Le volume et la position des deux testicules sont précisés (en place, ectopiques, non palpables de façon uni- ou bilatérale, cryptorchidie). Enfin, la présence d’une anosmie permet d’évoquer le diagnostic rare d’hypogonadisme hypogonadotrope dû à un syndrome de Kallmann-de Morsier.
Des dosages hormonaux sont nécessaires :
– un taux bas de stéroïdes sexuels – testostérone chez le garçon, estradiol (dosage peu utilisé chez la fille) – confirme l’absence de démarrage pubertaire ;
– en cas de cause centrale : les taux de gonadotrophines de base (FSH et LH) sont bas ;
– en cas de cause périphérique : les taux de FSH et LH sont élevés. À ces dosages, on associe un bilan antéhypophysaire complet (bilan thyroïdien, dosage de prolactine, IGF1 et cortisol) ainsi qu’une recherche de pathologie chronique ou inflammatoire (maladie cœliaque, par exemple).
L’imagerie cérébrale est effectuée en cas d’hypogonadisme central ou de vitesse de croissance ralentie. La réalisation d’un caryotype est à envisager en cas d’origine périphérique.
Centrale ou périphérique, les causes diffèrent
Le retard pubertaire d’origine centrale
Il peut être congénital, acquis ou fonctionnel.
Congénital, l’hypogonadisme hypogonadotrope peut être isolé (avec ou sans anosmie) ou associé à d’autres déficits hypophysaires. Il peut se manifester sous la forme d’un micropénis (verge < 25 mm, cryptorchidie), mais ne s’accompagne généralement pas d’une cassure de la croissance.
Le syndrome de Kallmann et ses apparentés, l’hypoplasie congénitale des surrénales (DAX-1), les syndromes avec déficit gonadotrope congénital (Prader-Willi, Bardet-Biedl…) sont aussi congénitaux.5,6
Acquis, il est lié à une tumeur hypophysaire qui doit être éliminée par principe, surtout si le retard pubertaire s’accompagne d’une cassure de la croissance.
Fonctionnel, le retard pubertaire est lié à une maladie chronique déséquilibrée, à une maladie inflammatoire, à une dénutrition ou à une activité physique intense.
Le retard pubertaire d’origine périphérique
Il est lié à une anomalie primitive des gonades. Il peut être constitutionnel ou acquis.
Deux syndromes sont les principales causes de retard pubertaire périphérique constitutionnel :
– le syndrome de Klinefelter (47,XXY ; 1,6 garçon/1 000) peut se manifester par un démarrage pubertaire sans augmentation du volume testiculaire (< 25 mm) ; une gynécomastie est fréquente ;
– le syndrome de Turner (45,X ou mosaïques) doit être évoqué systématiquement devant un retard de croissance ou un retard pubertaire chez la fille. On retrouve le plus souvent une petite taille de naissance. Des antécédents d’infection ORL à répétition, une pathologie cardiaque (communication interauriculaire ou coarctation) sont recherchés.
Acquis, le retard pubertaire périphérique peut être dû à une irradiation ou une chimiothérapie gonadotoxique, une chirurgie de cryptorchidie ou une anorchidie.
Le retard pubertaire simple : diagnostic d’élimination
Le retard pubertaire simple est un diagnostic d’exclusion, fréquent chez les garçons. Le démarrage spontané de la puberté signe rétrospectivement le diagnostic.
Les antécédents familiaux de puberté tardive et l’absence de trouble de fertilité, le maintien d’une vitesse de croissance prépubère sans cassure staturale, l’absence d’éléments cliniques évoquant un syndrome – dont l’absence d’obésité, d’anosmie, de signes neurologiques, le retard d’âge osseux et l’absence de micropénis ou cryptorchidie – sont autant de signes qui peuvent orienter vers un retard pubertaire simple chez les garçons.
Prise en charge : différente selon la cause
En cas d’hypogonadisme hypogonadotrope fonctionnel réversible, le traitement consiste à prendre en charge la pathologie initiale, l’état inflammatoire et nutritionnel, le plus souvent sans substitution nécessaire.
En cas de pathologie organique pubertaire, la substitution hormonale chez le garçon dépend de la cause : gonadotrophines ou testostérone injectables. En revanche, pour la fille, l’induction pubertaire se fait par estrogénothérapie puis estroprogestatifs. Pour être efficace, ce traitement doit être entrepris dès l’âge normal de début de la puberté.
En cas de retard pubertaire simple, un suivi clinique est la règle. Si l’adolescent mentionne une gêne ou une plainte, un traitement substitutif court peut être discuté. L’évolution pubertaire doit être surveillée dans le temps.7
Puberté précoce : signes alarmants chez la fille
Un saignement vaginal, une accélération de la vitesse de croissance, une hypertrophie clitoridienne et une avance sur l’âge osseux sont des signes inquiétants qui doivent faire adresser à un spécialiste sans délai.
1. Bertelloni S, Massart F, Miccoli M, et al. Adult height after spontaneous pubertal growth or GnRH analog treatment in girls with early puberty: a meta-analysis. Eur J Pediatr 2017;176(6):697‑704.
2. Khan L. Puberty: Onset and Progression. Pediatr Ann 2019;48(4):e141‑5.
3. Carel JC, Eugster EA, Rogol A, et al. Consensus statement on the use of gonadotropin-releasing hormone analogs in children. Pediatrics 2009;123(4):e752-62.
4. Partsch CJ, Heger S, Sippell WG. Management and outcome of central precocious puberty.
Clin Endocrinol (Oxf) 2002;56(2):129‑48.
5. Sultan C, Gaspari L, Maimoun L, et al. Disorders of puberty. Best Pract Res Clin Obstet Gynaecol 2018;48:62‑89.
6. Tanner JM, Buckler JM. Revision and update of Tanner-Whitehouse clinical longitudinal charts for height and weight. Eur J Pediatr 1997;156(3):248‑9.
7. Wood CL, Lane LC, Cheetham T. Puberty: Normal physiology (brief overview). Best Pract Res Clin Endocrinol Metab 2019;33(3):101265.

 Encadrés
Encadrés