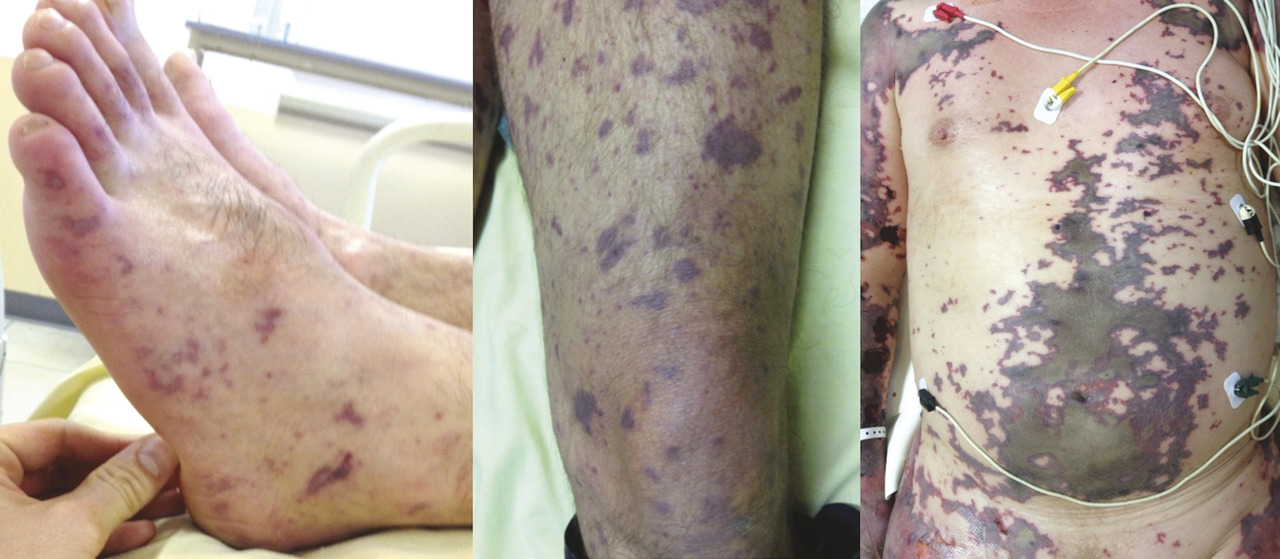
Le purpura fulminans est une maladie infectieuse rare mais de pronostic sombre, dont les deux principales bactéries responsables sont le méningocoque et le pneumocoque. Le diagnostic précoce est difficile. Or la prise en charge par antibiothérapie probabiliste doit être rapide.
Le purpura fulminans (PF) est une maladie infectieuse rare caractérisée par l’association d’un état de choc septique et d’un purpura d’apparition et d’extension rapides.1-3 Le PF représente moins de 0,5 % des causes de choc septique de l’adulte.4 Les deux principales bactéries responsables sont le méningocoque et le pneumocoque.1 Bien que ces bactéries soient extrêmement sensibles aux antibiotiques disponibles, le pronostic du PF reste sombre, avec une mortalité élevée en réanimation et un risque de séquelles sévères à distance chez les patients survivants.1, 5
Quelles sont les bactéries responsables du purpura fulminans ?
La documentation microbiologique du PF est obtenue chez plus de 90 % des patients.1 Neisseria meningitidis (surtout les sérogroupes B et C) est responsable de près des deux tiers des cas de PF alors qu’un quart des PF est dû à Streptococcus pneumoniae.1 La présentation clinique et l’évolution en réanimation diffèrent significativement selon la bactérie en cause : en cas de PF pneumococcique, l’âge des patients est plus élevé, on observe davantage de comorbidités et une sévérité accrue à l’admission.6
D’autres bactéries telles que Streptococcus pyogenes (Streptococcus du groupe A), Staphylococcus aureus ou certaines entérobactéries peu-vent être responsables de PF chez l’adulte.1 Capnocytophaga canimorsus est une bactérie commensale de la cavité buccale des chiens et des chats qui peut causer des tableaux de PF après morsure, griffure ou léchage de lésions cutanées préexistantes, surtout en cas d’asplénie ou d’hyposplénie sous-jacente.7, 8
Quelle est la physiopathologie du purpura fulminans à méningocoque ?
Neisseria meningitidis est une bactérie strictement humaine qui ne survit pas dans le milieu extérieur et qui se transmet par contacts interhumains rapprochés (moins de 1 mètre de distance) par projection aérienne de microgouttelettes issues des sécrétions salivaires. On estime qu’environ 10 % de la population générale a une colonisation nasopharyngée (portage asymptomatique) par Neisseria meningitidis avec un pic à 24 % à l’âge de 19 ans.9 L’infection invasive à méningocoque débute dès lors que la bactérie accède à la circulation sanguine après avoir traversé l’épithélium nasopharyngé. Les déterminants de cet événement très rare de « progression transépithéliale » sont peu connus et font intervenir des facteurs liés à l’hôte et à la bactérie. Les déficits congénitaux ou acquis en l’une ou plusieurs des protéines du complément constituent un facteur de risque reconnu de méningococcémies.10 Des modèles expérimentaux montrent qu’il existe une interaction étroite entre Neisseria meningitidis et les cellules endothéliales.11 Neisseria meningitidis a en effet la capacité d’adhérer aux cellules endothéliales et de proliférer en agrégats (microcolonies de méningocoques) pouvant occlure la lumière vasculaire. Cette adhérence aux cellules endothéliales est rendue possible grâce à une structure adhésive filamenteuse d’origine protéique appelée pili de type IV.12 Ces pili de type IV sont des facteurs de virulence essentiels pour la progression de la méningococcémie vers le PF.13 Le processus infectieux progresse depuis les lésions endothéliales induites par Neisseria meningitidis avec extravasation de globules rouges, jusqu’à l’infiltration de polynucléaires et l’implication tardive de la thrombose. La congestion microvasculaire, la thrombose et la perte de l’intégrité vasculaire, qui provoquent un purpura lorsqu’elles se produisent dans les microvaisseaux cutanés, affectent également tous les autres organes profonds : l’atteinte cutanée est la partie visible de la maladie.
Quels sont les facteurs de risques de purpura fulminans ?
Le PF touche principalement les adultes jeunes (âge médian de 34 ans) sans comorbidités.1 Cependant, deux populations sont particulièrement à risque de PF :
– les patients ayant un déficit congénital ou acquis en une ou plusieurs des protéines du complément comme ceux traités par éculizumab (anticorps monoclonal anti-C5 administré en cas de syndrome hémolytique et urémique atypique, d’hémoglobinurie paroxystique nocturne, de myasthénie sévère ou de neuromyélite optique) ont un risque accru de développer un PF à méningocoque. Ils doivent obligatoirement recevoir un schéma vaccinal contre les sérogroupes A, C, Y, W et B. Des méningococcémies récidivantes chez un même patient, un antécédent familial de méningococcémie ou une méningococcémie liée à un sérogroupe rare (en pratique, due à un sérogroupe autre que B et C) doivent alerter le clinicien sur la possibilité d’un déficit congénital en protéines du complément ;
– les patients aspléniques ou hypospléniques (drépanocytose homozygote, embolisation ou irradiation splénique, cirrhose sévère ou maladies auto-immunes) ont une susceptibilité accrue au PF pneumococcique qui survient le plus souvent très à distance de la splénectomie (médiane de survenue : vingt ans après la splénectomie).14 La moitié des PF pneumococciques surviennent ainsi chez des patients aspléniques ou hypospléniques.14
Quels sont les signes cliniques du purpura fulminans ?
Un diagnostic précoce difficile
Le diagnostic de PF est difficile à la phase initiale, avant que l’éruption cutanée n’apparaisse. En effet, l’éruption purpurique est précédée par une phase prodromique durant vingt-quatre à quarante-huit heures (
Le diagnostic est plus facile à la phase d’état, lorsque le purpura est apparu. Ce purpura (éruption cutanée rouge ou violacée ne s’effaçant pas à la vitropression, à l’inverse de l’érythème) a la particularité sémiologique d’être nécrotique ou ecchymotique (
Méningite bactérienne et PF : deux entités différentes, parfois associées
Il est important de retenir que la présentation clinique des patients ayant un PF diffère de celle de patients ayant une méningite bactérienne, même si les deux présentations cliniques peuvent coexister chez un même patient (
La présentation clinique peut être atypique
Enfin, le PF méningococcique peut avoir une présentation clinique abdominale, sans signe cutané, avec un examen clinique pouvant mimer une urgence chirurgicale ; cette présentation trompeuse est surtout due au méningocoque de sérogroupe W.17
Quels sont les examens microbiologiques à réaliser ?
Aucun examen complémentaire n’est nécessaire pour faire le diagnostic positif de PF (
Dans près de deux tiers des cas, la bactérie responsable est isolée dans les hémocultures prélevées à l’admission en réanimation ou aux urgences.1 En l’absence de trouble de l’hémostase, la réalisation d’une PL peut être discutée afin d’optimiser l’enquête microbiologique et/ou pour ajuster la dose de bêtalactamine à administrer en cas de méningite ou d’ensemencement méningé associé (id est dose dite « neuroméningée »). L’indication de la PL est à évaluer au cas par cas. En effet, les patients n’ont le plus souvent aucun signe neurologique1 mais ont une contre-indication à la réalisation de cet examen (perturbation sévère de l’hémostase ou état de choc sévère) ; de plus, il existe des alternatives moins invasives pour optimiser le diagnostic microbiologique : hémoculture et biopsie cutanée. Lorsqu’elle est réalisée, la culture du liquide cérébrospinal est positive dans 50 % des cas.1, 16 Il est important pour le clinicien de savoir que 42 % des patients ayant eu une PL ont une coloration de Gram positive malgré l’absence de méningite cytologique (taux de leucocytes inférieur à 10/mm3) et que 32 % des patients ont une culture positive malgré une coloration de Gram négative et l’absence de méningite cytologique.16
La biopsie cutanée d’une lésion purpurique avec culture bactérienne conventionnelle et recherche d’ADN bactérien de pneumocoque et de méningocoque par PCR (polymerase chain reaction ou réaction de polymérisation en chaîne) est un examen simple, non invasif, pouvant être réalisé même en cas de perturbation sévère de la coagulation ; elle permet de détecter la bactérie responsable jusqu’à soixante-douze heures après l’initiation de l’antibiothérapie.18 La PCR sur tissu cutané permet aussi de déterminer le sérogroupe de méningocoque responsable (utile pour la prophylaxie vaccinale des cas contacts).18
Enfin, la recherche d’antigène pneumococcique dans les urines peut aussi être utile au cours d’une pneumococcémie.6, 14
Quelle est la prise en charge initiale ?
La prise en charge d’un patient ayant un PF n’a aucune spécificité comparée à celle d’un patient ayant un choc septique lié à une autre porte d’entrée (
L’antibiothérapie probabiliste, au mieux par une céphalosporine de troisième génération (ceftriaxone ou céfotaxime à la dose de 1 g par voie intramusculaire ou intraveineuse), doit être administrée sans délai dès la suspicion diagnostique (son excès est sans conséquence), en préhospitalier, quel que soit l’état hémodynamique du patient (
Puisqu’une bactérie est isolée chez près de la moitié des patients adultes avec un PF ayant eu une ponction lombaire, il semble justifié d’administrer une dose élevée (dose dite « neuroméningée ») de céphalosporine de troisième génération jusqu’à la culture définitive du liquide cérébrospinal ou pour toute la durée du traitement si la PL n’a pas été réalisée en raison de l’absence de signes neurologiques initiaux ou en cas de troubles sévères de la coagulation. La durée de l’antibiothérapie n’est pas codifiée mais, par analogie avec les méningites bactériennes à méningocoque et à pneumocoque, on peut proposer une durée de quatre à sept jours pour les PF méningococciques et de dix à quatorze jours pour les PF pneumococciques.20
Les défaillances d’organes sont prises en charge comme au cours de tout autre état de choc septique : expansion volémique, amines vasopressives (noradrénaline), intubation trachéale en cas de retentissement neurologique, respiratoire ou circulatoire, et épuration extrarénale en présence des critères habituels (acidémie ou hyperkaliémie sévères, anurie persistante).
Il faut par ailleurs mettre en place un isolement respiratoire type « gouttelettes » pour éviter la transmission d’un éventuel méningocoque le temps d’éradiquer le portage pharyngé : vingt-quatre heures après le début de l’antibiothérapie en cas d’utilisation de céfotaxime et quelques heures seulement en cas d’utilisation de ceftriaxone, qui a une meilleure excrétion salivaire et rhinopharyngée.
Un signalement auprès de l’agence régionale de santé (24 h/24, 7 j/7) s’impose dès la suspicion diagnostique afin d’organiser au plus vite la prophylaxie médicamenteuse et vaccinale des cas contacts.
Quel est le pronostic à court et long termes ?
Le pronostic de ces jeunes patients sans comorbidités est mauvais, puisqu’environ 40 % des patients admis en réanimation pour un PF vont mourir d’une insuffisance circulatoire aiguë réfractaire, le plus souvent dans les vingt-quatre à quarante-huit heures suivant l’admission en réanimation.1 Parmi les patients survivant à la phase aiguë, près d’un tiers souffriront de nécrose des extrémités (en rapport avec la coagulation intravasculaire disséminée, les fortes doses de vasopresseurs, l’hypovolémie et les éventuels syndromes de loge liés à l’expansion volémique initiale) nécessitant une amputation d’un ou plusieurs membres, les infections à pneumocoque étant associées à un risque accru d’amputation de membre.1, 6 Finalement, sur 10 patients admis en réanimation pour un PF, seuls 4 sortiront de réanimation vivants sans avoir été amputés, ce qui illustre la lourde morbi-mortalité engendrée par cette infection.
La qualité de vie physique et mentale évaluée par le score SF-36 à distance de la réanimation semble comparable entre les patients survivant à un état de choc septique lié à un PF et ceux survivant à un état de choc septique lié à une autre porte d’entrée.5 En revanche, lorsque l’on compare, au sein des patients ayant survécu à un PF, ceux ayant subi une amputation de membre à ceux n’en ayant pas subie, on observe une diminution significative de la qualité de vie physique chez les premiers mais sans retentissement sur la qualité de vie mentale.5 Il est intéressant de noter que tous les patients amputés étaient capables de marcher, la moitié d’entre eux pouvant même marcher plus de 500 mètres. Ces données semblent primordiales à connaître car la question éthique du niveau d’engagement thérapeutique se pose logiquement lorsque s’installent et progressent les nécroses des extrémités lors de la phase de défaillance multiviscérale initiale, avec la crainte de l’amputation et de ses conséquences sur la qualité de vie ultérieure.21
Quelle prophylaxie autour d’un cas de PF ?
Il n’y a pas de prophylaxie pour les contacts de patients ayant un PF à pneumocoque.
La prophylaxie des cas contacts d’un patient ayant un PF à méningocoque est, quant à elle, organisée en lien avec les médecins de l’agence régionale de santé. Elle est détaillée dans l’instruction DGS/SP/2018/163 du 27 juillet 2018 accessible en ligne19 et repose sur l’antibioprophylaxie et la vaccination. Elle s’applique aux personnes ayant eu des contacts rapprochés (distance inférieure à 1 mètre) dans les dix jours précédant l’hospitalisation du cas (en pratique, les personnes vivant sous le même toit et les proches camarades de classe ou de travail), et ce quel que soit leur statut vaccinal.
L’antibioprophylaxie doit être débutée dans les plus brefs délais, idéalement dans les vingt-quatre à quarante-huit heures suivant l’identification du méningocoque chez le patient source. Son objectif est d’éradiquer une potentielle colonisation nasopharyngée. La molécule à utiliser en première intention est la rifampicine à la dose de 600 mg deux fois par jour pendant quarante-huit heures (4 doses au total). Il est indispensable d’informer les patientes de la nécessité d’utiliser une contraception mécanique pendant huit jours en cas de contraception orale. En cas d’indisponibilité, de contre-indication ou de résistance à la rifampicine, on peut utiliser une dose unique de ciprofloxacine orale (500 mg) ou de ceftriaxone (250 mg par voie intraveineuse ou intramusculaire).
La vaccination complète l’antibioprophylaxie lorsque la souche responsable du cas est un sérogroupe contre lequel il existe un vaccin (vaccin conjugué C en cas de sérogroupe C et vaccin tétravalent conjugué ACWY en cas de sérogroupe A, Y ou W). En cas de PF sporadique (hors épidémie) à méningocoque B, la vaccination des sujets contacts n’est actuellement pas recommandée en sus de la chimioprophylaxie, qui représente le moyen le plus efficace de prévention des cas secondaires.
Comment prévenir le PF et quel est le rôle du médecin traitant ?
L’amélioration du pronostic du PF repose avant tout sur un diagnostic précoce lors de la phase initiale. Déshabiller en totalité les patients ayant un syndrome infectieux à la recherche de la moindre petite tache purpurique doit être systématique chez tout patient ayant un syndrome infectieux sans cause évidente. La mise en évidence de purpura doit déclencher l’appel du Samu et l’administration dans les plus brefs délais d’une antibiothérapie intraveineuse ou intramusculaire par 1 g de ceftriaxone ou de céfotaxime (f
La vaccination contre le méningocoque C est obligatoire pour tous les enfants nés à compter du 1er janvier 2018 ; depuis 2022, la vaccination contre le méningocoque B est recommandée chez l’ensemble des nourrissons.22 La vaccination est recommandée par un vaccin tétravalent conjugué ACWY et par un vaccin contre le sérogroupe B pour les patients ayant un déficit en fraction terminale du complément, ceux recevant un traitement anticomplément ou ceux ayant une asplénie anatomique ou fonctionnelle, et pour les patients ayant reçu une greffe de cellules souches hématopoïétiques.
La prévention du PF à pneumocoque repose sur la vaccination et l’éducation des patients à risque, notamment ceux ayant une asplénie. Ces derniers doivent être vaccinés contre le pneumocoque (et le méningocoque et Haemophilus influenzae) avant une splénectomie programmée ou après une splénectomie non programmée, puis tous les cinq ans. Une antibioprophylaxie par pénicilline V (Oracilline 1 million d’unités, 2 fois par jour) est également prescrite pendant au moins deux ans après la splénectomie (cette durée peut être étendue dans certains cas). Le patient asplénique doit être éduqué, savoir qu’il présente un risque accru d’infections sévères qui persiste toute la vie et connaître la conduite à tenir en cas de fièvre ou de morsure par un chien. ●
1. Contou D, Sonneville R, Canoui-Poitrine F, Colin G, Coudroy R, Pène F, et al. Clinical spectrum and short-term outcome of adult patients with purpura fulminans: A french multicenter retrospective cohort study. Intensive Care Med 2018;44:1502-11.
2. Contou D, Urbina T, de Prost N. Understanding purpura fulminans in adult patients. Intensive Care Med 2022;48(1):106-10.
3. Contou D, de Prost N. Purpura fulminans de l’adulte. Médecine Intensive-Réanimation 2022;31:125-32.
4. Contou D, Roux D, Jochmans S, Coudroy R, Guérot E, Grimaldi D, et al. Septic shock with no diagnosis at 24 hours: A pragmatic multicenter prospective cohort study. Crit Care 2016;20(1):360.
5. Contou D, Canoui-Poitrine F, Coudroy R, Préau S, Cour M, Barbier F, et al. Long-term quality of life in adult patients surviving purpura fulminans: An exposed-unexposed multicenter cohort study. Clin Infect Dis 2019;69(2):332-40.
6. Contou D, de Prost N. Clinical phenotype and outcomes of pneumococcal versus meningococcal purpura fulminans: A multicenter retrospective cohort study. Crit Care 2021;25(1):386.
7. Mader N, Lührs F, Langenbeck M, Herget-Rosenthal S. Capnocytophaga canimorsus - a potent pathogen in immunocompetent humans - systematic review and retrospective observational study of case reports. Infect Dis (Lond) 2020;52(2):65-74.
8. Mantovani E, Busani S, Biagioni E, Venturelli C, Serio L, Girardis M. Purpura fulminans and septic shock due to capnocytophaga canimorsus after dog bite: A case report and review of the literature. Case Rep Crit Care 2018:7090268.
9. Christensen H, May M, Bowen L, Hickman M, Totter CL. Meningococcal carriage by age: A systematic review and meta-analysis. Lancet Infect Dis 2010;10:853-61.
10. Audemard-Verger A, Descloux E, Ponard D, Deroux A, Fantin B, Fieschi C, et al. Infections revealing complement deficiency in adults: A french nationwide study enrolling 41 patients. Medicine (Baltimore) 2016;95(19):e3548.
11. Melican K, Dumenil G. Vascular colonization by Neisseria meningitidis. Curr Opin Microbiol 2012;15(1):50-6.
12. Manriquez V, Nivoit P, Urbina T, Echenique-Rivera H, Melican K, Fernandez-Gerlinger MP, et al. Colonization of dermal arterioles by Neisseria meningitidis provides a safe haven from neutrophils. Nat Commun 2021;12:4547.
13. Melican K, Michea Veloso P, Martin T, Bruneval P, Dumenil G. Adhesion of Neisseria meningitidis to dermal vessels leads to local vascular damage and purpura in a humanized mouse model. PLoS Pathog 2013;9:e1003139.
14. Contou D, Coudroy R, Colin G, Tadie JM, Cour M, Sonneville R, et al. Pneumococcal purpura fulminans in asplenic or hyposplenic patients: A French multicenter exposed-unexposed retrospective cohort study. Crit Care 2020;24:68.
15. Rameix-Welti MA, Zarantonelli ML, Giorgini D, Ruckly C, Marasescu M, van der Werf S, et al. Influenza A virus neuraminidase enhances meningococcal adhesion to epithelial cells through interaction with sialic acid-containing meningococcal capsules. Infect Immun 2009;77(9):3588-95.
16. Contou D, Sonneville R, Mekontso Dessap A, de Prost N, Jaber S. Diagnostic yield of lumbar puncture in adult patients with purpura fulminans. Intensive Care Med 2019;45:1487-9.
17. Guiddir T, Gros M, Hong E, Terrade A, Denizon M, Deghmane AE, et al. Unusual initial abdominal presentations of invasive meningococcal disease. Clin Infect Dis 2018;67(8):1220-7.
18. Staquet P, Lemee L, Verdier E, Bonmarchand G, Laudenbach V, Michel C, et al. Detection of Neisseria meningitidis DNA from skin lesion biopsy using real-time PCR: Usefulness in the aetiological diagnosis of purpura fulminans. Intensive Care Med 2007;33:1168-72.
19. Instruction DGS/SP/2018/163 du 27 juillet 2018 relative à la prophylaxie des infections invasives à méningocoque. Disponible sur : www.legifrance.gouv.fr/circulaire/id/43909
20. Hoen B, Varon E, de Debroucker T, Fantin B, Grimprel E, Wolff M, et al. Management of acute community-acquired bacterial meningitis (excluding newborns). Long version with arguments. Med Mal Infect 2019;49(6):405-41.
21. Commission d’éthique de la Société de réanimation de langue française ; Quentin B, Grim O, Moine H, Bui NH, Eon B, Noizet O, et al. Amputations multiples après purpura fulminans : jusqu’où peut-on accepter le handicap ? Aspects anthropologiques et philosophiques. Med Intensive Rea 2017;26:261-7.
22. Calendrier des vaccinations et recommandations vaccinales 2022. Disponible sur https://solidarites-sante.gouv.fr/IMG/pdf/calendrier_vaccinal_2022_mis_a_jour_juin_2022_v2.pdf
Dans cet article
- Quelles sont les bactéries responsables du purpura fulminans ?
- Quelle est la physiopathologie du purpura fulminans à méningocoque ?
- Quels sont les facteurs de risques de purpura fulminans ?
- Quels sont les signes cliniques du purpura fulminans ?
- Quels sont les examens microbiologiques à réaliser ?
- Quelle est la prise en charge initiale ?
- Quel est le pronostic à court et long termes ?
- Quelle prophylaxie autour d’un cas de PF ?
- Comment prévenir le PF et quel est le rôle du médecin traitant ?