D’abord réservée à des patients ayant une contre-indication absolue à la chirurgie, cette technique va devenir progressivement le traitement de référence du rétrécissement aortique.
Le rétrécissement aortique calcifié est la plus fréquente des valvulopathies au sein des pays industrialisés. Il atteint approximativement 2 % de la population entre 70 et 80 ans, et 3 à 9 % après 80 ans.1-3 Dans un registre européen publié en 2003, il était en première position des valvulopathies, à savoir 43,1 % des patients inclus.4 Avec le vieillissement de la population, on estime que 3 à 4 millions de personnes en seront atteintes aux États-Unis en 2050.5
Les patients ayant une sténose aortique sont asymptomatiques pendant de nombreuses années, et la mortalité liée à la sténose est alors inférieure à 1 %. L’apparition de symptômes marque un tournant évolutif, avec une médiane de survie de 5 ans en cas d’angor d’effort, 3 ans en cas de syncope, et 2 ans en cas d’apparition de signes d’insuffisance cardiaque.6
Jusqu’au début des années 2000, le traitement du rétrécissement aortique était chirurgical, avec le plus souvent la mise en place d’une prothèse biologique. La mortalité de cette procédure est basse, entre 1 et 3 %. Elle nécessite cependant une anesthésie générale, une sternotomie, et la mise sous assistance extracardiaque pendant l’inter- vention. Si les suites sont le plus souvent simples, le retour à une activité normale n’est possible qu’au bout d’environ six semaines.
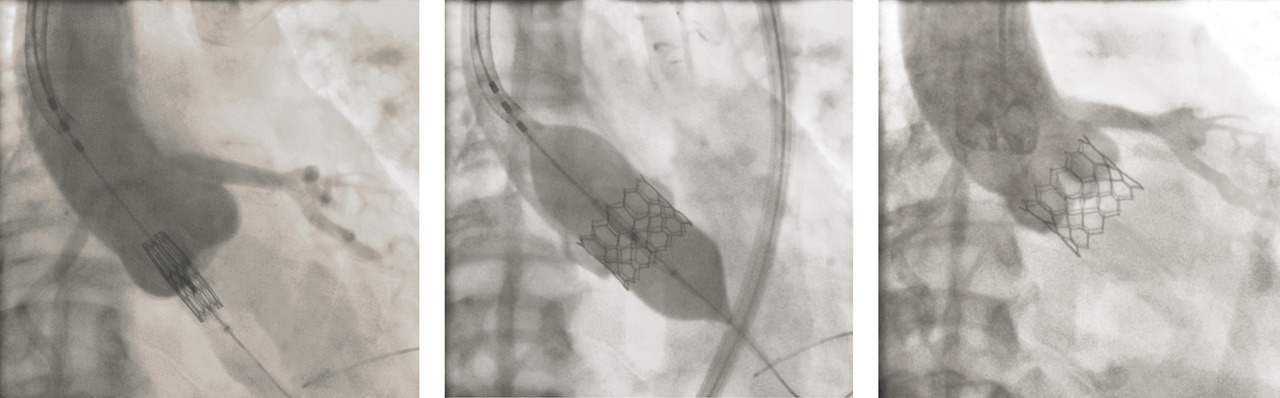
En 2002, le Pr Alain Cribier réalise à Rouen la première implantation par voie percutanée d’une valve biologique aortique (transcatheter aortic valve intervention [TAVI]). Proposée au début aux patients ayant des contre-indications absolues à la chirurgie, cette nouvelle technique a rapidement évolué et est désormais standardisée. Dans le modèle développé par Alain Cribier, une valve biologique est cousue dans une endoprothèse qui est sertie sur un ballon fixé à l’extrémité d’un cathéter (fig. 1 ). Le cathéter est monté le plus souvent par l’artère fémorale et l’ensemble ballon-endoprothèse est positionné au niveau de la valve aortique. Le ballon est ensuite gonflé brièvement puis retiré, permettant l’expansion de l’endoprothèse et le déploiement de la valve biologique (fig. 2 ).
Cette technique simple est bien entendu plus séduisante qu’une chirurgie conventionnelle ; elle est réalisée le plus souvent sous sédation et anesthésie locale, avec des durées d’hospitalisation courte et la reprise rapide d’une activité normale.
Peut-on prédire que dans un avenir proche tous les rétrécissements aortiques calcifiés seront traités presque exclusivement par l’implantation par voie percutanée d’une valve biologique et que nous allons assister à la disparition du remplacement valvulaire aortique par voie chirurgicale ? La réponse à cette question passe d’abord par quelques interrogations sur la technique et ses résultats à long terme.
Les patients ayant une sténose aortique sont asymptomatiques pendant de nombreuses années, et la mortalité liée à la sténose est alors inférieure à 1 %. L’apparition de symptômes marque un tournant évolutif, avec une médiane de survie de 5 ans en cas d’angor d’effort, 3 ans en cas de syncope, et 2 ans en cas d’apparition de signes d’insuffisance cardiaque.6
Jusqu’au début des années 2000, le traitement du rétrécissement aortique était chirurgical, avec le plus souvent la mise en place d’une prothèse biologique. La mortalité de cette procédure est basse, entre 1 et 3 %. Elle nécessite cependant une anesthésie générale, une sternotomie, et la mise sous assistance extracardiaque pendant l’inter- vention. Si les suites sont le plus souvent simples, le retour à une activité normale n’est possible qu’au bout d’environ six semaines.
En 2002, le Pr Alain Cribier réalise à Rouen la première implantation par voie percutanée d’une valve biologique aortique (transcatheter aortic valve intervention [TAVI]). Proposée au début aux patients ayant des contre-indications absolues à la chirurgie, cette nouvelle technique a rapidement évolué et est désormais standardisée. Dans le modèle développé par Alain Cribier, une valve biologique est cousue dans une endoprothèse qui est sertie sur un ballon fixé à l’extrémité d’un cathéter (
Cette technique simple est bien entendu plus séduisante qu’une chirurgie conventionnelle ; elle est réalisée le plus souvent sous sédation et anesthésie locale, avec des durées d’hospitalisation courte et la reprise rapide d’une activité normale.
Peut-on prédire que dans un avenir proche tous les rétrécissements aortiques calcifiés seront traités presque exclusivement par l’implantation par voie percutanée d’une valve biologique et que nous allons assister à la disparition du remplacement valvulaire aortique par voie chirurgicale ? La réponse à cette question passe d’abord par quelques interrogations sur la technique et ses résultats à long terme.
Quels sont les résultats des études ?
Le remplacement valvulaire aortique par voie percutanée a été comparé au remplacement valvulaire chirurgical dans des études randomisées réalisées chez des patients à haut risque chirurgical (risque estimé de mortalité post-chirurgicale à 30 jours à plus de 10 %). Elles ont prouvé la supériorité du remplacement valvulaire par voie percutanée en termes de mortalité par rapport à la chirurgie.7 Plus récemment, deux études ont montré que cette technique est non inférieure au remplacement valvulaire chirurgical chez des patients à risque inter- médiaire (risque estimé de mortalité post-chirurgicale à 30 jours entre 4 et 10 %).8, 9 Les dernières recommandations de la Société européenne de cardiologie préconisent le remplacement valvulaire aortique par voie percutanée à la place du remplacement chirurgical chez les patients ayant des contre-indications à la chirurgie, à haut risque, mais également chez les patients de plus de 75 ans, dont le risque pour la chirurgie est considéré comme inter- médiaire.10 Des études sont en cours pour évaluer le remplacement valvulaire aortique par voie percutanée comparé au remplacement chirurgical chez les patients à bas risque (risque estimé de mortalité post-chirurgicale à 30 jours de moins de 4 %).
Peut-on techniquement implanter une valve biologique par voie percutanée chez tous les patients ayant un rétrécissement aortique calcifié ?
Le remplacement valvulaire peut être réalisé par voie fémorale dans environ 85 % des cas. La procédure dure environ 45 minutes, et peut être réalisée sous sédation et anesthésie locale. Elle est entièrement percutanée : des désilets sont placés au niveau de l’artère fémorale commune et l’ouverture artérielle fermée à la fin de la procédure par des systèmes de fermeture qui permettent d’éviter une incision chirurgicale. Cependant, environ 10 à 15 % des patients ont des contre-indications à la voie fémorale (diamètre de l’artère fémorale commune < 6 mm, calcifications, tortuosités).
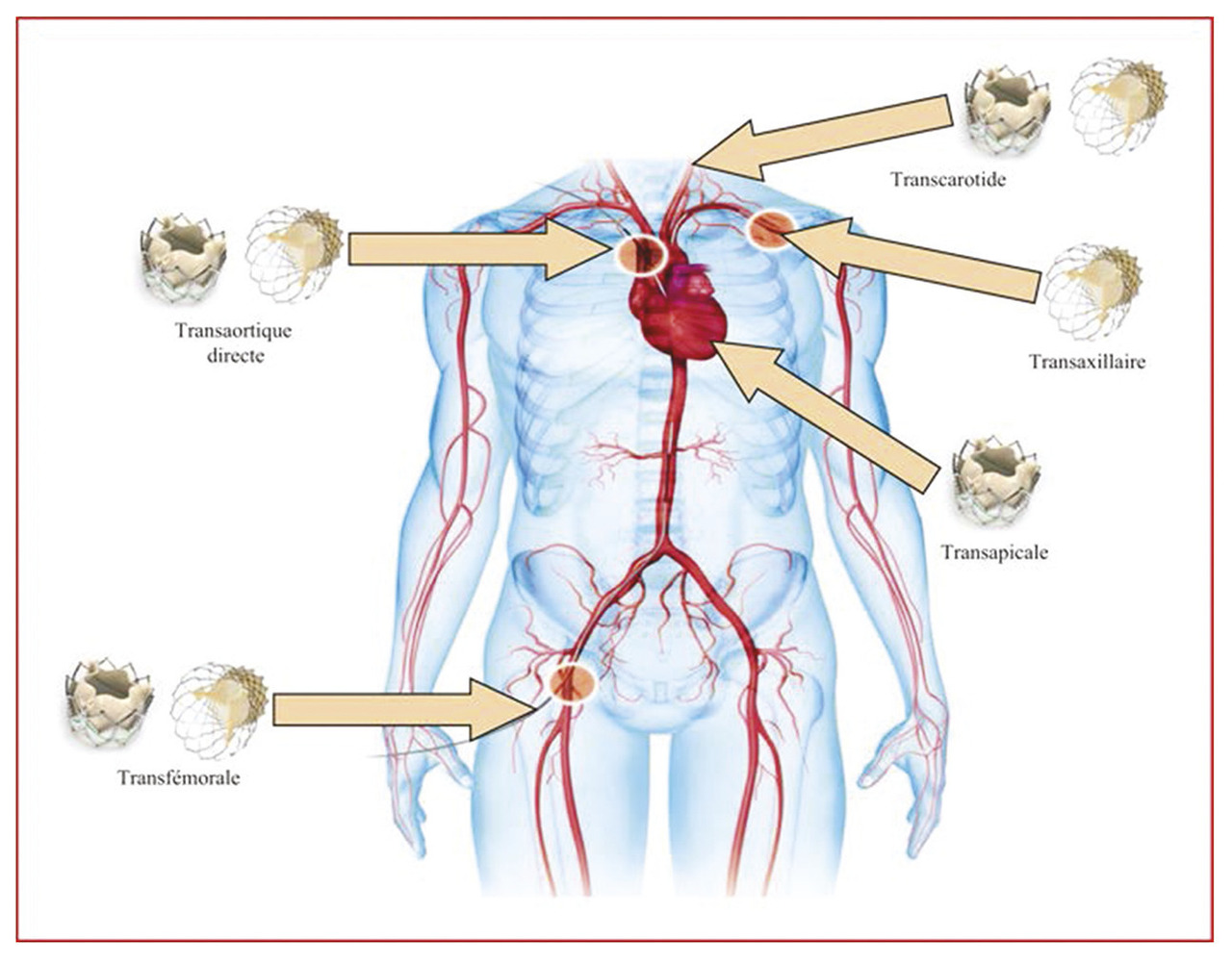
Des voies alternatives ont été développées (fig. 3 ), en premier la voie transapicale. Un accès à la pointe du ventricule gauche est obtenu par une courte incision chirurgicale latérothoracique gauche. Un désilet est positionné, permettant la montée du système par le ven- tricule gauche jusqu’à la valve aortique. Cette voie d’abord est malheureusement grevée d’un taux de complications importantes. Récemment, la voie transcarotidienne a été proposée, avec des taux de complications similaires à ceux de la voie fémorale, mais elle nécessite cependant un abord chirurgical de la carotide. Le développement de ces voies alternatives permettra d’étendre les indications du remplacement de la valve aortique par voie percutanée aux patients ayant une contre-indication à la voie fémorale. En dehors des problèmes de voie d’abord, il reste encore quelques conditions anatomiques défavorables au remplacement valvulaire par voie percutanée : un diamètre de la valve aortique non compatible avec les modèles de valves percutanées actuellement disponibles, des sténoses diffuses fémorales et carotidiennes.
Des voies alternatives ont été développées (
Peut-on pratiquer ces techniques dans tous les centres de cardiologie interventionnelle ?
Le remplacement de la valve aortique par voie percutanée a été inventé puis mis au point essentiellement par des cardiologues interventionnels. Ces derniers ont reçu une formation spécifique dans la réalisation de gestes interventionnels diagnostiques (coronarographie) et thérapeutiques (angioplastie coronaire). Cette spécialité a d’abord été pratiquée dans des centres disposant d’une chirurgie cardiaque, en raison des complications pouvant nécessiter un pontage aorto-coronarien en urgence. La quasi-disparition de ces complications a permis l’ouverture de centres de cardiologie interventionnelle pratiquant l’angioplastie coronaire sans chirurgie cardiaque.
Cette activité de remplacement valvulaire aortique par voie percutanée est réglementée par un décret spécifiant les conditions d’exercice : elle ne peut être réalisée que dans des centres disposant de chirurgie cardiaque et de cardiologie interventionnelle ; un travail en équipe multidisciplinaire composée de cardiologues interventionnels, de chirurgiens cardiaques, d’anesthésistes, d’échographistes, de radiologues et de gériatres est recommandé par la Haute Autorité de santé pour la sélection des patients et le choix de la technique de remplacement valvulaire, chirurgie ou implantation percutanée. Dans le second cas, la voie d’abord (fémorale ou voie alternative) est également choisie par l’équipe multidisciplinaire. L’avis d’un gériatre est très souvent nécessaire en raison de l’âge des patients. Dans la plupart des centres, les gestes sont réalisés par des équipes mixtes : cardiologue interventionnel et chirurgien cardiaque. Ces derniers sont bien entendu indispensables lors de la réalisation d’une implantation par voie carotidienne ou transapicale.
L’augmentation du nombre des remplacements de la valve aortique par voie percutanée fait craindre une saturation des centres spécialisés. Un débat est en cours au sein de la communauté cardiologique sur l’intérêt de pratiquer cette technique dans des centres ne disposant pas de chirurgie cardiaque, d’autant plus que le taux de conversion chirurgicale au cours du geste est devenu rare (moins de 1 %). Il est facile d’assimiler cette évolution à celle de l’angioplastie coronaire. Mais cette demande de changement réglementaire méconnaît l’importance du travail en équipe multidisciplinaire qui s’est développé autour du remplacement valvulaire aortique par voie percutanée et qui permet un dialogue constructif. Par ailleurs, même si les complications sont devenues rares, certaines peuvent nécessiter un abord chirurgical immédiat (tamponnade, plaie artérielle). Enfin, les voies alternatives, notamment la voie carotidienne, nécessitent la présence d’un chirurgien. Le progrès réalisé dans une technique ne doit pas être un prétexte pour abaisser des critères de qualité et réduire la sécurité.
Cette activité de remplacement valvulaire aortique par voie percutanée est réglementée par un décret spécifiant les conditions d’exercice : elle ne peut être réalisée que dans des centres disposant de chirurgie cardiaque et de cardiologie interventionnelle ; un travail en équipe multidisciplinaire composée de cardiologues interventionnels, de chirurgiens cardiaques, d’anesthésistes, d’échographistes, de radiologues et de gériatres est recommandé par la Haute Autorité de santé pour la sélection des patients et le choix de la technique de remplacement valvulaire, chirurgie ou implantation percutanée. Dans le second cas, la voie d’abord (fémorale ou voie alternative) est également choisie par l’équipe multidisciplinaire. L’avis d’un gériatre est très souvent nécessaire en raison de l’âge des patients. Dans la plupart des centres, les gestes sont réalisés par des équipes mixtes : cardiologue interventionnel et chirurgien cardiaque. Ces derniers sont bien entendu indispensables lors de la réalisation d’une implantation par voie carotidienne ou transapicale.
L’augmentation du nombre des remplacements de la valve aortique par voie percutanée fait craindre une saturation des centres spécialisés. Un débat est en cours au sein de la communauté cardiologique sur l’intérêt de pratiquer cette technique dans des centres ne disposant pas de chirurgie cardiaque, d’autant plus que le taux de conversion chirurgicale au cours du geste est devenu rare (moins de 1 %). Il est facile d’assimiler cette évolution à celle de l’angioplastie coronaire. Mais cette demande de changement réglementaire méconnaît l’importance du travail en équipe multidisciplinaire qui s’est développé autour du remplacement valvulaire aortique par voie percutanée et qui permet un dialogue constructif. Par ailleurs, même si les complications sont devenues rares, certaines peuvent nécessiter un abord chirurgical immédiat (tamponnade, plaie artérielle). Enfin, les voies alternatives, notamment la voie carotidienne, nécessitent la présence d’un chirurgien. Le progrès réalisé dans une technique ne doit pas être un prétexte pour abaisser des critères de qualité et réduire la sécurité.
Quel devenir à long terme ?
Les valves biologiques chirurgicales peuvent dégénérer dans environ 30 % des cas à 10 ans. La manipulation des valves biologiques posées par voie percutanée, notamment le sertissage sur le ballon, a fait craindre une dégradation plus rapide. Les premières études de suivi à 10 ans montrent des résultats satisfaisants. Il reste cependant à confirmer ces données sur des cohortes de patients plus importantes.
Quel avenir pour le remplacement de la valve aortique par voie percutanée ?
Les recommandations actuelles préconisent cette technique chez les patients ayant un rétrécissement aortique calcifié et des contre-indications absolues à la chirurgie, à risque chirurgical élevé ou intermédiaire quand il peut être réalisé par voie fémorale. Des voies alternatives telles que la voie carotidienne sont en développement. Des études sont en cours comparant le remplacement valvulaire aortique par voie percutanée au remplacement chirurgical chez les patients à bas risque opératoire. Si ces études montrent des résultats identiques en termes de mortalité et de complications entre la chirurgie et la voie percutanée, cette dernière, réalisée le plus souvent sous anesthésie locale avec une hospitalisation courte, deviendra le traitement de premier choix du rétrécis- sement aortique calcifié. Une page de l’histoire de la cardiologie sera alors tournée : introduit en 2002, le remplacement valvulaire aortique par voie percutanée a d’abord été proposé chez les patients ayant des contre- indications absolues à la chirurgie ; dans un avenir proche, il sera le traitement de référence, et la chirurgie sera proposée en cas d’impossibilité d’utiliser la voie percutanée (taille de l’anneau incompatible avec les dispositifs percutanés actuels, patients ayant des sténoses des artères fémorales et carotidiennes). L’implantation percutanée sera pratiquée au mieux dans des centres experts par des équipes multidisciplinaires avec un plateau technique de haut niveau (cardiologie interventionnelle, chirurgie cardiaque, imagerie non invasive).
Références
1. Nkomo, VT, Gardin JM, Skelton TN, Gottdiener JS, Scott CG, Enriquez-Sarano M. Burden of valvular heart diseases: a population-based study. Lancet 2006;368:1005-11.
2. Stewart, BF, Siscovick D, Lind BK, et al. Clinical factors associated with calcific aortic valve disease. Cardiovascular Health Study. J Am Coll Cardiol 1997:29:630-4.
3. Lindroos M, Kupari M, Heikkilä J, Tilvis R. Prevalence of aortic valve abnormalities in the elderly : an echocardiographic study of a random population sample. J Am Coll Cardiol 1993;21:1220-5.
4. Iung, B, Baron G, Butchart EG, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart survey on valvular heart disease. Eur Heart J 2003;24:1231-243.
5. Ortman JM, Velkoff VA, Hogan H. An aging nation: the older population in the United States. U.S. Census Bureau, 2014:25-1140. www.census.gov ou https://bit.ly/1dWwJB3
6. Pellikka PA, Sarano ME, Nishimura RA, et al. Outcome of 622 adults with asymptomatic, hemodynamically significant aortic stenosis during prolonged follow-up. Circulation 2005;111:3290-5.
7. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011;364:2187-98.
8. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic valve replacement in intermediate-risk patients. N Engl J Med 2016;374:1609-20.
9. Reardon MJ, Mieghem NM, Van Popma JJ, et al. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med 2017;376:1321-31.
10. Baumgartner H, Falk V. Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease The Task Force for the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2017;38:2739-91.
2. Stewart, BF, Siscovick D, Lind BK, et al. Clinical factors associated with calcific aortic valve disease. Cardiovascular Health Study. J Am Coll Cardiol 1997:29:630-4.
3. Lindroos M, Kupari M, Heikkilä J, Tilvis R. Prevalence of aortic valve abnormalities in the elderly : an echocardiographic study of a random population sample. J Am Coll Cardiol 1993;21:1220-5.
4. Iung, B, Baron G, Butchart EG, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart survey on valvular heart disease. Eur Heart J 2003;24:1231-243.
5. Ortman JM, Velkoff VA, Hogan H. An aging nation: the older population in the United States. U.S. Census Bureau, 2014:25-1140. www.census.gov ou https://bit.ly/1dWwJB3
6. Pellikka PA, Sarano ME, Nishimura RA, et al. Outcome of 622 adults with asymptomatic, hemodynamically significant aortic stenosis during prolonged follow-up. Circulation 2005;111:3290-5.
7. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011;364:2187-98.
8. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic valve replacement in intermediate-risk patients. N Engl J Med 2016;374:1609-20.
9. Reardon MJ, Mieghem NM, Van Popma JJ, et al. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med 2017;376:1321-31.
10. Baumgartner H, Falk V. Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease The Task Force for the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2017;38:2739-91.
Dans cet article
- Quels sont les résultats des études ?
- Peut-on techniquement implanter une valve biologique par voie percutanée chez tous les patients ayant un rétrécissement aortique calcifié ?
- Peut-on pratiquer ces techniques dans tous les centres de cardiologie interventionnelle ?
- Quel devenir à long terme ?
- Quel avenir pour le remplacement de la valve aortique par voie percutanée ?