L’accumulation de lipoprotéines de basse densité (LDL) est un facteur causal d’athérosclérose quelle que soit la localisation. De ce fait, baisser le taux de LDL-c est l’objectif lipidique principal dans toutes les recommandations thérapeutiques.
En prévention secondaire, il est proposé d’ajouter systématiquement une statine aux mesures hygiénodiététiques. Toutefois, l’objectif à atteindre pour le taux de LDL-c au décours d’un événement ischémique cardiaque ou cérébral reste l’objet de débats. La cible classique jusqu’à ces dernières années en Europe (à savoir inférieure à 0,70 g/L) a été revue récemment à la baisse en raison de bénéfices mis en évidence par de nouvelles études*.
En prévention secondaire, il est proposé d’ajouter systématiquement une statine aux mesures hygiénodiététiques. Toutefois, l’objectif à atteindre pour le taux de LDL-c au décours d’un événement ischémique cardiaque ou cérébral reste l’objet de débats. La cible classique jusqu’à ces dernières années en Europe (à savoir inférieure à 0,70 g/L) a été revue récemment à la baisse en raison de bénéfices mis en évidence par de nouvelles études*.
Baisser davantage le LDL-C en prévention secondaire ?
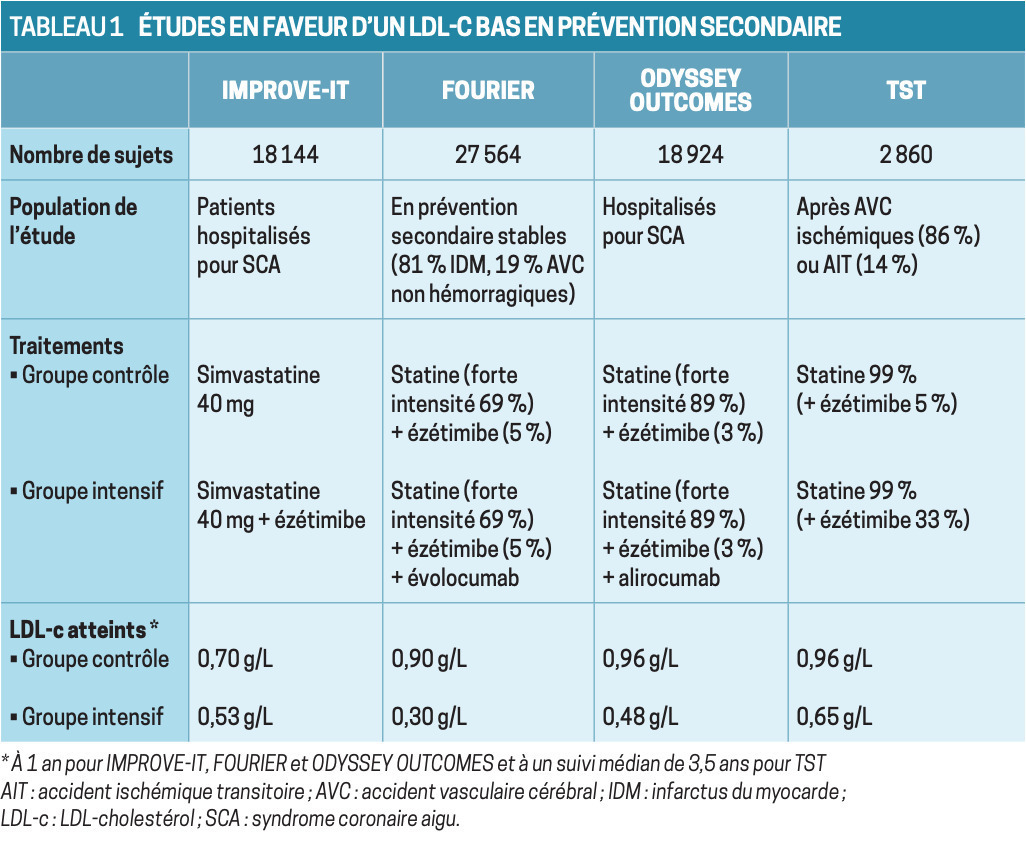
Dans 4 études récentes (tableau 1 ), une baisse plus intensive du LDL-c a induit une réduction significative des événements cardiovasculaires majeurs. Elles ont été réalisées en prévention secondaire essentiellement coronaire pour IMPROVE-IT1, FOURIER2 et ODYSSEY OUTCOMES 3, alors que TST 4 s’est adressée spécifiquement à des patients victimes d’un événement ischémique cérébral. IMPROVE-IT a entériné l’intérêt de l’association ézétimibe-simvastatine 40 mg après syndrome coronaire aigu (SCA), et FOURIER et ODYSSEY-OUTCOMES ont validé celui des inhibiteurs de PCSK9, évolocumab (Repatha) ou alirocumab (Praluent) chez des patients stabilisés ou après SCA. Dans ces 3 études, le LDL-c atteint sous traitement intensif était compris entre 0,30 et 0,53 g/L, ce qui a conduit à proposer de nouveaux objectifs de LDL-c.
TST a comparé 2 stratégies, l’une visant un LDL-c entre 0,90 et 1,10 g/L, et l’autre un taux inférieur à 0,70 g/L après événement ischémique cérébral. Atteindre 0,65 g/L a été possible dans le groupe « thérapie musclée » grâce à des statines de plus forte intensité et à une grande proportion de patients recevant de l’ézétimibe. Cette étude a confirmé qu’une cible inférieure à 0,70 g/L est certainement souhaitable pour éviter une récidive d’événement cardiovasculaire athérosclérotique.
Y a-t-il un seuil de LDL-c sous lequel il n’y aurait pas de bénéfice et une majoration des effets secondaires ? Des analyses complémentaires, en particulier d’IMPROVE-IT et de FOURIER, n’ont pas révélé d’impact délétère d’un LDL-c bas et même très bas (< 0,2 g/L) maintenu sur la durée de suivi des essais.
TST a comparé 2 stratégies, l’une visant un LDL-c entre 0,90 et 1,10 g/L, et l’autre un taux inférieur à 0,70 g/L après événement ischémique cérébral. Atteindre 0,65 g/L a été possible dans le groupe « thérapie musclée » grâce à des statines de plus forte intensité et à une grande proportion de patients recevant de l’ézétimibe. Cette étude a confirmé qu’une cible inférieure à 0,70 g/L est certainement souhaitable pour éviter une récidive d’événement cardiovasculaire athérosclérotique.
Y a-t-il un seuil de LDL-c sous lequel il n’y aurait pas de bénéfice et une majoration des effets secondaires ? Des analyses complémentaires, en particulier d’IMPROVE-IT et de FOURIER, n’ont pas révélé d’impact délétère d’un LDL-c bas et même très bas (< 0,2 g/L) maintenu sur la durée de suivi des essais.
Vers des LDL de plus en plus bas ?
Ces résultats ont conduit à modifier les objectifs en prévention secondaire pour les patients à très haut risque de récidive d’accidents cardiovasculaires.
Selon les recommandations européennes de 2019,5 on doit d’une part abaisser d’au moins 50 % le LDL-c (par rapport à la valeur avant hypolipémiant) et d’autre part atteindre, si possible, un taux inférieur à 0,55 g/L (1,4 mmol/L). Cela justifie l’usage systématique en prévention secondaire d’une statine de forte intensité (atorvastatine ou rosuvastatine) réduisant en moyenne le LDL-c d’au moins 50%. En cas d’intolérance (essentiellement musculaire), une réduction de posologie et/ou un changement de statine peut être effectué, l’objectif étant de parvenir à la dose maximale tolérée. Cependant, très souvent, il est nécessaire d’adjoindre un second hypolipémiant, en priorité l’ézétimibe pour passer sous le seuil de 0,55. Si besoin, on peut ajouter un inhibiteur de PCSK9, évolocumab ou alirocumab.
Pour les patients qui au décours d’un évènement ischémique cardiaque ou cérébral font un second accident vasculaire dans un délai de 2 ans (pas obligatoirement dans la même localisation), alors qu’ils étaient déjà sous statine à la dose maximale tolérée, un objectif inférieur à 0,40 g/L (1,0 mmol/L) est même envisagé. Même s’il paraît très difficile à atteindre dans la majorité des cas, l’essentiel est d’abaisser au maximum le LDL-c lorsque l’atteinte athéromateuse évolue, sans se fixer une réelle valeur limite basse.
Autre élément important : le bénéfice cardiovasculaire absolu dépend non seulement de l’importance de l’abaissement du LDL-c mais aussi de la durée de l’exposition à ce taux bas. Il faut donc veiller à ce que le traitement prescrit soit pris au long cours avec une tolérance correcte et le maintenir même si l’objectif de LDL-c n’est pas strictement atteint.
Selon les recommandations européennes de 2019,5 on doit d’une part abaisser d’au moins 50 % le LDL-c (par rapport à la valeur avant hypolipémiant) et d’autre part atteindre, si possible, un taux inférieur à 0,55 g/L (1,4 mmol/L). Cela justifie l’usage systématique en prévention secondaire d’une statine de forte intensité (atorvastatine ou rosuvastatine) réduisant en moyenne le LDL-c d’au moins 50%. En cas d’intolérance (essentiellement musculaire), une réduction de posologie et/ou un changement de statine peut être effectué, l’objectif étant de parvenir à la dose maximale tolérée. Cependant, très souvent, il est nécessaire d’adjoindre un second hypolipémiant, en priorité l’ézétimibe pour passer sous le seuil de 0,55. Si besoin, on peut ajouter un inhibiteur de PCSK9, évolocumab ou alirocumab.
Pour les patients qui au décours d’un évènement ischémique cardiaque ou cérébral font un second accident vasculaire dans un délai de 2 ans (pas obligatoirement dans la même localisation), alors qu’ils étaient déjà sous statine à la dose maximale tolérée, un objectif inférieur à 0,40 g/L (1,0 mmol/L) est même envisagé. Même s’il paraît très difficile à atteindre dans la majorité des cas, l’essentiel est d’abaisser au maximum le LDL-c lorsque l’atteinte athéromateuse évolue, sans se fixer une réelle valeur limite basse.
Autre élément important : le bénéfice cardiovasculaire absolu dépend non seulement de l’importance de l’abaissement du LDL-c mais aussi de la durée de l’exposition à ce taux bas. Il faut donc veiller à ce que le traitement prescrit soit pris au long cours avec une tolérance correcte et le maintenir même si l’objectif de LDL-c n’est pas strictement atteint.
* Le texte de la HAS de février 2017 sur les modalités de prise en charge des dyslipidémies ayant été abrogé le 21 novembre 2018, cet article est fondé sur les recommandations européennes ESC/EAS de 2019.
Références
1. Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, et al. for the IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015;372:2387-97.
2. Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, et al. for the FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017;376:1713-22.
3. Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, et al. for the ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med 2018;379:2097-107.
4. Amarenco P, Kim JS, Labreuche J, Charles H, Abtan J, et al. for the Treat Stroke to Target Investigators. A Comparison of Two LDL Cholesterol Targets after Ischemic Stroke. N Engl J Med 2020;382:9-19.
5. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020;41:111-88.
2. Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, et al. for the FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017;376:1713-22.
3. Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, et al. for the ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med 2018;379:2097-107.
4. Amarenco P, Kim JS, Labreuche J, Charles H, Abtan J, et al. for the Treat Stroke to Target Investigators. A Comparison of Two LDL Cholesterol Targets after Ischemic Stroke. N Engl J Med 2020;382:9-19.
5. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020;41:111-88.