Fistule anale. Même si la fistulotomie reste le traitement de choix des fistules simples cryptoglandulaires, les techniques d’épargne sphinctérienne ont toute leur place dans le traitement des fistules anales pour éviter le risque d’incontinence anale postopératoire.
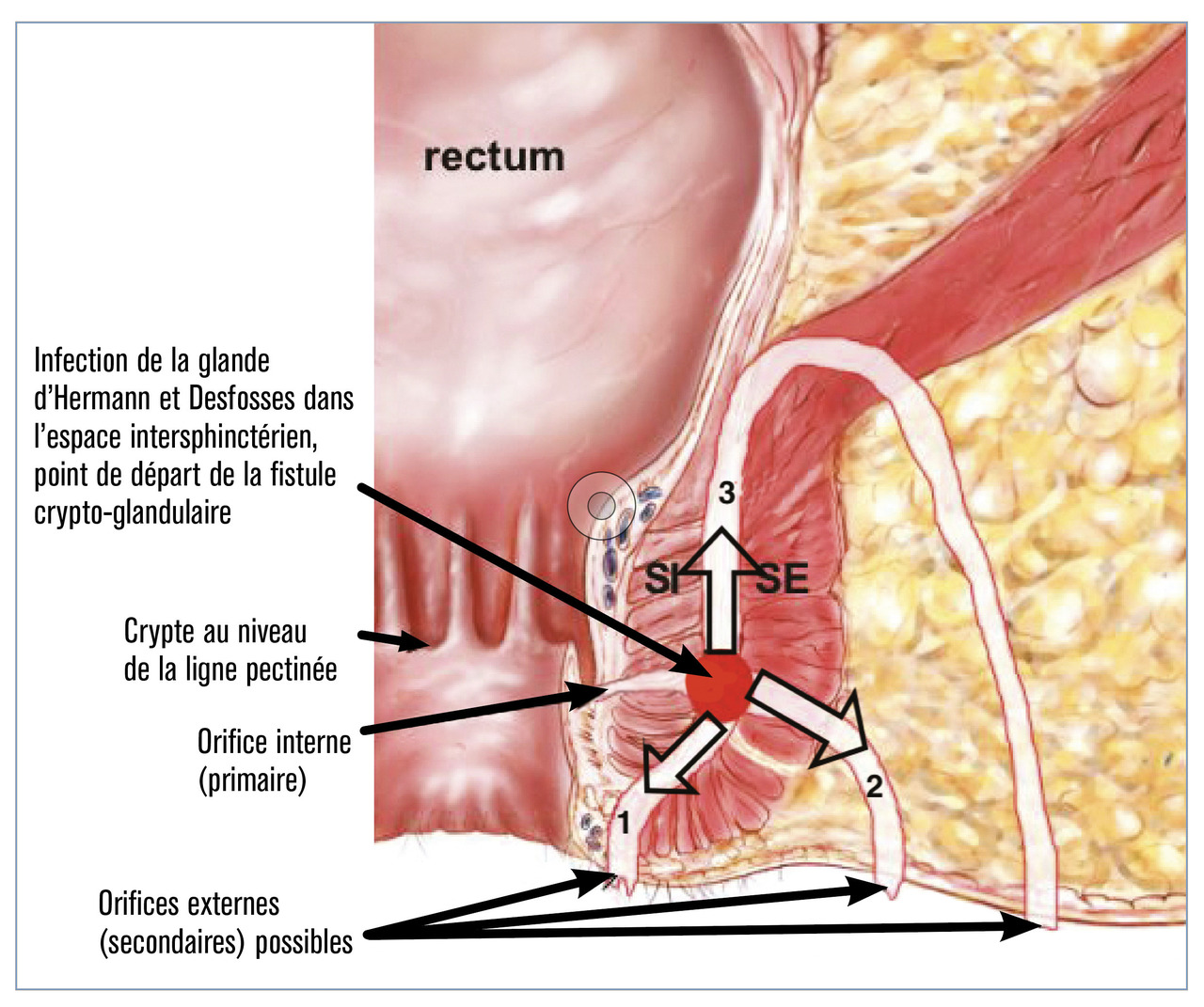
La fistule anale cryptoglandulaire est la première cause de suppuration anopérinéale. L’infection d’une glande d’Hermann et Desfosses au niveau du canal anal est à l’origine de ces fistules. Ces glandes sont situées au niveau de la ligne pectinée avec une prédominance postérieure expliquant la localisation préférentielle des fistules au pôle postérieur de l’anus. La physiopathologie reste encore méconnue. L’incidence annuelle est de 12 à 28/100 000 cas, avec une prédominance masculine (sex-ratio : 2/1). Cette affection peut survenir à tout âge, avec une augmentation de la prévalence entre 30 et 50 ans.
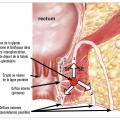
Trajet fistuleux
La fistule anale prend donc son origine dans le canal anal avant de traverser le sphincter interne. Le cheminement du trajet fistuleux est ensuite très variable selon les individus. Majoritairement, la fistule traverse ensuite le sphincter externe pour développer un abcès dans la graisse de la fosse ischio-anale ou rétro-anale, qui finit par se fistuliser à la peau. Il s’agit des fistules trans- sphinctériennes. Le trajet peut également cheminer dans l’espace intersphinctérien et passer au-dessus du sphincter externe, réalisant une fistule suprasphinctérienne.
Le trajet principal peut également se complexifier en donnant des ramifications ou « diverticules ». Le cas le plus connu est celui de la fistule en fer à cheval. Il s’agit le plus souvent d’une fistule transsphinctérienne avec un diverticule dans l’espace rétro-anal donnant un abcès dans les deux fosses ischio-anales. On utilise habituellement la classification de Parks (fig. 1 ) ou la classification simplifiée d’Arnous pour classer les fistules anales.
En dehors des fistules cryptoglan- dulaires, il existe également les fistules extrasphinctériennes d’origine obstétricale, radique, chirurgicale, infectieuse ou inflammatoire. On notera également les fissures anales infectées, réalisant des fistules sous-pectinéales.
Le trajet principal peut également se complexifier en donnant des ramifications ou « diverticules ». Le cas le plus connu est celui de la fistule en fer à cheval. Il s’agit le plus souvent d’une fistule transsphinctérienne avec un diverticule dans l’espace rétro-anal donnant un abcès dans les deux fosses ischio-anales. On utilise habituellement la classification de Parks (
En dehors des fistules cryptoglan- dulaires, il existe également les fistules extrasphinctériennes d’origine obstétricale, radique, chirurgicale, infectieuse ou inflammatoire. On notera également les fissures anales infectées, réalisant des fistules sous-pectinéales.
Traitement chirurgical et risque d’incontinence
La fistule anale peut se révéler soit par un abcès périnéal, soit par une suppuration chronique. Le traitement de la fistule est chirurgical (v. tableau ), sous peine de récidive d’abcès ou de persistance d’écoulements.
Le traitement a pour objectifs de tarir la fistule et de prévenir la récidive tout en minimisant le risque d’incontinence postopératoire. Les troubles de la continence sont d’autant plus embarrassants que les lésions sphinctériennes sont définitives et que le préjudice en termes de qualité de vie est important. Le choix de la technique chirurgicale doit donc prendre en compte ce risque pour traiter la fistule anale en mesurant le rapport bénéfice-risque de chaque technique au cas par cas.
La continence anale peut être altérée soit par lésion sphinctérienne, soit par déformation postopératoire avec un aspect en « trou de serrure » de l’anus. Les facteurs de risque des troubles de la continence sont : la fistule haute (enjambant plus de la moitié du sphincter), la fistule antérieure surtout chez la femme, les patients polyopérés, les fistules de la maladie de Crohn, les troubles du transit à type de diarrhée chronique et les antécédents de déchi- rure périnéale obstétricale.
Le traitement de référence est la fistulotomie en un ou plusieurs temps. En cas de risque d’incontinence élevé, on préfère utiliser des techniques dites d’épargne sphinctérienne.
Le traitement a pour objectifs de tarir la fistule et de prévenir la récidive tout en minimisant le risque d’incontinence postopératoire. Les troubles de la continence sont d’autant plus embarrassants que les lésions sphinctériennes sont définitives et que le préjudice en termes de qualité de vie est important. Le choix de la technique chirurgicale doit donc prendre en compte ce risque pour traiter la fistule anale en mesurant le rapport bénéfice-risque de chaque technique au cas par cas.
La continence anale peut être altérée soit par lésion sphinctérienne, soit par déformation postopératoire avec un aspect en « trou de serrure » de l’anus. Les facteurs de risque des troubles de la continence sont : la fistule haute (enjambant plus de la moitié du sphincter), la fistule antérieure surtout chez la femme, les patients polyopérés, les fistules de la maladie de Crohn, les troubles du transit à type de diarrhée chronique et les antécédents de déchi- rure périnéale obstétricale.
Le traitement de référence est la fistulotomie en un ou plusieurs temps. En cas de risque d’incontinence élevé, on préfère utiliser des techniques dites d’épargne sphinctérienne.
Fistulotomie
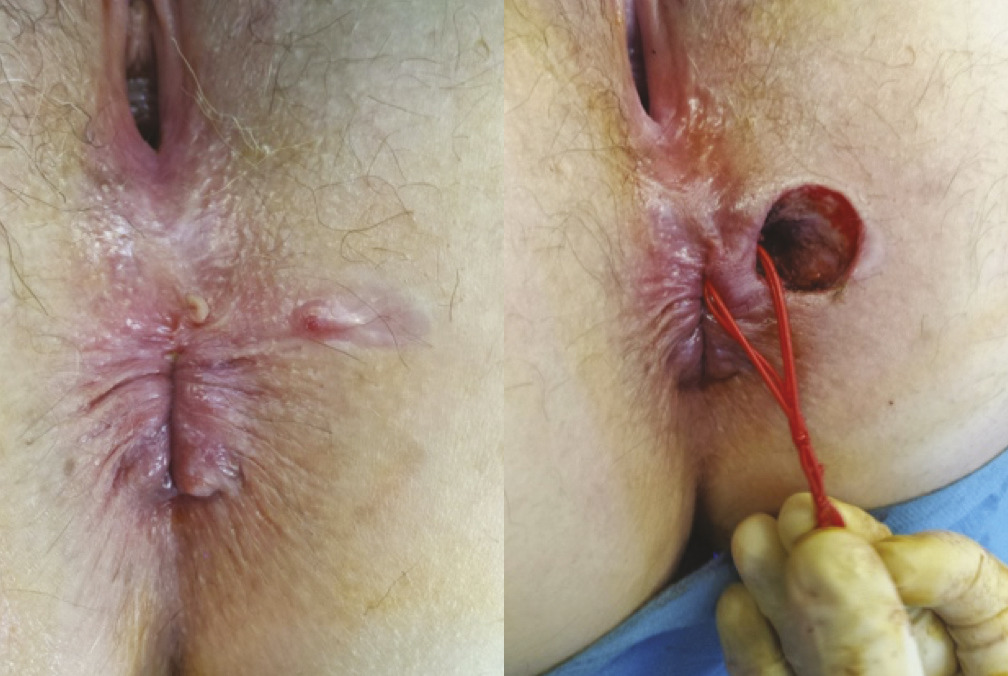
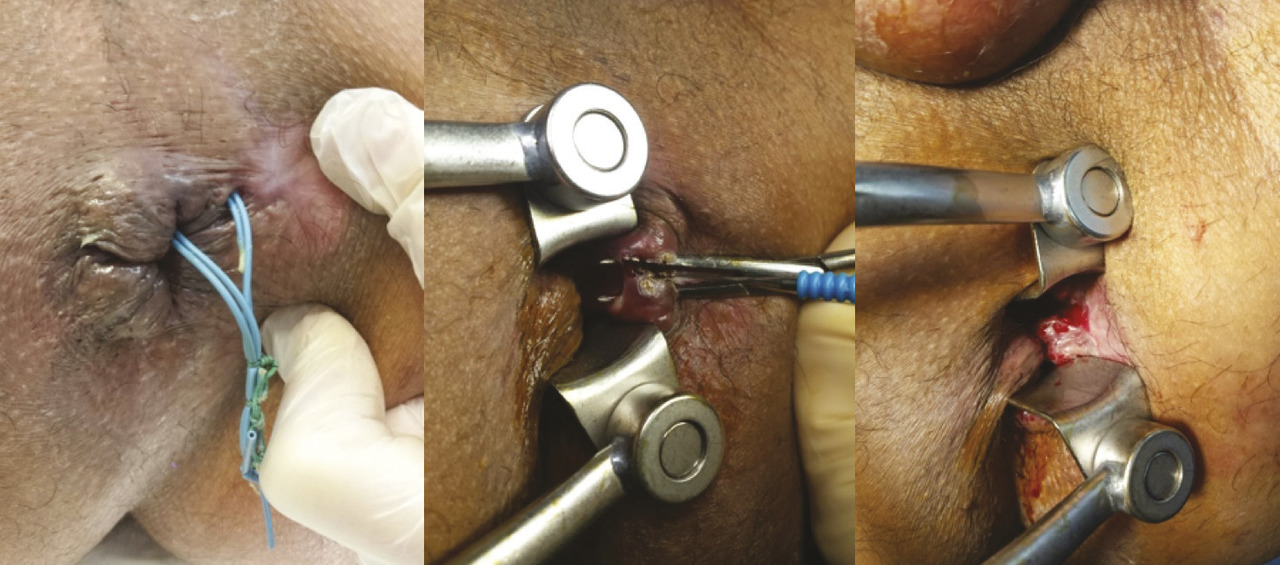
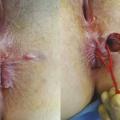
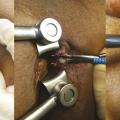
La fistulotomie reste l’étalon-or du traitement de la fistule anale basse. Le traitement consiste à sectionner le sphincter anal jusqu’au trajet fistuleux qui est préalablement repéré par un stylet. Cette intervention est simple, réalisée au bloc opératoire, en ambulatoire, avec des soins postopératoires réalisables par le patient lui-même. La cicatrisation s’effectue en 2 mois environ. En cas de fistule plus haute ou à fort risque de déformation anatomique, la fis- tulotomie peut se faire en plusieurs temps. Le premier temps consiste à repérer le trajet fistuleux, réaliser une fistulectomie jusqu’à l’appareil sphinctérien, puis abaisser le trajet fistuleux en sectionnant le sphincter anal par sa partie supérieure. Une anse de drainage souple (séton) est laissée en place le temps de la cica- trisation externe (fig. 2). Par effet mécanique (fil à couper le beurre), le trajet s’abaisse au cours de la cicatrisation et permet le plus souvent de procéder à une fistulotomie classique lors de la deuxième intervention (fig. 3). Certains praticiens préfèrent réaliser une fistulotomie progressive par serrage élastique. Une plaie cutanée entre l’orifice externe et l’orifice interne est alors réalisée lors de la première inter- vention, mettant à nu le sphincter anal. En consultation, l’élastique est resserré progressivement jusqu’à section complète du sphincter. Cette technique a pour avantage d’éviter un deuxième temps opératoire mais au prix de douleurs parfois importantes dans les 24 à 48 heures après chaque serrage. Une étude récente française1 confirme l’absence de troubles de la continence en cas de fistulotomie pour fistule anale basse (transsphinctérienne inférieure). En cas de fistule haute opérée en 2 temps, le score d’incontinence était discrètement augmenté (1 [0-14] en préopératoire contre 4 [0-19] en postopératoire) après un recul de 1 an, mais 88 % des patients étaient satisfaits.
Techniques d’épargne sphinctérienne
Lorsque le risque d’incontinence postopératoire est élevé, une technique dite « d’épargne sphinctérienne » est préférée. Le premier temps opératoire est identique (identification du trajet fistuleux, mise à plat des diverticules éventuels, drainage par un séton lâche). Une fois la cicatrisation de la plaie externe finie et après s’être assuré qu’il ne reste plus de diverticule résiduel, on s’oriente vers une de ces techniques. Parallèlement, le traitement médical d’une éventuelle maladie de Crohn associée doit être optimal.
Le choix entre les techniques se fait selon l’expérience du chirurgien, la disponibilité du matériel dans l’établissement de santé, et le type de la fistule.
Le choix entre les techniques se fait selon l’expérience du chirurgien, la disponibilité du matériel dans l’établissement de santé, et le type de la fistule.
Fermeture de l’orifice interne
Elle se fait au moyen d’un lambeau d’avancement, technique décrite au début du xxe siècle par Noble, initialement envisagée pour traiter les fistules rectovaginales d’origine obstétricale. Cette technique a été étendue aux fistules complexes cryptoglandulaires et crohniennes. Elle reste néanmoins majoritairement utilisée essentiellement dans les fistules ano- ou rectovaginales.
Après avoir drainé la fistule, on réalise un lambeau trapézoïdal de la muqueuse, de la sous-muqueuse, voire de la musculeuse rectale pour recouvrir l’orifice interne anal de la fistule. La suture doit être hermétique, avec des points résorbables séparés. L’orifice externe ou vaginal est laissé ouvert pour permettre l’évacuation d’un éventuel hématome sous le lambeau, car ce dernier favoriserait l’ischémie du lambeau et donc l’échec de la technique. Les suites postopératoires sont sim- ples, peu douloureuses, mais un bon transit intestinal est primordial. Des selles trop liquides ou trop dures peuvent être à l’origine d’un échec. Cette technique a un taux de réussite proche de 65 %.2 Un deuxième lambeau peut être fait après l’échec d’une première tentative. Il existe cependant quelques troubles minimes de la continence décrits dans cette technique chez moins de 10 % des patients.
Après avoir drainé la fistule, on réalise un lambeau trapézoïdal de la muqueuse, de la sous-muqueuse, voire de la musculeuse rectale pour recouvrir l’orifice interne anal de la fistule. La suture doit être hermétique, avec des points résorbables séparés. L’orifice externe ou vaginal est laissé ouvert pour permettre l’évacuation d’un éventuel hématome sous le lambeau, car ce dernier favoriserait l’ischémie du lambeau et donc l’échec de la technique. Les suites postopératoires sont sim- ples, peu douloureuses, mais un bon transit intestinal est primordial. Des selles trop liquides ou trop dures peuvent être à l’origine d’un échec. Cette technique a un taux de réussite proche de 65 %.2 Un deuxième lambeau peut être fait après l’échec d’une première tentative. Il existe cependant quelques troubles minimes de la continence décrits dans cette technique chez moins de 10 % des patients.
Fermeture du trajet fistuleux
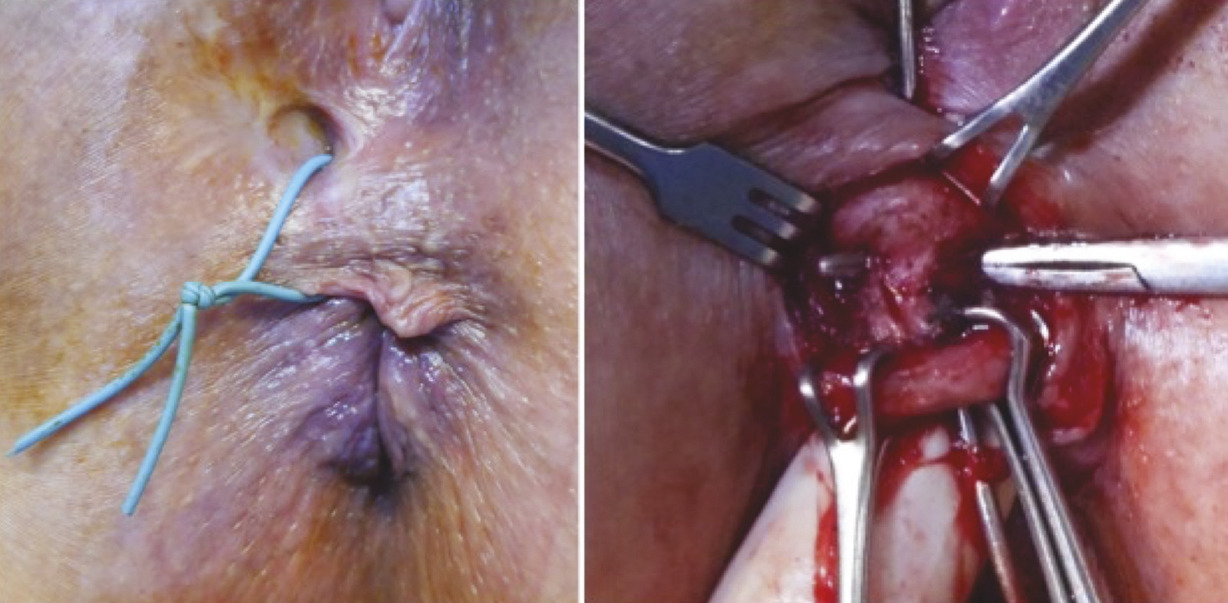
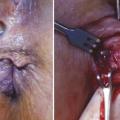
La ligation of the intersphincteric fistula tract (technique appelée LIFT) est très en vogue depuis quelques années ; le nombre de publications sur ce sujet ne cesse de croître. Il s’agit d’une technique consistant à atteindre la fistule anale à travers l’espace intersphinctérien et de la ligaturer afin d’interrompre la communication entre l’anus et la peau (fig. 4). L’espace intersphinctérien est ensuite refermé jusqu’à la peau. L’orifice externe est laissé ouvert. Le drainage préalable de la fistule est recommandé. Les soins postopératoires sont simples, peu douloureux, avec une cicatrisation très rapide de la plaie de la marge anale. Le taux de réussite dans les fistules anales complexes est de 70 % (40 à 95 % selon les études).3 La technique devient plus délicate chez les patients polyopérés, les fistules hautes et/ou complexes comme les fistules en fer à cheval car l’espace intersphinctérien est alors difficile à disséquer.
Injection de colle biologique
Après drainage par un séton lâche, le trajet fistuleux est comblé par de la colle biologique, un mélange de deux produits liquides qui se solidifient directement lorsqu’ils entrent en contact. Ce sont des mélanges liquides de fibrinogène et de facteurs de la coagulation servant de support aux cellules de l’hôte qui lysent le bouchon de fibrine ainsi formé et le remplacent par un tissu cicatriciel. La colle est déposée progressive- ment dans le trajet de l’orifice interne jusqu’à l’orifice externe. Un pansement non adhérent est posé sur l’orifice externe. La principale contrainte de cette technique, en dehors de son prix, est le fait que la colle n’est pas fixée et reste très mobile dans les premiers jours après l’intervention. Une rachianesthésie avec immobilisation quelques heures après le traitement est recommandée. L’activité physique et sexuelle est limitée dans les 10 jours postopératoires. L’utilisation de Betadine est contre-indiquée car elle pourrait endommager la colle. Le séchage après la toilette doit être prudent. Une méta-analyse d’études ayant comparé l’injection de colle biologique à d’au- tres traitements chirurgicaux (fistulotomie, traction par séton, lambeau d’avancement) a montré que le taux de récidive était de 54 % pour la colle contre 47 % pour les autres techniques sans que cette différence ne soit significative.4 Dans les fistules de la maladie de Crohn, une étude menée par le Groupe d’étude thérapeutique des affections inflammatoires du tube digestif, GETAID, a permis de mettre en évidence un bénéfice statistiquement significatif de l’utilisation de la colle en comparaison avec un simple retrait du séton. En effet, le taux de guérison était de 38 % contre 16 % à 8 semaines (intervalle de confiance à 95 % : 1,1-9,8 : p = 0,04).5 En cas d’échec, une nouvelle tentative peut être envisagée. Un trajet court semble être un facteur d’échec de cette technique.
Autres techniques : plug, clipage, laser, implantation de cellules souches
Le plug est un morceau de membrane d’intestin de porc roulé en cône et introduit dans le trajet fistuleux afin qu’il soit colonisé par l’hôte. Il n’est plus utilisé car trop coûteux pour un risque d’échec majeur.
Le clip est un dispositif très utilisé en endoscopie interventionnelle pour fermer certaines fistules digestives. Il s’agit d’un clip métallique, courbe, appelé over-the-scope clip, appliqué autour de l’orifice anal pour l’obturer définitivement. La littérature est pauvre pour le moment, avec des résultats contradictoires nécessitant d’autres évaluations. Son coût élevé et les incertitudes quant à son efficacité ne le mettent pas dans l’arsenal thérapeutique de première intention pour le traitement des fistules anales.
La fibre laser FiLaC(fistula laser closure) est une fibre laser introduite dans le trajet fistuleux qui est ensuite coagulé de l’orifice interne jusqu’à l’orifice externe. Cette technique est prometteuse mais nécessite des études à grande échelle pour confirmer son intérêt.
L’injection de cellules souches adipocytaires autologues dans le trajet fistuleux est une nouvelle technique qui a récemment fait l’objet d’ADMIRE, une étude randomisée multicentrique en double aveugle comparant à un placebo l’injection de ces cellules dans 107 fistules réfractaires de maladie de Crohn. Elle a montré un taux de réussite de 50 % en intention de traiter à 6 mois contre 36 % dans le groupe placebo.6 Ces résultats prometteurs sont à confirmer au long terme dans une large population.
Le clip est un dispositif très utilisé en endoscopie interventionnelle pour fermer certaines fistules digestives. Il s’agit d’un clip métallique, courbe, appelé over-the-scope clip, appliqué autour de l’orifice anal pour l’obturer définitivement. La littérature est pauvre pour le moment, avec des résultats contradictoires nécessitant d’autres évaluations. Son coût élevé et les incertitudes quant à son efficacité ne le mettent pas dans l’arsenal thérapeutique de première intention pour le traitement des fistules anales.
La fibre laser FiLaC(fistula laser closure) est une fibre laser introduite dans le trajet fistuleux qui est ensuite coagulé de l’orifice interne jusqu’à l’orifice externe. Cette technique est prometteuse mais nécessite des études à grande échelle pour confirmer son intérêt.
L’injection de cellules souches adipocytaires autologues dans le trajet fistuleux est une nouvelle technique qui a récemment fait l’objet d’ADMIRE, une étude randomisée multicentrique en double aveugle comparant à un placebo l’injection de ces cellules dans 107 fistules réfractaires de maladie de Crohn. Elle a montré un taux de réussite de 50 % en intention de traiter à 6 mois contre 36 % dans le groupe placebo.6 Ces résultats prometteurs sont à confirmer au long terme dans une large population.
AU CAS PAR CAS
La fistulotomie demeure le traitement de choix des fistules anales simples. Les techniques d’épargne sphinctérienne sont indiquées en cas de risque d’incontinence. Cependant, le choix est parfois difficile à faire entre elles du fait de leurs avantages et de leurs inconvénients respectifs. Il doit être fait au cas par cas par un chirurgien expérimenté, après la certitude d’un drainage satisfaisant préalable par un séton lâche
Références
1. Abramowitz L, Soudan D, Souffran M, Bouchard D, The outcome of fistulotomy for anal fistula at 1 year: a prospective multicentre French study. Colorectal Dis 2016;18:279-85.
2. Van Onkelen RS, Gosselink MP, Thijsse S, Schouten WR. Predictors of outcome after transanal advancement flap repair for High transsphincteric fistulas. Dis Colon Rectum 2014;57:1007-11.
3. Sirany AM, Nygaard RM, Morken JJ. The ligation of the intersphincteric fistula tract procedure for anal fistula: a mixed bag of results. Dis Colon Rectum 2015;58:604-12.
4. Chung W, Kazemi P, Ko D, et al. Anal fistula plug and fibrin glue versus conventional treatment in repair of complex anal fistulas. Am J Surg 2009;197:604-8.
5. Grimaud JC, Munoz-Bongrand N, Siproudhis L, et al. ; Groupe d’étude thérapeutique des affections inflammatoires du tube digestif. Fibrin glue is effective Healing perianal fistulas in patients with Chron’s disease. Gastroenterology 2010;138:2275-81.
6. Panés J, García-Olmo D, Van Assche G, et al.; ADMIRE CD study group collaborators. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016;388:1281-90.
7. Simpson JA, Banerjea A, Scholefield JH. Management of anal fistula. BMJ 2012;345:e6705.
8. Ritchie RD, Sackier JM, Hodde JP. Incontinence rates after cutting séton treatment for anal fistula. Colorectal Dis 2009;11:564-71.
9. Cirocchi R, Farinella E, La Mura F, et al. Fibrin glue in the treatment of anal fistula: a systematic review. Ann Surg Innov Res 2009;3:12.
2. Van Onkelen RS, Gosselink MP, Thijsse S, Schouten WR. Predictors of outcome after transanal advancement flap repair for High transsphincteric fistulas. Dis Colon Rectum 2014;57:1007-11.
3. Sirany AM, Nygaard RM, Morken JJ. The ligation of the intersphincteric fistula tract procedure for anal fistula: a mixed bag of results. Dis Colon Rectum 2015;58:604-12.
4. Chung W, Kazemi P, Ko D, et al. Anal fistula plug and fibrin glue versus conventional treatment in repair of complex anal fistulas. Am J Surg 2009;197:604-8.
5. Grimaud JC, Munoz-Bongrand N, Siproudhis L, et al. ; Groupe d’étude thérapeutique des affections inflammatoires du tube digestif. Fibrin glue is effective Healing perianal fistulas in patients with Chron’s disease. Gastroenterology 2010;138:2275-81.
6. Panés J, García-Olmo D, Van Assche G, et al.; ADMIRE CD study group collaborators. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016;388:1281-90.
7. Simpson JA, Banerjea A, Scholefield JH. Management of anal fistula. BMJ 2012;345:e6705.
8. Ritchie RD, Sackier JM, Hodde JP. Incontinence rates after cutting séton treatment for anal fistula. Colorectal Dis 2009;11:564-71.
9. Cirocchi R, Farinella E, La Mura F, et al. Fibrin glue in the treatment of anal fistula: a systematic review. Ann Surg Innov Res 2009;3:12.