La fibrillation atriale (FA) est la plus fréquente des arythmies. Sa prévalence estimée se situe entre 2 et 4 % chez l’adulte. Elle multiplie par 4 le risque de survenue d’accident vasculaire cérébral (AVC) et est responsable de 20 à 30 % des AVC ischémiques. Son évolution peut se faire sous forme paroxystique, persistante ou permanente (
Il est question ici de la cardioversion programmée de la FA, de loin la plus fréquente. La cardioversion urgente, motivée par une instabilité hémodynamique sévère, concerne peu de patients et n’est pas abordée.
À noter que les principes de la cardioversion de la FA s’appliquent également au flutter atrial ou aux tachycardies atriales (arythmies moins fréquentes, rarement isolées, souvent associées à la FA chez un même patient).
La cardioversion, pour qui ?
La cardioversion permet de restaurer le rythme sinusal, essentiellement pour la forme persistante de la FA.1
La remise en rythme sinusal n’est cependant pas systématiquement envisagée devant une FA persistante. La choisir, c’est privilégier une stratégie de « contrôle du rythme », c’est-à-dire opter pour ne pas laisser le patient en arythmie permanente.
La stratégie opposée de « contrôle de la fréquence » consiste à maîtriser la fréquence cardiaque par des médicaments ralentisseurs agissant sur la conduction atrioventriculaire. La cardioversion n’a pas sa place dans cette deuxième stratégie. Dans la population générale, il n’a pas été montré de différence nette, sur le plan pronostique, entre ces deux stratégies.
Cependant, ces dernières années, de nombreux arguments indirects plaident en faveur du contrôle du rythme.2 Très récemment, l’étude Early Rhythm-Control Therapy in Patients with Atrial Fibrillation (EAST-AFNET 4 Trial) a montré, pour la première fois, qu’une stratégie précoce de maintien du rythme normal permet de diminuer la mortalité cardiovasculaire, le risque d’accident vasculaire cérébral, le nombre d’hospitalisations pour insuffisance cardiaque ou syndrome coronaire aigu.3 De plus, chez les patients insuffisants cardiaques, plusieurs études montrent que le maintien du rythme sinusal diminue la mortalité et réduit les hospitalisations pour insuffisance cardiaque.4
Le
La cardioversion, comment ?
Deux méthodes de cardioversion sont possibles : la cardioversion électrique ou « choc électrique » ; et la cardioversion médicamenteuse
La cardioversion électrique est généralement préférée en raison de sa meilleure efficacité.
Dans un environnement contrôlé
Cardioversion électrique
La cardioversion électrique consiste à appliquer à la surface du thorax un courant électrique de haute tension et de très faible durée afin de dépolariser simultanément toutes les cellules atriales et permettre leur « redémarrage » en rythme sinusal. Ce courant est délivré au moyen de deux palettes, ou patchs, de défibrillation placés sur la cage thoracique en regard du cœur, de préférence en position antéro-postérieure. La procédure s’effectue dans un environnement hospitalier, permettant une surveillance des paramètres vitaux. Elle nécessite une sédation profonde de quelques minutes par propofol ou, plus rarement, midazolam.
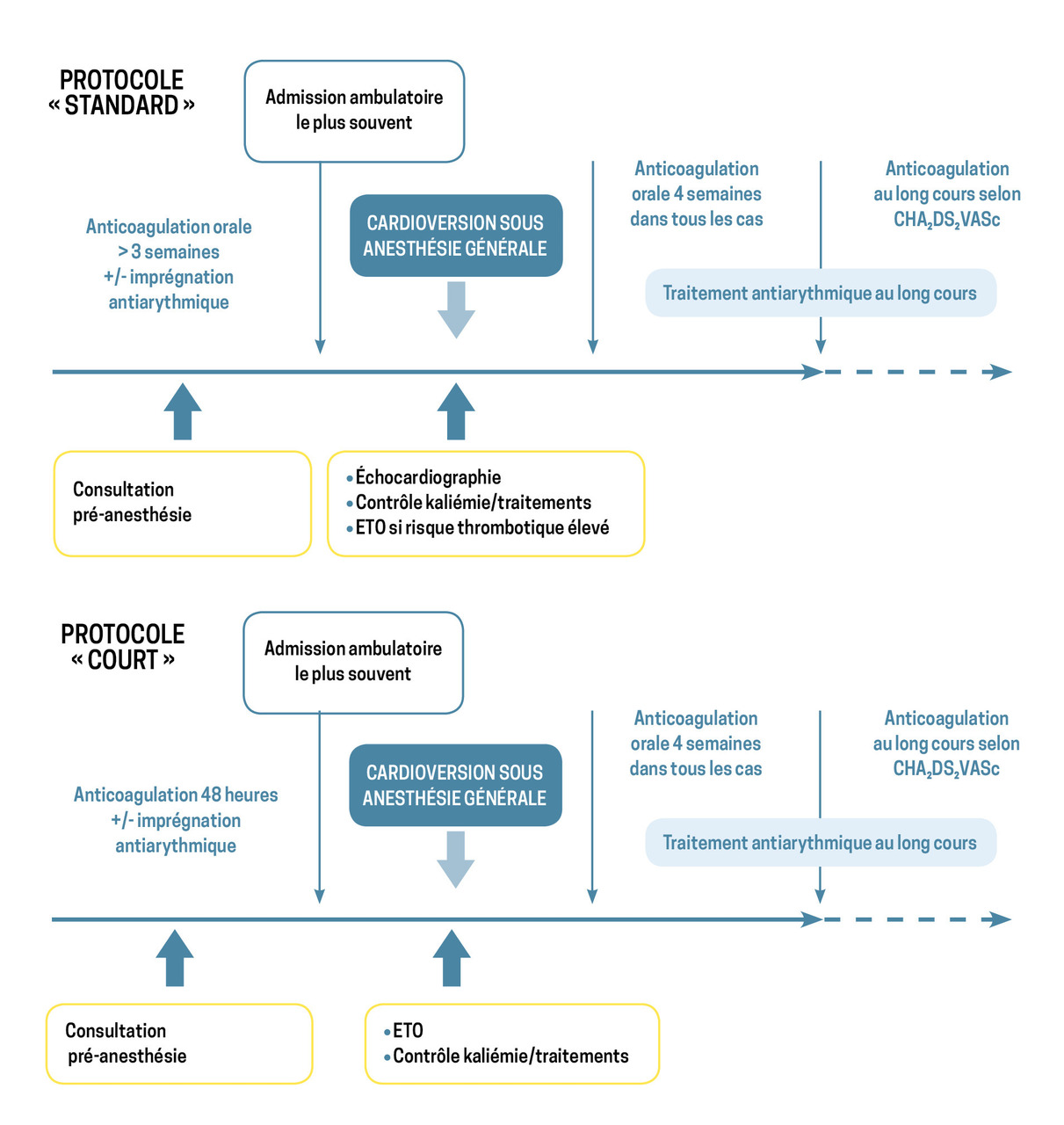
Quarante-huit heures avant le geste, le patient bénéficie donc d’une consultation pré-anesthésie. Le traitement anticoagulant doit être en place et efficace, les digitaliques arrêtés 48 heures avant le choc. Une imprégnation par un traitement antiarythmique de classe Ic (flécaïnide) ou III (amiodarone) peut être associée, quelques jours avant la cardioversion, afin d’en augmenter le taux de succès et de diminuer le nombre de récidives précoces.
La cardioversion électrique s’effectue maintenant majoritairement en ambulatoire si le patient dispose d’un accompagnant après la procédure.
Le choc électrique est réalisable en toute sécurité chez les patients porteurs d’un pacemaker ou d’un défibrillateur automatique implantable.
Cardioversion médicamenteuse
La cardioversion médicamenteuse est plus rarement réalisée de manière programmée. Elle est généralement indiquée en cas d’arythmie récente chez des patients pris en charge aux urgences ou en contexte hospitalier (arythmie faisant suite à une intervention chirurgicale, par exemple). En France, même s’il existe peu de preuves d’efficacité de ce protocole, il est souvent effectué à l’aide d’une dose de charge d’amiodarone per os de 30 mg/kg (6 à 10 comprimés) complétée, éventuellement, d’une deuxième prise de 15 mg/kg le lendemain en cas de non-retour au rythme sinusal.
Les recommandations internationales proposent, en l’absence de cardiopathie sous-jacente, de réaliser la cardioversion médicamenteuse à l’aide d’un antiarythmique de classe Ic comme la flécaïnide ou la propafénone (respectivement 2 mg et 1,5 mg/kg par voie intraveineuse en 10 minutes au moins). Il est à noter que cette classe thérapeutique n’est que peu efficace, voire délétère, en cas de flutter atrial.
L’amiodarone intraveineuse peut aussi être utilisée, mais elle est moins efficace que les antiarythmiques de classe Ic.
Après la cardioversion
Retour au rythme sinusal
Le taux de succès de la cardioversion électrique est proche de 90 % ; celui de la cardioversion médicamenteuse est évalué entre 50 et 70 % si l’arythmie est d’apparition récente.
Les facteurs prédictifs de retour en rythme sinusal stable après cardioversion électrique sont les suivants : le caractère récent de l’arythmie, l’âge jeune (avant 60 ans), l’absence d’insuffisance cardiaque ou de cardiopathie sévère et l’imprégnation par un antiarythmique avant la cardioversion. Le risque de récidive de l’arythmie est maximal dans la semaine qui suit la cardioversion. Mais ce risque existe aussi plus tardivement (jusqu’à plusieurs mois). Le temps en est un des facteurs prédictifs. Répéter la cardioversion est possible en cas de récidive. En dehors du risque embolique inhérent à toute cardioversion, la cardioversion électrique est une procédure sûre dont les effets secondaires sont essentiellement locaux (brûlures cutanées superficielles à l’endroit où les palettes ont été appliquées).
Prévention du risque thrombo- embolique au décours
Le risque principal lors d’une cardioversion est la survenue d’emboles systémiques à point de départ cardiaque. En effet, la FA favorise la formation de thrombus intracardiaques, et la reprise de l’activité mécanique atriale après rétablissement du rythme sinusal peut les mobiliser. La cardioversion de toute arythmie ayant duré plus de 48 heures doit donc être précédée d’au moins 3 semaines d’anticoagulation efficace (
Dans le cas d’une arythmie ayant débuté de façon certaine depuis moins de 48 heures, le risque d’événement thromboembolique est faible, autorisant la cardioversion immédiate, le plus souvent.
Le risque thromboembolique justifie le même protocole pour le flutter atrial ou la tachycardie atriale.
Pour une anticoagulation efficace, les anticoagulants oraux directs tels que le rivaroxaban, l’apixaban et le dabigatran sont utilisables, au même titre que les antivitamine-K. L’échographie transœsophagienne n’est pas systématique avant la cardioversion, sauf situations à risque thrombotique élevé (antécédents d’accident embolique artériel, valvulopathie sévère, dilatation atriale importante).
Une alternative au protocole habituel, autorisant une cardioversion précoce, consiste à pratiquer seulement 48 heures d’anticoagulation, puis une échocardiographie transœsophagienne systématique avant la cardioversion.
La
La majorité des événements thromboemboliques surviennent dans les 10 jours suivant la procédure. Il est nécessaire de maintenir, dans tous les cas, une anticoagulation efficace pendant 4 semaines après la cardioversion, quelle que soit la méthode utilisée. L’indication de l’anticoagulation au-delà de ces 4 semaines dépend, comme pour toute FA, du score CHA₂DS₂-VASc (
Maintien du traitement antiarythmique
La poursuite d’un traitement antiarythmique au long cours est nécessaire pour le maintien du rythme sinusal. En second temps et en cas de récidives, des techniques ablatives radicales peuvent être envisagées.
1. Brandes A, Crijns HJGM, Rienstra M, et al. Cardioversion of atrial fibrillation and atrial flutter revisited: current evidence and practical guidance for a common procedure. Europace 2020;22(8):1149-61.
2. Corley SD, Epstein AE, DiMarco JP, et al. Relationships between sinus rhythm, treatment, and survival in the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Study. Circulation 2004;109(12):1509-13.
3. Kirchhof P, Camm AJ, Goette A, et al. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. N Engl J Med 2020;383(14):1305-16.
4. Turagam MK, Garg J, Whang W, et al. Catheter Ablation of Atrial Fibrillation in Patients With Heart Failure: A Meta-analysis of Randomized Controlled Trials. Ann of Intern Med 2019;170(1):41-5.
5. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021;42(5): 373-498.