La transplantation est le traitement de choix de la maladie rénale chronique au stade terminal (stade 5). Elle permet, en effet, de meilleures qualité et espérance de vie par rapport à la dialyse. De plus, la transplantation rénale est 5 à 10 fois moins coûteuse que la dialyse, passée la première année de greffe.
Le 1er janvier 2019, 8 642 malades étaient en attente de transplantation rénale. Seules 3 643 transplantations rénales ont été réalisées en 2019 en France, dont 510 à partir d’un donneur vivant. Le nombre de transplantations a régressé de 25 % en 2020 en raison de la pandémie de Covid-19. La pénurie d’organes persiste donc et s’aggrave.
Greffe rénale : pour qui et comment faire mieux ?
Selon les recommandations de la Haute Autorité de santé (HAS), doit être dirigé vers une équipe de transplantation rénale « tout malade âgé de moins de 85 ans ayant une maladie rénale chronique irréversible, de stade 5, avec un débit de filtration glomérulaire (DFG) inférieur à 15 mL/min/1,73 m², dialysé ou non » ou tout patient ayant une maladie rénale évolutive de stade 4, pour qui on anticipe un besoin de suppléance ou avec un DFG inférieur à 20 mL/min/1,73 m² dans les douze à dix-huit prochains mois.1 L’inscription du patient sur la liste d’attente de greffe rénale doit alors se faire sans délai.
Cette orientation n’est cependant possible qu’à la condition qu’il n’ait aucune contre-indication évoquée dans les bonnes pratiques publiées en 2015 par la HAS (tableau 1).
Être inscrit sur la liste d’attente ne signifie pas être greffé rapidement
Un certain nombre de malades, bien qu’inscrits sur la liste d’attente, sont considérés (sur des critères divers), par l’équipe de greffe dont ils dépendent, comme n’étant pas en état, au moins transitoirement, d’être greffés ; ils sont donc mis en « contre-indication temporaire ». Ces critères d’exclusion peuvent être une infection, une tumeur, un événement cardiovasculaire. Une fois que l’infection est guérie, que le cancer en rémission (après un délai de carence) ou à distance de l’événement cardiovasculaire, les patients sont remis en situation d’appel actif.
D’autre part, pour les patients qui ont été inscrits sur la liste d’attente et qui sont en situation active (c’est-à-dire qui ne sont pas « en contre-indication temporaire »), le délai d’attente peut être long, compte tenu de la pénurie d’organes actuelle. Par exemple, en 2017, trois ans après avoir été mis sur liste d’attente active, seulement 54,5 % des patients ont été greffés, 6,8 % sont décédés et 6,9 % sont sortis de la liste ; 31,8 % sont donc restés sur la liste, en attente de greffe.2
En 2020, le nombre de candidats sur liste d’attente active était en augmentation, toutefois moindre qu’en 2019 (+ 4 % contre + 7 % en 2019). Le nombre de candidats een liste d’attente active pour un même greffon – indicateur principal de pénurie de greffe rénale – était de 3,3 en 2020 (contre 2,2 en 2018 et 2019), ce qui témoigne d’une aggravation de la pénurie de greffons (tableau 2).2
Lutte contre la pénurie d’organes : plusieurs pistes
Face au besoin de greffons, plusieurs initiatives peuvent être envisagées : en particulier l’augmentation des dons du vivant et des prélèvements de donneurs « Maastricht III ».
Augmenter le nombre de donneurs vivants
Actuellement, 14 % des greffes rénales en France se font à partir d’un donneur vivant, contre 30 à 50 % dans les pays anglo-saxons et les pays scandinaves.
Pour augmenter ces dons, qui sont gratuits et doivent être librement consentis sans pression psychologique ou financière, plusieurs pistes sont envisagées :
– la loi de bioéthique du 7 juillet 2011 a élargi le cercle des donneurs vivants possibles ; peuvent ainsi donner un père, une mère, un fils, une fille, un frère ou une sœur, un grand-parent, un oncle ou une tante, un cousin germain mais aussi un conjoint ou même un conjoint du père ou de la mère. Le donneur peut être une personne pouvant apporter la preuve d’un lien affectif étroit et stable depuis au moins deux ans avec le receveur ; les transplanteurs doivent informer systématiquement le malade de cette possibilité et rappeler que les avantages d’une greffe à partir d’un donneur vivant par rapport à une greffe à partir d’un donneur cadavérique sont multiples (greffon de meilleure qualité, caractère programmé de la greffe, accès à des délais plus courts et possibilité de greffe préemptive [c’est-à-dire avant de devoir recourir à la dialyse]) ;
– le don croisé, autorisé en France depuis le 7 juillet 2011, est très peu utilisé. Il consiste, lorsqu’un malade en attente de greffe dispose dans son entourage d’un donneur potentiel mais qui n’est pas compatible HLA (human leucocyte antigen) avec lui, à trouver un autre couple donneur-receveur dans la même situation, choisi de telle façon que le donneur d’un couple soit compatible avec le receveur de l’autre couple, et vice versa. On peut alors proposer d’inverser les donneurs. Le don croisé est régi par trois principes posés par la loi : l’information du donneur, l’anonymat entre les paires donneur-receveur et la simultanéité des interventions chirurgicales pour éviter tout refus secondaire d’un des donneurs. La nouvelle loi de bioéthique d’août 2021 a élargi le don croisé à six appariements, afin de multiplier les chances.
Augmenter les greffes à partir de donneurs « Maastricht III »
Les donneurs « Maastricht III » sont des patients décédés après une décision de limitation et d’arrêt programmé des thérapeutiques, décision prise en raison d’un pronostic vital défavorable à très brève échéance. Le programme de prélèvement d’organes sur ces patients a commencé en 2014 en France et a donné des résultats satisfaisants avec une bonne fonction rénale à un an et une reprise fonctionnelle dans un moindre délai. Le 3e Plan de greffe 2017-2021 visait 400 greffes à partir de donneurs « Maastricht III » ; or, entre 2017 et 2021, 552 greffes ont été réalisées selon ce protocole, allant donc au-delà des objectifs fixés, malgré la lourdeur du protocole.
Peu d’effets à attendre d’autres potentiels leviers
Les malades en état de mort encéphalique sont des donneurs potentiels classiques et constituent une source de donneurs déjà bien repérée. La marge de progression consisterait à augmenter les donneurs dits « marginaux » ou « à critères élargis », c’est-à-dire des donneurs qui ont des comorbidités rendant plus aléatoires les résultats de la greffe à long terme.
Le protocole de greffe de rein dérogatoire pour les donneurs porteurs du virus de l’hépatite C est déjà en place ; un protocole de greffe dérogatoire pour les donneurs infectés par le virus de l’immunodéficience humaine (VIH) a été récemment publié, mais il aura un effet limité.
Tirer les leçons des initiatives manquées
Le 3e Plan greffe français (2017-2021) avait pour objectif de développer les prélèvements de donneurs à cœur arrêté, de donneurs à critères élargis et de donneurs vivants. Il prévoyait la réalisation de 4 950 transplantations rénales par an, dont 1 000 à partir de donneurs vivants. Malheureusement, cet objectif n’a pas été atteint.
Le livre blanc de la transplantation
Ce livre a été élaboré dans le contexte d’échec du 3e Plan greffe par la Société francophone de néphrologie, dialyse et transplantation, la Société francophone de transplantation, l’Association française d’urologie et l’association de patients France Rein.
Il comporte cinq recommandations :
– étoffer les coordinations de prélèvements au sein des hôpitaux préleveurs afin d’augmenter le nombre de prélèvements ;
– développer la transplantation à partir d’un donneur vivant ;
– réduire les disparités d’accès à la liste d’attente selon les régions et le profil des patients ;
– améliorer la qualité de vie des patients greffés et des donneurs vivants ;
– soutenir la recherche pour faire face aux grands enjeux de la transplantation rénale.
Le 4e Plan greffe ministériel : nouvel élan ?
Le 4e Plan ministériel pour le prélèvement et la greffe d’organes (2022-2026) vient d’être publié. II comprend cinq innovations :
– recruter des infirmières en pratique avancée afin d’appuyer la coordination du prélèvement, de la greffe et le suivi des greffés ;
– poursuivre le développement du protocole « Maastricht III », encourager le don de vivant et développer le prélèvement pédiatrique afin de pallier la baisse de prélèvements à partir d’un donneur décédé ;
– revoir le financement du prélèvement et de la greffe pour les rendre plus attractifs : réévaluer le forfait du prélèvement à partir d’un donneur vivant ainsi que le prélèvement d’organe et harmoniser le tarif des astreintes chirurgicales ;
– créer des indicateurs de performance pour l’activité de prélèvement et de la greffe ;
– nommer, dans chaque agence régionale de santé, un référent du prélèvement et de la greffe afin de mettre en place les mesures envisagées en tenant compte des spécificités locales.
Ce 4e Plan a également l’objectif de réduire l’ischémie froide moyenne à dix heures en 2026, d’aboutir à une proportion de 20 % des greffes réalisées à partir de donneurs vivants et d’augmenter le nombre d’établissements de santé réalisant des prélèvements sur des donneurs « Maastricht III ».
En raison de l’épidémie de Covid-19 et des difficultés de recrutement du personnel, le 4e Plan ministériel de greffe ne fixe pas un nombre attendu de prélèvements ou de greffes d’ici à 2026, mais il propose un « couloir de croissance ».
La transplantation chez le sujet âgé est-elle envisageable ?
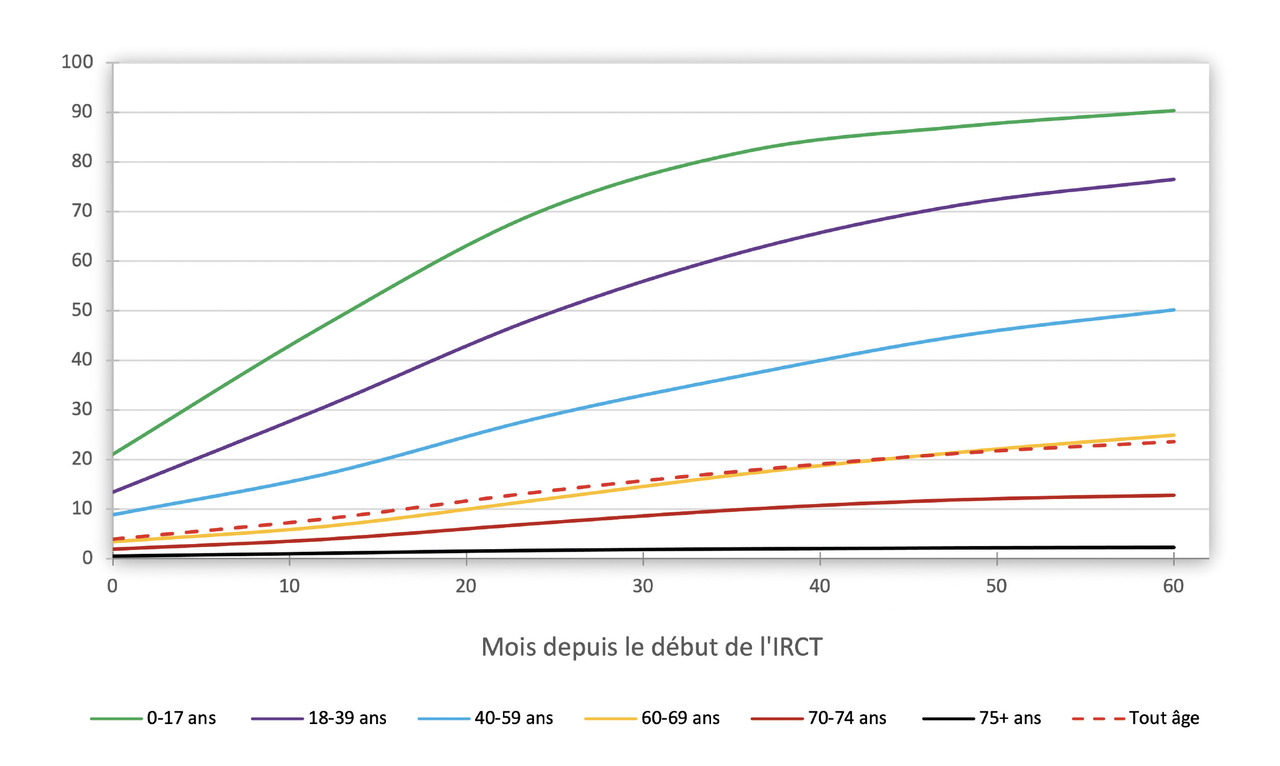
La prévalence des patients âgés en insuffisance rénale terminale augmente régulièrement d’année en année. En revanche, la probabilité d’être inscrit sur une liste de greffe pour ces patients diminue avec l’âge, contrairement aux préconisations de la HAS. Selon le rapport R.E.I.N. (réseau épidémiologie et information en néphrologie) publié en 2019, les patients de plus de 75 ans représentent ainsi 40 % des nouveaux patients dialysés, mais sont peu à être inscrits sur la liste de greffe : 2,7 % à 60 mois (fig. 1).3
Comparer ce qui est comparable
Le rapport de l’Agence de la biomédecine de 2020 conclut à une survie à 5 ans de 70,7 % pour les receveurs âgés de 71 à 74 ans versus 58,1 % après 75 ans. Cette survie est nettement inférieure à celle des receveurs âgés de 18 à 60 ans, estimée à 93,3 %.
Toutefois, il est difficile de comparer les bénéfices attendus par les malades pour ces taux de survie car l’espérance de vie théorique de ces sujets est très différente : 5 ans de survie sans dialyse après 75 ou 80 ans est en effet un gain majeur.
La survie du greffon rénal, prenant en compte les décès à 5 ans, est de 59,6 % entre 70 et 74 ans versus 47,3 % après 75 ans. Par comparaison elle est de 83,6 % entre 18 et 60 ans.2
Selon Legeai et al., le risque de décès chez les patients âgés de plus de 70 ans est multiplié par 3 pendant les trois premiers mois post-greffe par rapport à celui observé chez les patients encore sur liste d’attente. Cette étude porte sur 1 219 patients inscrits sur liste d’attente de transplantation en France : 877 ayant bénéficié d’une transplantation et 342 toujours inscrits. Les facteurs de risque de mortalité étaient la présence de diabète, de pathologies cardiovasculaires et une durée de dialyse supérieure à deux ans. Mais en comparant les patients transplantés rénaux appariés aux patients dialysés, l’étude conclut à une diminution de la mortalité à partir du troisième mois post-greffe.4
Dans une autre étude, il est montré que le type de donneur influence la mortalité chez les receveurs âgés de plus que 65 ans : la mortalité précoce après une greffe à partir d’un donneur à critères étendus est supérieure par rapport à celle à partir d’un donneur à critères standards ; la greffe à partir d’un donneur vivant est associée à une moindre mortalité par rapport à un donneur à critères standard.5
Identifier les patients pouvant tirer le meilleur bénéfice de la transplantation
En raison de ces résultats, la question se pose d’identifier les personnes âgées qui pourront bénéficier d’une meilleure qualité de vie après la transplantation rénale.
Dusseux et al. ont proposé un score pour prédire la survie à trois ans en dialyse chez les patients âgés de plus de 70 ans. Ce score pourrait être incorporé dans l’évaluation pré-greffe.6 L’évaluation gériatrique fait maintenant partie de l’évaluation pré-greffe de nombreuses équipes afin de dépister un état de fragilité. Cet état de fragilité serait en effet associé à une augmentation de la durée d’hospitalisation et de la mortalité ainsi qu’à une diminution de la qualité de vie. La pré-habilitation pourrait être proposée aux patients fragiles afin de restaurer leurs réserves fonctionnelles.
Amélioration de la survie du greffon et du patient transplanté !
Selon une étude publiée dans le New England Journal of Medicine, la survie du greffon rénal et du patient transplanté rénal s’est améliorée dans le temps, malgré la part croissante de donneurs plus âgés, ou à cœur arrêté, et malgré le moins bon profil des receveurs (plus âgés, avec un index de masse corporelle plus élevé, plus immunisés contre les antigènes HLA, plus fréquemment diabétiques et dialysés depuis plus longtemps).7
Aux États-Unis, la survie d’un greffon rénal provenant d’un donneur décédé a augmenté de 42,3 % entre 1996 et 1999 à 53,6 % entre 2012 et 2015. La survie du patient à 10 ans est passée de 60,5 % entre 1996 et 1999 à 66,9 % entre 2008 et 2011.
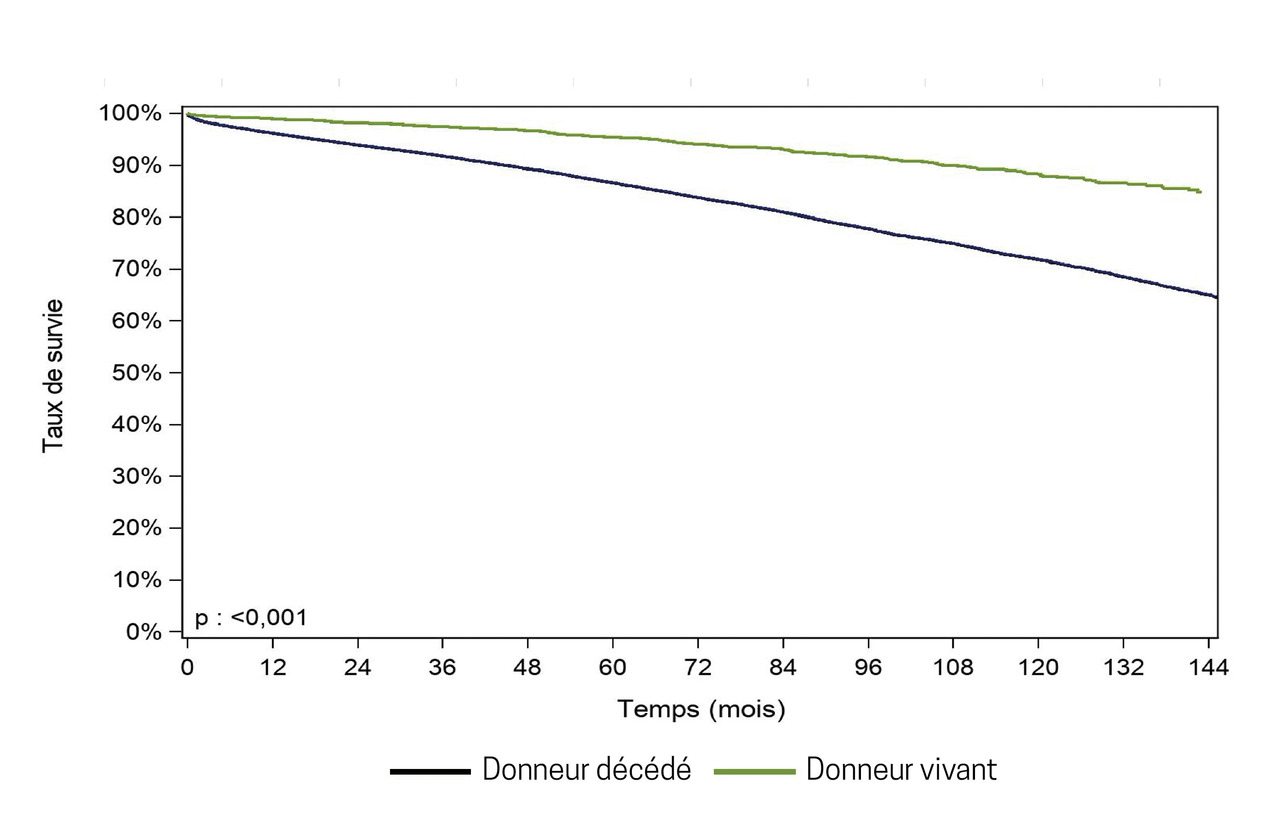
En France, la survie du receveur d’un rein provenant d’un donneur décédé à 10 ans est de 71,8 % contre 88,2 % pour un receveur greffé à partir d’un donneur vivant (fig. 2). La survie à 10 ans du greffon rénal issu d’un donneur décédé est de 56,5 %.2
Lutter contre la perte du greffon
Le rejet chronique et la récidive d’une maladie glomérulaire constituent les causes de la perte du greffon après la 1re année.
Le retard de la reprise de la fonction rénale affecte la survie du greffon rénal. La reprise fonctionnelle retardée est définie par le recours à au moins une séance d’hémodialyse la première semaine après la greffe. L’utilisation d’une machine de perfusion pour les greffons marginaux permet de diminuer de 15 % la reprise retardée de fonction des greffons les plus vulnérables.
La nephrotoxicité chronique des inhibiteurs de calcineurine (cyclosporine et tacrolimus) explique notamment la survie relativement faible du greffon rénal au très long cours.
Le bélatacept est une molécule de fusion bloquant la costimulation des lymphocytes T, médiée par le CD28 : elle inhibe leur activation. Un traitement combinant du bélatacept (en lieu et place des anti-calcineurines), du mycophénolate mofétil et des glucocorticoïdes permet une meilleure fonction rénale à sept ans par rapport à la triade conventionnelle.7 Le bélatacept est cependant réservé à des receveurs positifs pour le virus d’Epstein-Barr (EBV), car il augmente le risque de lymphome post-transplantation induit par l’EBV chez les receveurs négatifs. Il est associé à une légère augmentation du risque de rejet. Depuis la pandémie de Covid-19, le bélatacept peut être rétrocédé en ville : les perfusions intraveineuses mensuelles ne sont donc plus réalisées exclusivement à l’hôpital.
Le diagnostic d’un rejet reste invasif, porté sur l’analyse histologique d’une biopsie du greffon rénal combinée à la recherche d’anticorps dirigés contre les antigènes HLA du donneur (DSA, donor-specific antibody). Des marqueurs non invasifs sont en voie de développement pour permettre de réaliser les biopsies à un temps mieux choisi.
Que dire à vos patients ?
Le don du rein à partir d’un donneur vivant permet d’avoir un greffon de meilleure qualité et réduit considérablement la durée d’attente pour une greffe ; il faut en parler le plus tôt possible.
Des ressources sont disponibles pour aller plus loin :
- Brochure de l’agence de la biomédecine pour le grand public : « La greffe rénale à partir de donneur vivant. Du don à la greffe, enjeux, perspectives et résultats » : https://bit.ly/3NLAoDN
- Brochure de l’association de patients Renaloo : « La greffe rénale à partir d’un donneur vivant : et si on en parlait ? » : https://bit.ly/39nJWWs
2. Agence de la biomédecine. Organes. Greffe rénale. Rapport 2020. https://bit.ly/3twKlgh
3. Agence de la biomédecine. Rapport 2019. Réseau épidémiologie, information, néphrologie (R.E.I.N). https://bit.ly/3zxXhGm.
4. Legeai C, Andrianasolo RM, Moranne O, et al. Benefits of kidney transplantation for a national cohort of patients aged 70 years and older starting renal replacement therapy. Am J Transplant 2018;18(11):2695-707.
5. Gill JS, Schaeffner E, Chadban S, et al. Quantification of the early risk of death in elderly kidney transplant recipients. Am J Transplant 2013;13(2):427-32.
6. Dusseux E, Albano L, Fafin C, et al. A simple clinical tool to inform the decision-making process to refer elderly incident dialysis patients for kidney transplant evaluation. Kidney Int 2015;88(1):121-9.
7. Hariharan S, Israni AK, Danovitch G. Long-Term Survival after Kidney Transplantation. N Engl J Med 2021;385(8):729-43.
8. Vincenti F, Rostaing L, Grinyo J, et al. Belatacept and Long-Term Outcomes in Kidney Transplantation. N Engl J Med 2016;374(4):333-43.

 Encadrés
Encadrés