La radiothérapie tient une place prépondérante dans la prise en charge du cancer de prostate localisé. Elle offre une alternative à la chirurgie, avec des résultats carcinologiques équivalents (à 10 ans, survie sans progression : chirurgie 5,9 %, radiothérapie 6,6 %).1 Les progrès technologiques (une véritable révolution) de ces 30 dernières années en font maintenant une technique thérapeutique très bien tolérée.
Améliorations technologiques de la radiothérapie externe (RTE)
De la radiothérapie conventionnelle 2D à la 3D…
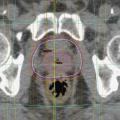
L’objectif de la radiothérapie est d’irradier un volume-cible (ici la prostate avec ou sans les vésicules séminales et les aires ganglionnaires) en préservant les organes à risque (OAR : rectum, vessie).
Initialement, jusqu’aux années 90, le volume-cible prostatique et les OAR n’étaient pas vus. Le centrage consistait en des clichés de radiologie conventionnelle : il fallait se fonder sur les structures osseuses pour définir une zone où devait se trouver la prostate. La dosimétrie (calcul de la répartition de dose) n’était donnée au mieux que dans 1 ou 2 plans. Différents faisceaux concourant sur le volume cible supposé étaient alors définis, la multiplication des portes d’entrée diminuant la dose reçue par les OAR.
La technique 3D (ou conformationnelle) a bénéficié d’une part de l’arrivée du scanner dans les services de radiothérapie, d’autre part des progrès de l’informatique, permettant de reconstruire en 3D les volumes souhaités et de donner également une dosimétrie plus précise pour chacun de ces volumes (
… à la radiothérapie conformationnelle avec modulation d’intensité (RCMI)…
La radiothérapie 3D ne modifiait pas la nature des faisceaux, seulement la précision balistique.
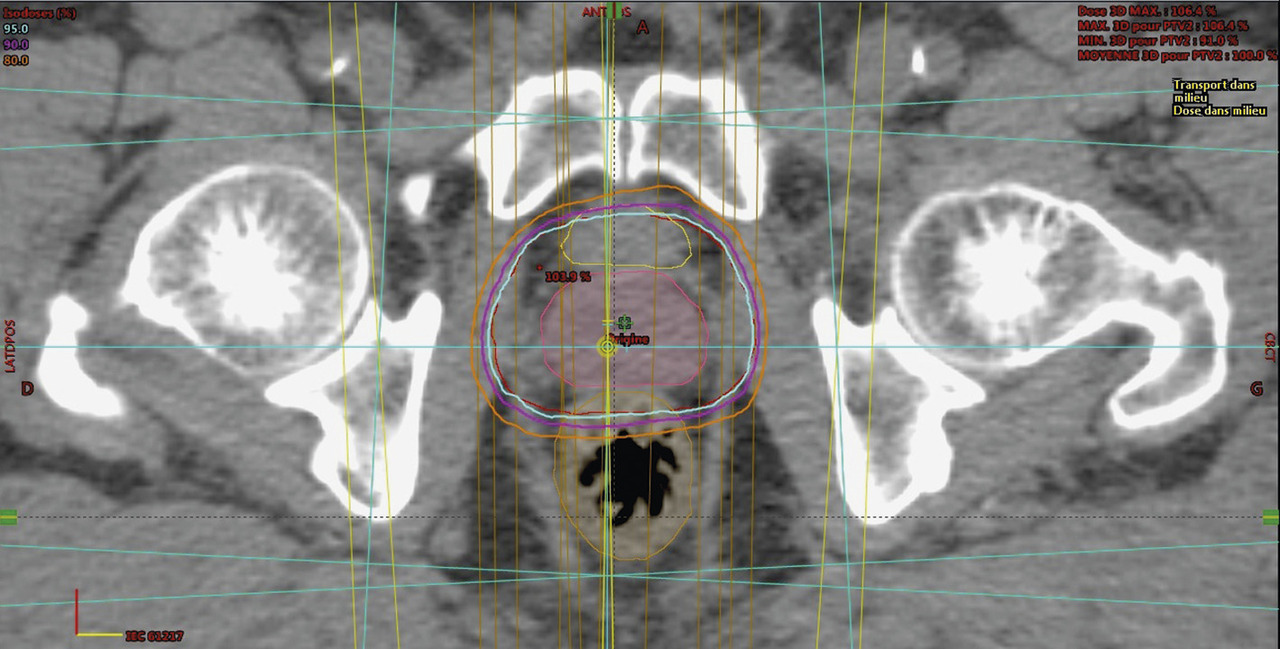
Pour que la dosimétrie soit encore plus précise, la fluence particulaire (nombre de photons par unité de surface du champ par seconde) doit être modifiée, pour que les zones ne devant recevoir qu’une faible dose soient épargnées. Ceci a été rendu possible par la mobilité des lames pendant l’irradiation, certaines zones étant cachées une partie du temps de traitement. Pour affiner encore la dosimétrie, le logiciel du système de traitement calcule la durée de chaque faisceau et le mouvement des lames, en fonction des contraintes dosimétriques que l’oncologue radiothérapeute demande (dose à délivrer aux volumes-cibles, dose à ne pas dépasser sur les OAR – dosimétrie inverse). Ces évolutions technologiques
caractérisent la RCMI, apparue et diffusée/infusée dans le courant des années 2000.
Depuis ces 10 dernières années, c’est l’ensemble de l’accélérateur qui tourne autour du malade, multipliant les portes d’entrée et par ce bais raccourcissant la durée d’une séance : actuellement, l’irradiation elle-même dure 3 à 5 minutes.
La prostate bouge, parfois de plus de 1 cm dans certaines directions, en fonction du degré de réplétion rectale ou vésicale. La précision balistique étant de l’ordre de quelques millimètres, il est nécessaire de rajouter des marges autour du volume-cible pour tenir compte de ces mouvements.
De plus, les accélérateurs actuels sont équipés d’un cone beam CT : avant chaque séance, un scanner est réalisé qui permet de repositionner la prostate dans les faisceaux. La radiothérapie est ainsi guidée par l’image.
… jusqu’à la stéréotaxie
La précision de tir est encore plus fine, la contention parfaite et le repositionnement idéal.
Initialement, elle nécessitait des machines dédiées, tel le cyberknife. Elle est maintenant réalisable sur des accélérateurs linéaires classiques, mais équipées des options stéréotaxiques.
Elle délivre de fortes doses par fraction (> 5 Gy) et permet donc de n’effectuer que quelques séances. Un protocole habituel dans le cancer de prostate est de 5 séances de 7,25 Gy ; cependant, cette technique n’est pas encore totalement validée.
Doses et fractionnement
Un effet dose démontré.2 Plusieurs essais randomisés ont évalué l’intérêt d’augmenter la dose. Classiquement, la radiothérapie prostatique délivrait 66 à 70 Gy, en 33 à 35 séances. Avec la radiothérapie conventionnelle, cette dose ne pouvait pas être dépassée, car le risque de toxicité rectale ou vésicale devenait élevé. Mais, avec la précision balistique des nouvelles techniques, il est aujourd’hui possible de délivrer 80 Gy, voire plus, sans augmenter la toxicité. Plusieurs essais randomisés ont démontré que cette « escalade » permettait d’améliorer le contrôle de la maladie. Une dose de l’ordre de 76 à 80 Gy devient donc la règle, particulièrement en l’absence d’hormonothérapie ou si cette dernière est courte, de 6 mois.
L’hypofractionnement modéré plébiscité : il est en 2020 le standard thérapeutique.3, 4 Le fractionnement classique consiste à délivrer 2 Gy par séance : pour des raisons radiobiologiques, il permet de mieux protéger les tissus sains. Cependant, là encore, la précision balistique obtenue avec les nouveaux appareils exclut du volume traité la majeure partie des OAR. Un hypofractionnement modéré (dose comprise entre 3 et 5 Gy) est alors possible. Des essais ont ainsi démontré que 60 Gy en 20 séances est équivalent, sur le contrôle de la maladie, au fractionnement conventionnel nécessitant de 37 à 40 séances.
La diminution du nombre de séances est bénéfique pour le patient, pour les services parfois débordés et pour la Sécurité sociale, car de nombreux transports sont économisés.
Comme déjà mentionné, l’hypofractionnement extrême (5 séances de 7 Gy ou plus) n’est pas totalement validé en 2020, mais pourrait devenir un standard dans les années qui viennent.
Résultats de la radiothérapie externe (RTE)
L’évaluation de ces nouvelles techniques a fait l’objet de nombreux essais. L’hypofractionnement également.
Le contrôle de la maladie, mesuré sur le taux de PSA après traitement, est de l’ordre de 80 à 90 % pour les tumeurs de bon pronostic et de 60 à 80 % pour celles de pronostic intermédiaire. Pour ces dernières, l’adjonction d’une hormonothérapie (suppression androgénique) de 6 mois améliore les résultats de 10 à 20 % selon les études.
Enfin, pour les formes à haut risque, localement avancées ou avec des scores de Gleason élevés, l’association d’une irradiation moderne à doses élevées et d’une suppression androgénique prolongée (> 18 mois) permet d’obtenir une survie sans progression clinique à 10 ans de l’ordre de 70 à 80 %.
De plus, les améliorations technologiques ont permis de minimiser les complications tardives : dans plusieurs essais prospectifs randomisés, incluant plusieurs milliers de patients, les taux de toxicité de grade 3 vésicaux ou rectaux sont inférieurs à 5 %.
L’évaluation de la qualité de vie par des questionnaires validés montre des fonctions urinaires ou digestives quasi normales chez plus de 90 % des patients.
Curiethérapie
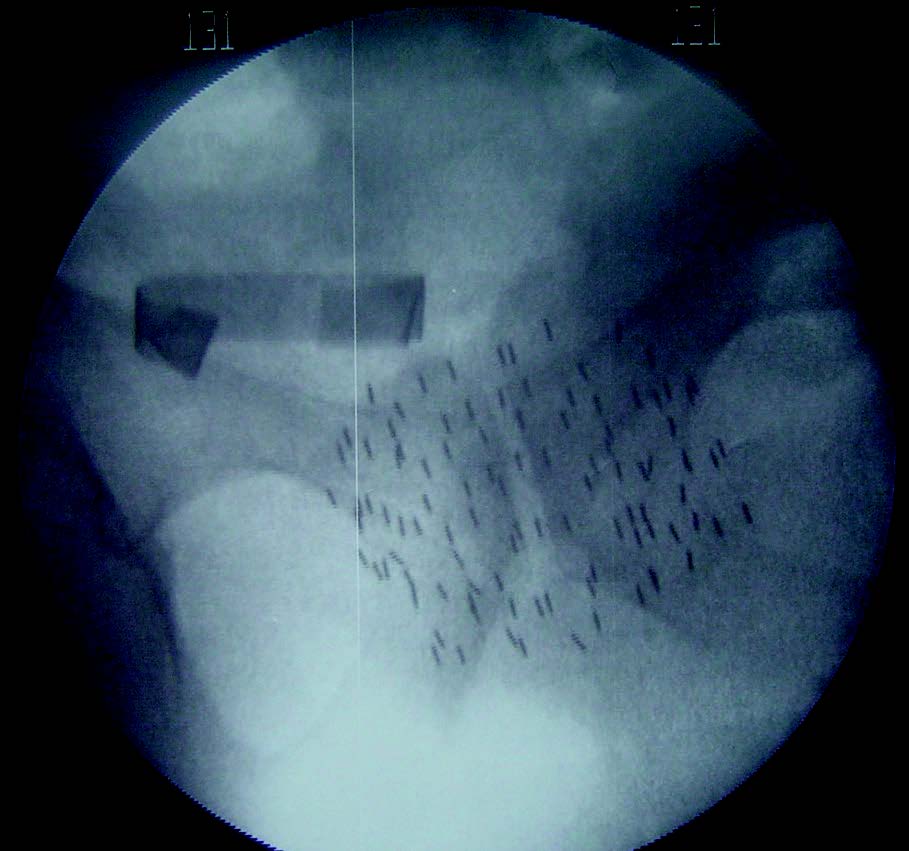
Cette technique consiste à fixer dans la prostate des sources radioactives. L’irradiation est alors très localisée, permettant une augmentation substantielle de la dose.
Classiquement, l’iode 125 était utilisé sous forme de grains, ceux-ci restant définitivement dans la glande, mais perdant leur radioactivité entre 4 et 6 mois.
Si l’on opte pour la curiethérapie dite à haut débit de dose, plus récente, la source radioactive est alimentée par des cathéters implantés dans la prostate. Selon les protocoles, entre 1 et 4 séances sont réalisées lors desquelles une dose de 5 à 10 Gy est délivrée en quelques minutes. Dans cette situation, la glande prostatique uniquement est irradiée.
Initialement utilisée seule, la curiethérapie est maintenant employée en combinaison avec la RTE. Cette dernière délivre une dose intermédiaire (de 45 à 50 Gy ou équivalent) sur la prostate et les tissus périprostatiques, le complément étant apporté par la curiethérapie. Quand elle est associée à la RTE, celle-ci autorise, versus la RTE seule, une escalade de dose plus élevée et ce, sans majorer la toxicité rectale.
Conclusion
Les progrès techniques de la radiothérapie ont clairement amélioré à la fois son efficacité et sa tolérance. Les résultats, en termes de contrôle de la maladie, sont similaires à ceux obtenus avec la chirurgie et font de cette méthode une option thérapeutique à tous les stades de la tumeur.
Le faible risque de complications permet de la proposer à des patients fragiles ou âgés, au-delà même de 80 ans, si la maladie le justifie. Sa réalisation est facilitée par l’hypofractionnement qui doit être considéré maintenant comme un standard de traitement.
1. Hamdy FC, Donovan JL, Lane JA, et al. 10-Year Out- comes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 2016; 375:1415-24.
2. Zaorsky NG, Palmer JD, Hurwitz MD, Keith SW, Dicker AP, Den RB. What is the ideal radiotherapy dose to treat prostate cancer? a meta-analysis of biologically equivalent dose escalation. Radiother Oncol 2015;115:295-300.
3. Hennequin C, Guillerm S, Quero L. Le retour de l’hypofractionnement: rationnel. Cancer Radiother 2019;23:500-2.
4. Line Krhili S, Crehange G, Albert-Dufrois H, Guimas V, Minsat M, Supiot S. Hypofractionnement modéré ou extrême des cancers prostatiques localisés: les temps sont en train de changer. Cancer Radiother 2019;23:503-9.